藤黄酸对人结肠癌HCT116细胞增殖及Gankyrin表达的影响
邱旭彬 曹杰 杨平
[摘要] 目的 觀察藤黄酸对人结肠癌HCT116细胞增殖和Gankyrin表达的影响,探讨其抑制人结肠癌生长增殖的作用机制。 方法 以1.0、2.0、4.0 μg/mL的藤黄酸作用体外培养的人结肠癌HCT116细胞,并设未予藤黄酸处理的对照组。处理12、24、36 h后,分别采用CCK-8法检测细胞增殖活性,流式细胞仪检测细胞周期分布和细胞凋亡率,Western blot检测Gankyrin蛋白水平的变化。 结果 藤黄酸对人结肠癌HCT116细胞生长增殖具有抑制作用,且呈浓度和时间依赖性,相同浓度不同时间点的抑制率差异有统计学意义(P < 0.05),不同浓度相同时间点的抑制率差异有统计学意义(P < 0.05)。流式细胞仪结果提示,藤黄酸阻滞HCT116细胞于G2/M期,1.0、2.0、4.0 μg/mL的藤黄酸处理24 h后,处于G2/M期的细胞数量均较对照组明显增加,差异均有统计学意义(P < 0.05或P < 0.01);HCT116细胞的凋亡率随藤黄酸浓度增加而逐步上升,2.0、4.0 μg/mL的藤黄酸处理后HCT116细胞的凋亡率均高于对照组,差异均有统计学意义(P < 0.05或P < 0.01)。用不同浓度的藤黄酸处理HCT116细胞24 h,Gankyrin蛋白水平随药物浓度的增加而下降(P < 0.05)。 结论 藤黄酸能够抑制人结肠癌HCT116细胞的生长增殖,诱导HCT116细胞阻滞于G2/M期,使Gankyrin的表达水平下降,其诱导肿瘤细胞凋亡的作用可能与抑制Gankyrin的表达相关。
[关键词] 人结肠癌;HCT116细胞;藤黄酸;Gankyrin
[中图分类号] R735.35 [文献标识码] A [文章编号] 1673-7210(2016)02(b)-0004-04
Effect of gambogic acid on human colon cancer HCT116 cell proliferation and expression of Gankyrin
QIU Xubin CAO Jie▲ YANG Ping ZENG Shanqi WANG Chengxing WU Qianlong CHEN Huacui
Area Two of Department of Gastrointestinal Surgery, Affiliated Guangzhou First Municipal People's Hospital, Guangzhou Medical University, Guangdong Province, Guangzhou 510180, China
[Abstract] Objective To observe the effect of gambogic acid on human colon cancer HCT116 cell proliferation and expression of Gankyrin, and to discuss the suppression mechanism. Methods 1.0, 2.0, 4.0 μg/mL of gambogic acid was used in human colon cancer HCT116 cells which were cultured in vitro, and the control group that without gambogic acid was set. 12, 24, 36 hours after gambogic acid treatment, the cell proliferation activity was tested by methyl thiazolyl tetrazolium (CCK-8) assay, the cell-cycle kinetics and cell apoptosis were tested by flow cytometry (FCM), and the change of expression of Gankyrin protein were tested by Western blot respectively. Results The proliferation of HCT116 cells was suppressed by gambogic acid in concentration and time dependent manner, inhibition rate of the same concentration in different time points had statistically significant difference (P < 0.05), and the inhibition rate of the HCT116 cells with different concentration at the same time points had statistically significant difference (P < 0.05). Results of FCM showed that, the HCT116 cell was stopped at G2/M period, 24 h after 1.0, 2.0, 4.0 μg/mL gambogic acid treatment, the number of cells in G2/M period increased significantly, compared with the control group, the differences were statistically significant (P < 0.05 or P < 0.01). The apoptosis of HCT116 cell rose with the increase of gambogic acid concentration, after 2.0, 4.0 μg/mL gambogic acid treatment, apoptosis rate of HCT116 cells was higher than that of the control group, the differences were statistically significant (P < 0.05 or P < 0.01). 24 hours after different concentration of gambogic acid treatment, the level of Gankyrin protein decreased as the concentration increased (P < 0.05). Conclusion Gambogic acid can significantly inhibit the proliferation of human colon cancer HCT116 cell, and induces the HCT116 cell stopped at G2/M period, decreases the level of Gankyrin expression, its effect of inducing apoptosis on tumor cells may related to the suppression of Gankyrin expression.
[Key words] Colon cancer; HCT116 cells; Gambogic acid; Gankyrin
结肠癌是一种发病率较高的消化道恶性肿瘤。近年来随着经济条件改善,人民生活水平逐渐提高,生活方式、饮食习惯及外部环境因素也随之发生了改变,我国结肠癌发病率呈4.2%的增长趋势逐年增长,当前已高居我国消化道肿瘤发病率的第2位,发病及病死人数已超过美国[1]。藤黄酸(gambogic acid,GA)是从中药藤黄中提取的主要活性成分,为一种低毒性广谱抗癌药。本课题组前期的研究表明,其对消化道肿瘤疗效显著,尤其对结直肠癌细胞具有良好的抑制作用[2]。本研究观察不同浓度的藤黄酸对体外培养的人结肠癌HCT116细胞作用情况,探讨藤黄酸对人结肠癌HCT116细胞的作用并检测其对Gankyrin蛋白表达的影响,分析中药成份藤黄酸诱导人结肠癌HCT116细胞发生凋亡的可能机制。
1 材料与方法
1.1 材料
人结肠癌HCT116细胞由美国ATCC公司引进,由南京凯基生物科技发展有限公司提供;藤黄酸粉剂,纯度为99%,购自美国Sigma公司,-20℃保存;细胞培养相关试剂均购自Gibco公司;CCK-8试剂盒购自上海生物工程有限公司;SDS-PAGE试剂盒购自碧云天生物技术研究所;兔抗人Gankyrin多克隆抗体由美国Abcam公司引进。
1.2 方法
1.2.1 结肠癌细胞培养 将人结肠癌HCT116细胞置于含10%胎牛血清及双抗(100 U/mL青霉素、50 mg/mL链霉素)的Gibco 1640培养基中,37℃,含5%CO2孵箱中培养。
1.2.2 采用CCK-8法检测藤黄酸对人结肠癌HCT116细胞生长增殖抑制作用 取对数生长期的人结肠癌HCT116细胞接种于96孔培养板培养,细胞定量每孔2×104个细胞,培养24 h后撤出所有培养液,每孔分别加入体积200 μL的藤黄酸,再次添加新鲜培养基,并使其最终的浓度分别为0、1.0、2.0、4.0 μg/mL(0 μg/mL为对照组,其他各浓度为实验组)。将各组细胞分别继续培养12、24、36 h后,于每孔中加入体积20 μL的CCK-8检测液体继续在原培养环境中孵育1 h后再小心吸弃各个孔内的培养上清液,用酶标仪在450 nm波长处测定各孔的吸光值(OD值)。根据各OD值计算细胞增殖抑制率,细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100,实验重复3次,取其均值。
1.2.3 采用流式细胞检测技术检测细胞增殖情况 将人结肠癌HCT116细胞分别接种于6孔培养板中,24 h后将含藤黄酸的浓度分别为1.0、2.0、4.0 μg/mL的新鲜Gibco 1640培养液加入培养板,把0 μg/mL设为对照组,培养24 h后按照AnnexinV-FITC/PI细胞凋亡检测试剂盒方法处理细胞,作流式细胞相关分析,将激发波长设为488 nm,并分析细胞周期的分布以及凋亡的情况。
1.2.4 采用Western blot检测Gankyrin蛋白表达水平 藤黄酸0、1.0、2.0、4.0 μg/mL处理24 h的HCT116细胞,细胞定量2×106,分别按每1×106添加200 μL蛋白裂解液提取蛋白质后,Bradford法分别测定蛋白含量。配用12%分离胶,5%浓缩胶进行SDS-PAGE电泳,于每孔中加入蛋白质50 pg,以100 V的恒压电泳至胶底部分离,再转移至硝酸纤维素膜上,用5%脱脂牛奶封闭2 h后,加入经1∶500体积稀释的兔抗人Gankyrin多克隆抗体,在摇床上匀速振摇2 h后,用PBST反复洗涤3次,每次持续15 min。然后再加人经1∶400体积稀释的兔抗羊IgG-HRP,在摇床上匀速振摇2 h,用PBST反復洗涤3次,最后用ECL试剂对硝酸纤维素膜进行显色,暗室曝光,拍照,灰度分析。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验或ANOVA方差分析,以P < 0.05为差异有统计学意义。
2 结果
2.1 藤黄酸对人结肠癌HCT116细胞生长增殖的抑制作用
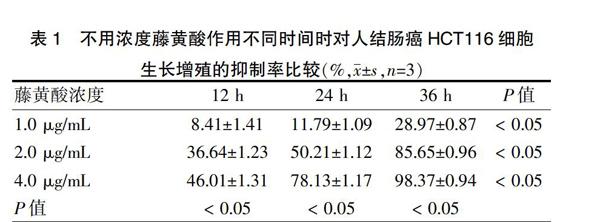
不同浓度的藤黄酸对HCT116细胞呈现出不同的抑制作用,当藤黄酸浓度为0 μg/mL时,其对HCT116细胞基本没有抑制作用,处理12、24、36 h后,抑制率分别为(0.71±1.21)、(0.89±1.01)、(1.07±0.97)%;当藤黄酸浓度分别为1.0、2.0、4.0 μg/mL时,处理12、24、36 h后抑制率逐渐升高,且相同浓度不同时间点的抑制率差异有统计学意义(P < 0.05),不同浓度相同时间点的抑制率差异有统计学意义(P < 0.05)。提示藤黄酸对人结肠癌HCT116细胞的生长和增殖具有一定的抑制作用,且抑制率随着药物浓度的增加和作用时间的延长而逐渐升高,抑制作用呈浓度及时间依赖性。见表1。
表1 不用浓度藤黄酸作用不同时间时对人结肠癌HCT116细胞
生长增殖的抑制率比较(%,x±s,n=3)
2.2 藤黄酸对人结肠癌HCT116细胞周期的影响
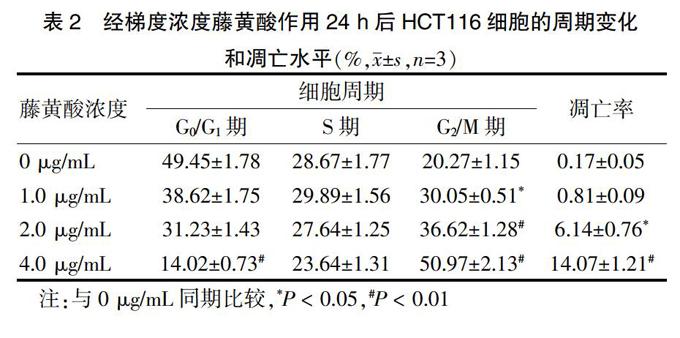
藤黄酸作用人结肠癌HCT116细胞后,可显著改变其细胞周期中各期细胞的构成。经1.0 μg/mL的藤黄酸处理24 h后,处于G2/M期的细胞数量较对照组增加,差异有统计学意义(P < 0.05),提示人结肠癌HCT116细胞已被阻断于G2/M期。此时细胞凋亡水平为(0.81±0.09)%,与对照组比较差异无统计学意义(P > 0.05);浓度为2.0 μg/mL时,G2/M期细胞数量较对照组明显增加,差异有高度统计学意义(P < 0.01);当藤黄酸剂量浓度增至4.0 μg/mL时,有50%以上的HCT116细胞被阻断于G2/M期,而处于G0/G1期的细胞数量则相应减少,与对照组比较,差异均有高度统计学意义(P < 0.01)。HCT116细胞的凋亡峰在药物浓度4.0 μg/mL时为(14.07±1.21)%,且2.0及4.0 μg/mL的藤黄酸与对照组比较,差异均有高度统计学意义(P < 0.05或P < 0.01),提示藤黄酸对人结肠癌HCT116细胞的生长增殖具有一定的抑制作用,结果呈浓度依赖性。见表2。
表2 经梯度浓度藤黄酸作用24 h后HCT116细胞的周期变化
和凋亡水平(%,x±s,n=3)
注:与0 μg/mL同期比较,*P < 0.05,#P < 0.01
2.3 藤黄酸作用人结肠癌HCT116细胞后Gankyrin表达量的变化
分别用0、1.0、2.0、4.0 μg/mL藤黄酸处理HCT116细胞24 h,各组培养结束后Western blot检测各组细胞Gankyrin蛋白表达水平,以GAPDH为内参,应用IPP测量各组平均灰度值。在相对分子量26kD处可见清晰Gankyrin蛋白条带,当藤黄酸浓度为0、1.0、2.0、4.0 μg/mL时其灰度值分别为(723.00±3.61)、(597.00±2.14)、(392.00±1.54)、(101.00±0.74),差异有统计学差异(P < 0.05)。提示经藤黄酸作用后Gankyrin蛋白的表达受到抑制,且随着藤黄酸浓度的升高,Gankyrin蛋白表达逐渐减少。见图1。
1:0 μg/mL;2:1.0 μg/mL;3:2.0 μg/mL;4:4.0 μg/mL;GAPDH:内参
图1 不同浓度藤黄酸处理后HCT116细胞中Gankyrin蛋白表达水平
3 讨论
结直肠癌是目前国内外最常见的恶性肿瘤之一,发病率呈逐年上升趋势,目前位居全球恶性肿瘤第3位[3-4]。其在经济发达国家发生率较高,是西方国家第2位高发的恶性肿瘤,美国结直肠癌的病死率位居所有癌症死因的第3位[5]。根据我国纳入肿瘤发生率监控的5个大城市近10年结直肠癌的发生率变化,各地区结直肠癌的发生率均有不同程度的上升,其中上海和北京上升最快,广州地区发病率已跃升至全国第3位[6]。而结直肠癌在广州地区的发病率已经高居所有肿瘤的第2位,仅次于肺癌,发病情况不容乐观[7]。目前对于结肠癌的主要治疗手段包括手术、化疗、放疗及三者的联合治疗等,现阶段药物治疗虽然可以降低患者的复发率,延长患者的生命,但是化疗药物的毒副作用使其应用受到了限制,且个别化疗效果欠佳。开发研究新的高效低毒药物,增强化疗药物特异性和敏感性是当前化疗领域的研究热点。
藤黄是藤黄科植物藤黄树干经切伤后所分泌的干燥树脂[8]。而藤黄酸是植物中药藤黄所分泌的干燥树脂的主要成分。中医药学记载,藤黄,酸、涩、凉、有大毒[9]。但藤黄具有抗炎、止血、抑菌、抗病毒等多种功效,常用于治疗跌打损伤、脓肿、疖痈及各种体藓[10]。藤黄酸分子式为C38H44O8,相对分子量为628.76,为橙黄色无定型粉末,具有光学活性[11]。现代研究表明藤黄酸具有潜在的抗肿瘤效应,能够抑制多种肿瘤的生长、侵袭转移及促进肿瘤细胞的凋亡等功能。藤黄酸在有效剂量范围内的毒副作用相对来说比较小,有非常高的肿瘤细胞抑制选择性,能够选择性地杀死癌细胞,而对正常动物机体的免疫功能和骨髓造血系统影响却非常小,相对现阶段临床常规化疗药物优势明显[12]。
Gankyrin作为近年发现的一个癌相关蛋白,与肿瘤细胞的细胞周期乃至凋亡存在明显相关性。它作为一个重要组成部分,参与26S蛋白酶体的构成。Gankyrin不仅参加调控P53及Rb通路,而且其与相关26S蛋白酶体参与DNA双链的修复过程,具有抗凋亡作用。Gankyrin可与MDM2结合,促使p53泛素化降解,也可作用于CDK4蛋白,促使Rb磷酸化降解。Gankyrin曾被报道可诱导NIH3T3细胞具有非依赖支持生长的功能,且使细胞瘤化[13-15]。近年来研究报道以及生物信息学数据库分析结果显示,Gankyrin与肝癌、胰腺癌、食道癌、胃癌、结直肠癌、肺癌、乳腺癌等多种肿瘤相关[16-21]。
本研究结果提示藤黄酸对人结肠癌HCT116细胞有明显的增殖抑制作用,当藤黄酸浓度≥1.0 μg/mL时,其对HCT116细胞具有明显抑制作用,且随着时间的延长,其抑制率逐渐升高,结果呈现浓度及时间依赖性。
流式细胞仪检测藤黄酸对人结肠癌HCT116细胞的G2/M期具有明显的阻滞作用,提示藤黄酸可以抑制HCT116细胞的DNA合成,从而阻止细胞周期中有丝分裂的关键进程,且主要使细胞停滞于细胞周期的G2/M期。而细胞周期的监测点和这种细胞周期的停滞存在一定关系,当细胞受损后于对应的检测点进行相关DNA修复时无法对受损DNA进行功能修复,细胞就会程序性死亡[22]。流式细胞检测结果提示除细胞周期阻滞外,藤黄酸还促进人结肠癌HCT116细胞的凋亡,本研究结果提示,在1.0 μg/m浓度状态下,HCT116细胞的凋亡情况与对照组比较,差异无统计学意义,当浓度为2.0、4.0 μg/mL时,HCT116细胞凋亡率显著上升,但总体凋亡率较周期阻滞率仍较低,提示藤黄酸这种药物作用于人结肠癌HCT116细胞时主要是由于对细胞周期阻滞的诱导作用,从而在一定程度上抑制了HCT116细胞的生长及增殖。
综上所述,藤黄酸对人结肠癌HCT116细胞的增殖具有明显的抑制作用并可诱导其凋亡,其机制可能是通过抑制Gankyrin的表达实现的。因此藤黄酸能够有效地诱导结肠癌细胞凋亡,在结肠癌的预防和治疗中具有广阔的应用前景,但其作用机制仍需进一步阐明。
[参考文献]
[1] 杨平,曹杰,谭明华,等.藤黄酸逆转人结肠癌细胞株SW480奥沙利铂耐药性的作用及机制研究[J].中华普通外科学文献:电子版,2013,7(4):273-277.
[2] 梁文龙,曹杰,杨平,等.藤黄酸对人结肠癌SW480细胞裸鼠移植瘤生长及血管生成的影响[J].廣东医学,2014, 35(16):2498-2501.
[3] 王磊,宋顺心,汪建平,等.结直肠癌实验研究现状及展望[J].中华实验外科杂志,2013,30(3):429-430.
[4] Shankat A,Mongin SJ,Geisser MS,et al. Long-term mortality after screening for colorectal cancer [J]. N Engl J Med,2013,369(12):1106-1114.
[5] Jemal A,Bray F,Center MM,et al. Global cancer statistics [J]. CA Cancer J Clin,2011,61(2):69-90.
[6] 王成兴,曹杰,杨平,等.年轻大肠癌患者非职业相关因素的调查分析[J].广州医药,2014,45(4):1-4.
[7] 广州市疾病预防控制中心.2013-2014广州市肿瘤登记年报[M].广州:广州市疾病预防控制中心,2015.
[8] 南京医学院.药材学[M].北京:人民卫生出版社,1960:161.
[9] 李时珍.本草纲目·第2册[M].北京:人民卫生出版社,1977,1344.
[10] 廖述文,杨平,张通,等.藤黄酸对结肠癌LoVo细胞增殖和侵袭能力的影响[J].国际中医中药杂志,2014,36(3):220-222.
[11] 柳文媛.抗肿瘤新药藤黄酸的结构、代谢产物及构效关系的研究[D].南京:中国药科大学,2004.
[12] 周兰贞,陈红波,李庆林,等.藤黄酸的抗肿瘤作用机制研究进展[J].安徽医药,2011,(3):269-271.
[13] 王倩,程堃.Gankyrin基因沉默对人卵巢癌SKOV3/CDDP细胞顺铂耐药性的逆转作用和机制[J].中国癌症杂志,2014,24(1):35-40.
[14] Kuo TC,Chang PY,Huang SF,et al. Knockdown of HURP inhibits the proliferation of hepacellular carcinoma cells via downregulation of gankyrin and accumulation of p53 [J]. Biochemical Pharmacology,2012,83(6):758-768.
[15] 王菁,姜爱民.Gankyrin与消化系统肿瘤关系的研究进展[J].现代生物医学进展,2014,14(4):789-791.
[16] Meng Y,He L,Guo X,et al.Gankyrin promote the proliferation of human pancreatic cancer [J]. Cancer Lett,2010, 297(1):9-17.
[17] Ortiz CM,Ito T,Tanaka E,et al. Gankyrin oncoprotein overexpression as a critical factor for tumor growth in human esophageal squamous cell carcinoma and its clinical significance [J]. Int J Cancer,2008,122(2):325-332.
[18] Chen X,Zhang M,Liu LX. The overexpression of multidrug resistance-associated proteins and gankyrin contribute to arsenic trioxide resistance in liver and gastric cancer cells [J]. Oncol Rep,2009,22(1):73-80.
[19] Tang S,Yang G,Meng Y,et al. Overexpression of a novel gene gankyrin correlates with the malignant phenotype of colorectal cancer [J]. Cancer Biol Ther,2010,9(2):88-95.
[20] Man JH,Liang B,Gu YX,et al. Gankyrin plays an essential role in Ras-induced tumorigenesis through regulation of the RhoA/ROCK pathway in mammalian cells [J]. J Clin Invest,2010,120(8):2829-2841.
[21] Zhen C,Chen L,Zhao Q,et al. Gankyin promote breast cancer cell metastasis by regulating Racl activity [J]. Oncogene,2013,32(29):3452-3460.
[22] Caron C,Spring K,Laramée M,et al. Non-redundant roles of the Gab1 and Gab2 scaffolding adapters in VEGF-mediated signalling,migration,and survival of endothelial cells [J]. Cell Signal,2009,21(6):943-53.
(收稿日期:2015-11-12 本文編辑:任 念)

