超高效液相色谱—电喷雾串联质谱法测定芒果中的吡虫啉和噻嗪酮
林靖凌 李胤均 徐志


摘要:采用超高效液相色谱-电喷雾串联四级杆质谱仪,多反应监测(MRM)模式下建立了吡虫啉和噻嗪酮在芒果(Mangifera indica L.)中的定性及定量分析方法。样品经纯水-乙腈漩涡振荡提取,经分散固相萃取净化,超高效液相色谱-电喷雾串联质谱仪测定。结果表明,在0.001~0.1 μg/mL质量浓度范围内,农药峰面积与进样质量浓度间均呈良好的线性关系(r>0.999),最小检出量(LOD)为5 ng,最低检测浓度(LOQ)为0.005 mg/kg,回收率在84%~101%之间,相对标准偏差(RSD,n=5)为1.9%~6.9%之间。该方法准确、简单、灵敏度高,适用于芒果中吡虫啉、噻嗪酮残留的检测。
关键词:芒果(Mangifera indica L.);吡虫啉;噻嗪酮;超高效液相色谱-电喷雾串联质谱
中图分类号:O657.6 文献标识码:A 文章编号:0439-8114(2016)06-1545-03
DOI:10.14088/j.cnki.issn0439-8114.2016.06.046
吡蟲啉(Imidacloprid)是硝基亚甲基类内吸杀虫剂,为烟酸乙酰胆碱酯酶受体的作用体,作用机制是干扰害虫运动神经系统使化学信号传递失灵,可用于防治刺吸式口器害虫,如蚜虫、蓟马、飞虱等[1-4]。噻嗪酮(Buprofezin),杂环噻二嗪类昆虫生长调节剂,作用机制是抑制昆虫几丁质合成和干扰新陈代谢,导致若虫蜕皮畸形或翅畸形而缓慢死亡,触杀作用强,对飞虱、叶蝉、粉虱及介壳虫类害虫有良好防治效果[5-7]。这2种农药在生产上已被广泛使用,目前在芒果(Mangifera indica L.)上应用的混剂登记的产品仅有1个,为38%吡虫·噻嗪酮悬浮剂。目前,中国未明确规定芒果上吡虫啉、噻嗪酮最大残留限量,CAC与欧盟规定芒果上吡虫啉最大残留限量为0.2 mg/kg,噻嗪酮为0.1 mg/kg。
吡虫啉的检测方法主要有液相[4]、液质联用[8,9],噻嗪酮的检测方法有液相[10]、气相[11]、气质[12]、液质[13],涉及的基质有蔬菜、水果、粮食、水和土等,提取方法有匀浆、超声、加速溶剂萃取等,净化处理主要有固相萃取、分散固相萃取等[9-13]。本研究将农业行业标准761法和QuEChERS法结合,并加以改进与液质联用,旨在建立1个准确、简单、高灵敏度能同时测定芒果中吡虫啉和噻嗪酮的检测方法,为满足日后检测要求,保障消费安全,降低出口损失,客观评价上述农药的残留水平提供参考。
1 材料与方法
1.1 材料与试剂
吡虫啉、噻嗪酮标准品,纯度99.0%,30 mg/瓶,德国Dr Ehrenstorfer GmbH公司;乙腈,色谱纯,美国Fisher公司;无水硫酸镁、氯化钠,均为分析纯,广州化学试剂厂;分散固相萃取,Dispersive SPE 15 mL,PSA 150 mg-magnesium sulfate 900 mg,美国Agilent公司;PSA,40~63 μm,60 A,德国CNW公司;有机相针式滤器,13 mm/0.22 μm,上海安谱科学仪器有限公司。
1.2 主要仪器
超高效液相色谱系统,Acquity Ultra Performance;质谱系统,API4000;涡流混合器,XW-80A;匀浆机,IKA?誖T25;超纯水机,Milli-Q;电子天平,METTLER TOLEDO PL303。
1.3 方法
1.3.1 样品前处理 称取(5.0±0.1) g的样品于50 mL离心管中,样品中加入5.0 mL超纯水,加入乙腈10.0 mL,经涡流混合器提取2.0 min后,4 000 r/min离心5 min,上清液转入装有3.0 g氯化钠的50 mL离心管中,剧烈振荡120次,4 000 r/min离心5 min,转移上清液10.0 mL于Dispersive SPE中,经涡流混合器萃取2.0 min后,8 000 r/min离心10 min,经0.22 μm滤膜过滤,待测。
1.3.2 标准溶液配置 称取标准品,用甲醇定容成母液,吸取不同体积至容量瓶中,氮气吹干,用经“1.3.1”处理后的样品空白溶液定容,定容后浓度为0.001、0.005、0.01、0.25、0.1 μg/mL。
1.3.3 仪器条件
1)色谱条件。色谱柱:Acquity UPLC?誖BEH C18色谱柱(1.7 μm,2.1 mm×100 mm);柱温:35 ℃;流动相:A-水,B-乙腈;流速:0.25 mL/min;梯度洗脱条件:0~0.2 min, 90%A;0.2~4.5 min,10%A;4.5~5.0 min, 10%A;5.0~5.5 min, 90%A;5.5~6.0 min, 90%A;进样量:5.0 μL。
2)质谱条件。离子源:电喷雾离子源ESI;扫描方式:正离子源;碰撞气:6 psi;气帘气:20 psi;雾化器Gas1:50 psi;雾化器Gas2:50 psi;离子喷雾电压:5 500 V;离子源温度600 ℃;检测方式:多反应监测(MRM)如下表1所示。
2 结果与分析
2.1 样品前处理
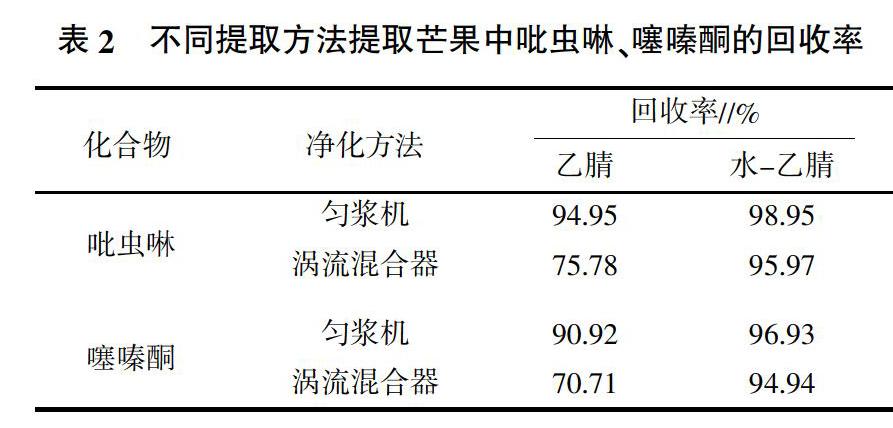
2.1.1 提取溶剂的选择 在5.0 g空白样品中加入标准溶液,浓度0.05 mg/kg,重复2次,比较了乙腈(10.0 mL)提取、水-乙腈(5.0 mL∶10.0 mL)提取2种方法。加水后的芒果在乙腈更易分散,提高提取率,具体结果见表2。
2.1.2 匀浆方法的选择 加入提取溶剂后,对比了匀浆机(18 000 r/min匀浆2 min)和涡流混合器(涡流混合2 min)2种提取方式。使用纯乙腈提取时,由于芒果含糖量高(不同品种和成熟度有差异),样品在溶剂中分散程度较差,使用涡流混合器提取效果较差,匀浆机刀头破碎效果好,因此提取效果较好;提取溶剂为水-乙腈时,由于预先加入水进行润湿,样品在乙腈中分散度好,二者提取效果相近,均能满足要求。但匀浆机的使用过程需要清洁刀头,增加了劳动量,另外噪音大,因此选择涡流混合器进行提取。具体提取结果见表2。
2.1.3 净化方法的选择 在具塞试管中加入标准溶液,吹干后加入10.0 mL空白样品提取液,定容后浓度为0.025 μg/mL,转移至分散固相萃取剂中,重复5次,共两组,比较了A、B两种分散固相萃取剂的净化效果:A(Dispersive SPE,15 mL,PSA 150 mg-magnesium sulfate 900 mg,Agilent),和现配现用的分散固相萃取剂B(150 mg,PSA 40~63 μm,60A)+无水硫酸镁(900 mg),二者净化杂质效果相近。综合比较,A价格略贵,但可节省大量劳动力,重现性较好,8 000 r/min离心后,分散固相不易重新散开,因此选择A作为净化方法。具体结果见表3。
2.2 方法的线性相关性
采用外标法峰面积定量,用乙腈配制吡虫啉、噻嗪酮标准贮备液。为消除基质效应,移取不同体积的母液,氮气吹干溶剂后,用经“1.3.1”条件处理后的样品空白定容,定容后浓度为0.001、0.005、0.01、0.025、0.1 μg/mL,注射标准工作系列溶液,绘制标准曲线,吡虫啉保留时间为2.13 min,噻嗪酮保留时间为5.19 min。结果表明,在该条件范围内,仪器响应值与进样量呈良好的线性关系,具体结果见表4,标准谱图见图1。
2.3 方法的回收率、精密度
在芒果果肉中,添加吡虫啉、噻嗪酮标准溶液0.005、0.050、0.200 mg/kg,每个浓度设5个平行。吡虫啉在芒果果肉中的回收率为86%~102%,相对标准偏差1.9%~4.3%,噻嗪酮在芒果果肉中的回收率84%~101%,相对标准偏差3.3%~6.9%,该方法的准确度和精密度符合农药残留试验准则要求(表5)。
3 小结
本研究建立了芒果中吡虫啉和噻嗪酮的超高效液相色谱法-电喷雾串联质谱检测方法,前处理方法将农业行业标准761法和QuEChERS法结合并加以改进,在一定程度上简化了操作过程,减轻了工作量,结合液质联用,能够对芒果中吡虫啉和噻嗪酮同时进行准确的定性定量分析,以基质校正曲线进行定量,消除基质影响,线性范围为0.001~0.1 μg/mL,该方法的定量限为0.005 mg/kg,该方法的回收率和精密度符合试验要求,可满足日常快速检测,为客观评价吡虫啉和噻嗪酮在芒果上的残留水平提供参考。
参考文献:
[1] 王钰冲,陈伟文,董诗浩,等.吡虫啉对东方蜜蜂的毒性研究[J]. 云南农业大学学报,2015,30(1):147-150.
[2] 张清明,冯瑞芝,张保华,等.盐胁迫下吡虫啉对棉田土壤微生物数量及酶活性的影响[J].水土保持研究,2014,21(3):25-30.
[3] 周晓静,吴 迪,周春江.11.1%吡虫啉缓释片剂在西瓜根区土壤的释放分布及在西瓜中的残留量分析[J].农药学学报,2014,16(5):586-593.
[4] 刘景坤,武春媛,邓 晓,等.吡虫啉在海南豇豆及土壤中的消解动态研究[J].热带作物学报,2014,35(6):1198-1202.
[5] 贝亚维,顾秀慧,陈华平,等.噻嗪酮的作用方式研究[J].浙江农业学报,1996,8(1):30-33.
[6] 衷敬峰,邱达椿,罗忠华,等.噻嗪酮·异丙威防治稻飞虱田间药效[J].浙江农业科学,2012(11):1555-1556.
[7] 张永忠,刘 檀,任红波.16%吡虫啉·噻嗪酮可湿性粉剂在水稻田中的残留动态研究[J].东北农业大学学报,2013,44(4):88-93.
[8] 李 芳,张 静,杨 中,等.QuEChERS/液质联用法测定蔬菜中17种农药残留[J].吉林农业科学,2013,38(3):93-96.
[9] 宋卫国,赵志辉,饶钦雄,等.水蜜桃中吡虫啉残留检测和安全性评价[J].农药,2013,52(2):125-127.
[10] 崔振峰,魏永強,韩肖聪.芹菜中噻嗪酮农药残留检测的不确定度分析[J].长春工程学院学报(自然科学版),2014,15(2):122-124.
[11] 汪芙蓉,张家俊,吴 萍,等.噻嗪酮-烯啶虫胺在水稻田样品中的残留检测方法[J].南京农业大学学报,2013,36(6):128-134.
[12] 张新忠,罗逢健,张 芬,等.分散固相萃取净化气相色谱串联质谱法测定茶叶、西葫芦和芒果中噻螨酮和噻嗪酮残留量[J].分析化学,2012,40(11):1686-1692.
[13] 胡贝贞,蔡海江,宋伟华.茶叶中氟虫腈等8种农药残留的液相色谱-串联质谱法测定及不确定度评定[J].色谱,2012,30(9):889-895.

