HPLC法测定双乙酰左旋多巴甲酯布洛芬的含量及其脂水分配系数
许崇摇 蒋伟哲 黄兴振
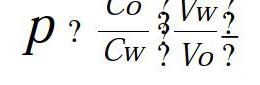
[摘要] 目的 建立双乙酰左旋多巴甲酯布洛芬的含量测定方法以及测定其脂水分配系数(LogP)。 方法 采用HPLC法和摇瓶法(正辛醇/水体系),Synergi Fusion-RP-C18色谱柱(4.6 mm×250 mm,4 μm);流动相为水-甲醇(25∶75,V∶V);流速0.8 mL/min,检测波长226 nm,柱温40℃,进样量为20 μL。 结果 双乙酰左旋多巴甲酯布洛芬质量浓度在8.5~340 μg/mL范围内与峰面积线性关系良好,r=0.9999,平均回收率为99.81%,RSD为0.36%( n = 6)。样品平均含量为98.26%,其LogP约为1.4。 结论 该检测方法准确、简便,精密度高,可用于双乙酰左旋多巴甲酯布洛芬酯的含量测定。
[关键词] 高效液相色谱法;双乙酰左旋多巴甲酯布洛芬酯;脂水分配系数;含量测定
[中图分类号] R927.2 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0149-04
[Abstract] Objective To establish a method for determine the content and partition coefficient (LogP) of diacetyl L-dopa methylester ibuprofen. Methods Shaking-flask method (n-Octanol/water system) and HPLC method were used. The Synergi Fusion-RP C18 column (4.6 mm×250 mm, 4 μm) was used and the mobile phase was H2O-CH3OH (25∶75,V∶V), the flow rate was 0.8 mL/min. The detection wavelength was 226 nm. The column temperature was 40℃ and the injective volume was 20 μL. Results A good linear relationship was observed in the concentration range of 8.5-340 μg/mL, with the correlation coefficient of 0.9999. The average recovery rate was 99.81% and RSD was 0.36% (n=6). The average content of diacetyl L-dopa methylester ibuprofen was 98.26%, and the LogP was about 1.4. Conclusion The determination method was accurate and sensitive with high precision, which can be applicable for the content assay of diacetyl L-dopa methylester ibuprofen.
[Key words] HPLC method; Diacetyl L-dopa methylester ibuprofen; Partition coefficient; Content determination
帕金森病是一种脑内的多巴胺能神经元病变为特征的神经元退化性疾病[1-2],目前临床药物治疗仍以左旋多巴(L-dopa)为主,但是L-dopa在治疗过程中会引起较多的副作用和生物利用度低等问题[3-5]。近年来有研究发现,布洛芬每周服用2~3次,患帕金森病的高龄人发生率减少30%左右;虽然布洛芬减少患帕金森病发病率的机制尚不清楚,但是目前认为,这可能与布洛芬的抗炎作用有利于降低导致帕金森病的细胞死亡有关[6]。这一发现将有助于帕金森病新治疗药物的研发。双乙酰左旋多巴甲酯布洛芬(diacetyl L-dopa methylester ibuprofen)为L-dopa与布洛芬拼合得到的一个潛在的治疗帕金森病的酰胺化合物,其化学名为4-[(2S)-2-(2-(4-异丁苯基)丙酰胺基]-3-甲氧基-3-氧代丙基)-1,2-苯二乙酸酯[4-((2S)-2-(2-(4 -isobutylphenyl)propanamido)-3-methoxy-3-oxopropyl)-1,2-phenylene diacetate],化学结构式见图1。为了对双乙酰左旋多巴甲酯布洛芬作进一步的研究和开发,笔者建立了其含量测定方法,并用HPLC法检测了其脂水分配系数(LogP),该法可用于其质量控制和检测分析,现报道如下:
1 仪器与试剂
EL204梅特勒-托利电子天平[梅特勒-托利多仪器(上海)有限公司];LC20AVP高效液相色谱仪(日本岛津公司);SHA-CA数显水浴恒温振荡器(金坛市易晨仪器制造有限公司);甲醇(Fisher公司,色谱纯,批号:111773);蒸馏水自制;其他试剂均为分析纯;双乙酰左旋多巴甲酯布洛芬样品(批号分别为20120101, 20120102和20120103),双乙酰左旋多巴甲酯布洛芬对照品(经纯化精制,其纯度为98.80%,百分归一化法)由实验室合成精制。
2 方法与结果
2.1 色谱条件
色谱柱为Synergi Fusion-RP80A C18柱(4.6 mm×250 mm,4 μm),流动相使用水-甲醇(25∶75,V∶V),流速为0.8 mL/min,检测波长为226 nm,柱温40℃,自动进样器进样,进样量为20 μL。
2.2 溶液配制
2.2.1 样品溶液配制 取双乙酰左旋多巴甲酯布洛芬对照品适量,精密称定,置100 mL容量瓶中,以流动相溶解,定容至刻度,摇匀,配制成浓度约为340 μg/mL对照品储备液,备用。取双乙酰左旋多巴甲酯布洛芬样品适量,精密称定,置100 mL容量瓶中,以流动相溶解,定容至刻度,摇匀,配制成浓度约为136 μg/mL的供试品溶液,备用。以流动相作为空白对照溶液。
2.2.2 缓冲溶液配制 pH值1.3缓冲液:取0.2 mol/mL KCl 25 mL和0.2 mol/L HCl 33.6 mL,混合再加蒸馏水稀释至100 mL,即得。
pH值5.0缓冲液:取0.2 mol/mL的NaH2PO4溶液,用NaOH试液调pH值至5.0,即得。(NaOH试液:NaOH 4.3 g,加水溶解成100 mL,即得。)
pH值7.4缓冲液:取KH2PO4 1.36 g,加0.1 mol/mL NaOH溶液79 mL用蒸馏水稀释至200 mL,即得。
2.3 方法学考察
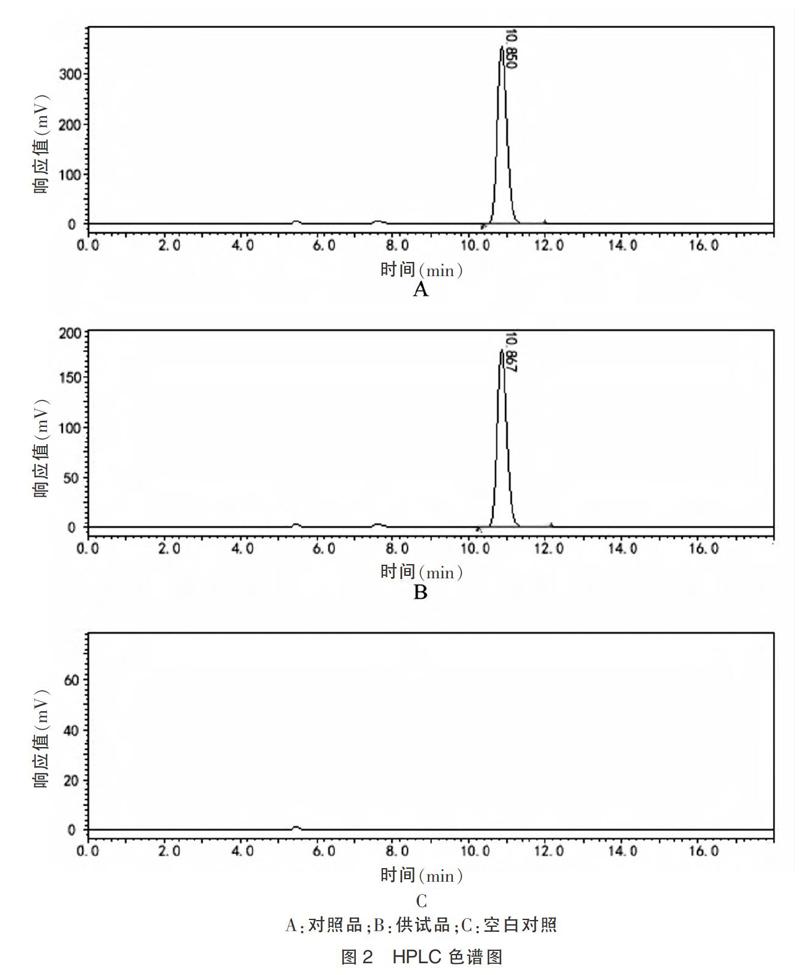
2.3.1 系统适应性试验 按“2.2.1”项下方法配制对照品和样品溶液,分别进样20 μL,按“2.1”项下色谱条件测定,结果显示,供试品溶液(图2B)色谱峰与双乙酰左旋多巴甲酯布洛芬对照品溶液(图2A)色谱峰保留时间相一致,空白对照溶液(图2C)显示无干扰,理论塔板数以双乙酰左旋多巴甲酯布洛芬峰计不低于5000,见图2。
2.3.2 线性关系考察 精密吸取上述对照品贮备溶液(340 μg/mL)10、8、4、2、1、0.5、0.25 mL,置于10 mL容量瓶,以流动相稀释至刻度,摇匀,制得浓度分别为340、272、204、136、68、34、17、8.5 μg/mL的对照品溶液,进样20 μL,记录色谱峰面积,以双乙酰左旋多巴甲酯布洛芬浓度为横坐标,峰面积为纵坐标,绘制标准曲线。结果,标准曲线方程为Y= 29 172X + 32 001,r =0.9999。
2.3.3 精密度试验 取浓度为136 μg/mL的对照品溶液按色谱条件连续进样6次,每次进样20 μL,以峰面积考察其日内精密度。试验结果显示,平均峰面积为4 034 815.3,RSD为0.39%(n = 6),表明仪器进样精密度较好。
2.3.4 稳定性试验 取浓度为136 μg/mL的对照品溶液每隔一定时间(0、2、4、8、12 h)进样20 μL测定,每次测定2针,平均峰面积为4 034 504.5,RSD为0.59%(n = 5),试验表明对照品溶液在12 h内保持稳定。
2.3.5 重复性试验 取同一批供试品(批号:20120102),按供试品溶液的配制方法平行配制3份,按色谱条件方法测定结果,3份样品测定平均值为98.20%,RSD为0.04%(n = 3),表明重复性良好。
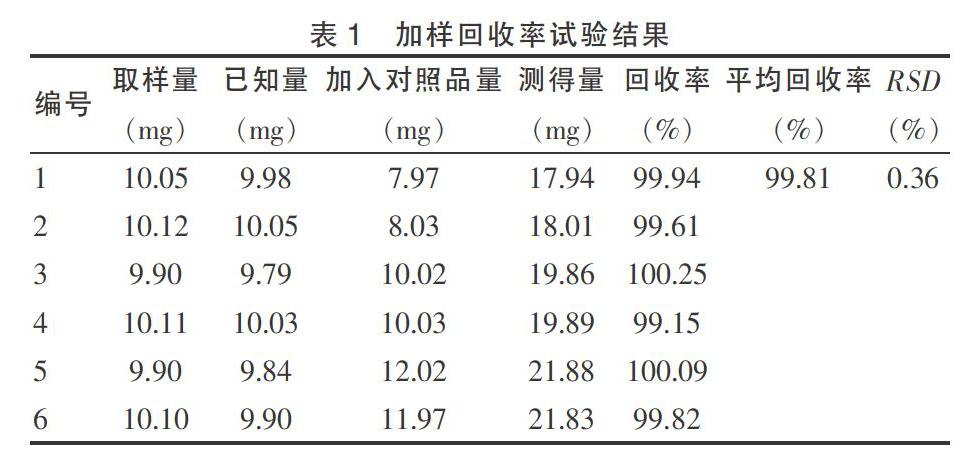
2.3.6加样回收率试验 取已知含量的双乙酰左旋多巴甲酯布洛芬样品约10 mg(批号:20120101)6份,精密称定,置100 mL容量瓶中,每两份中分别精密加入干燥至恒重的对照品约8、10、12 mg,以流动相溶解,定容至刻度,摇匀。按色谱条件方法测定,计算回收率[7-8]。结果,平均回收率为99.81%,RSD为0.36%(n = 6),表明加样回收结果符合要求。结果见表1。
2.3.7 定量限及检测限 在该色谱条件下,按信噪比(S/N)为3和10分别对检测限和定量限进行测定。对照品溶液逐级稀释后进样,测定结果显示,浓度为15.2 μg/mL进样量为0.1 μL时,主峰信号约为噪音信号的3倍;进样量为0.3 μL时,主峰信号约为噪音信号的10倍,即最低检测限和定量限分别为1.52、4.56 ng。
2.3.8 脂水分配平衡时间考察 称取双乙酰左旋多巴甲酯布洛芬约5 mg,加正辛醇(水饱和)于250 mL容量瓶中溶解,定容。取20 mL含样品的正辛醇(水饱和)溶液至锥形瓶,加入20 mL蒸馏水(正辛醇饱和),加塞密封,同样处理5份,置25℃水浴恒温振荡器分别剧烈振摇0.25、0.5、1、1.5、2 h,转入分液漏斗中静置,分离出水相和有机相,以水相进样20 μL,当含量不再增减时,即为平衡时间[9-11]。结果,振摇1 h时达到分配平衡。
3 结果
3.1 样品含量测定
稱取3批样品分别约为10 mg,精密称定,置100 mL容量瓶,加流动相溶解并稀释至刻度,摇匀,进样20 μL,记录色谱峰;另取对照品溶液,同法操作,以外标法峰面积计算。结果显示,批号为20120101、 20120102和20120103样品双乙酰左旋多巴甲酯布洛芬的含量分别为98.40%、98.18%、98.20%,平均含量为98.26%。
3.2 LogP的测定
按“2.3”项下“脂水分配平衡时间考察”方法,准确量取20 mL含双乙酰左旋多巴甲酯布洛芬的正辛醇(水饱和)溶液至锥形瓶,加20 mL蒸馏水、pH值7.4缓冲液、pH值5.0缓冲液和pH值1.3缓冲液(分别用正辛醇饱和),分别平行操作2份,加塞密封后振摇1 h(25℃),转入分液漏斗中静置,分离出水相和有机相,取有机层和水层溶液分别进样,检测分析样品浓度,计算不同pH值溶液下的脂水分配系数,计算公式为
4 讨论
双乙酰左旋多巴甲酯布洛芬的甲醇溶液(80 μg/mL)在200~400 nm波长范围内光谱扫描,有两个最大吸收峰分别为210、226 nm,因此选取226 nm作为检测波长;由于Synergi Fusion-RP 80A C18柱芯填充颗粒比较细(4 μm),柱温在室温时柱子压力较高,柱温在40℃条件下时柱压较为理想,不影响结果的分析;流动相采用水-甲醇(25∶75,V∶V),流速为0.8 mL/min时出峰时间大约为11 min。在该分析条件下,双乙酰左旋多巴甲酯布洛芬的检测限和定量限分别为1.52、4.56 ng,3批样品的平均含量为98.26%。
正辛醇-水为有机化合物测定脂水分配系数方法常用的溶液体系,有机化合物具有合适的LogP将有利于机体的吸收和转运,发挥更好的疗效[15]。笔者首先考察了双乙酰左旋多巴甲酯布洛芬在正辛醇和水溶液中分配平衡时间,发现在该实验条件下振摇60 min分配达到平衡。为了探讨双乙酰左旋多巴甲酯布洛芬在不同pH值缓冲溶液中的脂水分配情况[16-18],笔者还采用了蒸馏水、pH值7.4缓冲液、pH值5.0缓冲液和pH值1.3缓冲液作为水相,分别测定分析其LogP,发现其LogP分别为1.44、1.45、1.66和1.44(25℃),说明该化合物在不同pH值溶液中均具有较高的脂溶性[19-20]。其在不同pH值缓冲溶液中的LogP略有差别,可能与双乙酰左旋多巴甲酯布洛芬在不同pH值条件下的稳定性情况不同有关。
本文建立了双乙酰左旋多巴甲酯布洛芬的含量检测方法,操作较为简便、重复性好,可用于质量控制和分析检测以及反应过程的动态监测。
[参考文献]
[1] 安殿红.美多巴联合普拉克索治疗帕金森病的临床有效性及安全性[J].中国医药指南,2015,13(25):158.
[2] 秦皎娇,张琦,丁斐.帕金森病的治疗进展[J].南通大学学报:医学版,2015,35(3):211-215.
[3] 蒋雨平.对左旋多巴长期治疗帕金森病的评价[J].中国临床神经科学,2014,22(1):19-21.
[4] Hagan JJ,Middlemiss DN,Sharpe PC,et al. Parkinson's disease: prospects for improved drug therapy [J]. Trends in Pharmacological Sciences,1997,18(5):156-163.
[5] Blandini F,Greenamyre JT. Protective and symptomatic strategies for therapy of Parkinson's disease [J]. Drugs of Today,1999,35(6):473-483.
[6] Gao X, Chen H, Schwarzschild MA,et al. use of ibuprofen and risk of parkinson disease [J]. Neurology,2011,76(10):854-869.
[7] 潘俏凤.HPLC法测定盐酸左旋多巴甲酯的含量研究[J].中国医药导报,2010,7(21):51-52.
[8] 郑晓青,李浩.超高效液相色谱法测定复方止颤颗粒中二苯乙烯苷含量[J].安徽医药,2015,19(10):1885-1886.
[9] 于秀珍,何珺,钱一鑫,等.HPLC法测定大豆苷元的平衡溶解度和表观油水分配系数[J].安徽农业科学,2009,37(10):4367-4368.
[10] 朱彧,刘梦源,刘培毅,等.γ2氨基丁酸脂溶性前体药物合成及脂水分配系数测定[J].中国现代应用药学杂志, 2008,25(4):275-278.
[11] 孙洁胤,周芝芳,刘放.苦参素油水分配系数及pH值对其的影响[J].浙江省医学科学院学报,2006, 1:19-21.
[12] 钟玲,臧志和,吴敏,等.芦丁在不同介质中平衡溶解度的测定[J].时珍国医国药,2009,20(4):874-875.
[13] 王庆伟,梅其炳,刘雪英,等.染料木黄酮的物化常数测定[J].中国医院药学杂志,2003,23(12):729-730.
[14] 王弘,陈济民,张清民.黄芩苷的物化常数测定[J].沈阳药科大学学报,2000,17(2):105-106.
[15] 王艷玲,李婕,王任小.有机化合物脂水分配系数和溶解度的计算方法[J].物理化学学报,2010,26(7):1742-1754.
[16] Piera S,Antonio I,Laura SC,et al. New L-dopa codrugs as potential antiparkinson agents [J]. Arch Pharm Chem Life Sci,2008,341(7):412-417.
[17] 何翊,秦燕,范亚苇,等.槲皮素及其乙酸乙酯衍生物的平衡溶解度和油水分配系数的测定[J].食品科学,2015, 36(14):55-58.
[18] 涂瑶生,付建武,张建军,等.姜黄素和胡椒碱溶解度和表观油水分配系数的测定[J].按摩与康复医学,2013, 4(12):114-117.
[19] 高旭,于悦,王亚静,等.补骨脂酚平衡溶解度和表观油水分配系数的测定[J].华西药学杂志,2013,28(3):285-286.
[20] Jukka L,Juhani H,Tapio N,et al. Design and synthesis of a novel L-dopa-entacapone codrug [J]. J Med Chem,2002,45(6):1379-1382.
(收稿日期:2015-11-01 本文编辑:赵鲁枫)

