RNAi沉默CXCR6基因对肺癌A549细胞增殖、体外侵袭力和裸鼠成瘤能力的影响
周慧芬 王定淼 李勇湖北科技学院基础医学院病理教研室,湖北 咸宁 43700咸宁市中心医院重症医学科,湖北 咸宁 43700
3咸宁市卫生服务中心,湖北 咸宁 437100
RNAi沉默CXCR6基因对肺癌A549细胞增殖、体外侵袭力和裸鼠成瘤能力的影响
周慧芬1王定淼2李勇3#
1湖北科技学院基础医学院病理教研室,湖北咸宁4371002咸宁市中心医院重症医学科,湖北咸宁437100
3咸宁市卫生服务中心,湖北咸宁437100
目的探讨RNAi沉默CXC型趋化因子受体6(CXCR6)基因对A549细胞增殖、体外侵袭力和裸鼠成瘤能力的影响。方法MTT法和Transwell小室模型检测稳定沉默CXCR6基因的A549细胞增殖和细胞侵袭迁移能力。将稳定沉默CXCR6的A549细胞与正常A549细胞分别皮下接种裸鼠,观察接种后肿瘤生长情况。结果稳定沉默CXCR6基因的A549细胞与正常A549细胞相比,前者增殖速率下降(P<0.05),平均增殖抑制率为30.70%;前者的体外侵袭力也降低(P<0.05),平均侵袭抑制率为74.93%,平均迁移抑制率为70.19%。裸鼠体内实验显示,稳定沉默CXCR6基因的A549细胞与正常A549细胞相比,其裸鼠体内成瘤能力降低(P<0.05),瘤体重量下降了62.5%。结论RNAi沉默CXCR6基因,可以抑制A549细胞的增殖、体外侵袭力和成瘤能力。
RNAi干扰;CXCR6基因;肺癌;增殖;侵袭力
Oncol Prog,2016,14(4)
肺癌是全球发病率和死亡率最高的恶性肿瘤之一。虽然肺癌的多学科综合治疗水平已经得到较大提高,但5年生存率只有15%左右[1]。据研究报道,应用RNAi技术沉默CXCR4可明显抑制肿瘤细胞的转移[2-3]。但是,RNAi技术应用于CXC型趋化因子受体6(CXC chemokine receptor,CXCR6)基因还没有文献报道过。因此,我们应用RNAi技术特异性沉默CXCR6基因,降低CXCR6的表达,观察是否能抑制肺癌细胞的增殖、侵袭及迁移[3-4]。目前,CXCR6基因在肿瘤尤其在肺癌中的作用机制尚未明确,使用RNAi技术干扰CXCR6基因表达,观察对肺癌细胞的影响,可为肿瘤的治疗提供依据。本研究采用RNAi技术靶向沉默CXCR6基因,探讨其对肺癌A549细胞增殖、体外侵袭力和裸鼠成瘤能力的影响。
1 材料与方法
1.1实验材料
人肺腺癌细胞系A549由上海大学基础医学部免疫学实验室提供。
靶向CXCR6基因的shRNA表达质粒由上海吉凯公司合成,引物及其序列见下:
噻唑蓝(MTT)为北京普利莱基因技术有限公司产品;24孔培养板、96孔培养板为Corning公司产品;Transwell板为Corning公司产品;二甲基亚砜(dimethyl sulfoxide,DMSO)为Sigma公司产品;4%多聚甲醛溶液购自北京赛驰生物有限公司;苏木素染色液为碧云天产品;稀盐酸、75%乙醇和PBS缓冲液、1m l注射器、刻度标尺由实验室自行配置。
BALB/C裸鼠,雄性,4~6周龄,(18±2)g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2011-0003],SFP级环境饲养。
1.2实验方法
1.2.1脂质体法CXCR6-shRNA转染A549细胞及构建稳定转染A549细胞株把培养瓶内细胞生长处于对数期的A549细胞消化下来,以2×105/孔数目接种于6孔细胞培养板内,各孔放入2 m l完全培养基。当细胞融合率达到70%左右,用脂质体lipofectam ine 2000转染细胞。将细胞分为实验组(phU6/GFP/Neo-CXCR6)、阴性对照组(phU6/GFP/ Neo)和空白对照组(Mock),分别转染phU6/GFP/ Neo-CXCR6、phU6/GFP/Neo-NC及脂质体。按每个孔有l×105/孔细胞种24孔细胞培养板,等待细胞贴壁以后将0、100、200、400、800、1000 μg/μl这6个浓度分别加入对应的G418体积数。然后,每天观察细胞的死亡状况,当所有的细胞死亡时最低的G418浓度就可以确定为最终的稳筛细胞浓度。在转染后第二天将细胞消化下来,稀释接种24 h后加入G418试剂进行筛选,初始质量浓度为800 μg/m l,当有大量细胞死亡时,将G418浓度减半维持筛选,筛选2周后,可见有抗性克隆出现,通过荧光监测有效转染克隆情况,挑选阳性克隆转入24孔板扩大培养,直至扩增至25 cm2的培养瓶体系,同时将G418浓度改为200 μg/m l继续维持筛选。
1.2.2用MTT法检测细胞增殖实验分为3组:未转染对照组(Blank-control)、phU6/GFP/Neo-control组(shRNA-control)和phU6/GFP/Neo-CXCR6组(CXCR6-shRNA)。每组每个时间点设5个复孔,将细胞以2×103/孔的密度种植于96孔板,37℃培养24 h后每孔每100 μl培养基加入10 μl MTT stock(5 mg/m l),37℃培养箱内继续孵育4 h。4 h后吸出孔内液体,各个孔内放入100 μl DMSO,振荡培养板,10 m in后用酶标机测定570 nm处的光吸收度OD值。
1.2.3Transwell膜侵袭实验检测A549细胞侵袭迁移能力的影响实验也分为3组:正常对照组组、阴性对照组和干扰组。在24孔板每孔内加入含10%FBS 600 μl RPM I 1640培养液。收集生长处于对数期的各组细胞,将其重新悬浮于无血清培养基内,调成使用浓度为l×105/m l。将细胞悬液加入Transwell小室上室中,每孔100 μl,将小室浸于24孔板的条件培养基中,37℃5%CO2培养箱内孵育20 h。将Transwell小室取出,PBS洗涤小室上、下部2次,4%多聚甲醛固定10 m in。PBS洗涤2次,苏木素染色5 m in,稀盐酸乙醇分色1 s,自来水迅速冲洗数秒,用棉签轻擦掉上室未穿过膜的细胞;光学显微镜下观察穿过细胞密度并拍照,且计数穿透细胞个数,每张滤过膜分别计算5个不同区域所穿出的细胞个数,计算出每组平均值。每组平行设3个滤膜。
侵袭指数=实验组迁移至下表面的细胞数/对照组迁移至下表面的细胞数。
1.2.4沉默CXCR6基因对人肺癌A549细胞裸鼠成瘤的影响[5-6]将购买的裸鼠先放置在独立送风隔离笼具中饲养1周以适应新的环境,在适宜温度、适宜湿度、自然光昼夜照射及SPF级条件下进行饲养,提前将鼠笼、锯末垫料、饮用自来水和喂养的饲料都经过高压蒸汽灭菌处理,每间隔3 d换掉旧的饲料、饮用自来水及锯末垫料。实验过程中严格遵守无菌操作原则。在37℃,5%CO2培养箱中培养细胞,当CXCR6-shRNA-(2819-1)A549细胞和未转染对照组A549细胞长到2×105/m1密度后终止培养,对每组细胞分别经胰蛋白酶的适度消化,约3~4 m in后,倒掉消化液,然后用完全培养基终止消化,最后用细胞计数板计数,用无血清的RPM I 1640培养液调整细胞密度制成2×107/m1细胞悬液。分别收集细胞于1.5 m1 EP管中备用。将裸鼠随机分为2组,实验组接种CXCR6-shRNA-(2819-1)A549细胞;对照组接种A549细胞,每组15只。将裸鼠背部皮肤局部消毒后,用1 m l注射器吸取0.2 m l细胞悬液,接种于BALB/c鼠左侧臀背交界处皮下约5×106/只。完成肿瘤细胞注射后,常规饲养裸鼠,连续观察裸鼠成瘤情况,裸鼠长出肿瘤后,继续观察3周,并每周用刻度标尺测量肿瘤大小。观察结束后处死裸鼠,剥离肿瘤,称量瘤重,并解剖其他脏器观察移植瘤有无转移,最后绘制肿瘤体积变化曲线。将裸鼠断椎处死取材后,立即用4%多聚甲醛溶液行标本固定,经酒精梯度脱水,二甲苯透明,浸蜡,样本包埋,切成厚约4 μm的薄片,脱蜡,依次经二甲苯、梯度酒精处理,苏木素、伊红染色(HE染色),再依次经梯度酒精、二甲苯处理,晾干,最后用中性树胶封片。同时,参照相关文献实验方法对病理组织切片进行免疫组织化学染色[7-9]。
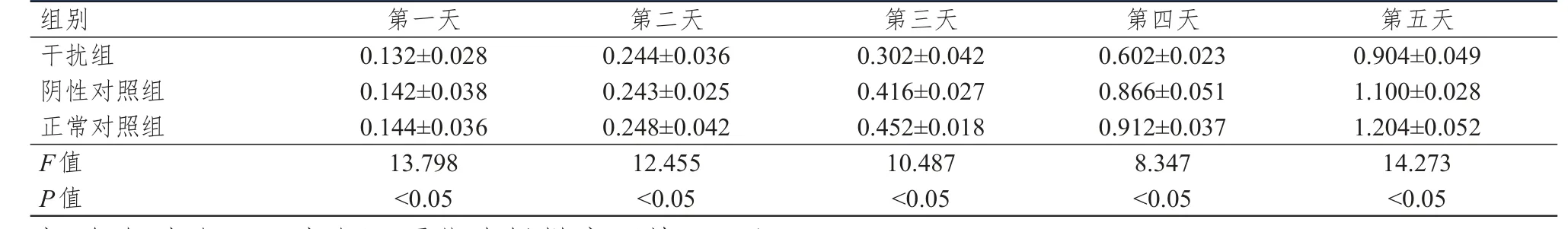
表1 沉默CXCR6表达抑制A549细胞的增殖
1.3统计学处理
应用SPSS 17.0统计软件进行统计分析,实验数据以均数±标准差(±s)的方式表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1MTT法分析沉默CXCR6表达抑制A549细胞的增殖
各个组分别设有5个复孔,每次检测的实验数值以OD值表示,结果见表1。经统计学分析,自第三天以后CXCR6-shRNA组较其他2个对照组的细胞增殖速率减缓,差异有统计学意义(P<0.01)。第3~5天的增殖平均抑制率分别为33.19%、33.99%、24.92%。结果显示,沉默CXCR6的A549细胞增殖率明显下降。稳定转染phU6/GFP/Neo-CXCR6质粒组(干扰组)3~5 d各时间点的OD值均低于稳定转染phU6/GFP/Neo组(阴性对照组)和未转染对照组(正常对照组)的OD值,差异有统计学意义(P<0.01),而阴性对照组和正常对照组差异无统计学意义(P>0.05)。
2.2沉默CXCR6表达抑制A549细胞的侵袭迁移结果
侵袭实验在接种细胞24 h后,迁移实验在接种细胞12 h后,分别用苏木素染色结果,如图1,侵袭及迁移至小室膜下表面的细胞计数结果(分别计数5个视野),详见表2。经统计学分析,转染CXCR6-shRNA组与其他2个对照组相比,侵袭及迁移至小室膜下表面的细胞数减少,差异有统计学意义(P<0.05)。

图1 光镜下各个组别细胞侵袭及迁移图像(×100)
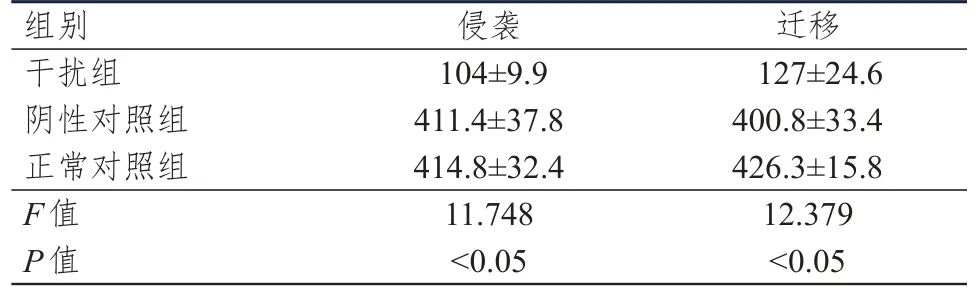
表2 侵袭及迁移至小室膜下表面的细胞数
2.3.1沉默CXCR6基因对两组瘤体质量、体积的变化接种瘤细胞第15天,对照组1只裸鼠死于真菌感染,其余裸鼠生长状态良好,肉眼未见瘤细胞长出。接种瘤细胞第20天,实验组1只裸鼠死于皮肤溃烂,其余裸鼠生长状态良好,但肉眼仍未见瘤细胞长出。接种瘤细胞第21天,对照组裸鼠臀背部长出大小为(0.2×0.3)~(0.3×0.4)cm2的瘤结节,实验组裸鼠臀背部长出大小为(0.1×0.2)~(0.2×0.3)cm2的瘤结节,继续观察3周,每隔7 d观察一次,并测量肿瘤的大小,观察结果显示实验组裸鼠瘤体生长速度明显比对照组慢,且体积比对照组小。接种第42天,将裸鼠处死,观察成瘤情况:解剖肺脏、肝脏、肠及胸腹壁,肉眼未见此器官的远处转移。如表3所示,从解剖出的瘤体可以看出,对照组裸鼠瘤体积明显比实验组大。分别称取两组瘤体质量,比较其差别,实验组瘤体质量低于对照组,差异有统计学意义(P<0.05)。
2.3沉默CXCR6基因对人肺癌A549细胞裸鼠成瘤的影响
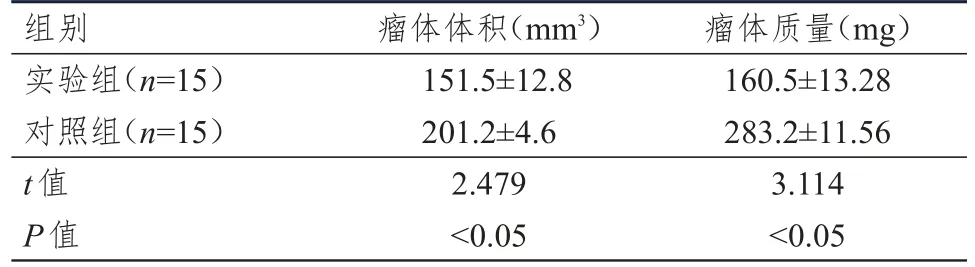
表3 两组裸鼠的瘤体体积及质量
2.3.2种植瘤病理学特征分析对解剖出的裸鼠移植瘤组织进行HE染色后,结果显示对照组的移植瘤组织有明显的异型性,瘤细胞实质分布呈巢穴状或者索条状,间质内纤维组织较少,瘤细胞大小呈不均一性,胞核大而浓染,核仁明显,可见病理性核分裂相,并可见多核细胞。实验组瘤细胞实质也呈现巢穴状或索条状分布,腺泡样结构可以在某一区域见到,间质的纤维组织比对照组多,瘤细胞和胞核较对照组小,可见核仁,极少见到有病理性核分裂相、多核细胞的分布(如图2)。
2.3.3两组种植瘤CXCR6表达差异分析人肺癌A549细胞表达CXCR6蛋白,阳性着色于癌细胞的胞质和胞膜。对解剖出的裸鼠移植瘤组织进行IHC染色后,结果显示实验组和对照组的癌细胞的胞质和胞膜均可观察到明显的棕褐色特异性染色(即阳性着色),但实验组的癌细胞阳性着色部分明显比对照组的少。详见图3。

图2 裸鼠移植瘤组织病理切片在光学显微镜下的HE染色图(×200)

图3 裸鼠移植瘤组织病理切片在光学显微镜下的IHC染色图(×200)
3 讨论
肺癌是全球发病率和死亡率最高的恶性肿瘤之一。虽然肺癌的多学科综合治疗水平已经得到了较大的提高,然而总体5年生存率只有15%左右,这就要求我们寻找新的方法,开辟新的治疗途径。趋化因子是新发现的一类细胞因子。它的主要作用是趋化细胞的迁移。趋化因子与趋化因子受体匹配后,不仅能够在淋巴细胞募集、胚胎生长发育、血管新生、造血等生理状况下起作用,而且能够在动脉粥样硬化性病变、炎症性病变、良恶性肿瘤以及艾滋病等病理状况下发挥重要作用。CXCL16/CXCR6就是一个具有这种独特功能的趋化因子配体-受体对。CXCL16属于趋化因子超家族成员之一,它具有cys-x-cys氨基酸(CXC)模序的特征,同时又具有cys-cys氨基酸(CC)家族和cys-x-3-cys氨基酸(CX3C)家族趋化因子的特征,它是由趋化结构域、糖基化黏蛋白样柄结构域、单螺旋的跨膜结构域及胞浆结构域4个部分组成。它是以跨细胞膜型(TM-CXCL16)和可溶解型(sCXCL16)两种形式存在的。膜整合素蛋白酶ADAM 10、ADAM 17对TM-CXCL16进行蛋白水解,趋化结构域从细胞表面脱落形成sCXCL16,行使趋化因子功能,产生的可溶性蛋白只有被活化巨噬细胞产生的ADAM-10或ADAM-17等蛋白酶作用才能清除。TM-CXCL16主要在APC细胞、肠滤泡相关性上皮细胞等免疫细胞膜表面高表达。CXCL16也被发现可异常表达于多种肿瘤细胞。CXCR6最初被称为Bonzo、STRL33或TYMSTR,由人第3号染色体编码,N端和细胞外第3环缺少半胱氨酸残基。最初认为CXCR6主要表达于某些特定的免疫细胞亚群如效应T细胞、树突状细胞、巨噬细胞、NK细胞、NKT细胞、浆细胞等。随着研究的不断深入,现在发现一些肿瘤细胞也存在CXCR6的异常表达,如在鼻咽癌、神经胶质瘤、恶性黑色素瘤、部分结直肠癌等肿瘤细胞表面均检测到CXCR6异常表达。
趋化因子受体CXCR6是CXCL16的唯一受体。CXCL16/CXCR6这一趋化因子配体受体对的相互作用会促进肿瘤血管生成,促进肿瘤增殖和转移。我们前期研究发现,人前列腺癌细胞有CXCL16/CXCR6的异常表达,且外源性CXCL16可以明显促进人前列腺癌细胞系的体外增殖活性和体外侵袭力。有研究也发现,CXCL16/CXCR6在人类肺癌组织中呈现高表达,它们也在人肺癌细胞系A549、95D及H292中异常表达,体外添加CXCL16可显著增强A549、95D及H292细胞系的生长增殖活力以及侵袭能力,且这种外来性的CXCL16作为抗原分子能够与CXCL16抗体结合产生中和反应,因而能成功地遏制CXCL16蛋白对3种肺癌细胞系产生的促进作用,这提示CXCL16/CXCR6这对趋化因子配体受体对的高表达与肺癌的浸润、转移密切相关[14]。新近发现这种趋化因子受体CXCR6在肿瘤的发生发展过程中可能起重要作用,进行此基因水平上的干预,将会有助于肿瘤的靶向治疗。据研究报道,孙琳等[12]应用RNAi技术沉默CXCR4可明显抑制肿瘤细胞的转移。另有实验表明,RNAi技术可抑制STAT3在人肺腺癌A549细胞中的表达,并抑制肿瘤细胞的生长,促进其凋亡[13]。本实验使用RNAi技术沉默CXCR6基因,有效抑制该基因的表达,既然CXCR6对肺癌细胞的生长增殖和侵袭、转移均有重要作用,那么沉默CXCR6基因将会抑制肺癌细胞的生长增殖和侵袭、转移,这在本文实验得到了进一步的验证。从以上可以看出,CXCR6对肺癌细胞的增殖和侵袭转移有重要作用,故本实验使用RNAi技术沉默肺癌A549细胞中的CXCR6基因,抑制该基因的表达,观察沉默CXCR6基因将对肺癌细胞生长增殖、侵袭和转移的影响,并利用MTT法和Transwell小室模型法来研究CXCR6基因沉默后A549细胞的增殖和侵袭迁移能力的变化。实验结果表明,转染CXCR6-shRNA组与其他2个对照组相比,侵袭及迁移至小室膜下表面的细胞数减少,且差异有统计学意义(P<0.05);从侵袭及迁移的图片结果来看,干扰组侵袭及迁移至小室膜下表面的细胞数比正常对照组和阴性对照组均减少。证明沉默CXCR6基因表达对A549肺癌细胞的增殖、侵袭和迁移能力具有抑制作用。以上结果提示CXCR6基因有望成为预防和治疗肺癌侵袭及转移的潜在靶点之一。
综上所述,稳定沉默CXCR6基因的A549细胞株增殖能力和侵袭迁移能力都明显降低,沉默CXCR6基因能够有效抑制肺癌裸鼠的成瘤能力。
[1]Zhang L,Ran L,Gam ia GE,et a1.Chemokine CXCLI6 regulates neutrophil and macrophage infiltration into injured muscle,promoting muscle regeneration[J].Am J Pathol,2009,175(6):2518-2527.
[2]A ltenburg JD,Siddiqui RA.Do cosah exaenoic acid down regulates interferon gamma-induced expression of CXCL16 in human aortic smooth muscle cells[J].Biochem Biophys Res Commun,2010,391(1):609-614.
[3]周雯慧,胡卫东,吴洲清,等.趋化因子轴CXCLl6/CXCR6在人前列腺癌转移中的作用[J].中华医学杂志,2010,90(14):947-951.
[4]周雯慧,胡卫东,刘越,等.趋化因子及其受体CXCLl6/ CXCR6在人肺癌转移中的作用[J].中华微生物学和免疫学杂志,2011,31(12):479-482.
[7]Balk WF.The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol,2004(14):171-179.
[8]M ichel U,Malik I,Ebert S,et al.Long-term in vivo and in vitro AAV-2-mediated RNA interference in rat retinal ganglion cells and cultured primary neurons[J].Biochem Biophys Res Commun,2005,326(2):307-312.
[9]Van der Velden VH,Hochhaus A,Cazzaniga G,et al.Deteetion of m inimal residual disease inhematologic malignaneies by real-time quantitative PCR:prineiples,approaehes and Laboratory aspeets[J].Leukem ia,2003,17(6):1013-1034.
[10]Walker NJ.Real-time and quantitative PCR:applications to mechanism-based toxicology[J].J Biochem Mol Toxicol,2001,15(3):121-127.
[11]Keeley EC,Mehrad B,Strieter RM.CXC chemokines in cancer angiogenesis and metastases[J].Adv Cancer Res,2010(106):91-111.
[12]孙琳,刘湘源,徐宁,等.趋化因子CXCLl6/CXCR6及其在类风湿关节炎发病中的作用及意义[J].中华风湿病学杂志,2009,13(11):1007-7480.
[13]Meijer J,Ogink J,Kreike B,et a1.The chemokine receptor CXCR6 and its 1igand CXCLl6 are expressed in carcinomas and inhibit proliferation[J].Cancer Res,2008,68(12):4701.
[14]Wang J,Lu Y,Wang J,eta1.CXCR6 inducesprostatecancer progression by the AKT/mammalian target of rapamycin signaling pathway[J].Cancer Res,2008,68(24):10367-10376.
The effect of CXCR6 silencing by RNAi on proliferation,invasion ability and tumorigenicity in nude m ice of lung cancer cell line A 549
ZHOU Hui-fen1WANG Ding-m iao2LI Yong3#
1Department of Pathology,Hubei Science and Technology Institute of Basic Medical Sciences,Xianning 437100,Hubei,China
2Department of Intensive Care,Xianning Central Hospital,Xianning 437100,Hubei,China
3Xianning Health Service Center,Xianning 437100,Hubei,China
Objective To investigate the effect of CXCR6 gene silencing by RNAi on proliferation,invasion ability and tumorigenicity in nude m ice of lung cancer cell line A549.Method The proliferation,invasion and m igration ability of cell line A549 w ith CXCR6 knockdown were detected by MTT and Transwell assay.Meanwhile,the grow th of subcutaneously implanted tumors was observed in nude m ice after inoculated w ith A549 cells w ith CXCR6 knockdown and w ith the control normal cells of A549.Result Proliferation of A549 cells w ith CXCR6 knockdown was significantly suppressed compared w ith normal cells(P<0.05),and the average rate of proliferation inhibition was 30.70%;CXCR6 knockdown also lowered the invasion ability(P<0.05),w ith an average rate of invasion inhibition of 74.93%,and an average rate of m igration inhibition of 70.19%,respectively.In nude mice tests,the tumorigenicity of A549 cells was inhibited when CXCR6 was silenced(P<0.05),and the tumor weight was reduced by 62.5%.Conclusion Silencing the expression of CXCR6 may inhibit the proliferation,in-vitro invasion ability as well as tumorigenicity of A549 cells.
RNA interference;CXCR6 gene;lung cancer;proliferation;invasiveness
R734.2
A
10.11877/j.issn.1672-1535.2016.14.04.12
2015-07-14)
(corresponding author),邮箱:zhovhf@163.com

