黄芪注射液辅助治疗在早期高危子宫内膜癌化疗增效减毒的研究
常培江 张国英 栾福玉
(山东省青岛市胶州中心医院,山东 胶州266300)
黄芪注射液辅助治疗在早期高危子宫内膜癌化疗增效减毒的研究
常培江 张国英 栾福玉
(山东省青岛市胶州中心医院,山东胶州266300)
目的观察黄芪注射液辅助治疗在早期高危子宫内膜癌化疗增效减毒的作用及对CA125与HE4的影响。方法收集我院2014年1月至2015年5月确诊为早期高危子宫内膜癌患者109例,按随机数字表法分为2个组别,即化疗组51例和黄芪辅助化疗组58例。结果化疗前,两个组别血清CA125和HE4、骨髓抑制状况、KPS评分和生活质量无显著差异(P>0.05),化疗后,两个组别的血清CA125和HE4均有降低(P<0.05),骨髓抑制增高(P<0.05),KPS评分和生活质量降低(P<0.05),与化疗组比,黄芪辅助化疗组血清CA125和HE4降低明显(P<0.05),骨髓抑制减轻(P<0.05),胃肠道不良反应明显降低(P<0.05),KPS评分和生活质量增高(P<0.05)。结论黄芪注射液辅助化疗早期高危EC不仅可通过降低外周血CA125和HE4水平达到抗癌作用,还可以通过提高患者对化疗的耐受,降低化疗不良反应,达到提高患者生存质量的作用。
早期高危子宫内膜癌黄芪注射液化疗CA125 HE4
子宫内膜癌(EC)是指原发在子宫内膜的一组上皮性恶性肿瘤,其中子宫内膜腺体的腺癌最常见,不到女性全身恶性肿瘤的10%,为女性生殖道恶性肿瘤1/3,绝经后的中老年妇女是EC的高发人群。国际妇产科联盟依据手术病理分期和复发的危险程度,将早期EC划分为低危、中危和高危3种。目前临床治疗EC方式主要依赖手术,借鉴化疗在晚期或复发肿瘤治疗有明显优势,早期高危EC患者术后辅助化疗可明显收益,术后辅助化疗早期高危EC患者5年无病生存期与总生存期显著高于单纯手术组,所以早期高危EC术后行辅助化疗得到较多关注和研究[1-3]。以往研究发现黄芪注射液在一些恶性肿瘤辅助化疗中获得了较好的效果[4-5],本课题拟采用癌抗原(CA125)、人附睾蛋白4(HE4)[6-7]及骨髓抑制程度评估黄芪注射液辅助化疗的疗效。同时观察两组不良反应。现将研究结果报告如下。
1 资料与方法
1.1临床资料选择胶州中心医院2014年1月至2015年5月确诊为早期高危EC患者109例。试验程序经胶州中心医院医学伦理委员会批准。所有患者按照随机数字表法将患者分为化疗组51例,黄芪辅助化疗组58例。化疗组年龄(62.31±10.72)岁,体质量指数(22.43±0.91)kg/m2。临床分期:Ⅰa10例,Ⅰb13例,Ⅱa 15例,Ⅱb13例。黄芪辅助化疗组年龄(63.00±9.04)岁,体质量指数(22.74±1.12)kg/m2。临床分期:Ⅰa 13例,Ⅰb 14例,Ⅱa 15例,Ⅱb 16例。两组一般资料差异无统计学意义(P>0.05)。
1.2病例选择EC诊断标准:绝经后阴道流血或围绝经期患者以不规则阴道流血、经期延长或经量增多;疼痛呈顽固性及进行性加重,伴有下腹坠胀痛或腰骶部酸痛;分段诊刮术、吸取内膜取样或宫腔镜检查证实;超声诊断子宫内膜厚度≥5mm。排除标准:1)精神异常,存在心理或认知功能障碍者;2)合并严重的心、脑、肾和肝功能障碍者,合并其他恶性肿瘤者;3)不接受治疗者,资料不完整者;4)哺乳或孕妇。化疗相关的纳入标准:1)年龄>18岁;2)签署知情同意书,依从性良好并自愿合作者;3)预期生存期≥3个月;4)化疗前血常规WBC≥4×109/L,血小板≥10×109/L,血红蛋白≥80 g/L;无化疗禁忌症者。
1.3治疗方法两组患者均采用两期手术治疗。Ⅰ期行筋膜外子宫切除+双附件切除术+盆腔淋巴结清除术,Ⅱ期行广泛性子宫切除+双侧附件切除术+盆腔淋巴结清除术。化疗组根据患者病情和经济状况给予环磷酰胺+阿霉素+顺铂、环磷酰胺+顺铂及紫杉醇+卡铂,其中环磷酰胺500 mg/m2(静脉推注)、阿霉素506 mg/m2(静脉推注)、顺铂65 mg/m2(静脉滴注)、紫杉醇140 g/m2(溶解到0.9%氯化钠注射液500mL中3 h滴注完毕)和卡铂350 mg/m2(溶解到0.9%氯化钠注射液500mL中滴注),7~8 d为1个疗程,间隔4~5周开始下1个疗程。黄芪辅助化疗组在化疗组基础上给予黄芪注射液(批号20140201,神威药业集团有限公司生产,10mL/支),每日静脉滴注20mL(取20mL溶解至250mL的0.9%氯化钠注射液),化疗开始的第1日使用,连续应用2个月。两个组别的化疗3~6个疗程。
1.4观察项目及评定标准分别在化疗前和末次化疗后第9日采用化学发光微粒子免疫分析法检测血清CA125和HE4,骨髓抑制,世界卫生组织生活质量量表(KPS)[8]。KPS分数越低提示生活质量越低,100分正常,0分死亡。FACT-P生活质量量表[9]以问卷调查的方式对患者的7项身体状况、6项感情状况、7项社交/家庭状况、7项功能状况以及与医生关系等进行评估,每个问题分别用0~4分回答。0:一点也不;1:有一点;2:有些;3:相当;4:非常,身体状况、感情状况越低越好;社交/家庭状况、功能状况和与医生的关系越高越好。骨髓抑制程度判断标准[10]:依据血红细胞、白细胞、粒细胞、血小板和出血情况将骨髓抑制分为5个级别,即0~Ⅳ级,判断标准可见表1。
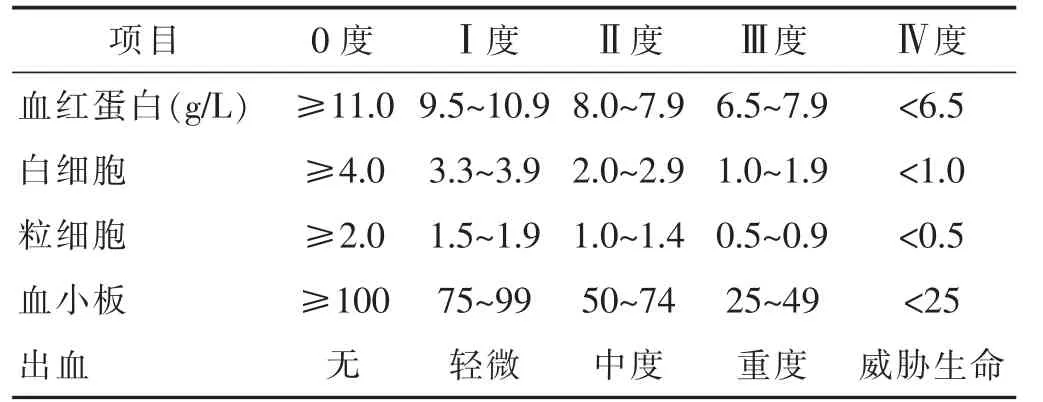
表1 骨髓抑制程度
1.5统计学处理应用SPSS7.0统计软件处理。计量资料以(表示,计数资料采用χ2检验,组间比较采用χ2或t检验。P<0.05为差异有统计学意义。
2 结 果
2.1两组化疗前后血清CA125和HE4比较见表2。化疗前,两个组别血清CA125和HE4无显著差异(P>0.05),化疗后,两个组别的血清CA125和HE4均有降低(P<0.05),与化疗组比,黄芪辅助化疗组血清CA125和HE4降低明显(P<0.05)。
表2 两组化疗前后血清CA125和HE4比较(
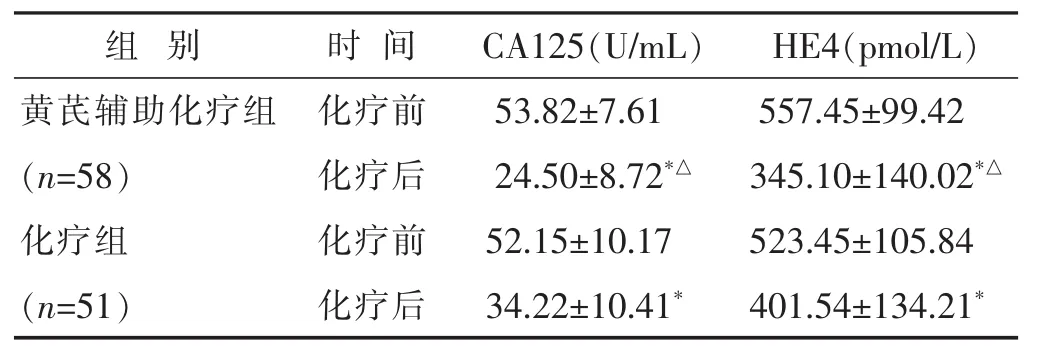
表2 两组化疗前后血清CA125和HE4比较(
与本组化疗前比较,*P<0.05;与化疗组化疗后比较,△P<0.05。下同。
组 别 时间CA125(U/mL)HE4(pmol/L)黄芪辅助化疗组 化疗前53.82±7.61 557.45±99.42(n=58) 化疗后24.50±8.72*△345.10±140.02*△化疗组 化疗前52.15±10.17 523.45±105.84(n=51) 化疗后34.22±10.41*401.54±134.21*
2.2两组化疗前后的骨髓抑制程度比较见表3。化疗前,两组的骨髓抑制状况差异无统计学意义(P>0.05),化疗后,两组的骨髓具有不同程度的损害(P<0.05)。与化疗组比,黄芪辅助化疗组化疗后骨髓抑制为0度的患者例数较多(P<0.05),Ⅱ度损害的例数较少(P<0.05)。
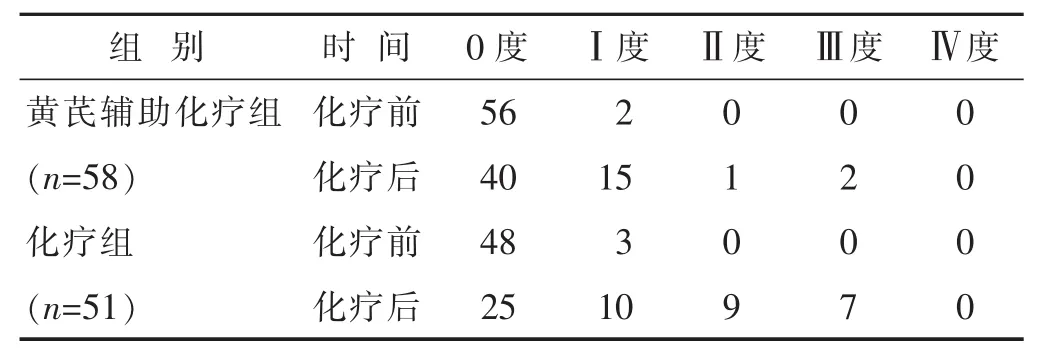
表3 两组化疗前后骨髓抑制程度比较(n)
2.3两组化疗后的胃肠道不良反应比较见表4。化疗前,两个组别没有明显的胃肠道不良反应,化疗后,两个组别均出现不同程度的胃肠道不良反应。与化疗组比,黄芪辅助化疗组的胃肠道不良反应明显降低(P<0.05)。
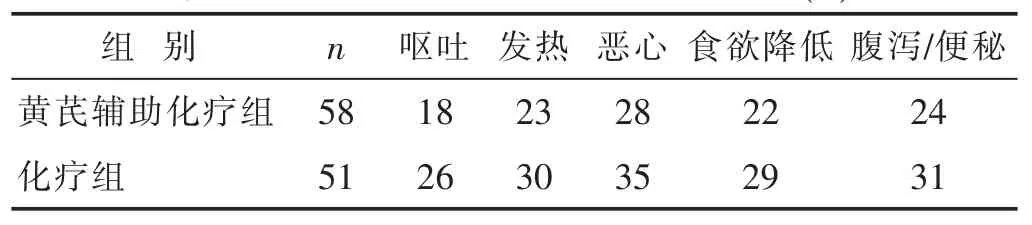
表4 两组化疗后胃肠道不良反应比较(n)
2.4两组化疗前后的生存质量KPS评分和FACT-P生活质量量表评分见表5。化疗前,两个组别的KPS评分和生活质量无显著差异(P>0.05),化疗后,两个组别的KPS评分和生活质量均有不同程度的降低(P<0.05)。但与化疗组比,黄芪辅助化疗组化疗后的KPS评分和生活质量较高(P<0.05)。
表5 两组化疗前后生存质量KPS评分及FACT-P生活质量量表比较(
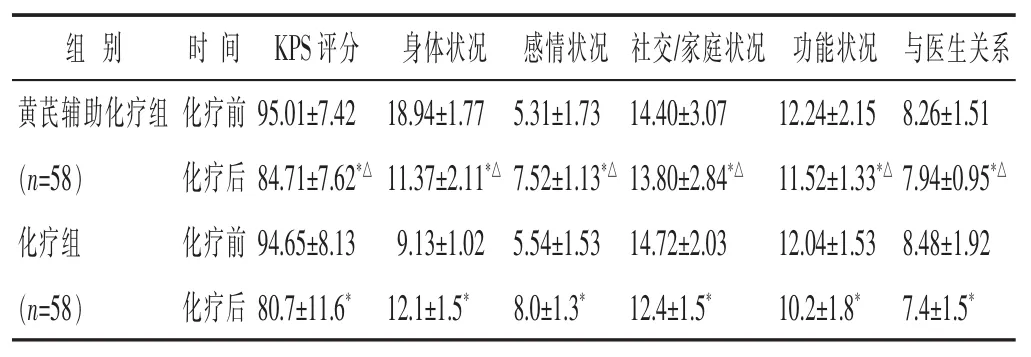
表5 两组化疗前后生存质量KPS评分及FACT-P生活质量量表比较(
组 别 时间KPS评分 身体状况 感情状况 社交/家庭状况 功能状况 与医生关系黄芪辅助化疗组 化疗前(n=58) 化疗后化疗组 化疗前95.01±7.42 18.94±1.77 5.31±1.73 84.71±7.62*△11.37±2.11*△7.52±1.13*△94.65±8.13 9.13±1.02 5.54±1.53 14.40±3.07 13.80±2.84*△14.72±2.03 12.24±2.15 8.26±1.51 11.52±1.33*△7.94±0.95*△12.04±1.53 8.48±1.92(n=58) 化疗后80.7±11.6*12.1±1.5*8.0±1.3*12.4±1.5*10.2±1.8*7.4±1.5*
3 讨 论
CA125是糖蛋白的一种,主要表达在胸膜、心包膜和腹膜等体腔上皮细胞,自细胞内合成,分泌进入体腔。CA125是目前研究较深入的血清肿瘤标志物,血清CA125升高较肿瘤检测阳性最早可近6个月,因此CA125常用于大规模筛查高危人群、恶性肿瘤病情监测和化疗效果评估等[11-13]。
HE4是分泌性糖蛋白,HE基因主要在附睾、输卵管、子宫内膜和宫颈的上皮组织表达。本课题结果显示HE4在早期高危EC患者血清中高表达,可能受到子宫内膜癌组织特异性因子的影响诱发了HE4基因转录活性异常,或HE4可能与天然免疫有关,恶性肿瘤降低了机体的免疫功能。与CA125相似,HE4也作为筛查高危人群、恶性肿瘤诊断和化疗效果评估的重要生物学指标,而且也有临床研究显示,CA125和HE4与子宫内膜癌的病理分期、肌层浸润深度和淋巴结转移密切相关,分期越高、肌层浸润越深和淋巴结转移者的外周血清的CA125和HE4水平越高。因此,常有研究将两者联合诊断恶性肿瘤,评估放化疗方案[13-15]。
本课题结果显示黄芪注射液在辅助化疗中,可明显降低早期高危EC外周血的CA125和HE4水平,提示黄芪注射液辅助治疗早期高危EC具有明显的增效作用,与文献结果相似[16-18]。体外试验也显示黄芪可明显降低腹膜间皮细胞的CA125水平,与黄芪保护腹膜结构和功能及减轻腹透液对巨噬细胞的抑制作用相关,另外也存在黄芪具有直接抗癌效应的机理[19-20]:1)黄芪富含硒,硒具有明确的抑制癌细胞氧化磷酸化作用,激活增强SOD活性,刺激免疫球蛋白和抗体产生;2)黄芪中的黄酮可降解细胞脂质过氧化物,阻断自由基链式反应,降低过氧化物损伤细胞和致突变作用,抑制癌变过程;3)黄芪通过参与调控免疫系统和细胞因子网络,如诱导淋巴细胞产生IL-2与IFN,调节机体免疫,达到杀灭癌细胞或诱导肿瘤细胞调亡。
另一方面,减轻化疗的骨髓抑制和胃肠道不良反应是肿瘤研究的关键问题,对早期高危EC术后化疗也不例外。中医认为肿瘤发生发展的病理基础为正虚,如《内经》所述“正胜则邪退,邪盛则正衰”。早期高危EC虽然没有出现乏力,但已有食少、舌淡和脉虚的症状,而且化疗是热毒之品,再加上手术损伤等也可损伤正气,降低抵抗力,导致正气亏损,容易招致外邪侵袭。黄芪,性味甘、温,可入肺和脾经,作为补气养血之品,含有黄芪多糖、黄芪皂苷、黄酮和氨基酸等多种有效成分,因此具有多种功效,如补气固表,增强免疫力,增强食欲,促进骨髓造血功能恢复和利尿排毒的作用,已有大量文献显示黄芪在辅助化疗减轻化疗的不良反应,如李惠等[20-24]使用黄芪注射液或含有黄芪的中药汤剂联合化疗治疗胃癌、中晚期非小细胞肺癌等恶性肿瘤患者。结果显示,与单独化疗组比,联合化疗组的治疗效果明显提高,且联合化疗组的毒副作用明显降低,患者的生活质量明显改善。黄芪注射液在降低化疗的骨髓抑制和胃肠道不良反应的可能机理具体表现在以下几方面[19-23]:1)在补血方面,黄芪具有促进血细胞生成、发育和成熟作用,与黄芪促进细胞内cAMP水平增加有关,CAMP可促进骨髓细胞分裂分化;2)黄芪具有抑制血小板聚集效果,通过抑制血小板钙调蛋白,抑制磷酸二酯酶的活性,增加血小板内cAMP数量,cAMP可抑制血小板聚集;3)黄芪的多糖成分可明显促进机体抗体生成,促进淋巴细胞转化,增强自然杀伤细胞细胞毒功能;4)黄芪具有明显的正性肌力作用,直接扩张外周血管与冠状动脉,增加心脏输出量;5)黄芪中的黄芪皂苷和黄酮可升高白细胞,黄芪皂苷和多糖也可增高血红蛋白和红细胞;6)黄芪还可保护肝和肾,稳定肝肾功能,防止肝糖原减少及防止肝脏受化疗药物和肝炎病毒损害的作用,降低化疗对肝肾的损害。
综上所述,黄芪注射液辅助化疗早期高危EC具有两方面的作用,不仅可通过降低外周血CA125和HE4水平达到抗癌增效的作用,还可以通过提高患者对化疗的耐受,降低和减轻了化疗的不良反应,保护骨髓造血功能,达到提高了患者生存质量的作用。因此,黄芪注射液辅助化疗有助于提高早期高危EC化疗效果,减轻不良反应,值得进一步研究。
[1]丁银花,马悦兵.早期高危子宫内膜癌术后辅助化疗临床分析[J].中华肿瘤防治杂志,2009,16(23):1892-1893.
[2]杨钦灵.顺铂辅助化疗在早期高危子宫内膜癌中的应用观察[J].医学综述,2013,20(15):2830-2831.
[3]施春明.高危早期子宫内膜癌术后辅助放疗与化疗的疗效比较[J].现代肿瘤医学,2013,21(9):2066-2068.
[4]王涛.黄芪注射液联合胸腺五肽对胃癌辅助化疗患者外周血T细胞亚群和NK细胞的影响[D].兰州:兰州大学,2013.
[5]吴成军,王锡英.黄芪多糖在晚期胃癌新辅助化疗中的作用[J].中国中西医结合外科杂志,2013,20(5):542-543.
[6]林莺莺,陈燕,胡敏华,等.术前HE4单项及联合CA125检测在子宫内膜癌中的临床价值[J].现代免疫学,2014,34(1):47-51.
[7]潘姿女,丁金旺,王克义,等.血清人附睾蛋白4、CA125和CA19-9联合检测在子宫内膜癌诊断中的临床价值[J].中国卫生检验杂志,2014,24(11):1600-1603.
[8]Verlaan JJ,Choi D,Versteeg A,et al.Characteristics of patients who survived<3 months or>2 years after surgery for spinalmetastases:Can we avoid inappropriate patient selection[J].JClin Oncol,2016 Jul11.pii:JCO651497.
[9]Wong CK,Choi EP,Tsu JH,etal.Psychometric properties of functionalassessmentof cancer therapy-prostate(FACT-P)in Chinese patientswith prostate cancer[J].Qual Life Res,2015,24(10):2397-2402.
[10]Lin HH,Hwang SM,Wu SJ,etal.The osteoblastogenesis potentialofadiposemesenchymalstem cells inmyeloma patients whohad received intensive therapy[J].PLoSOne,2014,9(4):e94395.
[11]孙盛梅,肖晓超,张丹凤.CA125和HE4联合监测在子宫内膜癌诊断中的临床价值[J].黑龙江医药科学,2014,43(3):2-3.
[12]王慧儒,王焕妮,莫凌昭.CA125和HE4在子宫内膜癌临床中的应用[J].中国癌症防治杂志,2014,31(2):198-201.
[13]林莺莺,陈燕,胡敏华,等.HE4、CA125和CA19-9单项和联合检测在子宫内膜癌诊断中的价值[J].临床检验杂志,2014,32(6):471-473.
[14]吴飞,周慧芹,崔满华.联合检测CA125与HE4在子宫内膜癌诊断中的价值[J].中国妇幼保健,2011,26(10):1559-1561.
[15]杨胜晗.HE4在子宫内膜癌患者血清中的表达及其与CA125联合检测的临床意义[D].蚌埠:蚌埠医学院,2011.
[16]陈华兴.参甚扶正注射液辅助化疗治疗恶性肿瘤的临床疗效分析[J].肿瘤药学,2013,3(2):143-146.
[17]张红梅,范颖,林庶茹.黄芪有效部位干预化疗贫血小鼠模型的药效学研究[J].辽宁中医药大学学报,2011,13(8):74-76.
[18]杨金泉,何海波.黄芪的药理作用研究进展[J].医学理论与实践,2010,(2):48-150.
[19]Wang X,Wang S,LiY,etal.Sulfated Astragalus polysaccharide can regulate the inflammatory reaction induced by LPS in Caco2 cells[J].Int JBiolMacromol,2013,51(60):248-252.
[20]李惠,李建成,李静,等.黄芪注射液联合化疗治疗胃癌的临床观察[J].科技信息,2012,29(28):456.
[21]陈玉超,刘沈林,王瑞平,等.“健脾养正消症汤”改善晚期胃癌患者化疗后生活质量84例临床研究[J].江苏中医药,2013,45(6):18-20.
[22]Lu S,Chen KJ,Yang QY,et al.Progress in the research of Radix Astragali in treating chronic heart failure:effective ingredients,dose-effect relationship and adverse reaction[J]. Chin JIntegrMed,2011,17(6):473-477.
[23]田翠丽,赵博雅,田翠霞,等.减毒增效升白汤联合化疗改善恶性肿瘤患者生活质量的临床观察[J].当代医学,2010,(6):9-10.
[24]Ligibel JA,Cirrincione CT,Liu M,et al.Body mass index,PAM50 subtype,and outcomes in node-positive breast cancer:CALGB 9741(Alliance)[J].JNatl Cancer Inst,2015,107(9):179.
R730.59
B
1004-745X(2016)09-1822-04
10.3969/j.issn.1004-745X.2016.09.062
2016-01-08)

