5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮高分辨电喷雾串联质谱裂解规律对比研究
王 燕,李晓波,李俊杰,熊海燕,彭崇胜
(上海交通大学药学院,上海 200240)
5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮高分辨电喷雾串联质谱裂解规律对比研究
王燕,李晓波,李俊杰,熊海燕,彭崇胜
(上海交通大学药学院,上海200240)
以5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮为例,运用高分辨电喷雾串联质谱在正离子模式下(HR-ESI-MS/MS)获得的碎片离子,根据一、二级质谱离子的精确质荷比,分别推导出两种黄酮可能的裂解途径,并比较多甲氧基、多羟基黄酮质谱裂解规律的异同。结果表明:在正离子模式下,5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮的一级质谱均可获得稳定的准分子离子。5,6,7,4′-四羟基黄酮的二级质谱碎片离子由准分子离子[M+H]+经RDA裂解及进一步脱水和(或)脱一氧化碳中性分子产生,直接由准分子离子脱水及一氧化碳中性分子获得的碎片离子丰度比较低;5,6,7,4′-四甲氧基黄酮二级质谱碎片即可由准分子离子[M+H]+直接经RDA裂解,还可先脱去乙烷或甲烷中性分子再经RDA裂解(1,3断裂)获得。此外,该化合物还有大量的碎片离子是由准分子离子[M+H]+分别经脱水、甲烷、乙烷或进一步脱甲基、一氧化碳而获得。两个化合物质谱碎片的比较结果表明,多甲氧基黄酮的二级质谱碎片裂解机制更复杂,碎片信息更丰富。该方法可为黄酮类化合物成分的快速定性分析提供支持,也可为黄酮类化合物体内代谢产物的LC-MS/MS鉴定提供依据。
5,6,7,4′-四羟基黄酮;5,6,7,4′-四甲氧基黄酮;高分辨电喷雾串联质谱;质谱裂解途径
黄酮是一类广泛分布于植物药和天然食物中的生物活性明确的天然有机成分[1],以多羟基取代黄酮及其苷类较为常见,如槲皮素(3,5,7,3′,4′-五羟基黄酮)、3-O-芸香糖苷(芦丁)等。近年来,相继分离鉴定的多甲氧基黄酮因被证实具有抗病毒、抗菌、抗肿瘤、抗氧化等多种药理作用而受到广泛关注[2]。
液相色谱-串联质谱(LC-MS/MS)法已广泛应用于包括黄酮在内的天然化合物的鉴定与分析[3-4]。但如何通过串联质谱法区别多羟基、多甲氧基取代的两类黄酮结构还未见报道。
本工作以5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮(结构示于图1)为例,探讨正离子模式下,高分辨电喷雾串联质谱(ESI-MS/MS)分析多甲氧基黄酮和多羟基黄酮的质谱裂解规律,并比较两种黄酮生成碎片离子的差异性,旨为黄酮类化合物以及其体内代谢产物的LC-MS/MS鉴定分析提供依据。
1 实验部分
1.1仪器与试剂
Acquity-QTOF Premier四极杆串联飞行时间质谱仪:美国Waters公司产品,配有在线脱气四元泵、自动进样器和Masslynx 4.1工作站;Gradient A10 Mill-Q超纯水器:美国Millipore公司产品;Sartorius电子分析天平:赛多利斯仪器(北京)系统有限公司产品。

图1 5,6,7,4′-四羟基黄酮(a)和5,6,7,4′-四甲氧基黄酮(b)的结构式Fig.1 Chemical structures of 5,6,7,4′-tetrahydroxy-flavone (a) and 5,6,7,4′-tetramethoxy-flavone (b)
5,6,7,4′-四甲氧基黄酮:纯度>98%,本课题组自制;5,6,7,4′-四羟基黄酮:纯度>98%,四川省维克奇生物科技有限公司产品;乙腈、甲酸:均为HPLC级,德国Merck公司产品;实验用水:超纯水。
1.2实验条件
用甲醇配制浓度为100 mg/L的样品溶液,直接进样,进样体积为1 μL。
质谱条件:电喷雾离子源(ESI)正离子模式;毛细管电压3.0 kV;锥孔电压35 V;碰撞能量35 eV;离子源温度115 ℃;脱溶剂温度350 ℃;锥孔气和脱溶剂气均为氮气,纯度为99.99%;锥孔气流速50 L/h;脱溶剂气流速600 L/h;质量扫描范围m/z50~1 000;扫描时间0.2 s;间隔时间0.02 s;碰撞气为氩气,纯度为99.99%。
2 结果与讨论
在软电离条件下,黄酮类化合物母核质谱裂解通常发生在C环上[4],产生相应的1,3A+,1,3B+和0,2B+碎片离子,示于图2。5,6,7,4′-四羟基黄酮的结构特征是:黄酮母核上A环有3个相邻羟基取代,B环4′位有1个羟基取代,黄酮母核是超共轭体系,结构比较稳定,在正离子模式下可获得稳定的准分子离子峰m/z287.055 0([M+H]+);5,6,7,4′-四甲氧基黄酮在正离子模式下也可获得稳定的准分子离子峰m/z343.124 5([M+H]+)。在ESI正离子模式下,5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮的高分辨二级质谱图示于图3,二者的二级质谱碎片离子元素组成的分析数据分别列于表1、表2。
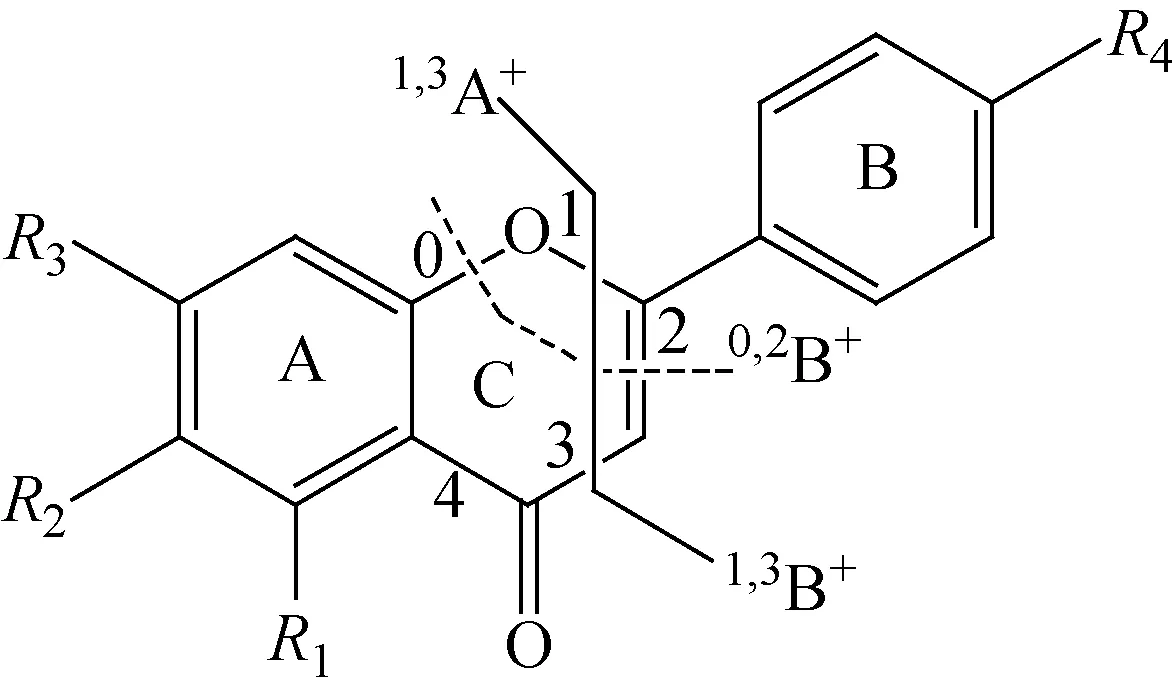
图2 黄酮母核C环裂解Fig.2 Cleavage at C-ring for flavone
2.15,6,7,4′-四羟基黄酮可能的裂解途径及特征碎片
由图3a可见,在5,6,7,4′-四羟基黄酮碎片离子中,C7H5O5(m/z169.013 9)和C8H7O(m/z119.049 2)分别是[M+H]+直接经RDA裂解产生的1,3A+、1,3B+,丰度较高;而C环裂解产生的0,2B+为C7H5O2(m/z121.029 1),丰度较低;碎片离子C6H3O3(m/z123.007 6)、C5H3O2(m/z95.013 2)只能由RDA碎片1,3A+进一步裂解产生。5,6,7,4′-四羟基黄酮可能的裂解途径示于图4。该化合物主要裂解途径Ⅰ是通过RDA裂解产生C7H5O5,该离子进一步脱水生成碎片离子C7H3O4,再脱去1分子CO,得到基峰C6H3O3(m/z123.007 6),继续脱去1个CO,得到五元芳环的碎片离子C5H3O2。该化合物的另一个主要裂解途径Ⅱ是先进行RDA裂解(1,3)产生C8H7O,然后脱去1分子CO,得到较稳定的环庚三烯正离子C7H7。该化合物的裂解途径Ⅲ产生C7H5O2(m/z121.029 1)。除了RDA裂解及进一步丢失CO、H2O等中性分子产生的特征离子外,还观察到多次脱去H2O、CO产生的多个碎片离子,如裂解途径Ⅳ、Ⅴ。另一个碎片离子峰m/z227.033 9比准分子离子少C2H4O2,可能是A环脱去2个甲醛中性分子得到的离子C13H7O4。

图3 ESI正离子模式下,5,6,7,4′-四羟基黄酮(a)和5,6,7,4′-四甲氧基黄酮(b)的高分辨二级质谱图Fig.3 High resolution mass spectrometry of 5,6,7,4′-tetrahydroxy-flavone (a) and 5,6,7,4′-tetramethoxy-flavone (b) in ESI positive ion mode
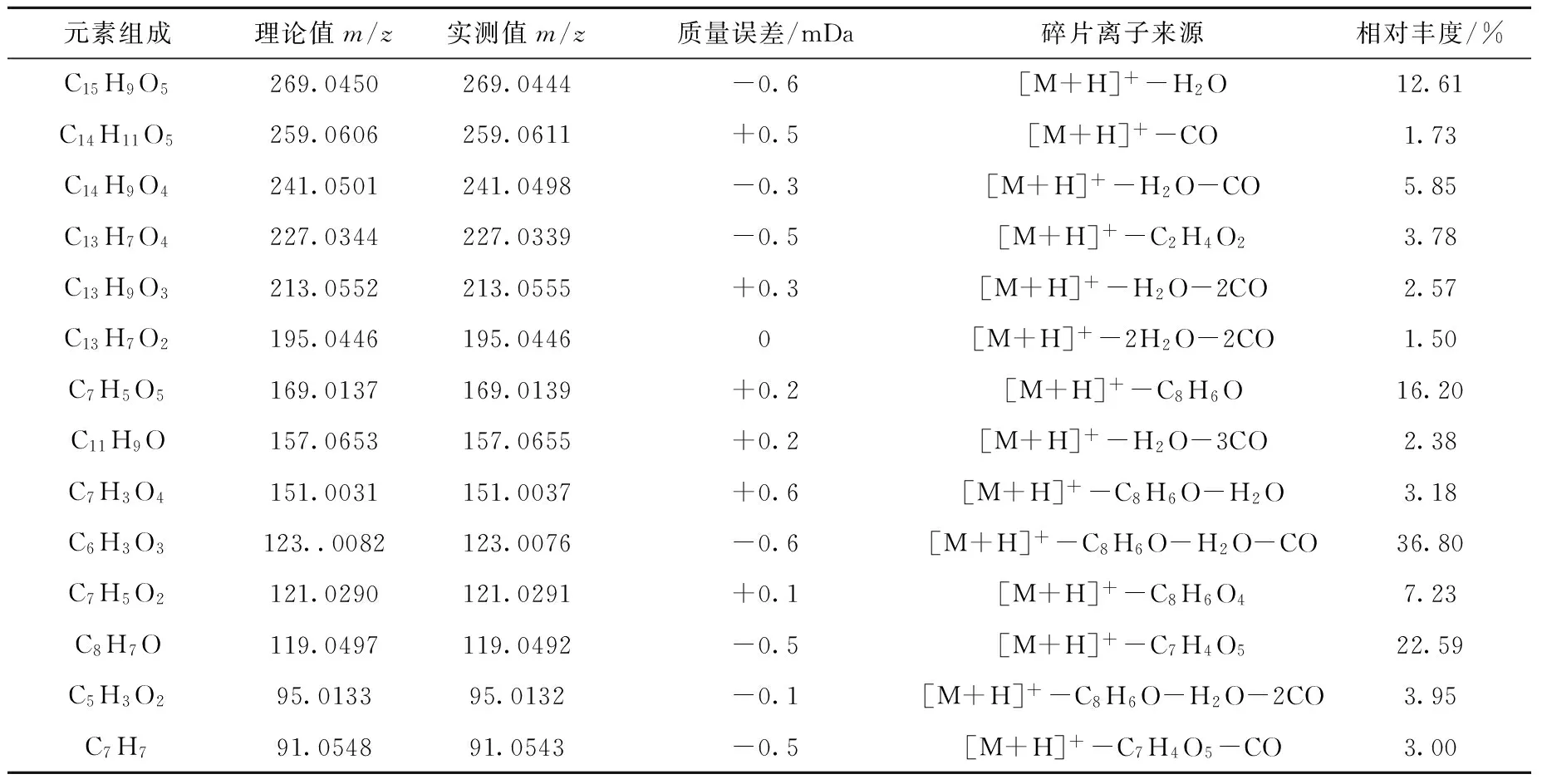
元素组成理论值m/z实测值m/z质量误差/mDa碎片离子来源相对丰度/%C15H9O5269.0450269.0444-0.6[M+H]+-H2O12.61C14H11O5259.0606259.0611+0.5[M+H]+-CO1.73C14H9O4241.0501241.0498-0.3[M+H]+-H2O-CO5.85C13H7O4227.0344227.0339-0.5[M+H]+-C2H4O23.78C13H9O3213.0552213.0555+0.3[M+H]+-H2O-2CO2.57C13H7O2195.0446195.04460[M+H]+-2H2O-2CO1.50C7H5O5169.0137169.0139+0.2[M+H]+-C8H6O16.20C11H9O157.0653157.0655+0.2[M+H]+-H2O-3CO2.38C7H3O4151.0031151.0037+0.6[M+H]+-C8H6O-H2O3.18C6H3O3123..0082123.0076-0.6[M+H]+-C8H6O-H2O-CO36.80C7H5O2121.0290121.0291+0.1[M+H]+-C8H6O47.23C8H7O119.0497119.0492-0.5[M+H]+-C7H4O522.59C5H3O295.013395.0132-0.1[M+H]+-C8H6O-H2O-2CO3.95C7H791.054891.0543-0.5[M+H]+-C7H4O5-CO3.00
表2 ESI正离子模式下,5,6,7,4′-四甲氧基黄酮的质谱碎片离子

图4 ESI正离子模式下,5,6,7,4′-四羟基黄酮可能的裂解途径Fig.4 Proposed fragmentation pathway of 5,6,7,4′-tetrahydroxy-flavone in ESI positive ion mode
2.25,6,7,4′-四甲氧基黄酮可能的裂解途径及特征碎片
5,6,7,4′-四甲氧基黄酮可能的裂解途径及特征碎片示于图5。该化合物二级质谱基峰(m/z153.019 3,C7H5O4)是通过裂解路径Ⅰ得到的,即首先由准分子离子[M+H]+在A环脱去1分子乙烷(C2H6),得到二醌结构碎片(m/z313.071 2,C17H13O6),再经RDA裂解获得碎片离子1,3A+(m/z181.013 4,C8H5O5),进一步脱去1分子CO而得到的。二醌碎片离子C17H13O6直接脱1分子CO,得到丰度仅次于基峰的碎片离子C16H13O5(m/z285.076 4),再脱去甲基游离基,获得碎片离子C15H10O5(m/z270.057 2)。裂解途径Ⅰ中出现的碎片离子C8H3O5(m/z178.999 2)可能是RDA裂解后脱去H2获得的6位甲氧基与4位羰基正离子的成环产物。裂解途径Ⅰ产生的二醌碎片离子C17H13O6还可脱去1分子H2O和1分子CO生成稠环芳香醚类碎片离子C16H11O4(m/z267.068 0)。裂解途径Ⅱ中,5,6,7,4′-四甲氧基黄酮直接经RDA裂解获得1,3B+(m/z133.066 1,C9H9O),其离子丰度为36.4%;裂解途径Ⅲ中,C环裂解产生0,2B+(m/z135.045 0,C8H7O2)的离子丰度为22.3%;而裂解途径Ⅳ中,直接经RDA裂解产生的1,3A+离子(m/z211.063 0,C10H11O5)丰度仅为4.5%。
该化合物的另一条重要裂解途径Ⅴ示于图6。它是由准分子离子[M+H]+的A环邻二甲氧基脱去1分子甲烷形成亚甲二氧结构的碎片离子C18H15O6(m/z327.087 4)。该碎片离子可进一步经RDA裂解得到1,3A+离子(m/z195.031 4,C9H7O5);也可在C环脱1分子CO,生成m/z299.092 3碎片离子C17H15O5;还可进一步在B环脱CH3得m/z284.070 6碎片离子C16H12O5,继续在B环脱1分子CO得到m/z256.074 7碎片C15H12O4。此外,亚甲二氧碎片离子C18H15O6可先脱去H2O生成稠合的芳香醚碎片离子C18H13O5(m/z309.077 0),并可在B环继续脱甲基、CO获得m/z266.059 2碎片离子C16H10O4。由于观察到m/z325.072 5碎片离子,推测m/z309.077 0碎片可能存在直接由准分子离子[M+H]+脱去1分子H2O后,再脱去1分子CH4的裂解途径。
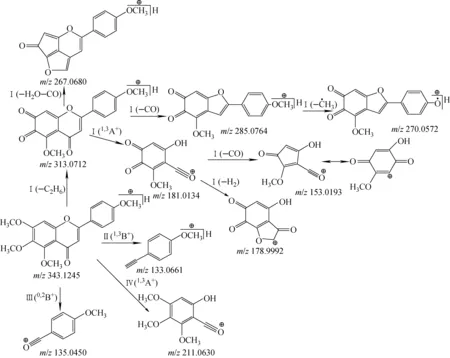
图5 ESI正离子模式下,5,6,7,4′-四甲氧基黄酮可能的裂解途径Ⅰ~ⅣFig.5 Proposed fragmentation pathwayⅠ-Ⅳ of 5,6,7,4′-tetramethoxy-flavone in ESI positive ion mode

图6 ESI正离子模式下,5,6,7,4′-四甲氧基黄酮可能的裂解途径ⅤFig.6 Proposed fragmentation pathway Ⅴ of 5,6,7,4′-tetramethoxy-flavone in ESI positive ion mode
5,6,7,4′-四甲氧基黄酮其他可能的裂解途径示于图7。此途径中,该化合物通过准分子离子[M+H]+同时脱去2分子CH4得到碎片离子C17H11O6(m/z311.058 7),或同时脱去2个甲氧基得到碎片离子C17H13O4(m/z281.082 0),并进一步脱去1分子CO得到碎片离子C16H13O3(m/z253.086 0)。也可在A环同时脱去1分子H2O,1分子CO和1个甲基得到碎片离子C17H14O4(m/z282.088 4),这与文献[5]报道的5,6-二甲氧基取代黄酮的质谱裂解途径一致,该碎片离子还可进一步脱去1分子CO和1个甲基得到碎片离子C15H11O3(m/z239.073 1)。
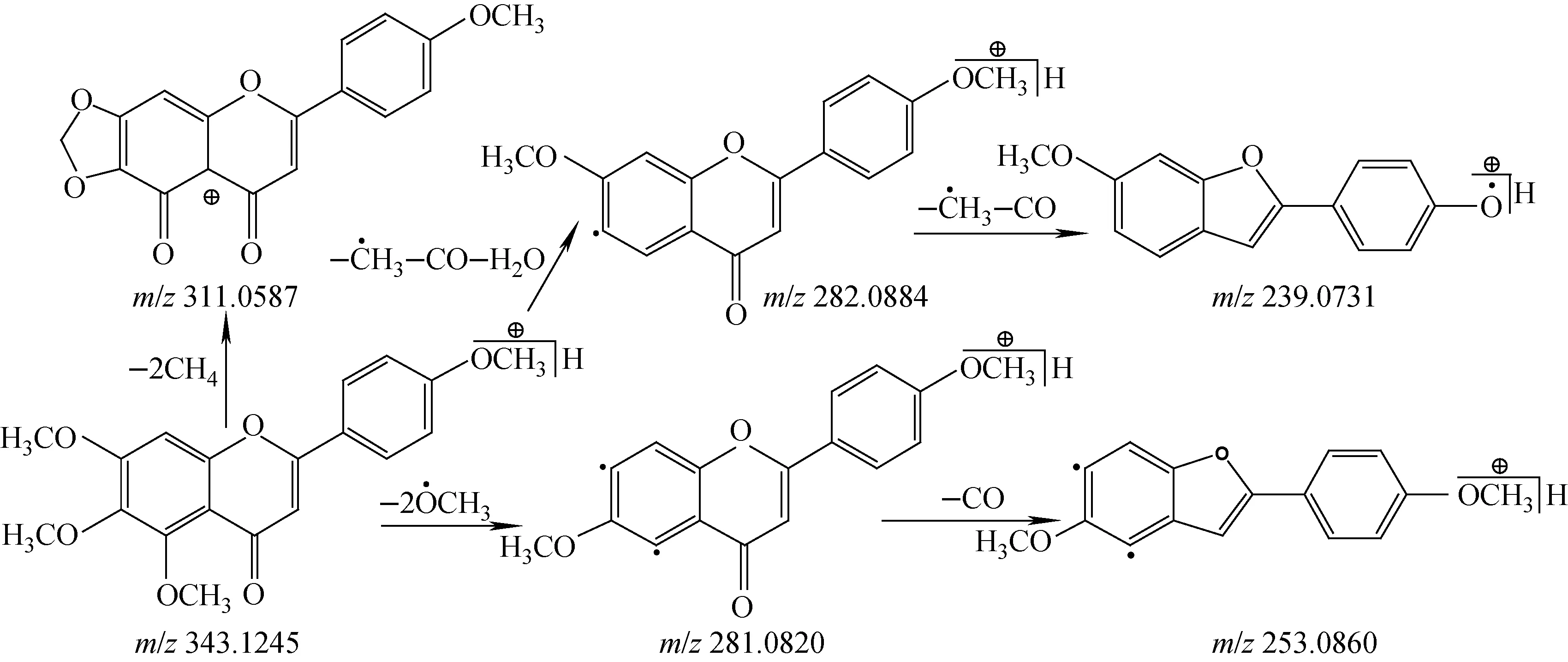
图7 ESI正离子模式下,5,6,7,4′-四甲氧基黄酮其他可能的裂解途径Fig.7 Other possible fragmentation pathway of 5,6,7,4′-tetramethoxy-flavone in ESI positive ion mode
2.3讨论
黄酮类化合物在化学诱导碰撞解离(CID)中可见C环裂解模式,分别产生1,3A+、1,3B+和0,2B+3类碎片离子[4]。在电喷雾条件下,C环裂解模式的研究较少,一般出现于亚甲二氧基取代的黄酮,只提及到1,4B+和0,3A+的裂解途径,未见裂解产生0,2B+碎片的报道[5]。以往,多甲氧基黄酮较少被关注,虽有ESI质谱特征的报道,但主要观察到准分子离子脱去CH4、H2O、CO、CO2等中性碎片及甲基自由基,未见C环裂解的相关碎片[6]。本研究较系统地对比了多羟基、多甲氧基取代模式的两种黄酮母核裂解和(或)脱中性分子得到的碎片离子,并给出了可能的裂解途径。多甲氧基黄酮EI质谱的C环裂解规律已有文献报道[7],但主要得到的是未质子化的碎片离子,与ESI质谱获得的质子化的碎片离子不同。
3 结论
本研究以5,6,7,4′-四羟基黄酮和5,6,7,4′-四甲氧基黄酮为例,比较了多羟基取代黄酮与多甲氧基取代黄酮在电喷雾质谱正离子模式下的裂解规律,找到了各自的特征碎片离子。实验结果丰富了黄酮类,特别是多甲氧基黄酮的质谱裂解规律,可为黄酮类成分的快速定性分析提供支持。
[1]周传核. 植物生物活性物质[M]. 北京:化学工业出版社,2005:33-36.
[2]LIN Y S, LI S, HO C T, et al. Simultaneous analysis of six polymethoxyflavones and six 5-hydroxy-polymethoxyflavones by high performance liquid chromatography combined with linear ion trap mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(49): 12 082-12 087.
[3]SCORDINO M, SABATINO L, TRAULO P, et al. HPLC-PDA/ESI-MS/MS detection of polymethoxylated flavones in highly degraded citrus juice: A quality control case study[J]. European Food Research and Technology, 2011, 232(2): 275-280.
[4]MA Y L, LI Q M, van den HEUVEL H, et al. Characterization of flavone and flavonol gglycones by collision-induced dissociation tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 1997, 11(12): 1 357-1 364.
[5]MENEZES J C, CAVALEIRO J A S, KAMAT S P, et al. Electrospray tandem mass spectrometry analysis of methylenedioxy chalcones, flavanones and flavones[J]. Rapid Communications in Mass Spectrometry, 2013, 27(12): 1 303-1 310.
[6]WANG K W, ZHANG H. Positive electrospray ionization tandem mass spectrometry of polymethoxylated flavones[J]. Rapid Communications in Mass Spectrometry, 2009, 23(13): 2 107-2 111.
[7]BERAHIA T, GAYDOU E M, CERRATI C, et al. Mass spectrometry of polymethoxylated flavones[J]. Journal of Agricultural and Food Chemistry, 1994, 42(8): 1 697-1 700.
Fragmentation Pathway Comparison of 5,6,7,4′-Tetrahydroxy-Flavone and 5,6,7,4′-Tetramethoxy-Flavone by High Resolution Electrospray Ionization Tandem Mass Spectroscopy
WANG Yan, LI Xiao-bo, LI Jun-jie, XIONG Hai-yan, PENG Chong-sheng
(ShanghaiJiaoTongUniversity,Shanghai200240,China)
5,6,7,4′-Tetrahydroxy-flavone and 5,6,7,4′-tetramethoxy-flavone were subjected to high resolution electrospray ionization tandem mass spectrometry (HR-ESI-MS/MS) in positive ion mode to obtain their protonated molecules and subsequent product ions, which were further analyzed to give proposed fragmentation pathways for the two flavones of polyhydroxy and polymethoxy substitution according to the high resolution mass to charge of product ions. The results show that the two compounds give stable pseudo-molecular ions (protonated molecules) in positive ion mode. Product ions for 5,6,7,4′-tetrahydroxy-flavone are mainly produced by Retro Diels-Alder (RDA) reaction from its protonated molecule [M+H]+and subsequent neutral loss of H2O and (or) CO, while direct neutral loss of H2O and (or) CO from [M+H]+give product ions with low relative abundance. Product ions for 5,6,7,4′-tetramethoxy-flavone are obtained both by direct RDA cleavage from protonated molecule [M+H]+and neutral loss of C2H6and CH4with subsequent RDA cleavage. More product ions for 5,6,7,4′-tetramethoxy-flavone are produced by loss of CH4, C2H6, CO and H2O, even CH3. HR-ESI-MS/MS comparison of the two flavones shows very different MS fragmentation pathways, which leads to more special ion peaks for polymethoxy substitution than for polyhydroxy substitution.
5,6,7,4′-tetrahydroxy-flavone; 5,6,7,4′-tetramethoxy-flavone; high resolution electrospray ionization tandem mass spectrometry (HRESI-MS/MS); fragmentation pathways
2015-11-02;
2015-12-09
傣族药“肾茶”治疗慢性肾炎的物质基础及其研究方法课题(81173655)资助
王燕(1990—),女(汉族),江苏人,硕士研究生,药学专业。E-mail: sjtuywang@163.com
彭崇胜(1966—),男(汉族),安徽人,副教授,从事民族药药效物质基础研究。E-mail: cspeng@sjtu.edu.cn
O657.63
A
1004-2997(2016)05-0385-08
10.7538/zpxb.youxian.2016.0023
网络出版时间:2016-03-28;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20160328.1443.006.html

