气相色谱-质谱法测定水产品中19种氯代酚及其钠盐
钟惠英, 柳 海, 柴丽月, 郑 丹, 杨家锋, 邱纪时, 邱洁琼
(宁波市海洋与渔业研究院,浙江宁波 315012)
氯酚类化合物(Chlorophenols,CPs)是芳香族化合物中用途广、污染较为严重的一类化合物,具有慢性毒性、致癌性、致突变性[1]。目前,世界上有近15 000种CPs被用作杀虫剂、有机溶剂和药物[2,3]。CPs普遍存在于炼油、炼焦、石化、塑胶、煤气和纸浆等工业废水和生活污水中,常以其钠盐形式存在,是一类化学性质相对稳定的化合物,能够在环境中相对持久地存在,并可通过食物链累积[3]。美国环保局(US EPA)和中国国家环保部都将2,4-二氯酚、2,4,6-三氯酚和五氯酚列入优先管理的毒性污染物[4,5]。
含有CPs的废水约占中国工业废水总量的16%,生产CPs的化工、石油化工企业是水环境CPs污染的主要来源[6]。由于水环境的污染必然招致生活其中的鱼虾贝等遭受污染,从而影响到人类,因而有必要对水环境和其中的生物体进行监测。氯代酚的检测方法以对水、土壤的报道较多[7 - 12],生物体中氯代酚的检测方法报道的仅见于五氯酚或五氯酚钠盐的测定[13 - 15]。
本方法选用H2SO4将样品消解,通过液-液萃取净化,应用气相色谱-质谱(GC-MS)联用技术,选择离子(SIM)方式同时测定水产动物肌肉中2-氯酚(2-CP)、3-氯酚(3-CP)、4-氯酚(4-CP)、2,3-二氯酚(2,3-DCP)、2,4-二氯酚(2,4-DCP)、2,5-二氯酚(2,5-DCP)、2,6-二氯酚(2,6-DCP)、3,4-二氯酚(3,4-DCP)、3,5-二氯酚(3,5-DCP)、2,4,6-三氯酚(2,4,6-TCP)、2,4,5-三氯酚(2,4,5-TCP)、2,3,4-三氯酚(2,3,4-TCP)、2,3,5-三氯酚(2,3,5-TCP)、2,3,6-三氯酚(2,3,6-TCP)、3,4,5-三氯酚(3,4,5-三氯酚)、2,3,5,6-四氯酚(2,3,5,6-TeCP)、2,3,4,6-四氯酚(2,3,4,6-TeCP)、2,3,4,5-四氯酚(2,3,4,5-TeCP)和五氯酚(PCP)。上述19种氯代酚及其钠盐,分别用氘代4-氯-3-甲基酚(PCMC-d2)和氘代2,4,6-三溴苯酚(2,4,6-TBP-d2)为内标准物质,标准曲线内标法进行定量。方法准确度和精密度好,19种氯酚检出限在0.2~0.4 μg/kg之间,加标回收率符合污染物分析要求。
1 实验部分
1.1 仪器、试剂及材料
Trace GC-DSQ 气相色谱-质谱联用仪(美国,Thermo Finnigan);DL-8M低速冷冻离心机(上海离心机研究所);SHA-C水浴恒温摇床(常州国华);HGC-24A氮吹仪(天津恒奥);MS3旋涡混合器(德国,IKA)。
单标准贮备溶液:100~1 000 mg/L;单标准中间液(10.0 mg/L):氯代酚贮备液的溶剂为甲醇时,选用1∶1正己烷-二氯甲烷溶液配制单标准中间液,氯代酚贮备溶液为正己烷或二氯甲烷时用正己烷配成单标准中间液;混合标准使用液(100 μg/L):用正己烷配制。内标标准物质PCMC-d2、2,4,6-TBP-d2(纯度≥98%,加拿大C/D/N Isotopes)。内标单标贮备液(1.00 g/L):分别称取PCMC-d2、2,4,6-TBP-d210.00 mg于10 mL容量瓶中,用正己烷稀释至刻度;内标单标中间溶液(10.0 mg/L):用正己烷配制;PCMC-d2使用液(500 μg/L):用正己烷配制;2,4,6-TBP-d2使用液(150 μg/L):用正己烷配制。2,4,6-三氯酚钠(纯度≥95.0%)和2,3,4,6-四氯酚钠(纯度≥89.0%),购于上海安谱实验科技股份有限公司。二氯甲烷、正己烷(农残级,美国Tedia);环己烷、乙酸乙酯(色谱纯,美国Tedia);H2SO4、NaOH(优级纯);H3PO4、无水Na2SO4(分析纯)。无水Na2SO4经650 ℃灼烧,冷却后置干燥器中贮存备用。硅烷化衍生试剂:N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)/三甲基氯硅烷(TMCS)体积比99∶1(美国Supelco公司)。
标准系列:依次吸取100 μg/L的混合标准使用溶液10.0、30.0、50.0、100.0、150.0、200.0、350.0 μL于7个2 mL进样瓶内,各加2,4,6-TBP-d2内标使用液100 μL、PCMC-d2内标使用溶液10 μL和硅烷化衍生试剂40 μL,正己烷定容至500 μL,密闭摇匀,与样品溶液一起置40 ℃柱温箱衍生30 min,冷却摇匀后上机分析。标准系列浓度依次为2.0、6.0、10.0、20.0、30.0、40.0、70.0 ng/mL。
大黄鱼、草鱼、南美白对虾、缢蛏取自本地养殖场。大黄鱼、草鱼去皮取背部肌肉,南美白对虾取去头去壳后虾体,缢蛏取去壳后软体部,样品分别用捣碎机绞碎后,装于聚乙烯塑料袋,-18 ℃冷冻保存,备用。
1.2 样品处理
称绞碎均质后样品5.00 g于100 mL聚乙烯塑料离心管中,加入2,4,6-TBP-d2使用溶液100 μL,50%H2SO4溶液30 mL,40 ℃水浴恒温摇床消解6 h以上或过夜。冷却后分两次加入4∶1环己烷-乙酸乙酯溶液10 mL,每次振摇1 min,4 000 r/min离心后,上清液(提取液)转移到50 mL聚乙烯塑料离心管中。向提取液中加入4% NaOH溶液5 mL,振摇1 min,4 000 r/min离心。弃去二相间膜状物,上层有机相转移到另一50 mL聚乙烯塑料离心管中,并用5 mL 4% NaOH溶液重复提取1次。弃去上层有机相,合并下层稀碱提取液。向稀碱提取液中加入5 mL正己烷,振摇2 min,4 000 r/min离心后除去二相间膜状物和上层正己烷,用6 mol/L H3PO4溶液调pH至6.2。分两次加入正己烷-二氯甲烷(1∶1)溶液10 mL,每次振摇1 min,4 000 r/min离心后,上清液过无水Na2SO4柱后转移到10 mL刻度离心管中。置氮吹仪上60 ℃氮吹至0.8~1.0 mL,转移到2 mL进样瓶中,60 ℃氮吹至约400 μL。加入10 μL PCMC-d2使用溶液和40 μL硅烷化衍生试剂,定容到500 μL,密闭摇匀,置40 ℃柱温箱衍生30 min,冷却后摇匀,上机分析。
1.3 仪器条件
色谱条件:色谱柱为DB-5MS石英毛细管柱(60 m×0.25 mm×0.25 μm,美国Agilent公司);柱箱升温程序:初始温度80 ℃,保持1 min,以10 ℃/min 升至160 ℃,再以3 ℃/min,升至200 ℃,然后以40 ℃/min升至300 ℃,保持3 min;载气:氦气(纯度≥99.999%),流速1.0 mL/min,恒流模式;进样口:PTV进样口,恒温不分流模式,温度260 ℃;进样方式:不分流进样,0.75 min后开阀;进样量:2.0 μL。
质谱条件:传输线温度:250 ℃;离子源温度:230 ℃;电离方式:EI;电子能量:70 eV;溶剂延迟:10.5 min;数据采集结束时间:26.0 min;测定方式:选择离子(SIM)监测方式,选择离子序列见表1。
按上述仪器条件对定容至500 μL的标准工作系列和待测试样溶液上机分析,以标准溶液作参照,根据保留时间和特征离子的丰度进行定性。按照表2中规定的定量离子(MCP和DCP以PCMC-d2为内标,其它氯代酚以2,4,6-TBP-d2为内标),以标准溶液中被测组分峰面积与相应内标物峰面积之比为纵坐标,标准溶液中被测组分浓度为横坐标绘制标准曲线,用标准曲线对试样进行内标法定量。
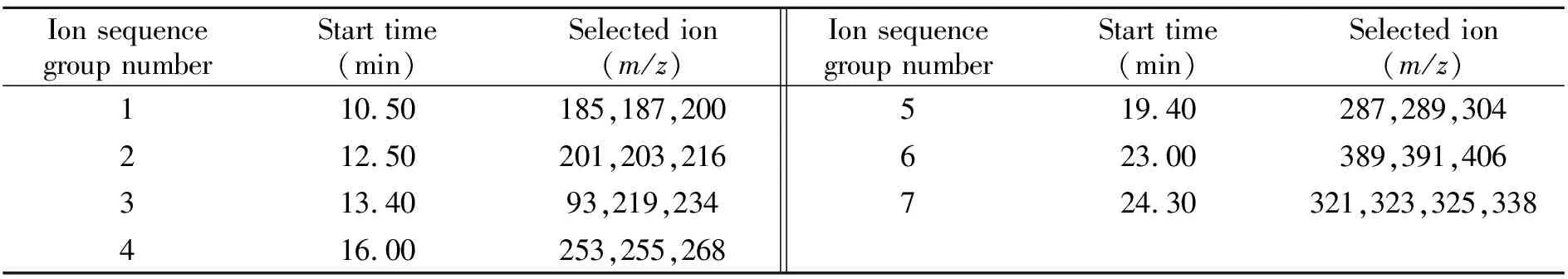
表1 SIM模式下的选择离子序列
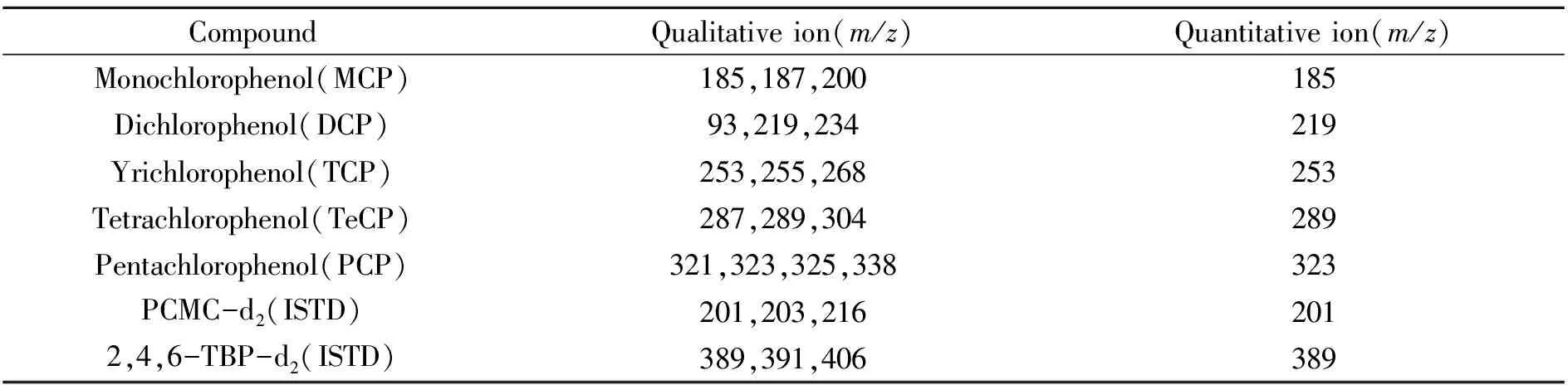
表2 硅烷化衍生后的19种氯代酚和内标物的定性、定量离子
2 结果与讨论
2.1 标准溶液的总离子流色谱图
图1给出了19种CPs标准溶液在SIM检测模式下的总离子流色谱图。从图中可见,CPs所有成分的峰形较好,除2,5-DCP和3,5-DCP色谱峰保留时间完全相同,其它组分分离度都很好。所以应用本法进行测定时,2,5-DCP和3,5-DCP只能测定二者的总量。

图1 19种氯代苯酚标准溶液的总离子流色谱图(10.0 ng/mL)Fig.1 The total ions chromatograms of 19 chlorophenol standard solution(10.0 ng/mL)1.2-CP;2.3-CP;3.4-CP;4.PCMC-d2;5.2,5-DCP+3,5-DCP(10.00 ng/mL);6.2,6-DCP;7.2,4-DCP;8.2,3-DCP;9.3,4-DCP;10.2,4,6-TCP;11.2,3,5-TCP;12.2,4,5-TCP;13.2,3,6-TCP;14.3,4,5-TCP;15.2,3,4-TCP;16.2,3,5,6-TeCP;17.2,3,4,6-TeCP;18.2,3,4,5-TeCP;19.2,4,6-TBP-d2;20.PCP.
2.2 线性范围与检出限
在实验选定的仪器条件下,氯代酚含量在2.0~70.0 μg/L范围内,所有氯代酚的浓度(x)与该化合物峰面积和内标物峰面积之比(y)均呈良好的线性相关,相关系数均可达到0.999以上。19种氯代酚的线性方程及相关系数列于表3。

表3 19种氯代酚浓度与峰面积的线性方程及相关系数
(续表3)

CompoundLinear equation and correlation coefficientCompoundLinear equation and correlation coefficient4-CPy=0.4877x-0.1984,0.99972,3,6-TCPy=0.3194x+0.07013,0.99962,5-DCP+3,5-DCPy=0.1684x-0.05636,0.99933,4,5-TCPy=0.2137x+0.09424,0.99942,6-DCPy=0.1404x-0.02951,0.99972,3,4-TCPy=0.1021x+0.056256,0.99982,4-DCPy=0.1007x-0.03654,0.99962,3,5,6-TeCPy=0.1018x+0.08870,0.99972,3-DCPy=0.09444x-0.01910,0.99932,3,4,6-TeCPy=0.1028x+0.06899,0.99943,4-DCPy=0.1917x-0.08189,0.99942,3,4,5-TeCPy=0.08627x+0.08963,0.99932,4,6-TCPy=0.1832x+0.03801,0.9995PCPy=0.05650x+0.1180,0.9993
实验检测的19种氯代酚,以PCP的响应值最低,而3-CP/4-CP响应值最高。当氯代酚的测试量均为0.004 ng 时,PCP的信噪比(S/N) 为4,3-CP的S/N为45。当样品中氯代酚添加量为0.40 μg/kg时PCP的S/N值为5,而当氯代酚添加量为0.20 μg/kg时3-CP 的S/N为18。所以应用本方法测定19种氯代苯酚,方法检出限至少可达0.2~0.4 μg/kg。
2.3 回收率和精密度
以南美白对虾、草鱼、大黄鱼和缢蛏为实验材料,标准溶液添加浓度为1.00 μg/kg、2.00 μg/kg、3.00 μg/kg和7.00 μg/kg,测试回收率和精密度(RSD),结果列于表4。符合污染物检测分析要求。
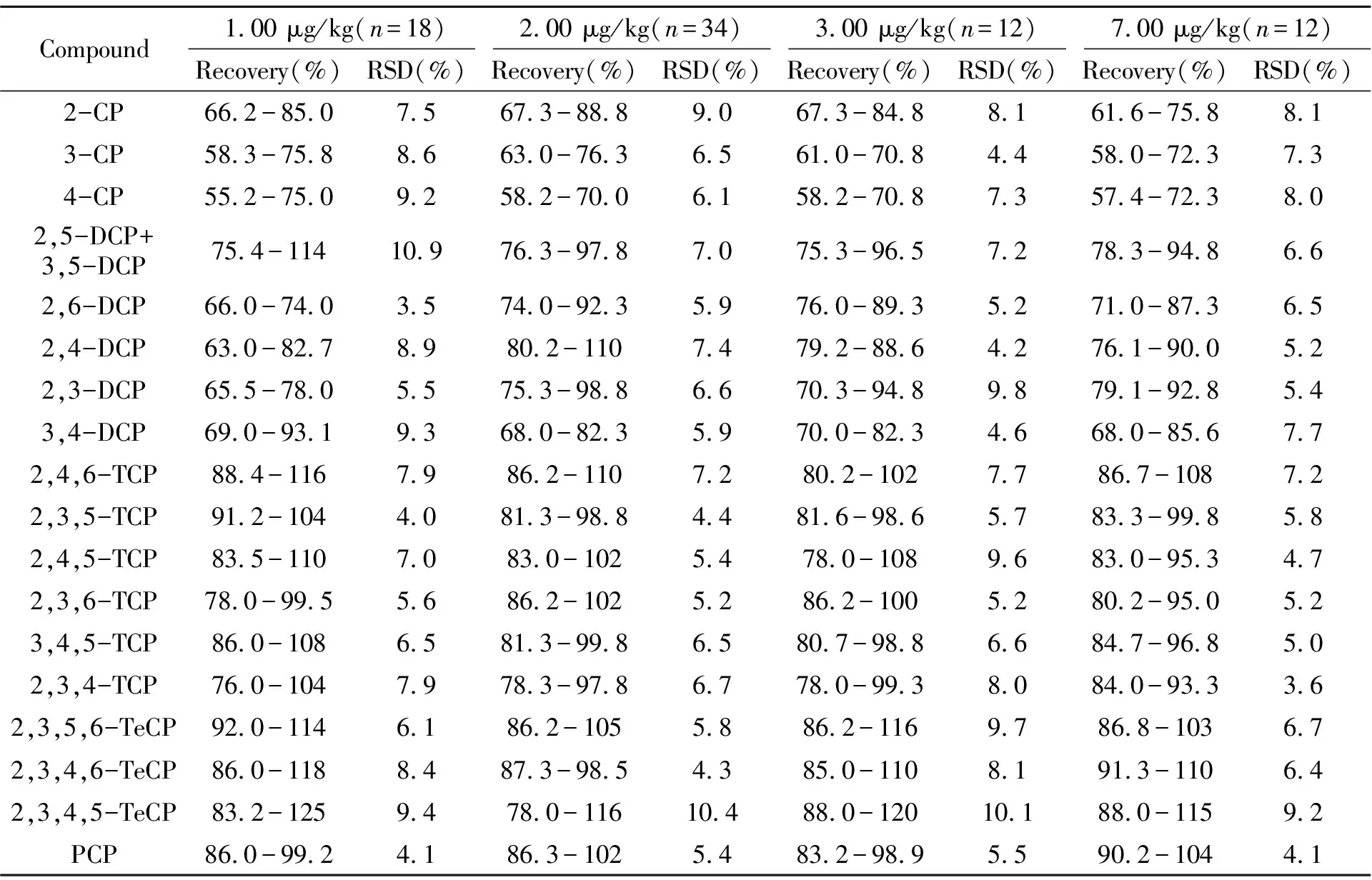
表4 水产品中19种氯代酚的回收率和精密度
2.4 样品处理
2.4.1溶剂的选择和操作提取氯代酚的溶剂报道有二氯甲烷[8,9]、正己烷[9 - 13]、环己烷-乙酸乙脂[14]等。由于正己烷在本方法实验过程中,有的样品在提取时上层有机层出现了凝胶状冻结现象。二氯甲烷作为提取溶剂效果很好,但氯烷类试剂比重大、容易从提取容器口渗漏或移液时不易操作,且二氯甲烷渗透性强,当不慎洒到操作者肌肤时会有灼痛感,对人体有伤害。本实验选用了4∶1环己烷-乙酸乙酯溶液,取得了满意的结果。比较了正己烷和正己烷-二氯甲烷溶液(1∶1,V/V)从微酸性水溶液中对氯代酚的提取效率,后者好于前者。
2.4.2酸解和酸解温度酸解能使水产品中的蛋白质、脂肪和色素等有机物质分解,并且在酸性溶液中其酚盐以氯代酚形式存在,且由于氯代酚结构中含有羟基,样品酸解后能提高酚类化合物的回收率[9]。但由于氯代酚类化合物具有挥发性,会随水蒸汽一起挥发,所以酸消解时的温度不宜太高,本实验选择了40 ℃,在此温度下一般2~3 h左右能将肌肉组织水解,但有的水产样品酸解不彻底,当用有机溶剂提取时,二相间会出现乳化层,而影响提取效果,因此,酸解时间以6 h以上或过夜为好。
2.4.3实验温度提取的有机溶剂易挥发,过高的实验室温度会使实验操作时提取溶剂快速挥发,从而导致氯代酚一起损失而影响回收率,所以实验室温度不应高于25 ℃。试样60 ℃氮吹仪浓缩时,一定要缓缓地充上氮气,否则会降低回收率。
2.4.4衍生剂和衍生温度氯代酚分子中含有羟基,极性较大,如果不经过衍生化,很容易出现拖尾峰,并且峰形很宽,影响检测灵敏度和重现性。氯代酚的衍生方法有乙酰化法和硅烷化法,本实验选用了硅烷化法。试样中的少量水就会使硅烷化失败,因而硅烷化前试样必须脱水完全。关于衍生剂的用量,比较了40、60、80、100 μL等不同的衍生剂加入量,其效果差异不大,所以本实验选用了40 μL。衍生时温度过高会使试样的溶剂挥发导致氯酚损失,本实验选用了40 ℃,在此温度下衍生,既不会造成溶剂和目标物的挥发,又有较好的衍生效率。
2.5 酚盐回收率实验
用2,4,6-三氯酚钠和2,3,4,6-四氯酚钠进行了回收率实验。用水逐级将二种酚盐稀释,分别配制成100 ng/mL(以酚计)的使用溶液。以大黄鱼为基质,二种酚盐的添加量均为2.00 μg/kg,进行了3平行样实验,测定结果二种钠盐的回收率为77.0%~97.8%。
2.6 样品测定
以2014年7月从宁波余姚临山海水中捕获的1份鲈鱼为代表按本方法测定。4-CP 0.27 μg/kg、2,5-DCP+3,5-DCP 0.65 μg/kg、2,4-DCP 0.37 μg/kg、2,4,6-TCP 0.78 μg/kg、2,3,4-TCP 0.36 μg/kg、2,3,4,6-TeCP 3.79 μg/kg、PCP1.19 μg/kg,其它氯代酚未检出,测得的氯代酚总量为7.41 μg/kg。
3 结论
应用本研究建立的方法测定19种氯代酚,方法的准确性和精密度符合污染物分析要求,可作为石油、化工企业排放的氯代酚及其钠盐对水生动物污染的监控方法。

