藏药大花黄牡丹根皮挥发油的提取和成分分析
蒋丽丽,李鹏飞,蒋 帅,张彦龙,胡 楠,赵丹丹,,*
(黑龙江大学 a. 生命科学学院;b. 黑龙江省普通高等学校分子生物学重点实验室;c. 黑龙江大学医院,哈尔滨 150080)
藏药大花黄牡丹根皮挥发油的提取和成分分析
蒋丽丽a,b,李鹏飞a,b,蒋帅a,张彦龙a,b,胡楠c,赵丹丹a,b,c,*
(黑龙江大学 a. 生命科学学院;b. 黑龙江省普通高等学校分子生物学重点实验室;c. 黑龙江大学医院,哈尔滨 150080)
西藏大花黄牡丹(Paeonialudlowii)为芍药科、芍药属植物,主要生长在海拔2 900~3 200 m的雅鲁藏布江红河谷和林缘坡麓次生灌木林。主要分析西藏大花黄牡丹根皮部挥发油成分。通过回流法对其挥发油组分进行提取,进行单因素影响实验摸索最适的提取条件,通过GC-MS对其化学成分进行分析,采取面积归一法对成分相对含量进行分析。结果表明,大花黄牡丹根皮部挥发油最适提取为4倍水量,浸泡4 h,提取4 h,提取率为1.36%。通过GC-MS共检测出来22个化合物,其中最主要成分为丹皮酚。
挥发油;藏药;大花黄牡丹;回流法;GC-MS
全球范围内,芍药属植物包括约35个种,主要分布在欧洲和亚洲的温带地区,其中在我国西南和西北分布着11个种,仅有少数种类分布在东北、华北及长江两岸各省[1]。西藏大花黄牡丹(Paeonialudlowii)为芍药科(Paeoniaceae)、芍药属(Paeonia)的一种亚灌木植物,为我国西藏特有种,主要分布在林芝地区米林县境内(米林藏语意为“药州”)[2],堪称牡丹中的王中之王,其花朵呈金黄色、植株高大极具观赏价值[3]。
大花黄牡丹根皮作为藏药的一种,常为民间所用[3-5]。芍药属的其他植物的根皮,也作为重要的天然药物使用,如牡丹(Paeoniasuffruticosa)、芍药(Paeonialactiflora)、白芍(Paeoniaalbiflora)、草芍药(Paeoniaobovata)等,都具有镇痛、镇痉、抗炎、清热凉血、活血散瘀、促进血液循环等功效[6-7],近年来因其具有较好的药理活性[8],得到广泛的关注,在抗心脑血管疾病[9],抗肿瘤[10-12],抗炎[13]等活性研究中,均表现出较好的活性。其主要成分丹皮酚具有减缓皮肤色素沉着的效果[14],在大鼠中可有效地抑制酒精造成的损伤[15],且在骨质疏松[16]和糖尿病治疗[17]研究中,均有疗效。对心脑血管疾病,妇科疾病也有好的疗效[6-7]。根据相关文献的梳理,国内外学者在芍药属根皮的化学成分及生物活性研究成果丰硕,然而对于西藏大花黄牡丹(P.ludlowii)根皮的化学成分和生物活性研究较少。国内主要针对其生物学特性作了少量研究,如生长、繁殖、引种、营养元素等;还有少量生态学研究,如生态习性直径[5]、种群数量动态[3,7-18]等。大花黄牡丹根皮富含大量活性成分,当地地方志记载,藏民早在几百年前就已经使用其根皮治疗妇科疾病、心脑血管疾病、皮肤癣菌病等,常以水煎法使用。所以,通过回流法对藏药大花黄牡丹根皮挥发油成分进行提取和成分分析。
1 材料与方法
1.1试验材料和仪器
采用的大花黄牡丹根皮是本课题组2015年采自西藏林芝地区,无水乙醚、无水硫酸钠为国产分析纯。
仪器:万能粉碎机、回馏装置、调温电热套、旋转蒸发仪、电热恒温鼓风干燥箱、电子分析天平、超声清洗仪、Thermo气相色谱/质谱联用仪TRACE_1300GC-ISQ_LT。
1.2试验方法
1.2.1挥发油的提取
将大花黄牡丹根皮部用蒸馏水清洗,室温晾干,剪碎呈小块,用万能粉碎机粉碎后用40目筛子筛选制成粉末状样品。精确称40 g粉碎后样品,置于1 000 mL的圆底烧瓶中,加水室温浸泡。连接回流装置,将样品进行回流处理,保持圆底烧瓶里的混合液保持微沸的状态,回流后将混合液取出过滤,留上清液,用乙醚进行萃取,萃取3次后回收乙醚液,并对其进行过滤。得到液体利用旋转蒸发仪在40 ℃下将乙醚旋转蒸发掉,得到挥发油成分,精密称量,得到大花黄牡丹根皮部挥发油的提取率:
提取率=大花黄牡丹根皮部挥发油量(g)/样品量(g)×100%
1.2.2挥发油提取的单因素实验
在前期预实验发现,大花黄牡丹的挥发油提取量和加水量,浸泡时间以及蒸馏时间有关系,所以进行单因素实验对提取工艺进行摸索。
浸泡时间对挥发油提取率的影响 。按照1.2.1项方法,设置相对的浸泡时间为2 h、4 h、6 h,2倍水量蒸馏2 h,进行挥发油的提取,计算提取率。
加水量对挥发油提取率的影响。按照1.2.1项方法,设置相对的加水量为2、4、6倍,浸泡2 h,蒸馏2 h,进行挥发油的提取,计算提取率。
提取时间对挥发油提取率的影响。按照1.2.1项方法,设置相对的回流时间为2 h、4 h、6 h,2倍水量,浸泡2 h,进行挥发油的提取,计算提取率。
1.2.3GC-MS分析条件
气相条件。使用Hp-5毛细管色谱柱。程序升温:初始温度为60 ℃,以10 ℃/min升至250 ℃,保持15 min。分析总时间30 min;分流比20∶1,载气为高纯He,载气流速1 mL/min,进样量1 μL。
质谱条件。电离方式EI,电离电压70 eV;离子源温度230 ℃;质量扫描范围m/z:20~550,全扫描方式。
2 试验结果与分析
2.1单因素实验结果
加水量对浸泡挥发油提取率的影响见图1。由图1可见,挥发油提取率随着加水量的增加而增加,4倍水量为最佳加水量,过多的加水量,容易产生暴沸现象,挥发油溢出,影响提取率。
浸泡时间对挥发油提取率的影响见图2。由图2可见,挥发油提取率随着浸泡时间的延长而增加,在4~6 h趋于不变。浸泡理论认为浸泡可以加快内外液动态交换,有利于挥发油提取[9]。
提取时间对挥发油提取率的影响见图3。由图3可见,2~4 h挥发油提取率随时间延长而增加,在4~6 h 变化不大。
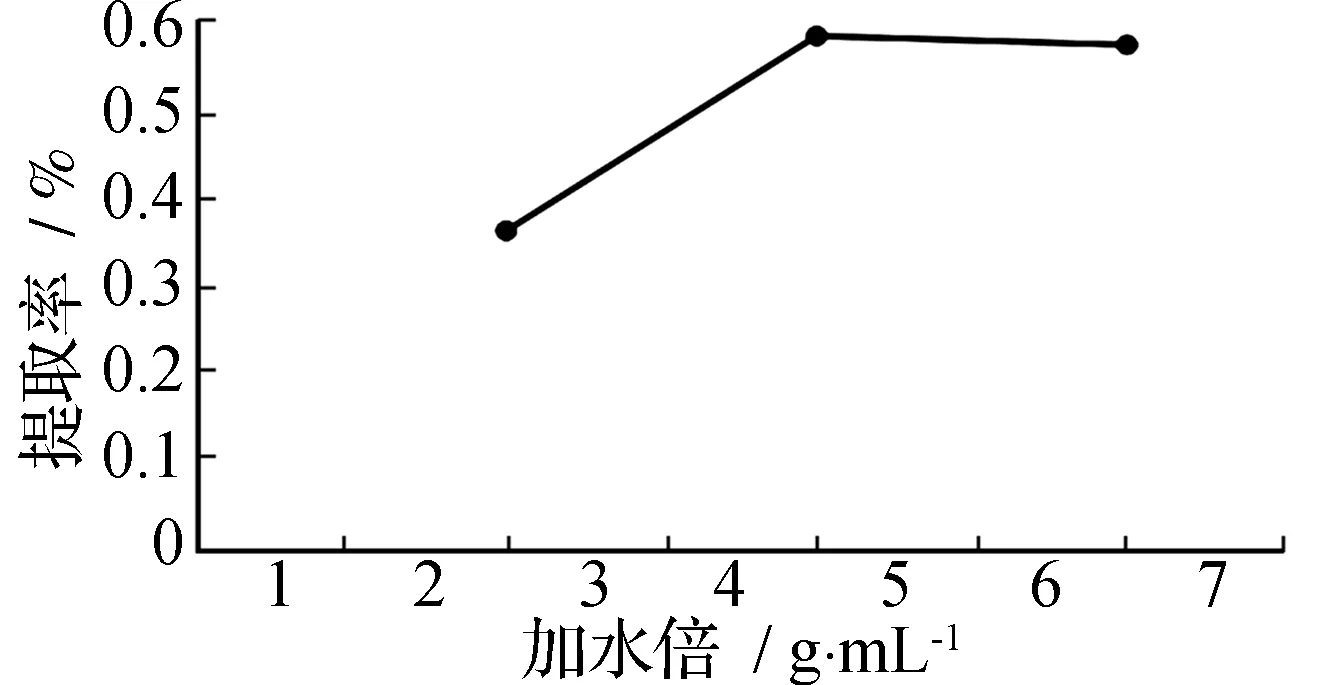
图1 加水量对挥发油提取率的影响Fig.1 Influence of water of volatile oil extraction yield

图2 浸泡时间对浸泡挥发油提取率的影响Fig.2 Influence of soaking time of volatile oil extraction yield

图3 提取时间对挥发油提取率的影响Fig.3 Influence of extraction time of volatile oil extraction yield
综合考虑挥发油的提取率,以及实验成本和效率,本实验选定加水量为4倍,浸泡4 h,回流4 h为最佳实验方案。
2.2挥发油提取率
使用最佳提取方案进行回流提取后,得到棕黄色的油状挥发油物质,精确称重,质量为0.545 g,通过公式计算提取率为1.36%。
2.3GC-MS分析
采用GC-MS对大花黄牡丹挥发油进行分析,得到样品总离子流图(图4),共分离出22个组分。
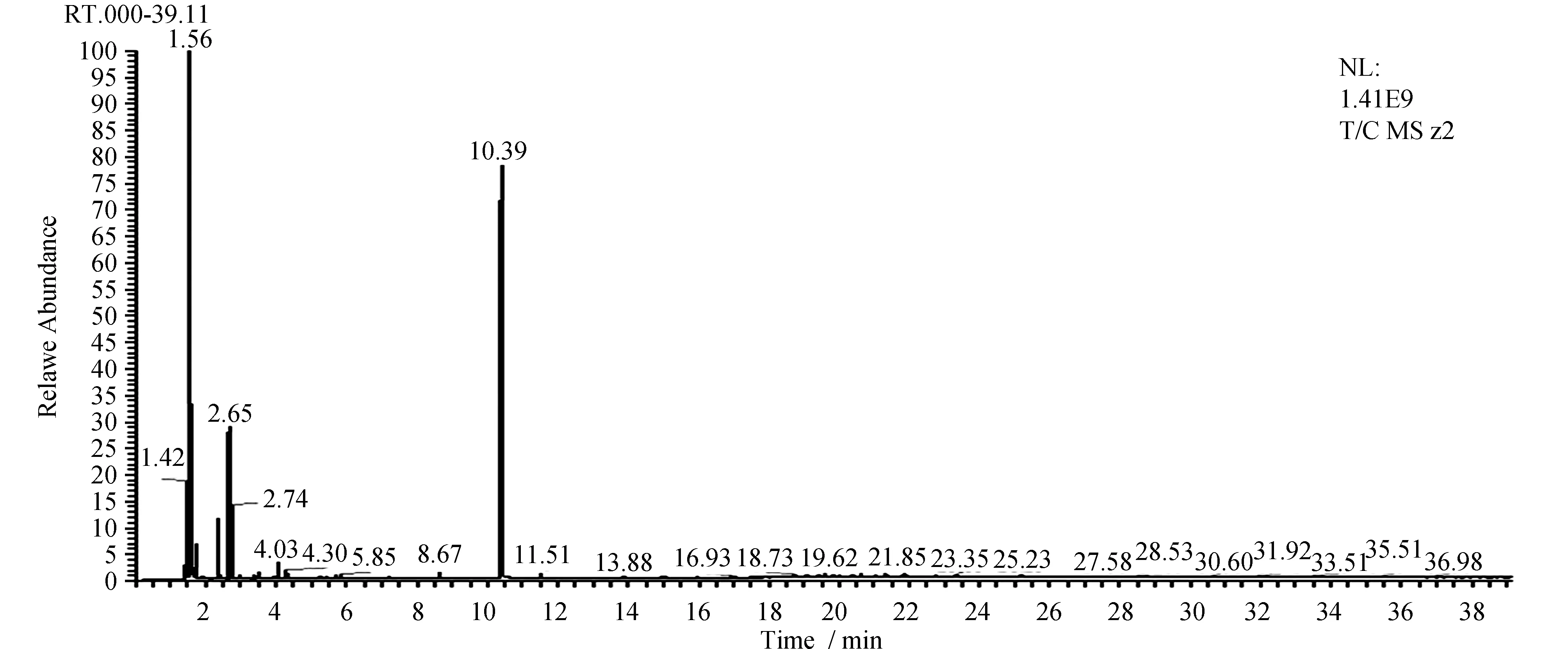
图4 GC-MS总离子图Fig.4 Total ion current chromatogram
将各组分质谱数据由NIST质谱数据库检索结合有关参考文献等,鉴定其中22个化合物,用峰面积归一法计算各成分在挥发油里的相对含量(表1)。其中,丹皮酚为主要成分占总量的57.19%。

表1 大花黄牡丹根皮部挥发油化学成分
3 结 论
本文首次对大花黄牡丹的挥发油成分进行提取和成分分析,通过单因素实验摸索大花黄牡丹挥发油的最适提取方案;通过回流法提取得到棕黄色的油状挥发油物质,提取率为1.36%;通过GC-MS共检测出22个化合物,其中最主要成分为丹皮酚,占总化合物的57.19%。本研究着重于大花黄牡丹挥发油的化学成分,这对于丰富藏药大花黄牡丹的化学研究具有一定的参考价值,为其将来在医药中更好的应用奠定一定基础,为更好地开发利用西藏植物资源提供一定的科学依据。
致谢:本实验部分得到国家自然科学基金项目(31570635)资助。
[1]中国植物志编辑委员会. 中国植物志:第27卷[M]. 1979:37.
[2]雷菊芳, 李富银, 扎西顿珠, 等. 青藏高原藏药用植物生长特性及藏药资源保护初探[J]. 世界科学技术-中药现代化,2002, 4:60-64.
[3]杨小林,王秋菊,兰小中,等. 濒危植物大花黄牡丹(Paeonialudlowii)种群数量动态[J]. 生态学报,2007, 27:1242-1247.
[4]Yu S, Du S, Yuan J, et al. Fatty acid profile in the seeds and seed tissues of paeonia l. Species as new oil plant resources[J]. Scientific Reports,2016, 6:26944.
[5]He C, Peng B, Dan Y, et al. Chemical taxonomy of tree peony species from china based on root cortex metabolic fingerprinting[J]. Phytochemistry,2014, 107:69-79.
[6]周生军, 鲍隆友. 濒危植物大花黄牡丹的野生资源现状与栽培研究[J]. 中国林副特产,2009(2):93-94.
[7]王景升, 郑维列, 潘刚. 巨柏种子活力与濒危的关系[J]. 林业科学,2005, 41: 37-41.
[8]苏建荣, 刘万德, 郎学东, 等. 濒危植物大花黄牡丹与生境地群落特征的关系[J]. 林业科学研究,2010, 23:487-492.
[9]郑勇, 张志兰. 正交实验法优选豆蔻挥发油提取工艺 [J]. 时珍国医国药, 2006, 17(4): 569.
[10] 中华人民共和国卫生部药典委员会. 中华药典 [S]. 北京:化学工业出版社, 2010.
[11] Li Y J, Bao J X, Xu J W, et al. Vascular dilation by paeonol a mechanism study [J]. Vascul Pharmacol, 2010, 53 (3-4): 169-176.
[12] Almosnid N M, Gao Y, He C, et al. In vitro antitumor effects of two novel oligostilbenes, cis-and trans-suffruticosol d, isolated from paeonia suffruticosa seeds[J]. International Journal of Oncology,2016, 48:646-656.
[13] Wu J, Xue X, Zhang B, et al. The protective effects of paeonol against epirubicin-induced hepatotoxicity in 4t1-tumor bearing mice via inhibition of the pi3k/akt/nf-kb pathway[J]. Chemico-biological Interactions,2016, 244:1-8.
[14] Zhao Y, Fu B S, Zhang X J, et al.Paeonol pretreatment attenuates cerebral is chemic injury via upregulating expression of pAkt, Nrf2, HO-1 and ameliorating BBB permeability in mice [J]. Brain Research Bulletin, 2014, 109: 61-67.
[15] Chena N, Liu D F, Soromou L W, et al. Paeonol suppresses lipopolysaccharide induced inflammatory cytokines in macrophage cells and protects mice from lethal endotoxin shock [J]. Fundamental & Clinical Pharmacology, 2014, 28: 268-276.
[16] Bu J, Ma P C, Chen Z Q, et al. Inhibition of MITF and tyrosinase by paeonol-stimulated JNK/SAPK to reduction of phosphorylated CREB [J]. Am J Chin Med, 2008, 36 (2): 245-263.
[17] Hu S, Shen G, Zhao W, et al. Paeonol the main active principles of Paeonia moutan,ameliorates alcoholic steatohepatitis in mice [J]. J Ethnopharmacol, 2010,128 (1): 100-106.
[18] Tsai H Y, Lin H Y, Fong Y C, et al. Paeonol inhibits RANKL-induced osteoclastogenesis by inhibiting ERK, p38 and NF-kappaB pathway [J]. Eur J Pharmacol, 2008, 588 (1): 124-133.
[19] Juan Y C, Tsai W J, Lin Y L, et al. The novel anti-hyperglycemic effect of Paeoniae radix via the transcriptional suppression of phosphoenopyruvate carboxykinase (PEPCK) [J]. Phytomedicine, 2010, 17 (8-9): 626-634.
Extraction and chemical constituents analysis of essential oil from cortical root of Tibetan medicinal herb Paeonia ludlowii
JIANG Li-Lia,b, LI Peng-Feia,b, JIANG Shuaia, ZHANG Yan-Longa,b, HU Nanc, ZHAO Dan-Dana,b,c,*
(HeilongjiangUniversitya.CollegeofLifeSciences;b.KeyLaboratoryofMolecularBiologyofHeilongjiangProvince;c.HospitalofHeilongjiangUniversity,Harbin150080,China)
Paeonialudlowiiof Tibet, a species distributed in secondary shrub forest of Red River Valley and forest edge of Yalu Tsangpo River in the altitude of 2 900~3 200 m, belongs to the Paeonia of the family of Paeoniaceae. Chemical constituents of the essential oil from the cortical root ofPaeonialudlowiiwere analyzed and their contents were detemined. The essential oil was extracted from the cortical root ofPaeonialudlowiiby the reflux method, carried on the single factor experiment grope for the optimal extracting conditions. The amount of the compounds from the essential oil were separated and identified by GC-MS, and the relative content of each compound was calculated by the area normalization method. Optimum extraction conditions were determined as follows: solid-to-water 1:4 (g/mL), cold water soaking time 4 h and extraction time 4 h , leading to an extraction yield of 1.36%. Twenty-two compounds were separated by GC-MS, and paeonol was the major component.
essential oil; Tibetan medicinal herb;Paeonialudlowii; reflux method; GC-MS
10.13524/j.2095-008x.2016.03.043
2016-06-15
黑龙江省教育厅科学技术研究项目(12541643)
蒋丽丽(1992-),女,黑龙江同江人,硕士研究生,研究方向:植物生物技术与基因工程,E-mail: 409970173@qq.com;*通讯作者:赵丹丹(1977-),女,黑龙江哈尔滨人,副教授,硕士研究生导师,研究方向:活性天然产物的研究,E-mail: zhaodandan@hlju.edu.cn。
R284.2
A
2095-008X(2016)03-0063-05

