伊利石对四环素的吸附动力学及热力学研究
孙 文,王 珊,王高锋,郑水林
(中国矿业大学(北京)化学与环境工程学院,北京 100083)
伊利石对四环素的吸附动力学及热力学研究
孙文,王珊,王高锋,郑水林
(中国矿业大学(北京)化学与环境工程学院,北京100083)
对伊利石原矿和采用擦洗分散-离心分选方法选矿提纯后的精矿吸附溶液中四环素的饱和吸附量、吸附动力学和热力学进行了研究,并考察了pH值对四环素在伊利石上吸附效果的影响。结果表明,伊利石原矿与选矿提纯后的伊利石精矿在常温条件下(T=25 ℃)的饱和吸附量分别为28.11 mg/g与45.37 mg/g;pH值为4~6时伊利石有较好的吸附效果;准二级动力学方程对伊利石吸附四环素分子的过程描述更为准确;伊利石对四环素的等温吸附过程符合Langmuir等温吸附模型,是一个不可逆的自发吸热过程,吸附热力学参数吉布斯自由能(ΔG0)<0,焓变(ΔH0)>0,熵变(ΔS0)>0。
伊利石; 四环素; 吸附; 动力学; 热力学
1 引 言
抗生素广泛应用于人类与动物的治疗与疾病预防,并以亚治疗剂量的方式长期添加于动物饲料中促进动物生长[1]。研究表明,人畜摄入体内的抗生素中85%以上以原药和代谢产物随粪尿排出体外,致使抗生素进入环境[2]。其中,四环素类抗生素具有质优价廉、广谱性的特点,因此在禽畜生产与水产养殖过程中应用更为广泛[3]。进入环境中的四环素会发生降解反应,其代谢及降解产物相比母体抗生素,往往活性降低,毒性却大大增强,对生态系统及人体健康造成潜在威胁[4]。因此,研究四环素污染水体的去除技术具有重要的现实意义。
伊利石是一种非膨胀的2∶1型层状硅酸盐类黏土矿物[5],具有一定的阳离子交换容量(CEC)和比表面积。目前已有关于利用粘土矿物对四环素(Tetracycline,TC)进行吸附的研究,如蒙脱石[6]、累托石[7]和高岭石[8]等,但未发现有伊利石吸附四环素的相关报道。本文通过擦洗分散-离心分选法对伊利石进行选矿提纯,对比研究伊利石原矿与精矿对四环素的吸附性能,并对吸附过程中的动力学与热力学进行分析,为伊利石在含四环素这类抗生素废水处理技术中的应用提供理论依据。
2 实 验
2.1实验试剂及仪器
伊利石原矿由河北承德人和矿业有限责任公司提供。根据X射线衍射分析,原矿矿物组成(w%)为:伊利石,40.8;石英,55.2;长石,2.2;石膏,1.8,其比表面积为4.053 m2/g;选矿提纯后,伊利石精矿矿物组成(w%)为:伊利石,95.5;长石,4.5,其比表面积为13.510 m2/g;盐酸四环素(TC),美国Amresco公司,纯度≥90%;盐酸,国药集团化学试剂有限公司,分析纯;氢氧化钠,北京化工厂,分析纯。
HSJ系列恒温水浴搅拌器,金坛市科析仪器有限公司;TGL-160高速台式离心机,上海安亭科学仪器厂;FE20实验室pH计,梅特勒-托利多仪器(上海)有限公司;UV-9000S型紫外/可见分光光度计,上海元析仪器有限公司。
2.2实验方法
2.2.1精矿样品制备
采用擦洗分散-离心分离工艺[9]对伊利石原矿进行湿法选矿,烘干打散后制得伊利石精矿,备用。
2.2.2吸附动力学试验
称取伊利石0.100 g置于250 mL烧杯中,加入200 mL含有四环素浓度为25 mg/L的溶液,以5%的盐酸溶液或0.5 mol/L氢氧化钠溶液调至pH值,在25 ℃下恒温磁力搅拌,分别在不同时间(1、2、4、6、8、10、12、22、24 h)采集样品,离心5 min,离心转速为8000 r·min-1,并取上清液于359 nm处测定溶液的吸光度值。
2.2.3等温吸附平衡试验
配制初始浓度分别为10、50、80、100、150、200 mg/L的四环素溶液,取0.100 g伊利石与40 ml四环素溶液置于100 mL烧杯中,在25 ℃、35 ℃和45 ℃下恒温磁力搅拌24 h,离心后取上清液供分光光度计分析。
3 结果与讨论
3.1pH值对吸附的影响
pH值是矿物吸附过程中的一个重要因素,图1反映了pH值对伊利石原矿与精矿吸附四环素的影响。
由图1可知,在强酸性条件(pH值为2~4)下,伊利石吸附吸附能力随pH值的升高而增强,当pH值为4~6时吸附量达到最大,而当碱性增强时的伊利石的吸附能力急剧下降。这主要与四环素的自身结构有关,当pH值<3.3时,四环素以TCH3+形式存在,溶液中高浓度的H+与四环素形成竞争吸附,导致其不能有效吸附在伊利石表面;在pH值为3.3~7.7时,四环素可看作是带一个二甲氨基基团和一个负电荷酚羟基的兼性离子,当pH值为5.5时,四环素几乎以电中性的兼性离子形态(TCH2±)存在,此时四环素上的阳离子基团可以与伊利石表面的负电荷相互结合;随着pH值不断升高,四环素分子中负电荷所占比例不断增加,与电负性的伊利石表面产生强烈的排斥作用,导致其吸附能力下降。因此,当溶液pH值呈弱酸性时,伊利石对四环素有最佳的吸附效果。
3.2吸附动力学研究
根据试验所得结果,以时间t为横坐标,以伊利石对四环素的吸附量q为纵坐标作图,伊利石原矿与精矿对溶液中四环素分子的吸附量随时间的变化曲线如图2所示。
由图2可知,伊利石原矿和精矿对四环素的吸附动力学曲线趋势基本相同,吸附过程可分为初始的快速吸附阶段和随后的缓慢吸附阶段。由于伊利石原矿中含有大量石英杂质,且伊利石的有效含量仅为40.8%,因此在相对较高浓度的四环素溶液中,伊利石原矿迅速达到吸附平衡;提纯后的伊利石精矿平衡吸附量大幅增加但吸附速率有所放缓。
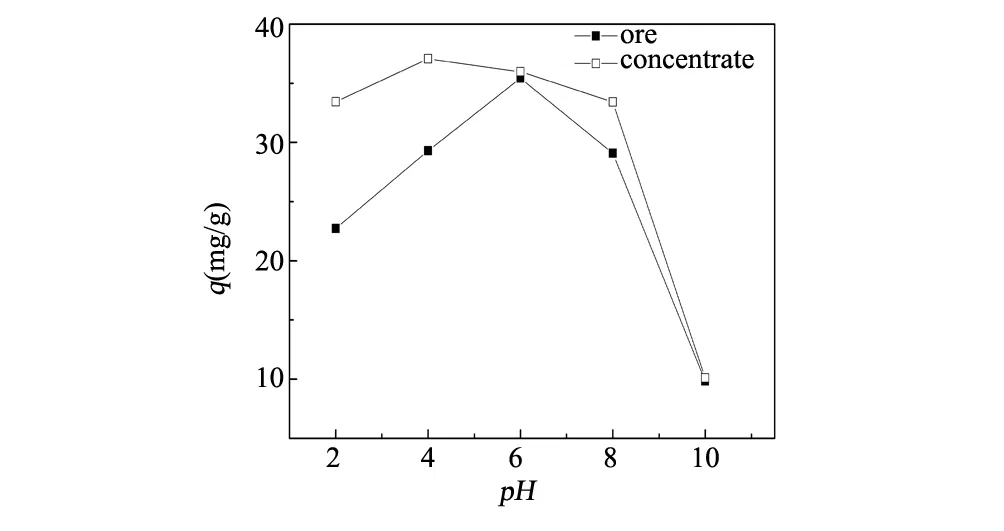
图1 pH值对伊利石吸附四环素的影响Fig.1 Sorption of TC on illite as affected by solution pH

图2 四环素吸附动力学曲线Fig.2 The dynamic adsorption curve of tetracycline
吸附动力学主要是用来描述吸附材料对物质吸附速率的快慢,通过采用不同的数学模型对吸附数据进行拟合可进一步探讨其吸附机理。固体吸附剂对溶液中溶质的吸附动力学过程常用准一级动力学模型(Pseudo-first-order)、准二级动力学模型(Pseudo-second-order)及颗粒内扩散模型(Intra-particle diffusion)进行描述[10,11]。准一级动力学模型可由应用最为广泛的基于固体吸附量的Lagergren一级速率方程进行描述[12]。准二级动力学模型是基于假定吸附速率受化学吸附机理的控制,这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移[13]。内部扩散模型常用来分析反应中的控制步骤,最适合描述物质在颗粒内部扩散过程,而对于颗粒表面、液体膜内扩散的过程往往不适合[14]。三种动力学模型线性表达式如下:
准一级动力学模型:
ln(qe-q)=lnqe-k1t
(1)
准二级动力学模型:
(2)
内部扩散模型:
q=A+kt1/2
(3)
式中,t为吸附时间,h;q为t时间的吸附量,qe为平衡吸附量,mg/g;A为模型参数;k为吸附扩散速率常数,mg/(g·h1/2);k1为准一级吸附速率常数,h-1;k2为准二级吸附速率常数,g/(mg·h)。
对伊利石精矿及原矿的吸附动力学试验结果分别用准一级动力学方程、准二级动力学方程及内扩散方程进行拟合,拟合结果如图3和表1所示。

表1 动力学模型拟合参数

图3 吸附动力学模型拟合曲线(a)准一级;(b)准二级;(c)内部扩散Fig.3 Fitted curves of adsorption kinetics models (a)pseudo-first-order;(b)pseudo-second-order;(c)intra-particle diffusion
由表1可知,与其他两种动力学模型相比,准二级动力学模型对四环素分子在伊利石原矿和精矿上的吸附过程描述更为准确,相关度分别为0.999和0.997,且准二级动力学方程计算所得出的平衡吸附量(qe)与试验所得的平衡吸附量(qe,exp)非常相近,说明伊利石对溶液中四环素分子的吸附过程更适合准二级动力学。动力学方程计算所得的平衡吸附量(qe)略大于实验所得的平衡吸附量(qe,exp),这是由于溶液中四环素分子不断被伊利石吸附,溶液中四环素浓度不断降低,从而使得吸附反应的推动力不断降低,因而伊利石对四环素分子的吸附量也会不断减少。伊利石原矿与精矿的平衡吸附量(qe)分别为29.63 mg/g和43.96 mg/g,可见提纯后的伊利石精矿对四环素分子的吸附能力明显优于原矿。
3.3吸附热力学研究
为了进一步描述四环素吸附过程中的吸附平衡关系,采用Langmuir等温吸附模型与Freundlich等温吸附模型对四环素吸附过程进行模拟[15]。Langmuir等温吸附模型假设吸附是一个单分子层的饱和吸附,吸附位只有一种且能量相当,各个被吸附的目标污染物分子之间没有相互作用。而Freundlich等温吸附模型一般适用于表面能量不是均一分布的吸附材料,该模型基于吸附剂的吸附位能量分配呈降低趋势的假设[16,17]。
Langmuir等温吸附模型:
(4)
Freundlich等温吸附模型:
(5)
式中,qe,qm分别为平衡吸附量和饱和吸附量,mg/g;Ce为吸附平衡时四环素溶液的浓度,mg/L;KL为Langmuir吸附平衡常数;KF为Freundlich吸附平衡常数。
对热力学试验数据按照Langmuir等温吸附模型和Freundlich等温吸附模型进行线性拟合,拟合结果如图4和表2所示。由表2可以看出,伊利石原矿和精矿对四环素的吸附等温式更符合Langmuir模型,拟合系数优于Freundlich模型,表明伊利石对四环素分析的吸附接近于单分子层吸附理论,固体表面各吸附位点的吸附能力相同。在T=298 K时,由Langmuir方程计算得出的精矿与原矿的饱和吸附量分别为28.1057 g/mg与45.3721 g/mg,与之前动力学拟合结果基本相同,进一步证实Langmuir模型可以很好的描述整个吸附过程。
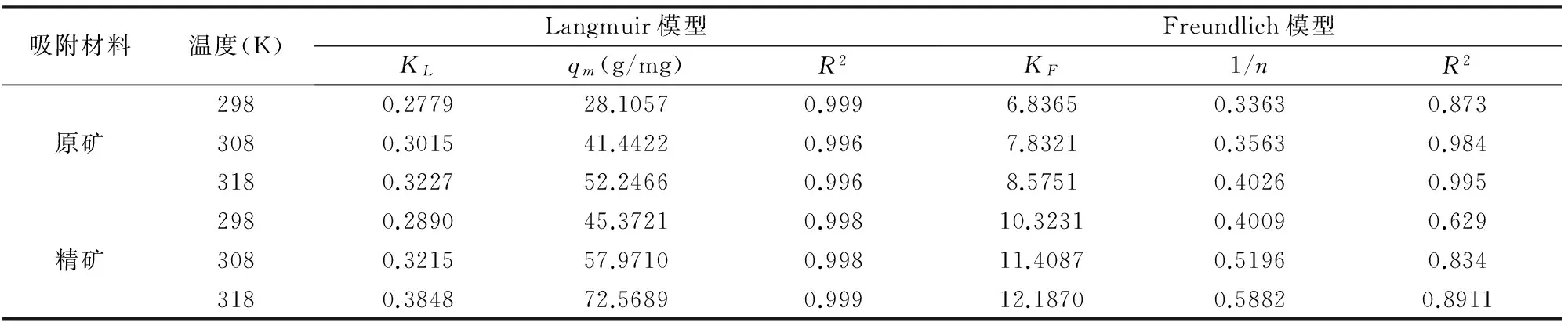
表2 等温吸附模型拟合参数
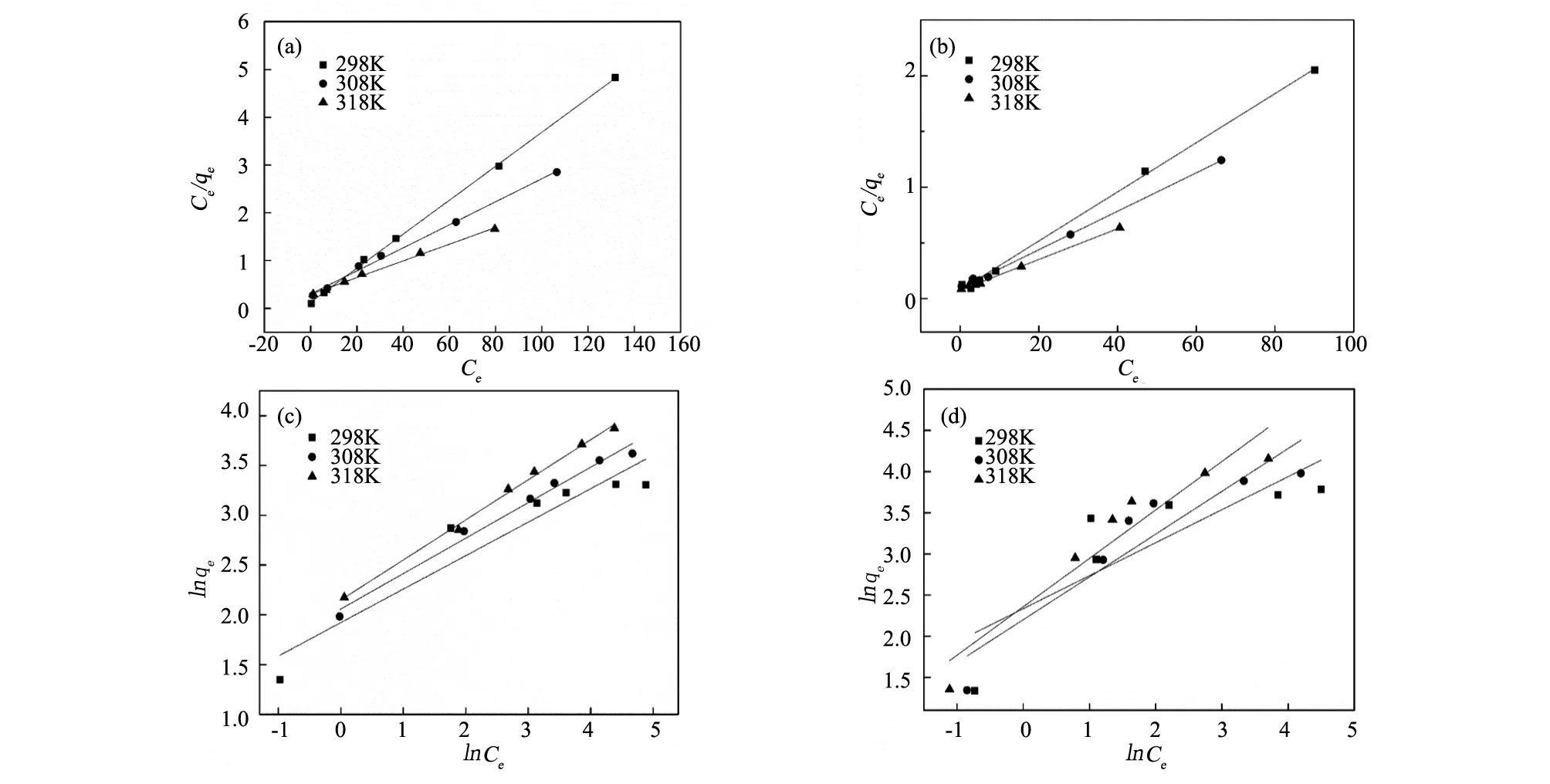
图4 吸附热力学模型拟合曲线(a)原矿Langmuir;(b)精矿Langmuir;(c)原矿Freundlich;(d)精矿FreundlichFig.4 Fitted curves of adsorption thermodynamics models(a)raw ore Langmuir;(b)concentrate Langmuir; (c)raw ore Freundlich;(d)concentrate Freundlich
通过进一步对吸附热力学性质进行研究,可以了解污染物吸附过程进行的趋势及程度。表征热力学性能的参数主要包括标准吉布斯自由能变(ΔG0)、标准反应焓变(ΔH0)、标准反应熵变(ΔS0)与平衡吸附分配系数(Kd),关系式见(6)~(8)[18]。
(6)
ΔG0=ΔH0-TΔS0
(7)
Kd=qe/Ce
(8)
式中,Kd为平衡分配系数,L/kg;ΔG0为标准吉布斯吸附自由能,kJ/mol; ΔH0为标准吸附焓变,kJ/mol; ΔS0为标准吸附熵变,kJ/(mol·K);R为理想气体常数,8.314 J/(mol·K);T为绝对温度,K;qe为平衡吸附量,mg/g;Ce为吸附平衡浓度,mg/L。
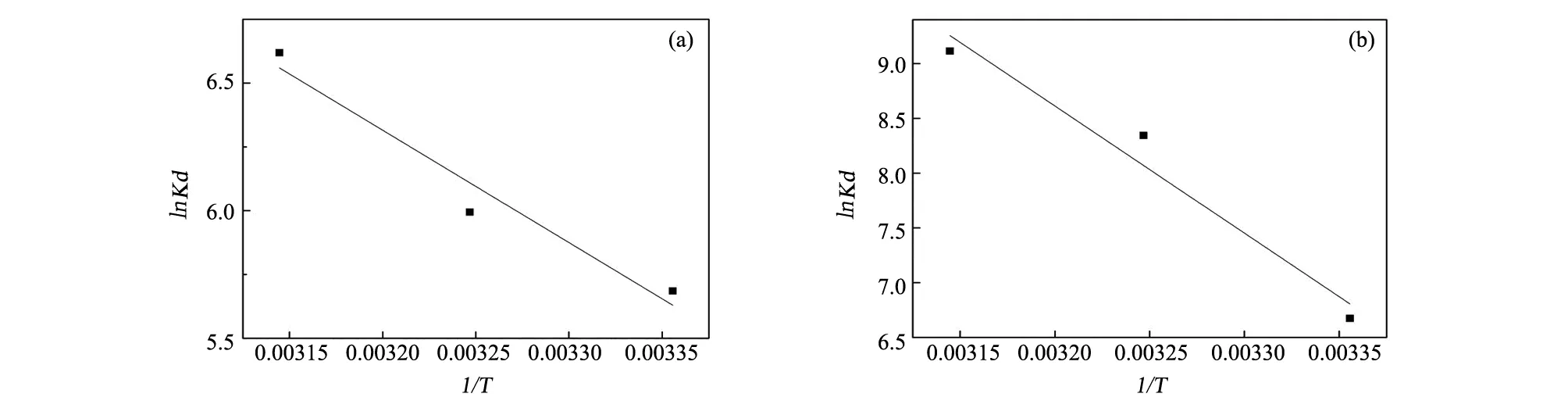
图5 lnKd与1/T的关系图(a)原矿;(b)精矿Fig.5 The relationship between lnKd and 1/T (a)raw ore and (b)concentrate
以公式(6)中lnKd为纵坐标、1/T为横坐标作图所得的截距和斜率分别得出ΔS0和ΔH0,继而由(7)式求得ΔG0,结果见图5和表3。由表3可知,吸附过程的ΔH0均为正值,说明伊利石对四环素分子的吸附为吸热过程,即吸附量随温度的升高而增加,升高温度有利于吸附的进行[19]。吸附过程的ΔS0>0,说明伊利石对溶液中四环素分子的吸附是熵值增加的过程,且优先在吸附剂表面进行[20]。吸附过程的ΔG0<0,说明吸附是自发进行的,随温度T的增加,ΔG0减小,有利于吸附的进行。

表3 伊利石吸附四环素热力学参数
4 结 论
(1) pH值为4~6时有伊利石有较好的吸附效果,伊利石原矿与选矿提纯后的伊利石精矿在常温条件下(T=25 ℃)的饱和吸附量分别为28.11 mg/g与45.37 mg/g,选矿提纯可以显著提升伊利石对四环素吸附能力;
(2)动力学研究表明,伊利石吸附溶液中四环素过程是一个先快速后慢速的过程,用准二级动力学来模拟伊利石对四环素的吸附过程更为准确;
(3)热力学研究表明,伊利石对四环素的吸附过程符合Langmuir模型,说明其吸附行为为单分子层吸附,而且该吸附过程是一个吸热的自发反应过程。
[1] 王冉.抗生素在环境中的转归及其生态毒性[J].生态学报, 2008,28(2): 761-766.
[2] Andreas H, Alfredo C A. Identification of fluoroquinolone antibiotics as the main source of umucgenotoxicity in native hospital wastewater[J].EnvironmentalToxicologyandChemistry,1998,17(3): 377-382.
[3] 邰义萍.东莞市蔬菜基地土壤中四环素类抗生素的含量与分布[J].中国环境科学, 2011,31(1): 90-95.
[4] 李伟明,鲍艳宇.四环素类抗生素降解途径及其主要降解产物研究进展[J].应用生态学报, 2012,23(8): 2300-2308.
[5] 郑水林.非金属矿物加工应用[M].北京:化学工业出版社, 2013:103-104.
[6] Li Z H, Po-Hsiang Chang. Interaction between tetracycline and smectite in aqueous solution[J].JournalofColloidandInterfaceScience,2010,341:311-319.
[7] Po-Hsiang Chang, Jiin-Shuh Jean. Mechanism of tetracycline sorption on rectorite[J].ColloidsandSurfacesA:PhysicochemicalandEngineeringAspects,2009,339:94-99.
[8] Li Z H.Adsorption of tetracycline on kaolinite with pH-dependent surface charges[J].JournalofColloidandInterfaceScience,2010,351:254-260.
[9] 屈小梭,宋贝,郑水林.海泡石的选矿提纯与精矿物化特性研究[J].非金属矿,2013,36(4): 35-36.
[10] Sun Z M.Removal characteristics of ammonium nitrogen from wastewater by modified Ca-bentonites[J].AppliedClayScience,2015,107:46-51.
[11] Morais W A,Fernandes A L P,Dantas T N C.Sorption studies of a model anionic dye on crosslinked chitosan [J].ColloidsandSurfacesA:Physicochem.Eng.Aspects,2007,310:20-31.
[12] 仇满德,牛苗,王亦丹,等.纳米镁铝水滑石的合成、微结构及吸附性能研究[J].人工晶体学报,2016,45(4):1047-1054.
[13] Ho Y S,McKay G.Pseudo-second order model for sorption processes [J].ProcessBiochemistry,1999,34:451-465.
[14] Asem A. Atia, Ahmed M. Donia. Removal of some hazardous heavy metals from aqueous solution using magnetic chelating resin with iminodiacetate functionality[J].SeparationandPurificationTechnology,2008,61:348-357.
[15] 李晓苇,李莉,张荣香,等.染料吸附对氯化银微晶表面结构的影响[J].人工晶体学报, 2006,35(4): 826-829.
[16] 郝建文.片状纳米氢氧化镁吸附铅离子吸附平衡与动力学[J].硅酸盐通报, 2012,31(5): 1127-1132.
[17] 胡家朋,吴代赦.Mn-Al 双氢氧化物对氟离子的吸附热力学和动力学研究[J].硅酸盐通报, 2015,34(4): 1071-1077.
[18] El-Shahawi M S,Nassif H A.Retention and thermodynamic characteristics of mercury (II) complexes onto polyurethane foams[J].AnalyticaChimicaacta,2003,418:29-39.
[19] Chih-Huang Weng,Cha-Zen Tsai.Adsorption characteristics of copper (II) onto spent activated clay[J].SeparationandPurificationTechnology,2007,54: 187-197.
[20] Ahmet Sar.Equilibrium, thermodynamic and kinetic studies on adsorption of Sb(III) from aqueous solution using low-cost natural diatomite[J].ChemicalEngineeringJournal,2010,162:521-527.
Kinetics and Thermodynamics Research of Tetracycline Adsorption by Illite
SUNWen,WANGShan,WANGGao-feng,ZHENGShui-lin
(School of Chemical and Environmental Engineering,China University of Mining & Technology,Beijing 100083,China)
The illite was purified through the scrubbing-centrifugation separation technique. Adsorption capacity, kinetics and thermodynamics of tetracycline sorption onto illite in solution were investigated, and the effect of pH was also studied. The results illustrated that the saturated adsorption capacity (T=25℃) of raw ore and concentrate was 28.11 mg/g and 45.37 mg/g, respectively.A higher adsorption capacity for thermodynamics was pH=4-6.The process of pseudo second-order kinetic equation could more accurately describe the adsorption process of tetracycline.In addition, the adsorption isotherms can be well described by Langmuir model, and various thermodynamics parameters including Gibbs free energy (ΔG0) , enthalpy (ΔH0) and entropy (ΔS0) indicated that the adsorption of tetracycline with illite was an irreversible, spontaneous and endothermic process.
illite;tetracycline;adsorption;kinetics;thermodynamics
孙文(1991-),男,硕士.主要从事非金属矿物材料方面研究.
郑水林,教授.
TU502
A
1001-1625(2016)07-2153-06

