钛丝负载Pt/TiO2电极的制备及其电催化测定化学需氧量研究
彭诗月,王宏志,李耀刚,张青红
(东华大学纤维改性国家重点实验室,上海 201620)
钛丝负载Pt/TiO2电极的制备及其电催化测定化学需氧量研究
彭诗月,王宏志,李耀刚,张青红
(东华大学纤维改性国家重点实验室,上海201620)
采用阳极氧化的方法,在钛丝上制备TiO2纳米管阵列薄膜,用恒电流沉积的方法在TiO2纳米管表面沉积Pt纳米晶,制备了钛丝负载的Pt/TiO2电极。用SEM对电极的形貌进行了表征,纳米管长度在3.5~10 μm之间与氧化电压和氧化时间密切相关,Pt纳米晶均匀沉积在TiO2纳米管表面。用极化曲线、循环伏安曲线、电流-时间曲线对Pt/TiO2电极的电催化性能进行表征。当沉积电流密度大于1.0 mA/cm2时,制备的Pt/TiO2电极的电催化性能显著高于Pt电极。而且,在甲醛等五种有机物溶液中的电催化结果表明,净电流和理论COD之间表现出很好的线性相关性,说明钛丝负载的Pt/TiO2电极可用于电催化快速检测水体中的化学需氧量。
阳极氧化; 电沉积; 化学需氧量; 电催化
1 引 言
化学需氧量(COD)是用氧化还原反应来测定水体中还原性有机物被氧化时所消耗的氧化剂的量,它反映了水中被还原性物质污染的程度,是评估水体质量的重要指标之一[1]。目前应用最普遍的检测方法酸性高锰酸钾法和重铬酸钾氧化法都需要通过滴定来测定过量的氧化剂的浓度,检测时间通常在2 h以上。为提高有机物的氧化程度,还需配合微波消解法[2]、紫外光化学消解法[3]和光催化氧化法[4]来缩短有机物与氧化剂的反应时间。最近,研究人员越来越关注TiO2的光催化在环境领域中的应用[5-7]。因为TiO2光催化产生的电子-空穴对具有很强的氧化能力,能将绝大多数有机物矿化为水和二氧化碳[8-10],Li等[11]采用激光煅烧的方法在钛网上制备的TiO2电极,对普鲁士蓝的光降解率达到了87%。Hua等[12]利用阳极氧化法在钛基底上制备出珊瑚结构的TiO2电极,该电极在模拟织物废水中对活性艳红染料表现出很高的光吸附性和降解率。Mu等[13]在钛箔上制备出一种高度致密排列的TiO2纳米棒,利用有机物不同浓度的净光电流变化,可定量快速测定多种有机物溶液的COD。
虽然TiO2光电催化在COD检测中具有重要的应用前景[14-16],但是仍然有一些因素制约了其催化效率。比较突出的问题是这种器件需要紫外光源来激发TiO2电极。此外,TiO2光催化电极本身的光催化活性也有待提高。
与光电催化检测相比,电催化氧化法检测COD的报道还比较少。与纳米半导体材料的光催化类似的是,电催化技术被认为是“环境友好技术”,它具有其他处理方法不可比拟的优越性,如可在常温常压下进行,设备及操作比较简单,占地面积小,成本较低且没有或很少产生二次污染等。最近, Gutierrez-Capitan等[17]制备了CuO/AgO纳米复合材料传感器,利用该传感器电催化检测废水的化学需氧量,检测结果与重铬酸钾法的检测结果一致。但是这种方法制备过程比较复杂,而且成本较高。为了降低成本,简化制备过程,本文采用恒电流沉积的方法在钛丝上氧化出TiO2纳米管,并在表面电化学沉积Pt纳米晶,制备了无需光照的电催化Pt/TiO2复合电极。经Pt修饰后,电催化电流成倍提高,显著提高了电催化检测COD的灵敏度和准确性。
2 实 验
2.1原材料
所用实验原料:氢氟酸、过氧化氢、乙二醇、氯铂酸、乙醇、丙酮、甲醛、甲醇、琥珀酸、甲苯、甲醛、氢氧化钾 (AR,均购于国药集团),钛丝 (99.99%,直径0.102 mm,Alfa Aesar)。
2.2实验过程
2.2.1TiO2纳米管的制备
称取一定质量的氢氟酸,溶解于含双氧水的乙二醇溶液中,充分混合均匀配成0.25 mol/L的氢氟酸-乙二醇电解液,其中,氢氟酸浓度为0.25 mol/L,双氧水浓度为0.022 vol/L。钛丝剪成长为6 cm的样品,分别用丙酮、异丙醇、无水乙醇和超纯水各超声清洗15 min,烘箱中烘干后放入无水乙醇中备用。将约70ml的电解液倒入100 ml左右的离心管中,使用Keithley 2400数字源表提供恒定电压,钛丝作为工作电极,铂丝作为对电极,采用两电极体系进行阳极氧化,两电极间隔为3 cm,钛丝浸入深度为5 cm,分别设定20 V、30 V和40 V的氧化电压,制备 TiO2纳米管。阳极氧化完成后,将样品在丙酮和无水乙醇中各超声清洗5 min后烘箱75 ℃烘干,随后在马弗炉中进行煅烧,使二氧化钛晶化。升温速率3 ℃/min,450 ℃保温2 h,随炉冷却至室温。
2.2.2恒电流沉积制备Pt/TiO2电极
称取一定量的氯铂酸配成0.05 mol/L的氯铂酸电解液,使用电化学工作站提供恒定电流(上海辰华仪器有限公司,CHI760D),采用三电极体系,铂丝作为阳极,制备的TiO2纳米管阵列作为阴极,Ag/AgCl电极作为参比电极,三电极间呈等边三角形排列,边长为3 cm,铂丝和TiO2纳米管阵列浸入氯铂酸溶液的深度均为3 cm,沉积过程用磁力搅拌器进行不断搅拌以减小浓差,保证电解液浓度均匀。直流电沉积时,电流值和沉积时间由电化学工作站的参数设置。
2.2.3样品的测试与表征
用日本Hitachi公司的Model S-4800型场发射扫描电子显微镜分析观察薄膜的形貌。光电化学检测由德国Zahner-elecktrik GmbH & Co.的Zennium电化学工作站测定。紫外光源由可控强度调制光谱仪(Controlled intensity modulated photo spectroscopy, CIMPS)提供。辐射主波长365 nm,最大辐射强度1.2 mW cm-2。电催化测试由上海辰华仪器有限公司的电化学工作站(型号:CHI760D)测定。
3 结果与讨论
3.1TiO2纳米管阵列的形貌分析
如图1 TiO2纳米管的SEM照片所示,若不改变氧化电压,随着反应时间的增加,钛丝表面会逐渐形成TiO2纳米管阵列。当反应时间为15 min时,表面形成了一层致密的氧化物,并分布有小孔,随着反应时间的增加,氧化物层不断被腐蚀溶解,孔的深度不断增加,孔与孔之间的突出部位变得越来越突出,最后,孔在不断的腐蚀溶解下形成纳米管。如图1c所示,当反应时间为60 min时,形成了排列紧密有序的纳米管。管径约为40 nm,管壁厚约10 nm。

图1 恒定电位为30 V时,不同反应时间下制备的TiO2纳米管的SEM照片(a)15 min;(b)30 min;(c,d)60 minFig.1 SEM images of the TiO2 nanotube array oxidized at 30V voltage for (a)15 min;(b)30 min and (c,d)60 min
图2是在室温条件下,氧化时间均为60 min,阳极氧化电压分别为20 V、30 V和40 V时形成的TiO2纳米管的SEM照片。如图2所示,当电压为20 V时(图2a),TiO2纳米管长度约为3.5 μm。当电压增加到30 V (图2b) 时,纳米管阵列厚度增加到5 μm。当电压增加到40 V(图2c)时,TiO2纳米管呈现高度有序排列的管状结构,纳米管阵列长度约为10 μm。通过上述分析可知,TiO2纳米管管长随着氧化电压的升高而增加,且高电压有利于薄膜表面覆盖物的去除,说明正电压加速了氧化物薄膜的溶解和钛的氧化。因此,阳极电压越大,Ti的氧化和TiO2的溶解速率也越快,因此可制得更长和管径更大的TiO2纳米管。采用氢氟酸-乙二醇体系,可以制备排列致密的TiO2纳米管阵列。

图2 氧化时间为60 min,不同氧化电压下制备的TiO2纳米管的SEM照片(a)20 V;(b)30 V;(c,d)40 VFig.2 SEM images of the TiO2 nanotube array in a duration of 60 min with voltages of (a)20 V;(b)30 V and (c,d)40 V
3.2Pt/TiO2电极的形貌分析
图3是不同沉积电流制备的Pt/TiO2电极的SEM照片。从图中可以看出,随着沉积电流的增加,Pt沉积量增加。如图3a所示,当沉积电流为0.5 mA/cm2时,TiO2纳米管表面只散落着零星的Pt纳米晶,若进一步增加沉积电流,如图3b和3c所示,Pt负载量有了显著的增加。沉积的Pt渐渐覆盖了TiO2纳米管表面,沉积的Pt呈现一种类似片状的无定形形貌。当沉积电流增加到2.0 mA/cm2,Pt几乎覆盖了纳米管的表面。这一组电镜照片表明,利用恒电流沉积的方法,可以非常容易地在钛丝基底上均匀沉积Pt纳米晶,从而制备出Pt/TiO2复合电极。

图3 沉积时间为10 min, 不同沉积电流密度制备的Pt/TiO2纳米管阵列电极的SEM照片 (a)0.5 mA/cm2;(b)1.0 mA/cm2;(c)1.5 mA/cm2;(d)2.0 mA/cm2Fig.3 SEM images of the Pt/TiO2 nanotube array electrode in a duration of 10 min with different current densities
3.3光催化性能及极化曲线测试分析
如图4所示,对不同电压下制备的TiO2纳米管电极进行光电催化测试。该测试在室温下进行,采用三电极体系,电解池为20 ml的石英比色皿,电解质溶液为0.1 mol/L的NaNO3溶液,以制备的钛丝负载TiO2纳米管为工作电极,铂丝为对电极,Ag/AgCl为参比电极。紫外光强由可控强度调制光谱仪(Controlled intensity modulated photo spectroscopy, CIMPS)控制。辐射主波长365 nm,紫外光辐射强度为1.2 mW·cm-2。当有紫外光照射时,光电流随着工作电极上施加的偏压增加而增加,然后平稳达到饱和光电流。从图4可看出,纳米管的光电流响应与纳米管的形貌和长度有关。一方面,管长的增加会增加半导体材料的吸附量和比表面积,另一方面,管长增加也会增加电子-空穴对的传输时间从而增大复合概率。此外,纳米管过长,管中会有裂纹,晶界间电阻也会增大。在进行光催化过程中越容易断裂,纳米管的阵列也会被破坏。从图中可以看出,阳极氧化条件为30 V,氧化时间为60 min制备的电极具有最大的光电流。因此,在随后的测试中,均选择30 V氧化电压制得的TiO2电极作为Pt沉积的基底。

图5 不同电流密度制备的 复合电极的极化曲线Fig.5 Polarization curves of Pt/TiO2 electrode with different current densities
如图5所示是不同电流密度制备的Pt/TiO2电极的极化曲线。电解液是1 mol/L的 KOH溶液,扫描速率为50 mV/s。将复合电极与纯Pt电极进行对比,说明与纯Pt电极相比,负载Pt的复合电极的活性高低。从图5可以看出,当电流密度为0.5 mA/cm2时,复合电极没有达到Pt电极的活性。而当沉积电流密度增加到1 mA/cm2时,制得的电极活性远远超过了Pt电极。电流密度越大,相同沉积时间内基底表面Pt的沉积量就越多,负载的Pt越多,电极表面传输电子的活性点也就越多,电极表面的活性也随之增加。当电流进一步增加为1.5 mA/cm2和2.0 mA/cm2时,电极的活性变化不大。由此可知,若沉积时电流过小,基底电极表面的Pt活性点太少,不利于提高Pt/TiO2电极的催化活性,只能增加沉积时间来增加电极的活性。而当电流密度达到一定程度之后,Pt的增加对电极的催化活性的影响越来越小。因此应选择合适的电流密度进行沉积,过小增加反应时间,过大则浪费Pt的使用。
3.4电催化化学需氧量检测
结合甲醇电催化氧化的原理和半导体光催化降解有机物的原理可知,Pt的电催化理论上可以应用到有机物的检测上。以甲醇为例,甲醇在 Pt/TiO2电极上发生的主要反应是:
2Pt+CH3OH→Pt-CH2OH+Pt-H
(1)
2Pt +Pt-CH2OH→ Pt2CHOH+Pt-H
(2)
2Pt+Pt2CH2OH→Pt3COH+Pt-H
(3)
Pt-H→Pt+H+e-
(4)
在阳极上甲醇氧化的总反应为:
CH3OH+H2O→CO2+6H+6e-
(5)
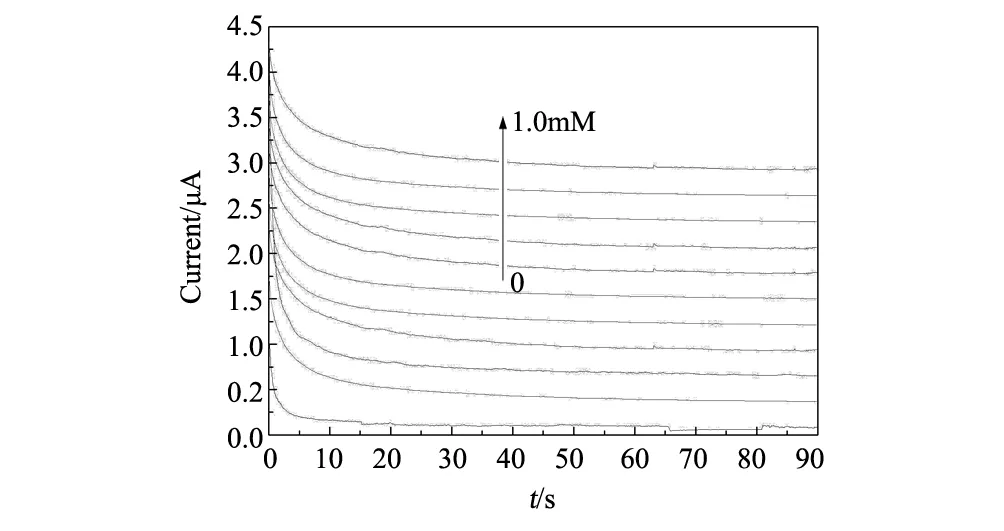
图6 在不同浓度的甲醇溶液中的时间-电流曲线Fig.6 Photocurrent -time curves of 0.1M KOH solutions containing various concentrations of CH3OH (0, 0.1 mM,0.2 mM,0.3 mM, 0.4 mM, 0.5 mM, 0.6 mM,0.7 mM,0.8 mM,0.9 mM,1.0 mM)
从总反应式可以看出,甲醇被氧化为CO2是6电子反应,同理,不同的有机物在电催化氧化反应中电子转移数不同,净电流也会不同。
图6为一组在加正向偏压1.5 V的条件下,在不同浓度的甲醇溶液中的时间-电流曲线。由图6可知,电流随着时间的增加而减少,然后逐渐达到稳定的电流,这主要是因为随着时间的延长,水中甲醇组分减少,因而电流也降低。 随着甲醇浓度的增加,稳定电流也在增加。
为了验证Pt/TiO2电极对不同有机物的电催化氧化能力,选取五种有机物在相同条件下进行电催化化学需氧量检测。图7为Pt/TiO2纳米管阵列电极的净稳态电流与有机物浓度(0~1 mM)的关系图。从图中可以看出,在规定的浓度范围内,净稳态电流与选取的有机物浓度呈线性关系,进行线性拟合可以进一步发现,这是一种正比例关系。斜率由有机物被矿化为H2O和CO2时转移的电子数目决定。如果用COD标准浓度(mg/L of O2)来代替摩尔浓度,就可以得到如图8的线性关系曲线,从得到的线性拟合方程:y=0.5011x+0.0578可以看出,净稳态电流和COD标准浓度具有非常好的线性关系。

图7 不同浓度、不同种类有机物的样品 溶液获得的净稳态电流(inet)与 有机物浓度之间的关系Fig.7 Relationship between inet and the molar concentration of different organic compounds
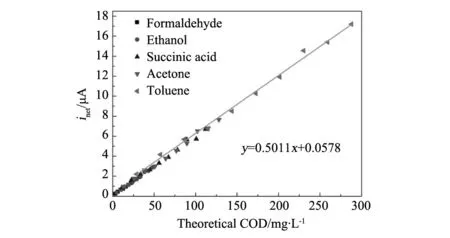
图8 不同浓度、不同种类有机物 的样品溶液获得的净稳态电流(inet)与 有机物理论COD值之间的关系Fig.8 Quantitative relationship between inet and the theoretical COD of different organic compounds
4 结 论
采用阳极氧化的方法在钛丝基底上制备了致密排列的TiO2纳米管。通过线性伏安扫描曲线发现,厚度为5 μm的TiO2电极具有最佳的光催化性能。之后,采用恒电流沉积的方法,在TiO2纳米管表面均匀沉积了Pt纳米晶。沉积电流密度为1.5 mA/cm2制备的Pt/TiO2电极具有最好的电催化极性。选取包括甲醇在内的五种有机物进行电催化化学需氧量检测,Pt/TiO2复合电极均表现出很好的精确性和稳定性,净稳态电流和有机物标准浓度具有非常好的线性关系。该Pt/TiO2复合电极可以准确快速对水体进行电催化化学需氧量的检测。
[1] Li X,Yin W,Li J,et al.TiO2nanotube sensor for online chemical oxygen demand determination in conjunction with flow injection technique[J].WaterEnvironmentResearch,2014,86(6): 532-539.
[2] Jardim W F,Rohwedder J J R.Chemical oxygen demand (COD) using microwave digestion [J].WaterResearch,1989,23(8): 1069-1071.
[3] Anas M,Dong Suk H,Mahmoud K,et al.Photocatalytic degradation of organic dye using titanium dioxide modified with metal and non-metal deposition[J].MaterialsScienceinSemiconductorProcessing, 2016, 41: 209-18.
[4] Bougrier C,Carrere H,Delgenes J P.Solubilisation of waste-activated sludge by ultrasonic treatment[J].ChemicalEngineeringJournal, 2005, 106(2): 163-169.
[5] 李石,赵东风,郑经堂,等.三维有序大孔二氧化钛光催化降解有机废水研究[J].硅酸盐通报,2012,31(04):818-821.
[6] 张媛,蒋文伟,杨琴.锐钛矿 TiO2薄膜的低温制备及其光催化性能研究[J].中国陶瓷,2014,50(2):34-36.
[7] 许凤秀,冯光建,刘素文,等.TiO2降解有机染料废水的研究进展[J].硅酸盐通报, 2008, 27(05):991-995.
[8] Quan X,Yang S G,Ruan X L,et al.Preparation of titania nanotubes and their environmental applications as electrode[J].EnvironmentalScience&Technology,2005,39(10):3770-3775.
[9] Zhang H,Chen G,Bahnemann D W.Photoelectrocatalytic materials for environmental applications[J].JournalofMaterialsChemistry,2009,19(29):5089-5121.
[10] Leng W H,Zhang Z,Zhang J Q,et al.Investigation of the kinetics of a TiO2photoelectrocatalytic reaction involving charge transfer and recombination through surface states by electrochemical impedance spectroscopy[J].JournalofPhysicalChemistryB,2005,109(31):15008-15023.
[11] Li J,Zheng L,Li L,et al.Fabrication of TiO2/Ti electrode by laser-assisted anodic oxidation and its application on photoelectrocatalytic degradation of methylene blue[J].JournalofHazardousMaterials, 2007, 139(1):72-78.
[12] Hua X S,Zhang Y J,Ma N H,et al.A new coral structure TiO2/Ti film electrode applied to photoelectrocatalytic degradation of reactive brilliant red[J].JournalofHazardousMaterials, 2009, 172(1):256-261.
[13] Mu Q,Li Y,Zhang Q,et al.Template-free formation of vertically oriented TiO2nanorods with uniform distribution for organics-sensing application[J].JournalofHazardousMaterials, 2011, 188(1-3):363-368.
[14] Zhang M,Shi L,Yuan S,et al.Synthesis and photocatalytic properties of highly stable and neutral TiO2/SiO2hydrosol[J].JournalofColloidandInterfaceScience, 2009, 330(1): 113-118.
[15] Tian G,Fu H,Jing L,et al.Synthesis and photocatalytic activity of stable nanocrystalline TiO2with high crystallinity and large surface area[J].JournalofHazardousMaterials, 2009, 161(2-3): 1122-1130.
[16] Ghasemi S,Rahimnejad S,Setayesh S R,et al.Transition metal ions effect on the properties and photocatalytic activity of nanocrystalline TiO2prepared in an ionic liquid[J].JournalofHazardousMaterials, 2009, 172(2-3): 1573-1578.
[17] Gutierrez-Capitan M,Baldi A,Gomez R,et al.Electrochemical nanocomposite-derived sensor for the analysis of chemical oxygen demand in urban wastewaters[J].AnalyticalChemistry, 2015, 87(4): 2152-2160.
Preparation of Titanium Wire Supported Pt/TiO2Nanotube Array Electrode and Application in Electrocatalytic Determination of Chemical Oxygen Demand
PENGShi-yue,WANGHong-zhi,LIYao-gang,ZHANGQing-hong
(State Key Laboratory for Modification of Chemical Fibers and Polymer Materials,Donghua University,Shanghai 201620,China)
TiO2nanotube arrays were prepared on the Ti wire by anodic oxidation method. Pt nanocrystals were deposited on the surface of TiO2nanotube by galvanostatic deposition method and thus titanium wire supported Pt / TiO2nanotube array electrodes were prepared. Morphology of the obtained samples was characterized by SEM. The length of the nanotube is between 3.5 μm to 10 μm depending on the oxidized voltage and duration. Pt nanocrystals were uniformly deposited on the surface of TiO2nanotubes. The electric catalytic performances were characterized by polarization curve, linear voltammetry and photocurrent-time curves. When the deposition current density is greater than 1 mA/cm2, the electric catalytic performance of the Pt/TiO2electrode is significantly higher than that of Pt electrode. The electric catalytic oxidation of the five kinds of organic compounds results showed a good linear correlation between static electricity and theoretical chemical oxygen demand (COD). This titanium wire supported Pt/TiO2nanotube array electrode can be used for rapid electrocatalytic detection of COD in water.
anodic oxidation;electrodeposition;chemical oxygen demand;electrocatalytic
上海市科委项目 (15ZR1401200,13JC1400200)
彭诗月(1990-),女,硕士研究生.主要从事纳米功能材料研究与应用.
张青红,教授.
O646
A
1001-1625(2016)07-2059-06

