水蕨精子发生过程中中心体蛋白和微管蛋白的免疫荧光定位
曹建国,王 尧,陈雪菲,戴锡玲,王全喜,2
(1 上海师范大学 生命与环境科学学院 上海 200234;2 上海资源植物功能基因组重点实验室,上海辰山植物园 上海201602)
水蕨精子发生过程中中心体蛋白和微管蛋白的免疫荧光定位
曹建国1,王 尧1,陈雪菲1,戴锡玲1,王全喜1,2
(1 上海师范大学 生命与环境科学学院 上海 200234;2 上海资源植物功能基因组重点实验室,上海辰山植物园 上海201602)
采用透射电镜技术和免疫荧光标记技术对水蕨精子发生的超微结构以及中心体蛋白和微管蛋白在精子发生过程中的动态表达进行了观察。研究发现:(1)生毛体分化早期周围有放射状微管分布,这与线粒体向生毛体的聚集有关。(2)免疫荧光观察表明,中心体蛋白仅定位于生毛体、基体和鞭毛带上,自生毛体至基体阶段呈现明亮的荧光标记,在核塑形、鞭毛形成至精子成熟阶段,中心体蛋白荧光标记随着鞭毛的发生而逐渐减弱,至游动精子阶段中心体蛋白荧光标记信号几乎消失。(3)微管蛋白早期荧光标记与中心体蛋白标记形相同,在生毛体、鞭毛带、基体等运动细胞器上呈现明亮荧光标记,但微管蛋白随着鞭毛的发生其荧光标记越来越强。从二者的时空表达特征可以推断,中心体蛋白主要是运动细胞器的组织者,而非这些运动细胞器的结构成分,其功能是参与或负责中心粒、基体和鞭毛的发生。
水蕨;中心体蛋白;微管蛋白;荧光标记
蕨类植物精子发生是一个运动细胞器,如生毛体、多层结构(片层带和微管带)和鞭毛等重新发生的过程,超微结构观察表明这些运动细胞器均含微管[1-5];免疫研究表明蕨类运动细胞器含有丰富的微管蛋白(tubulin)[6-7],在成熟精子的多层结构上还有肌动蛋白[7];免疫金标记显示水蕨生毛体、多层结构和微管带背面不定形物质内含有中心体蛋白(centrin)[4, 8-9];在水蕨精细胞生毛体上还含有中心体识别蛋白MPM-2和C-9[9];在这些蛋白中,中心体蛋白的出现与生毛体等运动细胞器的形成密切相关[10-11]。我们在水蕨蛋白组学研究中发现中心体蛋白在水蕨雄配子体精子器发生阶段特异表达,是雄配子大量表达的一种蛋白[12],并对水蕨中心体蛋白基因进行了克隆和表达分析[13]。然而,中心体蛋白的动态表达及与微管蛋白表达的相关性尚未可知,本研究以水蕨为材料对中心体蛋白和微管蛋白在精细胞发生过程中的动态表达进行了研究,这对阐明中心体蛋白在精子运动细胞器发生中的特点和作用有一定的科学意义。
1 材料和方法
1.1 水蕨配子体培养
水蕨孢子采自上海师范大学植物园,孢子用5%的次氯酸钠溶液消毒3 min,用蒸馏水冲洗3次后接种于改良Knop’s培养基上,置于人工气候箱内培养,光照18 h/d,温度为25 ℃,光照强度约35 μmol·m-2·s-1,黑暗6 h,培养温度为22 ℃。在此条件下,精子器于2~3周后在雄配子体的边缘产生。
1.2 透射电镜观察
在解剖镜(Nikon SMZ1500)下选取具不同发育阶段精子器的配子体,用0.1 mol/L磷酸缓冲液配制的3%戊二醛固定6 h,经相同缓冲液冲洗3次,用2%锇酸后固定2 h后,再用相同缓冲液冲洗3次,系列丙酮(50%、70%、90%、100%)脱水后,用spurr’s树脂渗透并包埋,经70 ℃聚合9 h得到包埋块。经半薄切片定位,选择不同发育阶段的精子器进行超微切片(Leica EM UC7, Germany),超薄切片经醋酸铀和柠檬酸铅染色后,用FEI 电镜观察和照相(Tecnai G2 Spirit BioTWIN, FEI Company)。
1.3 中心体蛋白和微管蛋白的免疫标记和观察
1.3.1 荧光观察材料样品的制备 挑选含有不同发育阶段精子器的雄配子体迅速投入到用0.1 mol/L磷酸缓冲液配制的4%多聚甲醛固定液中,在室温条件下固定2 h。用0.1 mol/L的Pipes溶液进行漂洗3次,每次10 min。酒精梯度(25%、50%、75%)脱水,每次30 min,为提高可见性,在酒精中可加入1 μL 8% (w/v) 酸性品红。在酒精和LR White包埋剂按不同混合比渗透(2∶1,1 h;1∶1,1 h;1∶2,1 h;纯包埋剂4 h,纯包埋剂12 h,纯包埋剂24 h),最后用纯LR White包埋剂包埋和聚合,将配子体放置在0.5 mL锥形管中,于低温紫外包埋箱中-10 ℃、紫外(波长365 nm)照射条件下进行聚合48 h,得到包埋块。
1.3.2 蛋白免疫标记 (1)切片和粘片:选择具不同发育阶段精子器的配子体,用超薄切片机切1 μm的薄片(PowerTome-XL型号),薄片经过甲苯胺蓝染色后,光镜检查确定发育时期后,再切取20~30片,用捞片器将薄片轻放在已滴有水滴的正电荷防脱载玻片上,待切片自然展开后用吸水纸从水滴侧面吸去多余的水分,将载玻片放入塑料反应盒中在30 ℃温箱烤片至切片完全吸附于载玻片上。(2)脱脂:将粘有树脂的载玻片放入装有纯酒精的培养皿中5 min中,中间换2次,即可将树脂大部分脱掉。(3)抽提:室温下用1% Triton-X-100溶液抽提5~15 min,PBS冲洗3次,每次5 min,抽提及冲洗时反应盒置于摇床上。(4)封闭:3%BSA牛血清蛋白中温室下封闭20 min,封闭及PBS冲洗时反应盒置于摇床上。(5)一抗孵育:本实验中使用的一抗分别为anti-centrin兔单克隆抗体和anti-Χ-tubulin鼠单克隆抗体。将单克隆抗体按1∶1 000浓度稀释,将材料置于一抗中37 ℃孵育4 h或者在4 ℃过夜,PBS中清洗3次,每次5 min,一抗可以用封闭液稀释。(6)二抗孵育:本实验使用的二抗分别为羊抗兔lgG(H+L)和羊抗鼠 lgG(H+L),于37 ℃,二抗中孵育2 h,PBS中冲洗3次,每次5 min,孵育清洗过程中均在摇床上进行,尽量置于黑暗的环境中操作。(7)染核:用1 μg·mL-1DAPI染细胞核5 min,PBS冲洗3次,每次5 min。暗室中,用Nikon80i-荧光显微镜检查及拍照。
2 观察结果
2.1 精原细胞
水蕨的产精细胞可经连续有丝分裂形成8~16个精原细胞,16~32个精母细胞,最后产生32~64个精细胞,精细胞再分化形成精子。电镜观察显示精原细胞常呈多边形,直径15 μm左右,细胞核显著,呈圆形或略方形,具不规则形状的核仁,精原细胞含有丰富的细胞器(图版Ⅰ,1)。DAPI染色观察表明精原细胞具有显著的细胞核,中心体蛋白免疫荧光标记显示精原细胞阶段细胞无任何中心体蛋白荧光标记(图版Ⅰ,2);而微管蛋白免疫荧光标记显示细胞质呈弱荧光标记(图版Ⅰ,3)。
2.2 生毛体发生
通过电镜观察,本研究在发育早期的精细胞细胞核附近观察到了一团不定形物质,放大观察表明该不定形物质是由致密的颗粒构成(图版Ⅰ,4、5)。当精细胞略变圆,我们在细胞核附近的细胞质中发现了早期的生毛体,呈球状,其直径大约在0.8 μm,它由一团电子染色暗的物质构成,与生毛体相对之处的细胞核常出现凹刻(图版Ⅰ,6),放大观察可见生毛体内具染色较浅的通道(图版Ⅰ,7),仔细观察可见微管呈放射状从生毛体向外延伸出来(图版Ⅰ,7,箭),在生毛体的周围聚集了许多发育良好的线粒体(图版Ⅰ,6、7)。此阶段,免疫荧光标记显示精细胞细胞质内具中心体蛋白特异性表达的绿色荧光亮点,根据亮点的大小和位置,可以推测该亮点为早期生毛体(图版Ⅰ,8,箭)。此时期亦可见到微管蛋白的特异荧光表达亮点(图版Ⅰ,9,箭)。与中心体蛋白免疫荧光标记相比,微管蛋白的免疫荧光标记亮点略呈扩散状,这与电镜观察到生毛体产生大量扩散的微管相一致。
2.3 多层结构发生
进一步发育可见生毛体的直径增长到1.5 μm左右,生毛体成为疏松的圆球状或椭圆状,其周围分化出多数中心粒(centrioles),生毛体内部由电子染色暗的不定形物质组成(图版Ⅱ,1)。偶尔可见中心粒在生毛体一侧打开,其内的不定形物质分化产生了微管带(MTR)(图版Ⅱ,2)。更多情况下,微管带与片层带(LS)相连,二者形成多层结构(MLS),多层结构再与一个线粒体相连,此线粒体最终发育为环状线粒体(图版Ⅱ,3、4)。不论最初的多层结构朝向如何,最终环状线粒体总是朝向精细胞核,微管带均背向细胞核,中心粒分布在微管带的外表面(图版Ⅱ,5~7)。多层结构发生初期,中心体蛋白荧光标记显示生毛体由原来的圆形斑点状变为弧形斑点,但细胞质均无中心体蛋白荧光标记(图版Ⅱ,8)。微管蛋白荧光标记也显示生毛体从一个圆点状逐渐向两侧延伸为弧形,此时的精细胞除了生毛体特异性微管蛋白标记外,精细胞的细胞质亦呈较显著的微管蛋白荧光标记(图版Ⅱ,9)。
2.4 微管带扩展和基体形成
微管带形成后很快延伸到核的表面(图版Ⅲ,1),放大观察,可见微管带是从多层结构延展到核表面的,多层结构内侧的环状线粒体亦十分显著(图版Ⅲ,2),生毛体的中心粒此时沿微管带外侧分散排列,成为基体(图版Ⅲ,2~4),从基体的横切可观察到微管三联体和轮状结构(图版Ⅲ,3),从基体的纵切可见基体两端生长,长度明显长于中心粒,其近极端形成楔状结构,与不定形的暗物质连接(图版Ⅲ,4),远端形成星状结构。在核的表面,微管与核膜结合紧密,微管带下方双层核膜清晰可辨(图版Ⅲ,3、4)。随发育,微管带扩展到核表面的1/2左右,但精细胞核仍然呈圆形,无明显的核塑形(图版Ⅲ,7)。免疫荧光观察显示中心体蛋白绿色荧光标记与电镜观察中微管带与基体在核表面的扩展相一致,此阶段的早期荧光标记呈短线状(图版Ⅲ,5,箭),随发育中心体蛋白荧光标记延伸并覆盖细胞核的1/2左右(图版Ⅲ,8,箭),仔细辨别可以看到每条绿色荧光标记线都是由数个荧光亮点构成,这表明绿色荧光标记可能是微管带外的不定形物质和基体(图版Ⅲ,5、8)。微管蛋白的特异性荧光标记与中心体蛋白相同(图版Ⅲ,6、9,箭),但荧光标记的亮度似乎略强于中心体蛋白荧光标记,值得说明的是精细胞细胞质亦呈一定的微管蛋白阳性标记,但标记的强度较微管带弱很多(图版Ⅲ,6、9)。此阶段,DAPI染色显示细胞核仍呈规则的圆形(图版Ⅲ,5、6、8、9)。
2.5 核塑形与鞭毛的发生
接下来,精细胞进入核塑形阶段。核塑形初期,精细胞外产生了明显加厚的细胞壁,精细胞原生质体开始消瘦,质膜与细胞壁之间产生空腔,细胞核开始由圆形变为扇状,基体已经长出鞭毛,伸入到原生质体的外方(图版Ⅳ,1)。DAPI标记观察到细胞核开始向两侧延伸,逐渐变为扇形或不规则形状(图版Ⅳ,2、3)。免疫荧光标记显示中心体蛋白特异性荧光标记信号显著下降,前一阶段标记的绿色条状荧光带此时不易观察,仅在微管带的表面观察到一些断续的绿色荧光亮点(图版Ⅳ,2,箭)。而微管蛋白特异性荧光标记依然显著,绿色荧光带除覆盖细胞核部分表面外,荧光标记也扩展到核外大部分区域,甚至包围着整个细胞(图版Ⅳ,3,箭),这与微管带和鞭毛在细胞外围的延展相一致,此时,细胞质无明显的微管蛋白荧光标记。
进一步发育,细胞核变为带状,染色质进一步浓缩,精细胞外可见大量的鞭毛(图版Ⅳ,4)。DAPI标记也观察到细胞核延展成为带状、扇形或不规则形状(图版Ⅳ,5、6)。荧光标记显示中心体蛋白特异性荧光标记依然微弱,仅在核表面呈现点状分布(图版Ⅳ,5,箭)。而此时微管蛋白荧光特异性标记显著增强,包围着整个精细胞(图版Ⅳ,6),这与精细胞产生了大量的鞭毛相一致,有的呈现为条状强绿色荧光标记,应该是鞭毛聚集处(图版Ⅳ,6,箭),这与电镜切片中鞭毛的聚集情况相一致。
2.6 游动精子
经过核塑形阶段,精细胞最终成为一个螺旋形游动精子,它主要由运动细胞器和螺旋状的细胞核构成,运动细胞器包括多层结构、环状线粒体、微管带和鞭毛。细胞核亦呈螺旋的带状,染色质高度浓缩(图版Ⅳ,7)。在成熟精细胞的内部,仍有许多大而明显的造粉体、囊泡和线粒体(图版Ⅳ,7)。DAPI染色亦可以观察到此阶段的细胞核呈螺旋状(图版Ⅳ,8、9)。荧光免疫标记显示,中心体蛋白荧光特异性标记几乎完全消失,偶尔可以看见零散分布的微弱绿色荧光亮点(图版Ⅳ,8,箭),而微管蛋白荧光特异性标记达到最高程度,有时可见块状的绿色荧光标记,这应该是鞭毛聚集处(图版Ⅳ,9,箭)。
3 讨 论
3.1 生毛体的形成和分化
生毛体的来源是人们感兴趣的问题之一,Hepler[14]在苹(Marsileavestita)精原细胞第8次分裂中观察到一团絮状物质,从该絮状物质内逐步分化产生生毛体。Vaudois和Tourte发现蕨(Pteridiumaquilinum)生毛体也来自电子染色暗的颗粒状或絮状物质[15]。Doonan等在Platyzomamicrophyllum精母细胞内发现了球形的颗粒状结构[6]。Kotenko在球子蕨(Onocleasensibilis)精细胞中也观察到了颗粒状物质构成的球形结构,他们认为这是生毛体的早期形态[3]。本研究中,我们通过透射电镜观察到了一团电子暗的颗粒状物质,位于精细胞细胞核附近,我们认为这是生毛体的最早可见形态,我们试图用免疫荧光标记方法确定其是否含有中心体蛋白成分,尽管我们定位到了中心体蛋白免疫荧光标记的亮点,但光镜观察到的荧光标记点尚无法准确对应电镜观察到的细致结构,免疫金标记是解决这一问题的方法。
水蕨生毛体的分化过程经历了前中心粒(procentrioles)、中心粒(centrioles)、多层结构分化等过程,这与蕨(P.aquilimum)、P.microphyllum、球子蕨(O.sensibilis)、苹(M.vestita)等其他蕨类生毛体的发育过程类似[1-3, 6,9]。本研究中通过电镜观察到前中心粒阶段的生毛体周围有细胞质微管呈放射状分布,通过微管蛋白免疫荧光标记也在生毛体周围观察到了弥散状的微管蛋白分布,我们在傅氏凤尾蕨(Pterisfauriei)精子发生中也观察到了生毛体周围放射状微光分布现象[5],产生放射状微管的功能尚无探讨,本研究发现此阶段有多数线粒体聚集在生毛体的周围,在植物细胞中线粒体的分布可能受微管的影响,如通过一些被子植物的研究表明线粒体的分布与微管有关或受微管分布的影响[16-18],因此,我们认为蕨类精细胞发生过程中生毛体周围的大量放射状微管与线粒体的聚集有关,而线粒体的聚集应该是为多层结构和环状线粒体的发生做好准备,因为在生毛体发育后期产生的多层结构都会连接一个环状线粒体[2-5,9],而此环状线粒体可能就是由这些分散的线粒体融合形成。
3.2 多层结构的形成和分化
蕨类植物精细胞发生中多层结构是由生毛体内的不定形物质产生,电镜观察表明多层结构是由微管带、片层结构、嗜锇层构成[1, 5,6,9,14],在这些研究中发现微管带一旦产生即与片层带相连接,二者谁先产生尚不清楚,本研究发现生毛体在中心粒扩散阶段,其内的不定形物质首先产生了微管带,其外侧尚无片层带、嗜锇层,可能表明微管带是先产生的,傅氏凤尾蕨(P.fauriei)精子发生研究中也观察到多层结构外侧的不定形物质可产生附属微管带[5],进一步表明不定形物质具有分化出微管带的能力,此后再产生片层带和嗜锇层,共同形成多层结构,但该结论仍有待于大量电镜观察。
3.3 微管蛋白的时空表达和功能
微管蛋白是构成微管的基本成分,电镜观察表明蕨类植物运动细胞器主要由微管构成,如生毛体内的中心粒、微管带、基体和鞭毛等都含有微管结构[1-5,9,19]。Marc和Gunning通过微管抗体免疫荧光标记表明蕨(P.aquilinum)的运动细胞器,包括生毛体、微管带、基体和鞭毛都呈明显的微管蛋白阳性标记,表明这些细胞器含有丰富的微管蛋白[7]。本研究也对水蕨精细胞发生过程中的微管蛋白进行了荧光标记,我们发现水蕨运动细胞器生毛体、微管带、基体和鞭毛都呈微管蛋白特异性标记,且微管蛋白的荧光染色随精子的发育而逐渐增强,这表明水蕨精细胞后期产生的微管蛋白数量越来越多,与电镜观察的结果一致。此外,本研究还发现,除了运动细胞器呈强微管蛋白荧光标记外,精细胞细胞质也呈弱荧光标记,这表明精细胞质中也存在一定数量的微管蛋白,这部分微管蛋白可能是基本的细胞骨架成分,也可能是作为鞭毛发生时所需要的原料。
3.4 中心体蛋白的时空表达和功能
中心体蛋白最初是在绿藻Tetraselmisstriata中发现的一种钙调蛋白,它是鞭毛基的一种成分[20]。大量研究表明中心体蛋白是真核生物微管组织中心(MTOC)中的一种保守成分,在中心体的定向、定位、有丝分裂、纺锤体的分离及微管组织方面都发挥着重要的作用[21-22]。在蕨类植物中,免疫金标记表明中心体蛋白最早定位于生毛体,多层结构、微管带背面的不定形物质区以及基体内部的星状区也含有中心体蛋白成分[8-9]。本研究中,我们也发现生毛体、微管带附近和基体均呈现较强的中心体蛋白免疫荧光标记,但细胞质内完全没有中心体蛋白荧光标记,表明中心体蛋白是参与精细胞运动细胞器发生的特有蛋白。尽管前人对中心体蛋白的分布进行了精细的细胞定位,但中心体蛋白在精细胞发育过程中的时间变化仍然不清,我们经过大量的荧光标记发现中心体蛋白在生毛体和基体发生阶段均呈较强的免疫荧光标记,一旦精细胞发育进入核塑形阶段,也即基体产生鞭毛后,微管带附近的中心体蛋白免疫荧光标记信号明显减弱,这种中心体蛋白荧光标记信号的减弱与鞭毛的形成呈完全的负相关,中心体蛋白的这种时空变化可能表明生毛体和微管带背面不定形物质内的中心体蛋白是微管的组织者,其功能可能是参与中心粒、基体和鞭毛的发生,一旦鞭毛产生后,其作为微管组织者的功能就已经完成,中心体蛋白的含量减少,免疫荧光标记减弱,故在核塑形时期,中心体蛋白的免疫荧光标记大大降低,至游动精子阶段几乎完全不见中心体蛋白的带状荧光标记,然而,中心体蛋白的点状荧光标记仍然可见,可能表明鞭毛基内仍然有中心体蛋白的存在,可能作为结构成分参与鞭毛带运动。
在原生动物毛滴虫(Trichomonasvaginalis)中,中心体蛋白被定位于鞭毛基内,是锚定臂的组成之一[23],在纤毛虫Nassula和Furgasonia中,中心体蛋白定位在胞咽器的上部,很可能参与鞭毛的收缩[24]。在衣藻中,中心体蛋白位于核与基体连接器纤维、相邻基体间连接纤维和基体与其鞭毛间的鞭毛转化区,主要参与核-基体连接器纤维的收缩[25],这些研究表明低等生物中心体蛋白是鞭毛基部的组成成分,参与鞭毛的运动。在高等植物苔藓和蕨类植物中都标记到了中心体蛋白[8],通过在蕨类植物苹(Marsileavestita)中心体蛋白翻译的中断实验,发现中心体蛋白的缺失影响了精细胞中的微管分布,表明其可能控制着细胞骨架和运动细胞器的形成[26],但仍不能确定中心体蛋白是否参与鞭毛的运动。种子植物细胞在整个生活史过程中不产生鞭毛,但其仍具有中心体蛋白基因,其中心体蛋白定位于发育的细胞板以及细胞壁胞间连丝上,其功能可能是作为钙敏感的纳米纤丝参与调控钙诱导的胞间运输[27],烟草的中心体蛋白主要参与细胞板的形成,也参与Ca2+调节的胞内运输[28]。本研究中,通过微管蛋白和中心体蛋白的同时标记和时空表达观察,发现它们都在生毛体和微管带附近显著标记,分布的位置相似,但微管蛋白表达越来越强,而中心体蛋白的表达在核塑形后越来越弱,由此可以推出中心体蛋白是微管组织中心的主要成分,负责或参与中心粒、基体和鞭毛的形成,当精子成熟后鞭毛基仍含有少量中心体蛋白,这部分中心体蛋白应该是基体和鞭毛基的组成成分,可能与鞭毛的运动有关。
[1] BELL P R, DUCKETT J G. Gametogenesis and fertilization inPteridium[J].BotanicalJournaloftheLinneanSociety, 1976, 73: 47-78.
[2] MYLES DG, HEPLER PR. Spermatogenesis in the fernMarsilea: Microtubules, Nuclear shaping, and Cytomorphogenesis[J].JournalofCellScience, 1977, 23:57-86.
[3] KOTENKO J L. Spermatogenesis in a homosporous fern,Onocleasensibilis[J].AmericanJournalofBotany, 1990, 77:809-825.
[4] VAUGHN K C, BOWLING A J. Recovery of microtubules on the blepharoplast ofCeratopterisspermatogenous cells after oryzalin treatment[J].Protoplasma, 2008, 233:231-240.
[5] 曹建国,代小菲, 王全喜. 傅氏凤尾蕨精子发生超微结构的研究[J]. 云南植物研究,2010,32(4):303-314.
CAO J G, DAI X F, WANG Q X. An ultrastructural study of the spermatogenesis of the fernPterisfauriei[J].ActaBotanicaYunnanica, 2010, 32(4):303-314.
[6] DOONAN J H, LLOYD C, DUCKETT J G. Anti-tubulin antibodies locate the blapharoplast during spermatogenesis in the fernPlatyzomamicrophyllumR.BR: a correlated immunofluorescence and electron-microscopic study[J].JournalofCellScience, 1986, 81: 243-265.
[7] MARCH J, GUNNING B E S. Immunofluorescent localization of cytoskeletal tubulin and actin during spermatogenesis inPteridiumaquilinum(L.) Kuhn[J].Protoplasma, 1986, 134:163-177.
[8] VAUGHN K C, SHERMAN T D, RENZAGLIA K S. A centrin homologue is a component of the multilayered structure in bryophytes and pteridophytes[J].Protoplasma, 1993, 175:58-66.
[9] HOFFMAN J C, VAUGHN K C, JOSHI H C. Structural and immunocytochemical characterization of microtubule organizing centers in pteridophyte spermatogenous cells[J].Protoplasma, 1994, 179: 46-60.
[10] HART P E, WOLNIAK S M. Spermiogenesis inMarsileavestita: a temporal correlation between centrin expression and blepharoplasty differentiation[J].CellMotilityandtheCytoskeleton, 1998, 41: 39-48.
[11] KLINK V P, WOLNIAK S M. Centrin is necessary for the formation of the motile apparatus in spermatids ofMarsilea[J].MolecularBiologyoftheCell, 2001, 12:761-776.
[12] 黄武杰. 水蕨雌、雄配子体差异表达蛋白组学的分析[D]. 上海:上海师范大学, 2011.
[13] 陈雪菲,王 尧,秦召远,等.水蕨(Ceratopteristhalictroides)centrin基因的克隆与原核表达[J]. 西北植物学报,2016. 36(3):444-448.
CHEN X F, WANG Y, QIN Z Y,etal. Cloning and prokaryotic expression of centrin gene from the fernCeratopteristhalictroides[J].ActaBot.Boreal.Occident-sin., 2016, 36(3):444-448.
[14] HEPLER P K. The blepharoplast ofMarsilea: its de novo formation and spindle association[J].JournalofCellScience, 1976, 21:361-390.
[15] VAUDOIS B, TOURTE Y. Spermatogenesis in a pteridophyte 1 first stages of the motile apparatus[J].Cytobios, 1979, 24:143-156.
[16] MICHAEL H H, SIMON M, SINGER S J. Association of mitochondria with microtubules in cultured cells[J].ProceedingsoftheNationalAcademyofSciences, 1978, 75(8): 3 863-3 866.
[17] BALL E H, SINGER S J. Mitochondria are associated with microtubules and not with intermediate filaments in cultured fibroblasts[J].ProceedingsoftheNationalAcademyofSciences, 1982, 79(1): 123-126.
[18] BAUMANN O,MURPHY D B. Microtubule-associated movement of mitochondria and small particles inAcanthamoebacastellanii[J].CellMotilityandtheCytoskeleton, 1995, 32(4):305-317.
[19] RENZAGLIA K S, MADEN A R. Microtubule organizing centers and the origin of centrioles during spermatogenesis in the pteridophytePhylloglossum[J].MicroscopyResearchandTechnique, 2000, 49:496-505.
[20] SALISBURY J, BARON A, SUREK B,etal. Striated fligellar roots: isolation and partial characterization of a calcium-modulated contractile organelle[J].TheJournalofCellBiology, 1984, 99(3): 962-970.
[21] SALISBURY J L. Centrin, centrosomes and mitotic spindle poles[J].CurrentOpinioninCellBiology, 1995, 7: 39- 45.
[22] HU H, SHEE J H, CHAZIN W J. The mode of action of centrin: binding of Ca2+and a piptide fragment of Kar1p to the C-terminal domain[J].TheJournalofBiologicalChemistry, 2004, 279(49): 50 895-50 903.
[23] BRUGEROLLE G, BRICHEUX G, COFFE G. Centrin protein and genes in trichomonas vaginalis and glose relatives[J].JournalofEukaryoticMicrobiology, 2000, 47(2): 129-138.
[24] VIGUES B, BLANCHARD M P, BOUCHARD P. Centrin-like filaments in the cytopharyngeal apparatus of the ciliatesNassulaandFurgasonia: evidence for a relationship with microtubular structures[J].CellMotilityandCytoskeleton, 1999, 43(1): 72-81.
[25] SANDERS M, SALISBURY J. Centrin-mediated microtubule severing during flagellar excision inChlamydomonasreinhardtii[J].TheJournalofCellBiology, 1989, 108: 1 751- 1 760.
[26] KLINK V P, WOLNIAK S M. The efficacy of RNAi in the study of the plant cytoskeleton[J].JournalofPlantGrowthRegulation, 2000, 19:371-384.
[27] BLACKMAN L M, HARPER J D, OVERALL R L. Localization of a centrin-like protein to higher plant plasmodesmata[J].TheJournalofCellBiology, 1999, 78: 297-304.
[28] STOPPIN-MELLET V, CANADAY J, LAMBERT A M. Characterization of microsome-associated tobacco BY-2 centrins[J].EuropeanJournalofCellBiology, 1999, 78(11):842-848.

图版Ⅰ 精原细胞和精细胞超微结构及中心体蛋白和微管蛋白免疫荧光标记1. 精原细胞;2. 中心体蛋白免疫标记;3. 微管蛋白免疫标记;4、5.精细胞早期,箭所指为一团致密物质;6. 早期生毛体(箭);7. 生毛体放大,其周围有放射状微管(箭);8. 中心体蛋白免疫标记,荧光标记亮点为生毛体(箭);9. 微管蛋白免疫标记,荧光标记亮点为生毛体(箭)PlateⅠ Ultrastructure and immunofluorescence labeling of anti-centrin and anti-tubulin antibodies of spermatogenous cell and spermatidFig. 1. A spermatogenous cell; Fig. 2. Immunofluorescence labeling of centrin;Fig. 3. Immunofluorescence labeling of tubulin;Fig. 4,5. Early stage of spermatid,arrow indicated the spherical granular bodies, which may be the nascent blepharoplasty;Fig. 6. Early blepharoplast(arrow) is seen in the spermatid;Fig. 7. Magnification of the blepharoplast,radial arranged microtubules (arrow) are seen around the blepharoplast;Fig. 8. The brighter spot of the immunofluorescence labeling of centrin is blepharoplast (arrow);Fig. 9. The brighter spot of the immunofluorescence labeling of tubulin is blepharoplast (arrow)

图版 Ⅱ 生毛体发生超微结构及中心体蛋白和微管蛋白的免疫荧光标记1. 生毛体(B),分化出中心粒;2. 生毛体(B)产生微管带(MTR);3、4. 微管带(MTR)与片层带(LL)相连形成多层结构(MLS),并与环状线粒体(CM)相连;5. 进一步分化的生毛体(B);6. 生毛体放大;7. 生毛体,中心粒进一步扩散;8. 中心体蛋白免疫标记,荧光标记亮点为扩大的生毛体(箭);9. 微管蛋白免疫标记,荧光标记亮点为扩大的生毛体(箭)Plate Ⅱ Ultrastructure of blepharoplast and immunofluorescence labeling of centrin and tubulinFig. 1. Blepharoplast (B), the centriole are formed; Fig. 2. Blepharoplast (B), the microtubular ribbon (MTR) is formed; Fig. 3,4. Blepharoplast (B). The MTR is associated with the lamellar strip (LS) and forms the multilayered structure (MLS) , which is connected with the coiled mitochondrion (CM);Fig. 5. The further developed blepharoplast (B); Fig. 6. The magnification of blepharoplasty; Fig. 7. The blepharoplast, showing the further dispersed centrioles;Fig. 8. The immunofluorescence labeling of centrin, the brighter spot is the expanded blepharoplast (arrow);Fig. 9. The immunofluorescence labeling of tubulin, the brighter spot is the expanded blepharoplast (arrow)
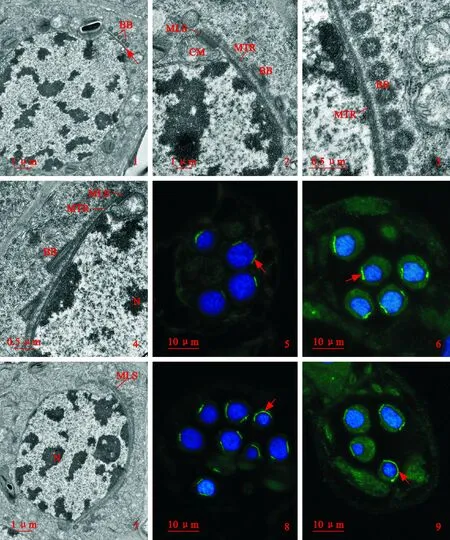
图版 Ⅲ 基体形成阶段超微结构及中心体蛋白和微管蛋白的免疫荧光标记1. 微管带(箭)扩展到核表面,分化出基体(BB);2. 放大示多层结构(MLS)和微管带(MTR);3. 基体(BB)横切;4. 基体(BB)纵切;5. 亮短线为 中心体蛋白荧光免疫标记(箭);6. 亮短线为微管蛋白荧光免疫标记(箭);7. 细胞核(N)表面的微管带进一步扩展;8. 亮线为中心体蛋白荧光免疫标记(箭);9. 亮线为微管蛋白荧光免疫标记(箭)。Plate Ⅲ Basal body formation stage, ultrastructure and immunofluorescence labeling of centrin and tubulinFig. 1. The microtubular ribbon (arrow) expands to the nuclear surface. Basal bodies (BB) are formed; Fig. 2. Magnification showing the multilayered structure (MLS) and the microtubular ribbon (MTR);Fig. 3. Transverse section of the basal bodies (BB). Fig. 4. Longitudinal section of basal bodies (BB);Fig. 5. The brighter short line (arrow) is the immunofluorescence labeling of centrin;Fig. 6. The brighter short line (arrow) is the immunofluorescence labeling of tubulin;Fig. 7. The microtubular ribbon (arrow) expands further along the nuclear(N) surface;Fig. 8 Immunofluorescence labeling of centrin (arrow);Fig. 9. Immunofluorescence labeling of tubulin (arrow)

图版 Ⅳ 核塑形和游动精子阶段超微结构及中心体蛋白和微管蛋白的免疫荧光标记1.核塑形早期,细胞核(N)呈扇形,分化出鞭毛(F);2. 中心体蛋白免疫荧光标记减弱(箭);3. 微管蛋白免疫荧光标记,鞭毛带呈明亮荧光标记(箭);4. 核塑形中期,鞭毛数量增加;5. 中心体蛋白免疫标记信号进一步减弱(箭);6. 微管蛋白免疫标记,鞭毛带、鞭毛呈明亮荧光标记(箭);7. 游动精子阶段,外有大量鞭毛;8. 中心体蛋白免疫标记,只有少量标记信号(箭);9. 微管蛋白免疫标记,鞭毛带、鞭毛呈明亮荧光标记(箭)Plate Ⅳ Nuclear shaping and spermatozoid stage, ultrastructure and immunofluorescence labeling of centrin and tubulinFig. 1. Early stage of nuclear shaping, the nucleus (N) shows fan-shaped. flagella (F) are formed; Fig. 2. The immunofluorescence labeling of centrin decrease (arrow); Fig. 3. The immunofluorescence labeling of tubulin, the flagellar band show brighter labeling (arrow); Fig. 4. Middle stage of nuclear shaping,the flagella number increase;Fig. 5. The immunofluorescence labeling of centrin decrease further; Fig. 6. The immunofluorescence labeling of tubulin, the flagella and flagellar band show brighter labeling; Fig. 7. Spermatozoid stage,numerous flagella are formed;Fig. 8. Almost no the immunofluorescence labeling of centrin are seen, but some labeling spots (arrows); Fig. 9. The immunofluorescence labeling of tubulin, the flagella and flagellar band show brighter labeling (arrow)
(编辑:潘新社)
Immunofluorescence Localization of Centrin and Tubulin during Spermatogenesis ofCeratopteristhalictroides
CAO Jianguo1, WANG Yao1, CHEN Xuefei1, DAI Xiling1,WANG Quanxi1,2
(1 College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234; 2 Shanghai Key Laboratory of Plant Functional Genomics and Resource,Shanghai Chenshan Botanical Garden, Shanghai 201602, China)
The ultrastructure and the dynamic expression of the centrin and tubulin during spermatogenesis of the fernCeratopteristhalictroideswere observed using the TEM technology and immunofluorescence technology. The present investigation shows that: (1) there are abundant radial microtubules around the early blepharoplast. The function of the radial microtubules may be used to converge mitochondria to the blepharoplast. (2) Immunofluorescence observations show that centrin is only located in the blepharoplast, basal bodies and flagellar band. The fluorescence labeling of centrin becomes brighter from the blepharoplast stage to the basal body stage. Then the fluorescence labeling of centrin becomes weak gradually with the formation of flagella and almost disappears at the spermatozoid stage. (3) The early fluorescence labeling of tubulin, showing the same form as the centrin labelling, is located in the blepharoplast, basal bodies, flagellar band. Then the fluorescence labeling of tubulin becomes more and more stronger as the flagella form in the spermatids. Based on the expression features of centrin and tubulin, it can be inferred that centrin is one of the organizer of the motile apparatuses, but not to be the components of the motile apparatuses. The main function of centrin may take part in formation of the centrioles, basal bodies and flagella of the spermatids.
Ceratopteristhalictroides; cetrin; tubulin; fluorescence labeling
1000-4025(2016)08-1575-10
10.7606/j.issn.1000-4025.2016.08.1575
2016-05-03;修改稿收到日期:2016-06-17
上海市自然科学基金(13ZR1429700);上海市科学技术委员会课题(14DZ2260400)资助
曹建国(1968-),男,教授,主要从事蕨类植物生殖发育和蕨类植物资源开发与利用的研究。E-mail:cao101@shnu.edu.cn
Q248;Q944.62
A
——水芹主要害虫识别与为害症状

