链霉亲和素化载紫杉醇相变型PLGA纳米粒的制备及体外超声显影
周 航,黄晓玲*,过 源,尚婷婷,王志刚
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所,重庆 400016)
·基础与实验研究·
链霉亲和素化载紫杉醇相变型PLGA纳米粒的制备及体外超声显影
周 航1,黄晓玲1*,过 源2,尚婷婷2,王志刚2
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所,重庆 400016)
目的 制备链霉亲和素化载紫杉醇相变型PLGA纳米粒(PTX-PLGA-SA/PFPs),并观察其体外低强度聚焦超声(LIFU)致相变后超声增强显影特性。方法 采用单乳化法(O/W)制备载紫杉醇相变型PLGA纳米粒,高效液相色谱法检测紫杉醇包封率;碳二亚胺法连接链霉亲和素(SA),共聚焦激光显微镜观察二者连接情况,流式细胞术检测二者链接率;体外LIFU致相变观察超声增强显影情况。结果 制备的纳米粒粒径为(322.2±85.6)nm,表面电位(-5.66±3.46)mV。紫杉醇的包封率及载药量分别为(71.56±6.51)%、(6.57±0.61)%,与链霉亲和素的连接率为(97.16±1.20)%。LIFU功率7.5 W作用3 min时可明显增强该纳米粒在体外的B-mode及造影模式下的超声显影。结论 成功制备了PTX-PLGA-SA/PFPs纳米粒,其紫杉醇包封率高、链霉亲和素连接率高,体外声致相变后可显著增强超声显影。
超声检查;造影剂;紫杉醇;液气相变;链霉亲和素
随着超声分子影像学的发展,可通过肿瘤新生血管内皮间隙(380~780 nm[1])的液态氟碳纳米级靶向超声造影剂成为近年研究的热点。已有研究[2]证实,超声波的空化效应、机械效应和热效应可致液态氟碳纳米粒发生相变而转变为具有超声显影功能的微泡。聚乳酸-乙醇酸[poly(lactic acid-co-glycolic) acid, PLGA]因具有高效的生物降解性及良好的生物相容性,被诸多学者用于各种纳米粒的制备、超声显影及肿瘤治疗等研究[3-4],包括携载不同化疗药物的纳米粒的研究[5-6]。然而如何提高纳米粒对肿瘤组织的靶向性,以提高对肿瘤的显像及治疗效果,一直是研究的难题。本研究拟制备链霉亲和素化的载紫杉醇相变型PLGA纳米粒,同时对其体外低强度聚焦超声(low intensity focused ultrasound, LIFU)致相变后超声增强显影特性进行研究,以期可用于联合二步法预定位技术提高该纳米粒的肿瘤靶向性。
1 材料与方法
1.1材料与仪器
1.1.1 实验材料 聚乳酸-乙醇酸(PLGA-COOH 聚合比50∶50;济南岱罡);紫杉醇原料药(paclitaxel, PTX;西安昊轩);聚乙烯醇(PVA;Sigma);EDC和NHS(Sigma);链霉亲和素(streptavidin, SA)及PE标记链霉亲和素(PE-SA;北京博奥森);全氟戊烷(perfluoropentane, PFP; Strem Chemicals)。荧光染料DiI,MES缓冲液。
1.1.2 实验仪器 声振仪(Sonics & Materials);磁力搅拌器;激光粒径测量仪(Zetasizer Nano ZS90,Malvern);S-3400N电子显微镜(Hitachi);FACSVantage SE流式细胞仪(BD公司)。LIFU治疗仪(重庆医科大学超声分子影像学研究所研制);百盛超声诊断仪(ESAOTE);TCSSP2激光共聚焦显微镜(Lecia公司);高效液相色谱分析仪(Waters e2695)。
1.2包裹PFP载紫杉醇PLGA纳米粒的制备 采用单乳化法(O/W)制备载紫杉醇相变型PLGA纳米粒(PTX-PLGA/PFPs)。精确称取50 mg PLGA及 5 mg PTX 溶解于2 ml二氯甲烷中,待充分溶解后,置于冰浴中,加入适量PFP及5% PVA水溶液,声振,磁力搅拌器搅拌挥发二氯甲烷2~3 h,双蒸水多次离心洗涤后,制得PTX-PLGA/PFPs纳米粒,4℃冰箱保存。
1.3一般特征评价及紫杉醇包封率测定 采用马尔文激光粒径测量仪检测PTX-PLGA/PFPs纳米粒粒径及表面电位,电镜观察其形态特征。应用高效液相色谱法(high-performance liquid chromatography, HPLC)检测该纳米粒中PTX的包封率及载药量。液相条件:流动相为乙腈∶水=45∶55,检测波长为227 nm,检测器为UV2489 C18 Xbridge(150×4.6 mm,3.5 μm)。将PTX溶于甲醇中配制成标准溶液,浓度分别为:12.5、25、50、75、100 μg/ml,采用HPLC进行检测并绘制标准曲线。样品处理:取新鲜制备的适量已知浓度PTX-PLGA/PFPs纳米粒悬液,离心洗涤后,所得沉淀用二氯甲烷溶解破乳,采用HPLC检测PTX含量。PTX包封率(%)=检测量/总投放量×100%;载药量(%)=检测量/纳米粒总质量×100%。
1.4链酶亲和素化纳米粒(PTX-PLGA-SA/PFPs)的制备 将制备的PTX-PLGA/PFPs纳米粒用MES缓冲液 (0.1 mol/L,pH 5.5)重悬,加入适量EDC及NHS,摇床孵育45 min,双蒸水离心、洗涤2~3次去除未反应的EDC和NHS,后用MES缓冲液(0.1 mol/L,pH 8.0)重悬为适宜浓度,加入适量PE-SA,4℃摇床孵育2 h,双蒸水多次离心洗涤后制得PTX-PLGA-SA/PFPs纳米粒。采用共聚焦激光显微镜观察二者连接情况,流式细胞术检测其连接率。
1.5 LIFU致相变体外超声显影 将一定浓度的PTX-PLGA-SA/PFPs纳米粒,置于凝胶模型孔洞中,分别用不同功率LIFU(3.3、4.4、5.5、6.5、7.5、 8.5 W)作用3 min后,采用超声诊断仪进行B-mode及造影模式观察,通过DFY图像分析系统对相变前后的超声图像的平均回声强度进行对比分析。

2 结果
2.1PTX-PLGA /PFPs纳米粒的基本特性 制备的PTX-PLGA /PFPs纳米粒在光镜、扫描电镜及投射电镜下观察:大小均匀,呈球形(图1)。马尔文粒径分析仪测得纳米粒粒径为(308.1±85.6)nm,多分散系数(polydispersity index, PDI) 0.138;表面电位为-5.66±3.46 mV。PTX标准曲线方程为:Y=1.356 759×105+6.969 440×104X,r2=0.999 961,包封率及载药量分别为(71.56±6.51)%、(6.57±0.61)%。

图2 共聚焦激光显微镜(×400)观察PE-SA与PTX-PLGA/PFPs纳米粒的连接情况 A.白光图像; B.红光图像; C.两者融合图
2.2链霉亲和素与PTX-PLGA/PFPs纳米粒连接情况 激光共聚焦显微镜下观察到PTX-PLGA/PFPs纳米粒表面呈橙红色,说明SA已成功连接于PTX-PLGA/PFPs纳米粒表面(图2)。流式细胞术测得两者的连接率为(97.16±1.20)%(图3)。
2.3体外LIFU致相变超声显影情况 体外声功率3.3、4.4、5.5、6.5、7.5、8.5 W的LIFU作用3 min后,各组B-mode下的超声强度均明显提高,在6.5 W及7.5 W时超声强度最高 (P<0.05),该两组间差异无统计学意义(P>0.05);造影模式下,回声强度随声功率增加而增加,在7.5 W时达到最高,与其余各组间两两比较,差异均有统计学意义(P均<0.01),当达到8.5 W时出现下降。见图4、5。

图3 流式细胞术检测SA与PTX-PLGA/PFPs纳米粒连接率
3 讨论
PLGA具有可控性、低不良反应、高效的生物降解性及良好的生物相容性,被美国FDA批准用于药物递送载体[7],已被诸多学者[3-6]用于各种纳米粒的制备、超声显影及肿瘤治疗等研究。紫杉醇是一种非水溶性广谱化疗药物,需要无水乙醇等有机溶剂溶解,可引起过敏反应。目前常用的直接靶向法多通过受体-配体直接靶向肿瘤组织[8],然而有研究[9]显示,用于配体的抗体分子与造影剂表面连接的部位是随机的,既可以是Fc段,也可以是Fab段,致靶向性较低。生物素-亲和素预定位技术,源于肿瘤放射免疫显像与治疗,二步法预定位技术为先将寻靶分子注射入体内,待其在肿瘤部位达到峰值时,再注射效应分子。研究[10-11]表明,采用预定位技术的肿瘤靶/非靶比值(T/NT值)明显高于直接靶向法,该技术已在影像学其他领域如MRI分子成像中得到应用,但鲜有将其运用于超声分子靶向研究。作为亲和素的衍生物,SA不仅具有亲和素的各种特点,同时等电点更低,且不含糖基,非特异性结合也远低于亲和素[12]。本研究制备了链霉亲和素化的载紫杉醇相变型PLGA纳米粒,旨在通过二步法预定位技术,在无有机溶剂情况下提高非水溶性抗肿瘤药物的定向传送。在PTX-PLGA/PFPs纳米粒的制备中,本研究采用了单乳化法(O/W),结果表明采用该种方法制备的纳米粒紫杉醇包封率高,与相关研究[13]报道一致;SA与PTX-PLGA/PFPs纳米粒的连接采用了碳二亚胺法,通过共价结合,使二者连接更加紧密。该方法操作简单,连接效率高,被诸多学者[14-15]用于纳米粒与配体的稳定连接。
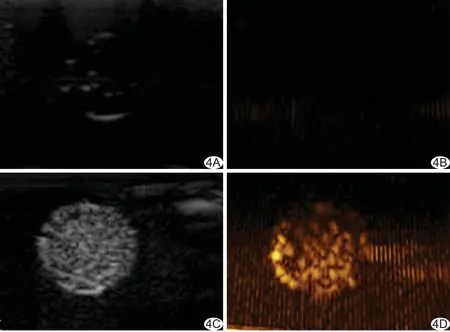
图4 LIFU作用前后,PTX-PLGA-SA/PFPs纳米粒超声显影情况 A、B.LIFU作用前B-mode及造影模式图像; C、D.LIFU作用后B-mode及造影模式图像
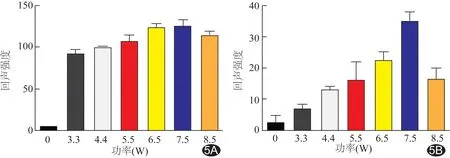
图5 不同功率LIFU致PTX-PLGA-SA/PFPs纳米粒相变后的回声强度 A.B-mode; B.造影模式
由于纳米粒粒径通常小于超声波长,超声波在接触纳米粒界面时发生衍射或绕射,导致无明显回声,进而无超声显影,因此需要通过一定手段致使其相变为具有大界面的强反射微泡,而超声波的空化效应、机械效应和热效应能使液态氟碳纳米粒更容易发生相变。为了降低LIFU致纳米粒相变的难度,本研究选择了沸点为29℃的PFP作为相变材料,研究[16]发现,纳米粒发生相变的温度明显高于所包裹PFP的沸点,可能是由于固体壳层对内核气化扩散的阻碍,及纳米粒内部拉普拉斯力的影响,另一方面也有利于其在体内的稳定性。本研究中,造影模式的回声强度在LIFU功率7.5 W时达到最高,而8.5 W时出现下降,推测可能原因为纳米粒相变时间和程度不一致,部分纳米粒先相变为微泡后,在LIFU持续作用下发生了破裂。
本研究的不足:未测定PFP的包封率,也未对纳米粒的释药特性进行研究,另外未检测纳米粒的稳定性,我们将在未来的实验中进一步完善,并将其运用于对肿瘤组织的靶向研究中。
综上所述,本研究成功制备了载紫杉醇相变型链霉亲和素化PLGA纳米粒(PTX-PLGA-SA/PFPs),其可发生LIFU及热致相变,明显增强B-mode及造影模式下超声显影。该纳米粒中紫杉醇的包封率高,有望成为肿瘤超声分子靶向显影与治疗的可行工具之一。为下一步联合二步法生物素-亲和素预定位技术靶向肿瘤组织进行显像与精准治疗提供了前期研究基础。
[1] Hobbs SK, Monsky WL, Yuan F, et al. Regulation of transport pathways in tumor vessels: Role of tumor type and microenvironment. Proc Natl Acad Sci USA, 1998,95(8):4607-4612.
[2] Sheeran PS, Daghighi Y, Yoo K, et al. Image-guided ultrasound characterization of volatile sub-micron phase-shift droplets in the 20-40 MHz frequency range. Ultrasound Med Biol, 2016,42(3):795-807.
[3] 何坤燕,冉海涛,李茂萍,等.包裹液态氟碳高分子纳米球相变及体外超声显影.中国介入影像与治疗学,2013,10(11):679-683.
[4] Niu C, Wang Z, Lu G, et al. Doxorubicin loaded superparamagnetic PLGA-iron oxide multifunctional microbubbles for dual-mode US/MR imaging and therapy of metastasis in lymph nodes. Biomaterials, 2013,34(9):2307-2317.
[5] Esfandyari-Manesh M, Mostafavi SH, Majidi RF, et al. Improved anticancer delivery of paclitaxel by albumin surface modification of PLGA nanoparticles. Daru, 2015,23(1):28.
[6] Deng L, Li L, Yang H, et al. Development and optimization of doxorubicin loaded poly (lactic-co-glycolic acid) nanobubbles for drug delivery into HeLa cells. J Nanosci Nanotechnol, 2014,14(4):2947-2954.
[7] Anderson JM, Shive MS. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv Drug Deliv Rev, 2012,64(S):72-82.
[8] Shi YL, Zhou MY, Zhang J, et al. Preparation and cellular targeting study of VEGF-conjugated PLGA nanoparticles. J Microencapsul, 2015,32(7):699-704.
[9] Kocbek P, Obermajer N, Cegnar M, et al. Targeting cancer cells using PLGA nanoparticles surface modified with monoclonal antibody. J Control Release, 2007,120(1-2):18-26.
[10] 许乙凯,刘岘,叶靖.二步法预定位技术对荷人肝癌裸鼠模型的MR免疫成像研究.中华放射学杂志,2005,39(4):357-361.
[11] Qiu LH, Zhang JW, Li SP, et al. Molecular imaging of angiogenesis to delineate the tumor margins in glioma rat model with Endoglin-Targeted paramagnetic liposomes using 3T MRI.J Magn Reson Imaging, 2015,41(4):1056-1064.
[12] Nguyen TT, Sly KL, Conboy JC. Comparison of the energetics of avidin, streptavidin, neutrAvidin, and anti-biotin antibody binding to biotinylated lipid bilayer examined by second-harmonic generation. Anal Chem, 2012,84(1):201-208.
[13] Sadat Tabatabaei Mirakabad F, Nejati-Koshki K, Akbarzadeh A, et al. PLGA-Based nanoparticles as cancer drug delivery systems. Asian Pac J Cancer Prev, 2014,15(2):517-535.
[14] 骆杰,王志刚,钟世根,等.携紫杉醇和Herceptin高分子超声造影剂体外寻靶及体内肿瘤药物含量分析.中国介入影像与治疗学,2016,13(2):102-106.
[15] 肖洋,冉海涛,夏琼,等.靶向VEGFR2光声/超声双模态造影剂的制备及体外寻靶实验研究.中国介入影像与治疗学,2015,12(9):554-558.
[16] Mountford PA, Thomas AN, Borden MA. Thermal activation of superheated Lipid-Coated perfluorocarbon drops. Langmuir, 2015,31(16):4627-4634.
Preparation of streptavidin-coated and paclitaxel-loaded phase-shifting PLGA nanoparticles and ultrasound imaging in vitro
ZHOUHang1,HUANGXiaoling1*,GUOyuan2,SHANGTingting2,WANGZhigang2
(1.DepartmentofUltrasound,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 2.InstituteofUltrasoundImaging,ChongqingMedicalUniversity,Chongqing400016,China)
Objective To prepare a paclitaxel-loaded and streptavidin-coated phase-shifting PLGA nanoparticle as an agents for tumor ultrasound molecular imaging and treatment, and to explore the condition of low intensity focused ultrasound (LIFU) inducing phase transition of the nanoparticles to enhance the ultrasound imaging. Methods The single emulsion method (O/W) was used to prepare the paclitaxel-loaded nanoparticles (NBs). The NBs size and zeta potential were detected by Melvin size analyzer. The streptavidin (SA) was covalently linked on the NBs through carbodiimide method, and the connection rate was detected by flow cytometry (FCM). The encapsulation efficiency of paclitaxel capsuled in NBs was determined by high-performance liquid chromatography (HPLC). Different intensities of LIFU were applied to optimize the condition of phase transition of NBs. Results The size of NBs was (322.2±85.6)nm, and zeta potential was (-5.66±3.46)mV. The SA was successfully conjugated to the NBs, and the connection rate was (97.16±1.20)%. The encapsulation efficiency and drug loading efficiency of paclitaxel were (71.56±6.51)% and (6.57±0.61)%, respectively. When the the LIFU powers was 7.5 W working for 3 min, the NBs occurring phase transition could significantly enhance the ultrasound imaging in both B-mode and contrast enhance mode. Conclusion The paclitaxel-loaded and streptavidin-coated phase-shifting PLGA nanoparticle is successfully prepared. With high encapsulation efficiency of paclitaxel and high connection rate of SA, the NBs can be used to significantly enhance ultrasound imaging in vitro after phase transition triggered by LIFU.
Ultrasonography; Contrast media; Paclitaxel; Phase-shift; Streptavidin
国家临床重点专科建设项目(国卫医办函 [2013] 544号)。
周航(1988—),男,四川雅安人,在读硕士。研究方向:超声造影。E-mail: zhouh528@163.com
黄晓玲,重庆医科大学附属第一医院超声科,400016。E-mail: huangxiaoling_4@163.com
2016-06-01
2016-07-16
R445.1
A
1672-8475(2016)09-0571-05
10.13929/j.1672-8475.2016.09.012

