植物miRNA的生物学特性及在环境胁迫中的作用
曾幼玲,杨瑞瑞
植物miRNA的生物学特性及在环境胁迫中的作用
曾幼玲,杨瑞瑞
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐830046)
MicroRNA(miRNA)是一类在生物体内普遍存在的非编码、长度约为21 nt的小RNA分子,一般由内源基因编码,RNA聚合酶Ⅱ转录后,经过Dicer-Like酶等一系列的蛋白复合物将pre-miRNA(precursor miRNA)剪切成成熟miRNA,在转录及转录后水平介导靶mRNA转录沉默、降解或翻译抑制来调控基因的表达,是真核细胞基因表达的重要调控因子。第一个miRNA是在秀丽隐杆线虫()中发现的,与mRNA 3′ UTR的碱基序列部分互补,降解,从而抑制的表达。对靶基因的调控与线虫的生长发育密切相关。而第一个发现的植物miRNA是拟南芥miR171,它靶向剪切编码基因Scarecrow-like(SCL)家族的mRNA,调控其基因的表达,进而影响植物的生长发育。植物部分miRNA,如miR156—miR408在各植物物种中相对保守,而miR408以后的miRNA具有物种特异性。植物在生长过程中会遭遇诸多不可预知(如同盐碱、干旱、重金属以及害虫和病原菌的侵扰等)的环境胁迫。固着生长的特性使得植物不能像动物那样通过移动来避免不利环境的影响,因此,需要自身特殊机制来应对这些环境胁迫。植物在长期逆境中已进化出极为精细复杂的生理和分子机制。miRNA与它作用的靶基因是响应环境胁迫的主要调控因子。miRNA参与了植物的生长发育、信号转导、蛋白质降解、营养胁迫、抗病原菌的入侵以及适应高盐和干旱等逆境胁迫过程,对于调节内源抗性基因表达具有一定意义。目前通过高通量测序、实时定量PCR检测和转基因等技术已经发现了很多与环境胁迫相关的miRNA,它们在逆境胁迫下的表达呈现显著差异性;miRNA的过表达植株经逆境胁迫处理可能表现出一定的抗逆或敏感性。同一家族的miRNA不同成员在响应环境胁迫时具有物种特异性。新疆地区是典型的大陆性干旱气候,降水量少,盐碱荒漠化地区多。在这样严酷的环境中顽强生存着许多盐生旱生类植物,这些植物的miRNA如何在逆境中发挥调控作用,依然需要更深入的探索。本文主要综述了现阶段植物miRNA生物合成、与靶基因作用方式、生物功能以及不同环境胁迫下对miRNA和作用的靶基因影响等方面的研究进展,以便更好地利用miRNA依据的生物技术开展研究和应用转化。
植物microRNA;生物合成;作用机制;环境胁迫影响
microRNA(miRNA)连续在2002和2003年被《科学》杂志评为十大科技新闻,目前成为生物研究领域的热点之一。20年来,miRNA的生物合成和功能研究方面已经取得令人瞩目的成就。miRNA是3类具有明显特征的小RNA(microRNA、siRNA、Piwi-interacting RNA)中的一种[1],是一类约21 nt的单链RNA,它对编码蛋白的基因表达起到负调控作用[2]。
1993年,LEE等[3]在秀丽线虫中发现长度为21 nt的第1个miRNA(),它能部分与的mRNA 3′ UTR的碱基互补,起到抑制的表达。是线虫由幼虫第一阶段向第二阶段转化调控通路中的重要基因,而第一个被发现的植物miRNA是拟南芥miR171[4],它靶向编码基因Scarecrow-like(SCL)家族,该基因家族在光信号通路、赤霉素信号传导、分生组织形成、根和腋芽的发育等不同的生物代谢过程中起着重要作用[5]。
植物在生长发育过程中,不可避免地受到多种逆境胁迫影响。为了应对植物固着生长而无法有效逃避胁迫这一缺点,植物进化出成熟且错综复杂的分子调控网络,涉及能量代谢、信号转导、mRNA转录、蛋白质生物合成及降解、细胞膜的物质交换、光合作用等植物生物化学、细胞和生理学进程等,而miRNA介导的转录后调控在这些生物学过程中发挥着重要作用[6-9]。miRNA广泛存在于真核细胞中,是最大的基因家族之一,约占基因组1%。植物中第二丰富的小RNA就是miRNA[10],是通过RNA聚合酶Ⅱ转录生成的小RNA[11]。在不同植物中,miRNA的保守性是不同的,miR156—miR408在各个物种中相对保守且表达量较高,而miR408之后的miRNA的表达量很低,具有物种的特异性,并且它们仅在某些特殊条件下受到诱导[12]。miRNA具有2种主要的生物学作用:第一,响应植物生长发育过程中内源性刺激诱导植物细胞的增殖;第二,响应外界环境胁迫的适应性反应[13]。有研究表明miRNA与它们作用的靶基因是响应各种胁迫的主要调控因子[14]。miRNA几乎调控着植物所有生物学和代谢过程[15],对于调节内源抗性基因的表达具有重要意义[16]。
新疆地区是典型的大陆性干旱气候,降雨量少,盐碱荒漠化地区多。在这样的严酷生境中顽强地生存着许多盐生旱生类植物,miRNA如何调控这些植物的抗盐碱和耐旱性,需要进行更深入的探讨。基于此,本文主要综述了植物miRNA的生物合成、与靶基因的作用方式、miRNA的生物功能以及不同环境胁迫下miRNA和对所调控靶基因的作用和影响,便于更好地利用miRNA依据的生物技术开展深入研究和应用转化。
1 植物miRNA的生物合成及作用机制
1.1 植物miRNA的生物合成
miRNA是一类保守的内源性小RNA,在真核生物基因转录后起重要调控作用[17]。大多数后生动物的miRNA基因存在于内含子或外显子中,而植物miRNA基因是存在于基因间的,并且它们的二级结构和长度在不同植物种类中差异性也比较大[10]。动物的miRNA在基因组上是成簇存在的,并且它们会通过多顺反子的形式进行共转录,相比之下,除大豆外,植物miRNA基因很少串联排列[18-19]。
植物miRNA的生物合成是一个复杂而精细的过程(图1),它最初由RNA聚合酶Ⅱ转录生成大约1 000 bp具有颈环结构的内源性转录物pri-miRNA(primary miRNA)[20-22],pri-miRNA与mRNA相似,具有5′端“帽子”结构,3′端polyA尾巴。植物pri-miRNA能够被DCL(Dicer-Like)酶剪切加工成双链pre- miRNA(precursor miRNA)。Dicer-Like酶具有一个位于氨基端的DExH-box RNA解旋酶结构域,pri-miRNA可以通过具有ATP依赖性的RNase Ⅲ活性的DCL-Like蛋白配合不同的蛋白(HYL1和SE等)进行剪切,在细胞核和细胞质中剪切成不同长度的dsRNA[21]。不同类型的DCL蛋白剪切成dsRNA的长度是不同的,如DCL1可以产生18—21 nt的小RNA,DCL2、DCL3和DCL4可以产生22、24和21 nt的小RNA。miRNA双链从前体中剪切下来后,细胞核中的HEN1蛋白会使miRNA/miRNA*双链两端的3′末端进行甲基化修饰,这种修饰会防止miRNA降解,使miRNA顺利进入RISC(-induced silencing complex,RNA介导的沉默复合物)[23-24]。miRNA/ miRNA*被甲基化后,通过转运蛋白HST将其由细胞核输送到细胞质中,其中,与成熟体miRNA互补的miRNA*链可能会进入降解途径,但是在某些环境条件下,miRNA*也可能不被降解。越来越多的研究表明miRNA*也具有一定功能[25]。而另一条链成熟体miRNA则与AGO(Argonaute,具有PAZ结构域,2个RNase Ⅲ结构域和一个碳端的dsRNA结合结构域[20])蛋白结合形成RNA介导的沉默复合体(RISC)[10],最后,RISC切割靶mRNA分子或是抑制靶mRNA翻译,从而抑制编码基因的表达[10,26]。目前,新的miRNA命名不再以miRNA和miRNA*表示,而是以成熟体在前体上的位置命名为miRNA-3p和miRNA-5p,miRNA-3p接近前体的3′端,而miRNA-5p则接近前体的5′端[27]。
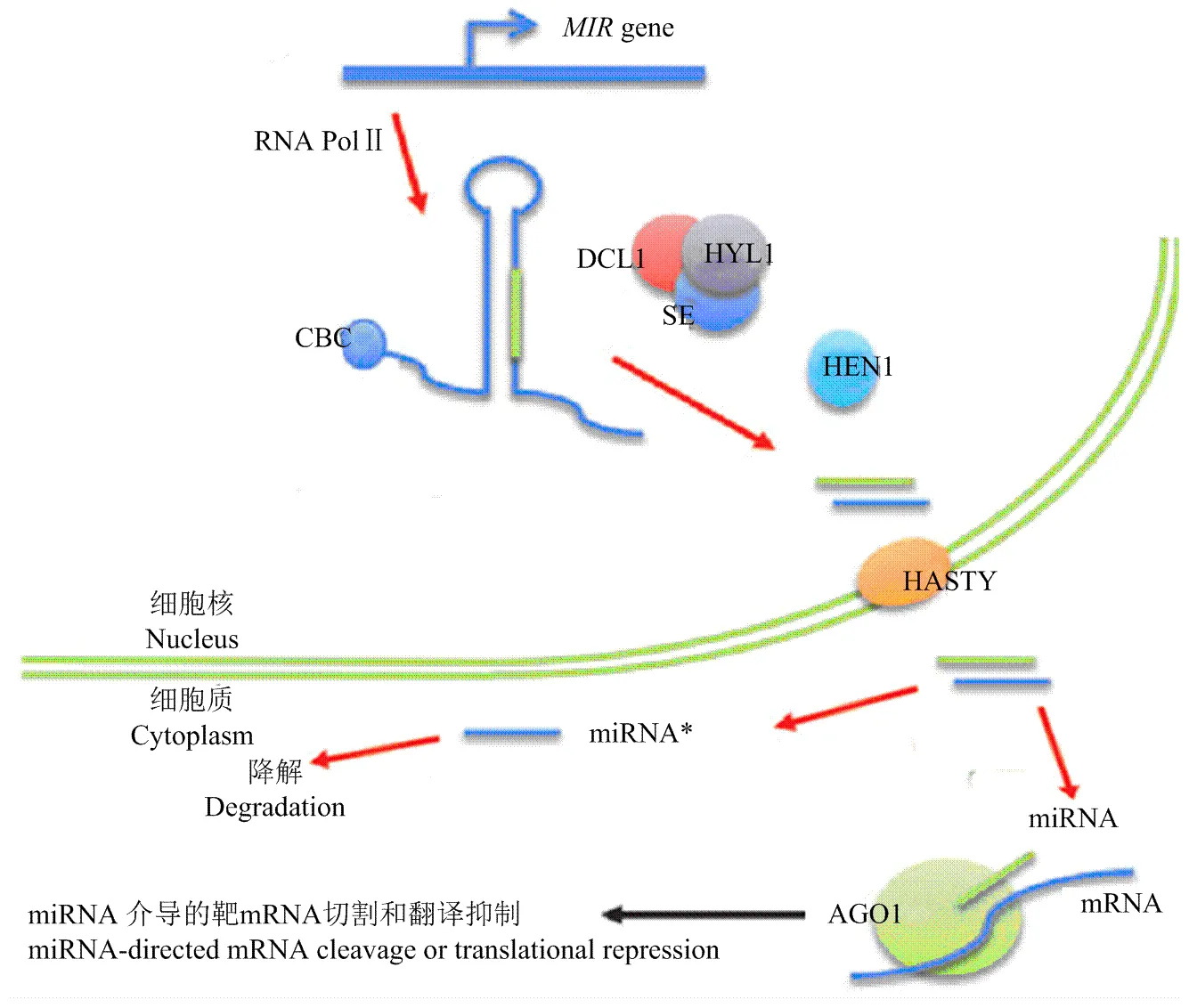
图1 植物miRNA的主要生物合成途径[28]
1.2 植物miRNA的特征和作用机制
miRNA作为一类调控基因表达的小RNA,具有自身独特性。首先表现为miRNA是一类20—24 nt的单链非编码核酸;其次,所有miRNA前体都能够形成可预测的颈环结构,且其颈环结构具有较低的自由能;第三,成熟体miRNA的5′磷酸基团和3′羟基基团使它们很容易从大部分的寡核苷酸中区分出来,并且加工成具有功能的小RNA;第四,很多miRNA都是比较保守的,且具有时间和空间特异性[29]。虽然miRNA具有以上一些共性,但是植物和动物miRNA还是存在一些区别,首先,动物miRNA成熟体主要为22 nt,而植物miRNA成熟体主要为21 nt,这一现象在许多保守miRNA中都可以观察到。例如拟南芥中大约有80%的miRNA成熟体为21 nt[25];其次,动物miRNA在前体和成熟体上都表现保守性,而植物miRNA只有成熟体才表现保守性;第三,植物miRNA前体的颈环结构比动物的更大且可变性也更为多样,其前体序列长度分布范围64—303 bp,这也比动物miRNA前体60—75 bp的序列长度分布范围大[20];第四,植物和动物中miRNA和靶mRNA的结合程度及作用部位是不同的,多数植物miRNA与其作用的靶基因几乎完全互补在靶基因的编码区,而动物miRNA与其靶基因是以不完全配对的方式作用在靶基因的3′ UTR区[29-30]。
miRNA对靶基因的调控方式可以分为3种类型,一是miRNA对靶mRNA的直接剪切(图2-A);二是miRNA结合靶mRNA,抑制编码基因的翻译(图2-B);三是在转录水平的另一种调控方式,即miRNA靶向靶DNA,在转录水平沉默基因的表达(图2-C)。miRNA与靶基因之间这种调控方式的不同,与miRNA和靶基因的互补程度有关。在靶mRNA与miRNA完全互补的情况下,miRNA则介导mRNA特异性切割;如果miRNA与靶基因存在一定的错配碱基,miRNA则抑制靶基因的翻译。大部分植物miRNA对靶基因的调控主要以前者为主[29]。miRNA通过转录后水平调控靶基因的表达[21,31-33],当miRNA在翻译水平上抑制靶mRNA的翻译时,就不能在转录水平上直接检测到靶基因变化,而只能在蛋白水平上被观测。
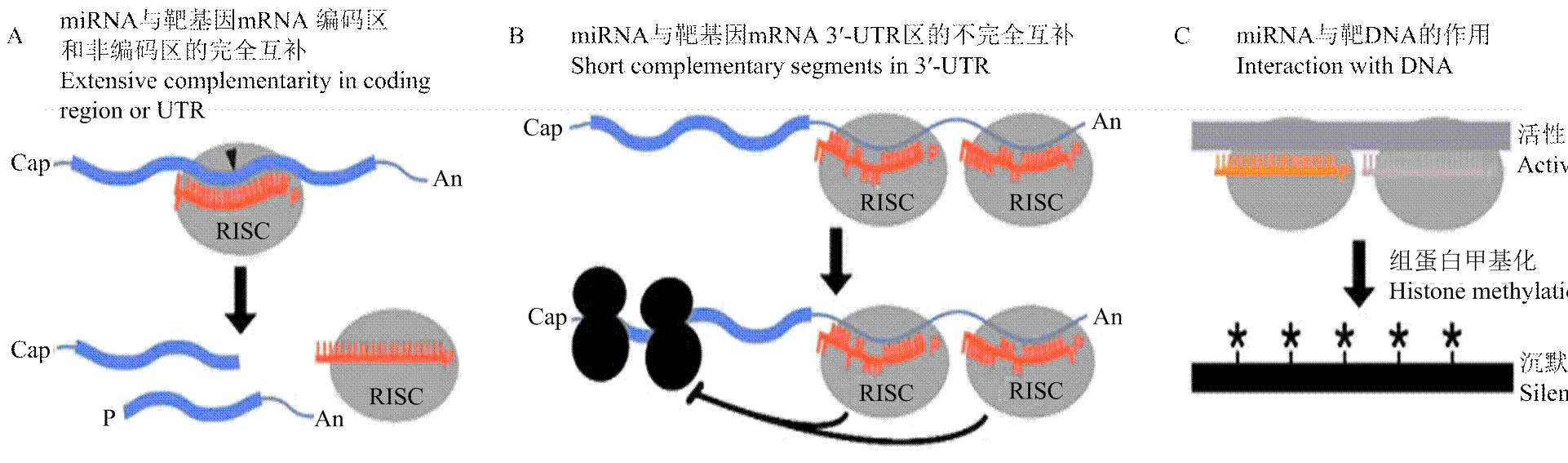
图2 miRNA的作用机制[20]
2 植物miRNA与环境胁迫
2.1 胁迫下部分miRNA与靶基因的作用关系
陆生植物在生长过程中会遭遇诸多不可预知的环境胁迫,如盐碱、干旱、虫害及病害的侵扰。固着生长的特性使植物不能像动物那样通过移动来避免不利环境的影响,需要自身特殊机制来应对这些胁迫,已进化出极为精细复杂的生理和分子调控机制。比如,植物自身会调控某些miRNA的生成与表达,通过miRNA精确靶向mRNA分子在转录和翻译水平调控编码基因的表达,并通过基因之间的相互作用,最终抵抗逆境。图3所示,植物对高盐、干旱、低温和重金属等非生物和生物胁迫的响应过程中涉及很多miRNA,通过与靶基因作用对其胁迫过程中植物的生长发育进行调控,进而应对环境中的各种胁迫。miR398通过靶向调控2种超氧化物歧化酶CSD1与CSD2,参与植物的生物胁迫、重金属、高盐、干旱、紫外辐射等非生物胁迫[34-35];干旱诱导马铃薯([36];在拟南芥中过表达miR156,转基因植株表现出增强的抗盐与抗渗透胁迫的能力[37]。由于大气臭氧层的破坏,UV-B辐射对于植物的伤害越来越严重。在拟南芥()、杨树(小麦(等植物中鉴定了一些UV-B胁迫相关的miRNA。miR156/157、miR159/319、miR160、miR165/ 166、miR167、miR169、miR170/171、miR172、miR393、miR398及miR401在拟南芥和杨树中是上调表达的[38-39],而小麦miR395在UV-B照射下下调表达,它的靶基因APS(ATP sulfurylases)是硫同化途径中第一个关键酶,miR395的表达水平依赖植物体内硫的水平,miR395上调会造成APS的表达下调,表明miR395通过调控APS来调控硫的同化。所以在UV-B的胁迫下,小麦miR395抑制表达会激发硫代谢途径以形成足够的硫代谢物用来保卫植物细胞逃避UV-B胁迫[40]。
2.2 植物miRNA与盐胁迫
大约6%的可耕地受到盐渍化危害[41]。植物体内存在诸多抵制盐胁迫的机制,其中很多miRNA参与盐胁迫。LIU等[42]研究拟南芥经300 mmol·L-1盐胁迫处理下的miR156、miR159、miR394、miR165、miR394、miR393的表达量都有1.5—3倍的增长;SI等[43]通过高通量测序技术鉴定了300 mmol·L-1NaCl处理3 d的杨树幼苗中164个保守的miRNA,属于44个miRNA家族,在叶中有95个保守miRNA具有显著地表达变化(56个上调,39个下调),在根中有84个上调,71个下调的表达变化。peu-miR393、peu-miR645、peu-miR860和peu-miR1444在杨树根中呈现显著下调,但在叶中变化不大,说明miRNA在胁迫中的表达具有组织特异性。水稻miR169家族成员被证明参与盐胁迫,miR169g和miR169n(靶基因具有CCAAT-box的转录因子NF-YA)在盐胁迫下显著诱导;拟南芥miR169家族中一些成员也受盐的诱导,因此,miR169被认为是盐响应的miRNA[42,44]。荧光定量PCR检测NaCl处理的棉花叶和根组织中的miRNA,棉花叶组织中miR156、miR157、miR159、miR172和miR397等在0.25% NaCl低盐胁迫下呈现上调或下调的趋势,而0.5% NaCl高盐胁迫下其全部表现为下调;棉花根组织中miR156、miR157与miR172在低盐胁迫下表现为上调,而高盐胁迫下表现为下调。棉花miR397在低盐浓度处理时,表达水平达到最低,随着盐浓度的升高其表达升高。总体来说,在盐胁迫下,棉花miRNA的表达具有胁迫浓度依赖性[45]。拟南芥miR402受盐诱导,过表达miR402的拟南芥植株在盐胁迫下的种子萌发率及植株生长都要好于非转基因植株[46]。水稻miR396c在水稻和拟南芥中的转基因功能验证的结果表明转基因植株在盐胁迫下的耐受性都降低了,而过表达拟南芥的miR396a/b(根据miRBase显示的结果,水稻miR396c与拟南芥miR396a/b成熟体只差一个碱基)转基因植株的耐盐性提高了,这两种不同的转基因结果暗示同一miRNA家族不同成员可能在不同的植物中对胁迫抗性发挥着不同作用[47]。目前,有超过40个家族的植物miRNA与胁迫有关,其中很多涉及盐和旱胁迫(表1),并且一些miRNA不止在一种植物中报道,表明这些miRNA在这些植物中可能具有保守功能[28,48];但同时也有发现miRNA在不同物种中受到盐胁迫的表达模式存在差异,表明miRNA的表达具有物种特异性(表1)。

表1 不同物种部分miRNA和靶基因及盐胁迫下miRNA的表达情况
2.3 植物miRNA与干旱胁迫
干旱是农业生产中经常发生的主要环境胁迫。植物主要通过调控一系列干旱响应的基因适应干旱环境。迄今为止,已鉴定了大量的干旱响应基因,这些基因的编码产物不仅在保护植物细胞免受干旱影响,而且有的会在信号转导过程中调控其他基因的表达来响应干旱胁迫。然而这些基因如何在转录及翻译水平组合在一起协调发挥功能等具体的调控机制,当前研究的并不完全,植物miRNA的发现对回答这些问题提供了一些线索。众所周知,miRNA介导的植物响应各种胁迫是通过调控它的靶基因(主要是一些转录因子)来实现的,从而成为植物胁迫响应机制中的重要组成部分[58]。土豆[59]、棉花[45]、大麦[60]、芥菜[61]等植物受到干旱胁迫后,其miRNA的表达都会受到影响;高通量测序干旱胁迫下的马铃薯小RNA,获得大量保守和特异的miRNA,差异表达分析的结果显示100个已知miRNA下调表达,99个上调表达;119个物种特异的miRNA诱导表达,151个下调表达。荧光定量PCR试验验证了这些与干旱相关的miRNA与它们的靶基因呈现负相关,与高通量测序的结果一致[59]。此外,通过转基因手段研究miRNA的功能是一个更为直接有效的方法。水稻miR319a转入翦股颖,转基因翦股颖的抗旱性提高。野生型植物缺水处理,叶片与茎秆生物量明显少于转基因植物[58]。有报道植物受到干旱胁迫,会通过提前开花逃避胁迫,但是这种自我保护的逃避方式会造成农业减产。有学者对这一过程中的基因展开研究,发现在拟南芥中miR172e受到光周期因子GI(光周期因子)的调控。长期干旱状态下,GI会促进miR172e的表达量升高,进而抑制它的2个靶基因与(调控开花模式)的表达,而WRKY44蛋白与TOE1蛋白之间会相互作用,miR172e与靶基因以及这2个靶基因编码产物之间的相互调节的关系会影响糖信号通路(sugar signalling),造成植物的提前开花。同样,过表达miR172e的拟南芥植物也会出现与干旱胁迫同样的表型,表明通过一系列miR172e与靶基因以及靶基因与靶基因之间的正负调控,最终导致植物在干旱状态下表现出提前开花的逃避现象(图4)[62]。植物miR169家族有许多成员,Wang等[63]利用基因芯片筛选到的199个陆地棉microRNA中,miRl69可能与干旱应激反应有关。然而这些成员在不同物种的干旱胁迫下的表现是不一样的。拟南芥miR169a和miR169c在干旱胁迫下下调表达,过表达miR169a和miR169c的转基因拟南芥植株较野生型表现出干旱更为敏感的表型;然而,番茄miR169c在干旱胁迫下上调表达,转基因miR169c的番茄植株的抗旱性增强,气孔导度与失水率较非转基因植株低[64],这些结果再次表明同一miRNA家族成员在不同物种中具有不同的作用。
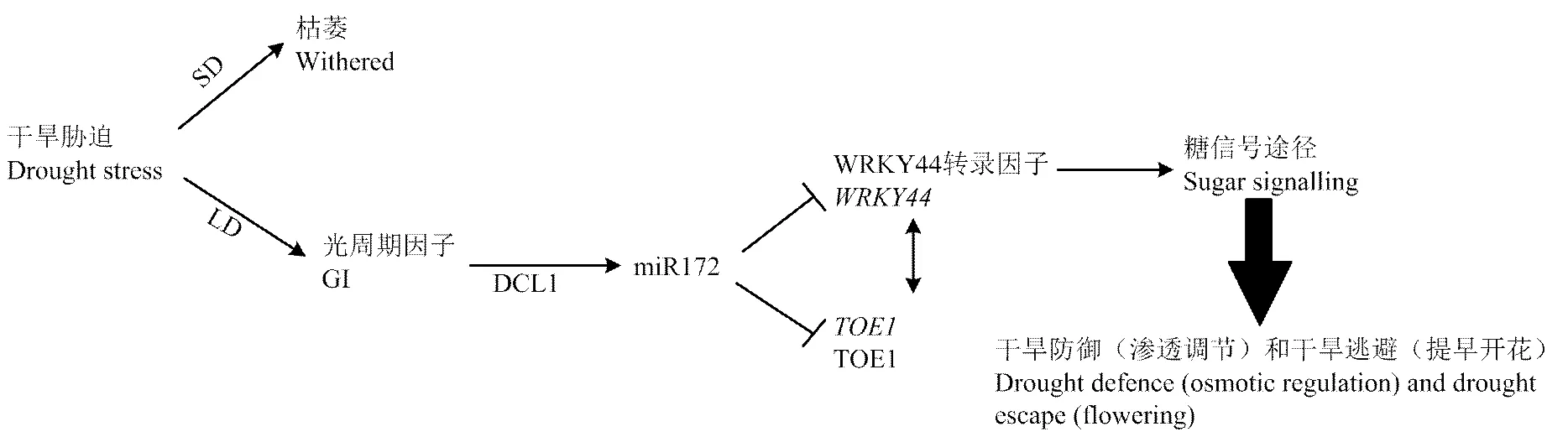
图4 拟南芥躲避干旱胁迫的调控方式
2.4 植物miRNA与重金属胁迫
一般情况下,重金属以环境可适浓度广泛分布在自然界中。随着社会发展和人类活动的加剧,包括采矿、废气和污水排放及重金属使用日益增多,造成铅、汞、镉和钴等生物毒性显著的重金属元素及化合物进入到大气、水和土壤中。有些重金属对于植物是必要元素,如Fe、Cu和Zn等参与植物正常的生理生化过程,而有些重金属元素是非必要的,如Cd、Co、Hg和Al等,但不论哪一种元素,植物体内的重金属浓度过高会触发机体内活性氧的积累,脂质、蛋白质以及DNA物质的损害,导致机体代谢紊乱,影响植物生长,甚至死亡[65-66]。植物在响应这些胁迫过程中涉及一些精确的转录及转录后水平调控。愈多的研究结果显示植物已进化出以信号转导、易位、滞留等特异的内在机制抵御重金属对植物的伤害[67],其中miRNA的调控占有重要地位[68]。SUNKAR等[69]研究拟南芥在高铜和高铁胁迫下,miR398的表达降低,其所调控的Cu/Zn超氧化物歧化酶靶基因表达上调,这种调控方式提高了拟南芥对重金属胁迫的耐受性。镉胁迫下水稻诸多miRNA的表达发生变化,微阵列芯片分离到了19个镉胁迫应答相关的miRNA,除了miR528表达显著上升外,miR166、miR171、miR168、miR162、miR396、miR390、miR156、miR1432、miR444等表达水平均下降[70]。拟南芥ABC运输体对镉(cadmium,Cd)和汞(mercury,Hg)等重金属通过螯合作用运输并储存在植物细胞的液泡中来降低对植物的伤害,同时ABC运输体基因缺失的拟南芥突变体会对Cd和Hg重金属相当敏感[71]。而miR192靶向ABC运输体基因,过表达miR192的水稻对Cd胁迫敏感[72],说明miRNA在植物受到重金属胁迫时,可以调节其作用的靶基因,其表达产物在植物体内的含量以应对环境胁迫。
2.5 植物miRNA与生物胁迫
动物miRNA介导病毒感染的抗性增强或减弱[73]。许多植物miRNA与病毒、细菌、真菌、线虫等生物胁迫也是有相互联系的。草酸(oxalic acid,OA)是多种植物病原真菌的致病因子。陈晓婷等[74]利用植物microRNA芯片获得了草酸胁迫下的拟南芥3个差异表达的miR2988、miR3090和miR3131,并鉴定了与靶基因的负相关性。烟草感染病毒后,miR156、miR160和miR164被诱导表达[75]。通过miRNA-microarray方法比较小麦抗真菌和真菌敏感的2个品种在真菌感染后miRNA的表达情况。抗性品种的小麦miR2592s、miR869.1和miR169b等miRNA较敏感型小麦品种具有显著的差异表达(200倍的差异变化),并且某些miRNA在真菌感染后第一时间产生。分析表明小麦中这些差异miRNA的靶基因很多都是与抗真菌相关的编码基因(葡萄糖醛酸转移酶,glucuronosyl transferase,LRR、peroxidase以及Pto kinase)[76]。Wu等[77]用类似方法检测到玉米经真菌感染后的某些miRNA(miR811、miR829、miR845与miR408)差异性表达。在水稻中与水稻-稻瘟病菌互作相关的miRl60a和miR398b的靶基因表达与相应miRNA累积量呈负相关性,过表达miRl60a和miR398b的转基因水稻明显增强水稻对稻瘟病的抗性[78]。几乎所有植物和动物都具有识别病原信号的病原识别受体(pathogen recognition receptors,PRRs)[21]。Li等[79]报道烟草的2个miRNA(miR6019和miR6020)的靶基因是TIR-NBLRR immune receptor N,miRNA在抵御病原菌感染,增强植物的生物抗性方面起调控作用。来源于拟南芥的miR159前体被修饰成人造miRNA(artificial miRNA或amiRNA),靶向2个基因沉默抑制子-芜菁黄花叶病毒(turnip yellow mosaic virus,TYMV)的P69以及芜菁花叶病毒(turnip mosaic virus,TuMV)的HC-Pro,分别过表达amiR-P69159和amiR-HC-Pro159的转基因拟南芥呈现出特异性抵抗TYMV和TuMV的表型,而同时拥有这2种人工miRNA的过表达转基因植株表现出对这2种病毒的双抗性[80-81]。此外,miRNA也可能会通过某些信号转导通路以响应病原菌对植物的伤害。拟南芥miR393靶向生长素信号通路中的F-box生长素受体,在受到丁香假单胞菌()侵害后,miR393被诱导表达,使得生长素受体表达受到抑制,从而抑制了细菌生长,表明miR393可能通过生长素信号通路参与宿主抗菌进程[21,82]。综上,生物胁迫过程中存在miRNA调节,这种调控方式对于改良农作物性状,抵御病害具有积极而重要的意义。
3 展望
世界人口数量不断增加,环境持续恶化,对人类生存造成极大威胁。提高在逆境下粮食品种的抗逆性迫在眉睫。科学家们一直在努力阐释植物的抗逆机制,但是这些研究成果依然不够成熟。miRNA在植物抗逆方面的研究和应用还有很长的路要走。
首先,过去十几年里,计算机和深度测序技术的不断发展[83-84],越来越多的植物miRNA相继被发现,又多在逆境胁迫和发育方面对miRNA表达水平进行鉴定,而miRNA的功能鉴定和调控机制方面的研究比较少。有很多植物成熟miRNA如何通过转录后修饰和降解影响miRNA的稳定性和活性,进而调控植物胁迫响应的生物学过程都尚未解析[85]。基于此,未来对参与环境胁迫的miRNA的探索是非常必要的;其次,对miRNA研究广度的不断拓展,发现了大量的novel miRNA,但是这些novel miRNA是如何进行调控的,基本都是未知的;第三,对于已知保守的miRNA,在表达上往往呈现物种和时空的特异性,寻找出植物miRNA这种特异性的原因对于深入了解miRNA的调控机制意义重大,所以现阶段对于miRNA的研究只是冰山一角,还有巨大的信息需要研究者去挖掘;第四,miRNA约占总基因的1%,这将意味着尚有许多miRNA有待发现。由于很多植物没有基因组信息以及植物miRNA 前体结构的多变性,使得植物miRNA前体不容易获得,这对于miRNA的功能研究是一个阻碍,虽然人工miRNA对于解决这一问题提供了一个不错的方法。迄今为止,很多植物miRNA的表达都与环境胁迫显著相关,其相关研究越来越多。综上所述,植物miRNA的抗逆研究存在挑战性,但其研究价值意义重大。
References
[1] Ding J, Zhou S, Guan J. Finding microRNA targets in plants: current status and perspectives., 2012, 10(5): 264-275.
[2] Gielen H, Remans T, Vangronsveld J, Cuypers A. MicroRNAs in metal stress: specific roles or secondary responses?, 2012, 13(12): 15826-15847.
[3] LEE R C, FEINBAUM R L, AMBROS V. Theheterochronic gene lin-4 encodes small RNAs with antisense complementarity to., 1993, 75: 843-854.
[4] Llave C, Xie Z X, Kasschau K D, Carrington J C. Cleavage of scarecrow-like mRNA targets directed by a class ofmiRNA., 2002, 297(5589): 2053-2056.
[5] Grimplet J, Agudelo-Romero P, Teixeira R T, Martinez- Zapater J M, Fortes A M. Structural and functional analysis of the GRAS gene family in grapevine indicates a role of GRAS proteins in the control of development and stress responses., 2016, 7: 353.
[6] Llave C. MicroRNAs: more than a role in plant development?, 2004, 5(4): 361-366.
[7] Kim B H, Kwon Y, Lee B, Nam K H. Overexpression of miR172 suppresses the brassinosteroid signaling defects of bak1 in., 2014, 447(3): 479-484.
[8] Sunkar R, Zhu J K. Novel and stress-regulated microRNAs and other small RNAs from., 2004, 16(8): 2001-2019.
[9] Ding D, Zhang L F, Wang H, Liu Z J, Zhang Z X, Zheng Y L. Differential expression of miRNAs in response to salt stress in maize roots., 2009, 103(1): 29-38.
[10] Voinnet O. Origin, biogenesis, and activity of plant microRNAs., 2009, 136(4): 669-687.
[11] Rogers K, Chen X M. Biogenesis, turnover, and mode of action of plant microRNAs., 2013, 25: 2383-2399.
[12] Tang G. Plant microRNAs: An insight into their gene structures and evolution., 2010, 21(8): 782-789.
[13] Kruszka K, Pacak A, Swida-Barteczka A, Nuc P, Alaba S, Wroblewska Z, Karlowski W, Jarmolowski A, Szweykowska-Kulinska Z. Transcriptionally and post- transcriptionally regulated microRNAs in heat stress response in barley., 2014, 65(20): 6123-6135.
[14] Fang Y J, Xie K B, Xiong L Z. Conserved miR164-targeted NAC genes negatively regulate drought resistance in rice., 2014, 65(8): 2119-2135.
[15] Zhang B H, Wang Q L. MicroRNA-based biotechnology for plant improvement., 2015, 230(1): 1-15.
[16] Lu Y D, Gan Q H, Chi X Y, Qin S. Roles of microRNA in plant defense and virus offense interaction., 2008, 27(10): 1571-1579.
[17] Verma S S, Sinha R, Rahman M H, Megha S, Deyholos M K, Kav N N V. miRNA-mediated posttranscriptional regulation of gene expression in ABR17-transgenicunder salt stress., 2014, 32(6): 1203-1218.
[18] Kim V N. MicroRNA biogenesis: Coordinated cropping and dicing., 2005, 6(5): 376-385.
[19] Zhang B H, Pan X P, Stellwag E J. Identification of soybean microRNAs and their targets., 2008, 229(1): 161-182.
[20] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function., 2004, 116(2): 281-297.
[21] Kumar R. Role of microRNAs in biotic and abiotic stress responses in crop plants., 2014, 174(1): 93-115.
[22] Zhou M, Luo H. MicroRNA-mediated gene regulation: potential applications for plant genetic engineering., 2013, 83(1/2): 59-75.
[23] Boutet S, Vazquez F, Liu J, Beclin C, Fagard M, Gratias A, Morel J B, Crete P, Chen X M, Vaucheret H.HEN1: a genetic link between endogenous miRNA controlling development and siRNA controlling transgene silencing and virus resistance., 2003, 13(10): 843-848.
[24] Yu B, Yang Z Y, Li J J, Minakhina S, Yang M C, Padgett R W, Steward R, Chen X M. Methylation as a crucial step in plant microRNA biogenesis., 2005, 307(5711): 932-935.
[25] Liu Y X, Wang M, Wang X J. Endogenous small RNA clusters in plants., 2014, 12(2): 64-71.
[26] Yu B, Wang H. Translational inhibition by microRNAs in plants., 2010, 50: 41-57.
[27] Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data., 2014, 42: D68-D73.
[28] Covarrubias A A, Reyes J L. Post-transcriptional gene regulation of salinity and drought responses by plant microRNAs., 2010, 33(4): 481-489.
[29] Lu X Y, Huang X L. Plant miRNAs and abiotic stress responses., 2008, 368(3): 458-462.
[30] Llave C, Kasschau K D, Rector M A, Carrington J C. Endogenous and silencing-associated small RNAs in plants., 2002, 14(7): 1605-1619.
[31] Kusenda B, Mraz M, Mayer J, Pospisilova S. MicroRNA biogenesis, functionality and cancer relevance.(), 2006, 150(2): 205-215.
[32] Rhoades M W, Reinhart B J, Lim L P, Burge C B, Bartel B, Bartel D P. Prediction of plant microRNA targets., 2002, 110(4): 513-520.
[33] Höck J, Meister G. The argonaute protein family., 2008, 9(2): 210.
[34] Lu Y Z, Feng Z, Bian L Y, Xie H, Liang J S. miR398 regulation in rice of the responses to abiotic and biotic stresses depends on CSD1 and CSD2 expression., 2011, 38(1): 44-53.
[35] Jagadeeswaran G, Saini A, Sunkar R. Biotic and abiotic stress down-regulate miR398 expression in., 2009, 229(4): 1009-1014.
[36] Hwang E, Shin S, Yu B, Byun M, Kwon H. miR171 family members are involved in drought response in.,2011, 54(1): 43-48.
[37] Cui L G, Shan J X, Shi M, Gao J P, Lin H X. The miR156-SPL9-DFR pathway coordinates the relationship between development and abiotic stress tolerance in plants., 2014, 80(6): 1108-1117.
[38] Zhou X F, Wang G D, Zhang W X. UV-B responsive microRNA genes in., 2007, 3: 103.
[39] Jia X Y, Ren L G, Chen Q J, Li R Z, Tang G L. UV-B- responsive microRNAs in., 2009, 166(18): 2046-2057.
[40] Wang B, Sun Y F, Song N, Wang X J, Feng H, Huang L L, Kang Z S. Identification of UV-B-induced microRNAs in wheat., 2013, 12(4): 4213-4221.
[41] Munns R, Tester M. Mechanisms of salinity tolerance., 2008, 59: 651-681.
[42] Liu H H, Tian X, Li Y J, Wu C, Zheng C. Microarray-based analysis of stress-regulated microRNAs in., 2008, 14(5): 836-843.
[43] Si J N, Zhou T, Bo W H, Xu F, Wu R L. Genome-wide analysis of salt-responsive and novel microRNAs inby deep sequencing., 2014, 15(Suppl. 1): S6.
[44] Zhao B T, Ge L F, Liang R Q, Li W, Ruan K C, Lin H X, Jin Y X. Members of miR-169 family are induced by high salinity and transiently inhibit the NF-YA transcription factor., 2009, 10(1): 29.
[45] Wang M, Wang Q L, Zhang B H. Response of miRNAs and their targets to salt and drought stresses in cotton (L.)., 2013, 530(1): 26-32.
[46] Kim J Y, Kwak K J, Jung H J, Lee H J, Kang H. MicroRNA402 affects seed germination ofunder stress conditions via targeting DEMETER-LIKE protein3 mRNA., 2010, 51(6): 1079-1083.
[47] Gao P, Bai X, Yang L, Lv D K, Li Y, Cai H, Ji W, Guo D J, Zhu Y M. Over-expression of osa-miR396c decreases salt and alkali stress tolerance., 2010, 231(5): 991-1001.
[48] Sunkar R. MicroRNAs with macro-effects on plant stress responses., 2010, 21(8): 805-811.
[49] Xie F L, Wang Q L, Sun R R, Zhang B H. Deep sequencing reveals important roles of microRNAs in response to drought and salinity stress in cotton., 2015, 66(3): 789-804.
[50] Jia X Y, Wang W X, Ren L G, Chen Q J, Mendu V, Willcut B, Dinkins R, Tang X, Tang G L. Differential and dynamic regulation of miR398 in response to ABA and salt stress inand., 2009, 71(1/2): 51-59.
[51] Zhu J F, Li W F, Yang W H, Qi L W, Han S Y. Identification of microRNAs inby high-throughput sequencing and expression analysis of 12 microRNAs and their targets under salt stress., 2013, 32(9): 1339-1349.
[52] Paul S, Kundu A, Pal A. Identification and validation of conserved microRNAs along with their differential expression in roots ofgrown under salt stress., 2011, 105(2): 233-242.
[53] Frazier T P, Sun G, Burklew C E, Zhang B H. Salt and drought stresses induce the aberrant expression of microRNA genes in Tobacco., 2011, 49(2): 159-165.
[54] Kazan K. Auxin and the integration of environmental signals into plant root development., 2013, 112(9): 1655-1665.
[55] Xie F L, Jr Stewart CN, Taki F A, He Q L, Liu H W, Zhang B H. High-throughput deep sequencing shows that microRNAs play important roles in switchgrass responses to drought and salinity stress., 2014, 12(3): 354-366.
[56] Li B S, Duan H, Li J G, Deng X W, Yin W L, Xia X L. Global identification of miRNAs and targets inunder salt stress., 2013, 81(6): 525-539.
[57] Tian Y H, Tian Y M, Luo X J, Zhou T, Huang Z P, Liu Y, Qiu Y H, Hou B, Sun D, Deng H Y. Identification and characterization of microRNAs related to salt stress in broccoli, using high-throughput sequencing and bioinformatics analysis., 2014, 14: 226.
[58] Zhou M, Li D Y, Li Z G, Hu Q, Yang C H, Zhu L H, Luo H. Constitutive expression of a miR319 gene alters plant development and enhances salt and drought tolerance in transgenic creeping bentgrass., 2013, 161(3): 1375-1391.
[59] Zhang N, Yang J W, Wang Z M, Wen Y K, Wang J, He W H, Liu B L, Si H J, Wang D. Identification of novel and conserved microRNAs related to drought stress in potato by deep sequencing., 2014, 9(4): e95489.
[60] Hackenberg M, Gustafson P, Langridge P, Shi B J. Differential expression of microRNAs and other small RNAs in barley between water and drought conditions., 2015, 13(1): 2-13.
[61] Bhardwaj A R, Joshi G, Pandey R, Kukreja B, Goel S, Jagannath A, Kumar A, Katiyar-Agarwal S, Agarwal M. A genome-wide perspective of miRNAome in response to high temperature, salinity and drought stresses in(Czern) L.., 2014, 9(3): e92456.
[62] Han Y Y, Zhang X, Wang Y F, Ming F. The suppression of WRKY44 by GIGANTEA-miR172 pathway is involved in drought response of., 2013, 8(11): e73541.
[63] Wang Gaskin, 余道乾, 杜雄明. 陆地棉种子发育过程中microRNA的挖掘与功能研究. 棉花学报, 2014, 26(1): 81-86.
WANG G, YU D Q, DU X M. ldentification of micoRNAs in upland cotton., 2014, 26(1): 81-86. (in Chinese)
[64] Ferdous J, Hussain S S, Shi B J. Role of microRNAs in plant drought tolerance., 2015, 13(3): 293-305.
[65] Lutts S, Lefevre I. How can we take advantage of halophyte properties to cope with heavy metal toxicity in salt-affected areas?, 2015, 115(3): 509-528.
[66] Kandziora-Ciup M, Ciepal R, Nadgórska-Socha A, Barczyk G. Accumulation of heavy metals and antioxidant responses inL. needles in polluted and non-polluted sites., 2016, 25(5): 970-981.
[67] Gupta O P, Sharma P, Gupta R K, Sharma I. MicroRNA mediated regulation of metal toxicity in plants: present status and future perspectives., 2014, 84(1/2): 1-18.
[68] 丁艳菲, 朱诚, 王珊珊, 刘海丽. 植物microRNA 对重金属胁迫响应的调控. 生物化学与生物物理进展, 2011, 38(12): 1106-1110.
DING Y F, ZHU C, WANG S S, LIU H L. Reulation of heavy metal stress response by plant microRNAs., 2011, 38(12): 1106-1110. (in Chinese)
[69] Sunkar R, Kapoor A, Zhu J K. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes inis mediated by downregulation of miR398 and important for oxidative stress tolerance., 2006, 18(8): 2051-2065.
[70] Ding Y F, Chen Z, Zhu C. Microarray-based analysis of cadmium-responsive microRNAs in rice ()., 2011, 62(10): 3563-3573.
[71] Park J, Song W Y, Ko D, Eom Y, Hansen T H, Schiller M, Lee T G, Martinoia E, Lee Y. The phytochelatin transporters AtABCC1 and AtABCC2 mediate tolerance to cadmium and mercury., 2012, 69(2): 278-288.
[72] Ding Y F, Qu A L, Gong S M, Huang S X, Lü B, Zhu C. Molecular identification and analysis of Cd-responsive microRNAs in rice., 2013, 61(47): 11668-11675.
[73] Lecellier C H, Dunoyer P, Arar K, Lehmann-Che J, Eyquem S, Himber C, Saib A, Voinnet O. A cellular microRNA mediates antiviral defense in human cells., 2005, 308(5721): 557-560.
[74] 陈晓婷, 刘军, 孙翠霞, 林桂芳. 草酸胁迫下拟南芥三个差异表达microRNA的分析. 农业生物技术学报, 2014, 22(4): 432-439.
CHEN X T, LIU J, SUN C X, LIN G F. Three differentially expressed microRNA inunder the stress of oxalic acid., 2014, 22(4): 432-439. (in Chinese)
[75] Khraiwesh B, Zhu J K, Zhu J H. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants., 2012, 1819(2SI): 137-148.
[76] Inal B, Turktas M, Eren H, Ilhan E, Okay S, Atak M, Erayman M, Unver T. Genome-wide fungal stress responsive miRNA expression in wheat., 2014, 240(6): 1287-1298.
[77] Wu F L, Shu J H, Jin W B. Identification and validation of miRNAs associated with the resistance of maize (L.) to., 2014, 9(1): e87251.
[78] 卢远根. 水稻中与水稻一稻瘟病菌互作相关的microRNA初步研究[D]. 雅安: 四川农业大学, 2014.
LU Y G. Identification of rice microRNAs invovled in rice--interaction [D]. Yaan: Sichuan Agricultural University, 2014. (in Chinese)
[79] Li F, Pignatta D, Bendix C, Brunkard J O, Cohn M M, Tung J, Sun H, Kumar P, Baker B. MicroRNA regulation of plant innate immune receptors., 2012, 109(5): 1790-1795.
[80] Niu Q W, Lin S S, Reyes J L, Chen K C, Wu H W, Yeh S D, Chua N H. Expression of artificial microRNAs in transgenicconfers virus resistance., 2006, 24(11): 1420-1428.
[81] Qu J, Ye J, Fang R X. Artificial microRNA-mediated virus resistance in plants., 2007, 81(12): 6690-6699.
[82] Navarro L, Dunoyer P, Jay F, Arnold B, Dharmasiri N, Estelle M, Voinnet O, Jones J D G. A plant miRNA contributes to antibacterial resistance by repressing auxin signaling., 2006, 312(5772): 436-439.
[83] 卫波, 张荣志, 李爱丽, 毛龙. 利用高通量测序技术发现植物小分子RNA研究进展.中国农业科学, 2009, 42(11): 3755-3764.
WEI B, ZHANG R Z, LI A L, MAO L. Progress in plant small RNA research via high-throughput sequencing., 2009, 42(11): 3755-3764. (in Chinese)
[84] 易小娅, 杨瑞瑞, 曾幼玲. 植物microRNA的研究方法概述. 植物生理学报, 2015, 51(4): 413-423.
YI X Y, YANG R R, ZENG Y L. Overview of research methods for plant miRNAs., 2015, 51(4): 413-423. (in Chinese)
[85] 张俊红, 张守攻, 齐力旺, 童再康. 植物成熟microRNA转录后修饰与降解的研究进展. 植物学报, 2014, 49(4): 483-489.
ZHANG J H, ZHANG S G, QI L W, TONG Z K. Research advances in post-transcriptional modification and degradation of mature microRNAs in plants., 2014, 49(4): 483-489. (in Chinese)
(责任编辑 李莉)
Biological Characteristics of Plant MicroRNAs and Actions in Environmental Stresses
ZENG You-ling, YANG Rui-rui
(College of Life Science and Technology, Xinjiang University/Xinjiang Key Laboratory of Biological Resources and Genetic Engineering, Urumqi 830046)
MicroRNA (miRNA) is an extensive class of non-coding and small molecular RNA with length about 21 nt. It is encoded by the endogenous gene and transcribed by RNA polymerase II and the precursor miRNA is processed into mature miRNA by Dicer-Like and a series of the protein complexes. miRNA mainly regulates its targets at the level of post-transcription mediated degradation of target mRNA or translation inhibition. miRNA is an important regulator of gene expression in eukaryotic cells.is the first animal miRNA discovered in(). It is essential for the growth and development ofby negative controlling the expression level of target genewith partial complementarity tomRNA in the 3′untranslated region (UTR), causing the degradation ofgene and thus inhibiting the expression ofgene.miR171 is discovered as the first miRNA in plant, which targets mRNA of Scarecrow-like (SCL) family, and thus miR171 can affect plant growth and development by negative regulating target gene expression. Plant partial miRNAs (from miR156 to miR408) are relatively conserved among different species and other miRNAs after miR408 are species-specific. Plants will encounter all kinds of unpredictably environmental stresses (salinity, drought, heavy metal, pest and pathogen infection), because of plant sessile growth, no moving to avoid the adversely environmental effects like animals. Therefore, it is necessary for plants to cope with these stresses with their special mechanisms. Actually, plants grown chronically in the stressed environments have evolved highly complicated and delicate physiological and molecular mechanisms. Studies have showed that miRNA and its target genes are the main regulatory factors in response to various stresses. miRNAs play important roles in regulating the expression of endogenous resistance genes by involving in plant growth and development, signal transduction, protein degradation, nutrient deficiency, preventing pathogen invasion and adapting to high salt- and drought-stressed environments as well. So far, lots of miRNAs are identified and have significantly differential expression by next-generation deep sequencing, advanced bioinformatics and real-time quantitative PCR technologies in response to environmental stresses; and the plants show the resistant or sensitive phenotypes by microRNA-based transformation. The different members of miRNA family responding to environmental stresses are also taken on being species-specific. It is well-known that China’s Xinjiang is a kind of typical continental arid climate with a low annual rainfall and more acid areas. In such harsh environments, some extremely salt- and drought-tolerant halophytes and xerophytes can still survive healthy and strong. It is very essential to study deeply how plant miRNAs play regulatory roles in coping with environmental stresses. This paper mainly summarizes plant miRNA biosynthesis, the modes of actions with target genes and research status of some miRNAs involving in the abiotic and biotic stresses. Some prospects are expected by microRNA-based biotechnology.
plant microRNAs; biosynthesis; mechanism; environmental stresses
2016-04-28;接受日期:2016-06-06
国家自然科学基金(31160186)、新疆维吾尔自治区自然科学基金(2015211C274)
曾幼玲,E-mail:zeng_ylxju@126.com

