一元强碱滴定二元弱酸的林邦滴定曲线方程及pHsp计算
乔成立
(齐齐哈尔大学应用技术学院,黑龙江齐齐哈尔161006)
·师生笔谈·
一元强碱滴定二元弱酸的林邦滴定曲线方程及pHsp计算
乔成立*
(齐齐哈尔大学应用技术学院,黑龙江齐齐哈尔161006)
用质子条件式PBE、物料平衡式MBE、副反应系数和条件稳定常数等知识,推导出一元强碱滴定二元弱酸溶液的林邦滴定曲线方程,并用其推导出第一、第二化学计量点和的计算公式。
酸碱滴定;副反应系数;条件稳定常数;滴定曲线方程
www.dxhx.pku.edu.cn
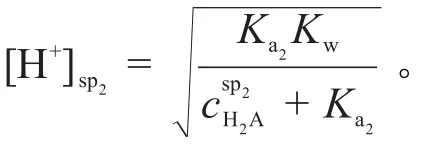
一元强碱滴定二元弱酸(H2A)溶液是酸碱滴定的一种类型,其林邦滴定曲线方程及化学计量点的pH计算具有重要的理论价值和实际意义[1-6]。由于一元强碱滴定二元弱酸溶液的林邦滴定曲线方程是描述被滴定体系中H+浓度变化的,所以用其推导化学计量点的pH计算公式是顺理成章的。然而,教材[1-3]仍然用体积计算法计算化学计量点的pH,这是不理想的。其原因是没有建立一元强碱滴定二元弱酸溶液的滴定曲线方程,仍然用体积计算法计算化学计量点的pH。用林邦滴定曲线方程计算化学计量点的pH比用体积计算法计算化学计量点的pH简便。例如:用0.10 mol·L-1的NaOH滴定同浓度的H2CO3溶液。计算第二化学计量点的已知
文献[7]讨论的是一元强碱滴定一元弱酸(HA)溶液的林邦滴定曲线方程及化学计量点的计算,本文讨论的是一元强碱滴定二元弱酸溶液的林邦滴定曲线方程及化学计量点的计算,二者讨论的是不同类型的酸碱滴定。文献[7]把H+和OH-的反应看成主反应,把HA解离为A-和 H+的反应看成是H+发生的副反应,有一个化学计量点,需要一个滴定曲线方程计算本文把H+和OH-的反应看成主反应,把H2A解离为H+和HA-的反应看成是H+发生的副反应,把HA-和OH-的反应看成是OH-发生的副反应,既有H+的副反应,又有OH-的副反应,有两个化学计量点,需要两个滴定曲线方程计算和显然,后者比前者具有创新性,难度更大,应用范围也更广。
为此,本文用MBE、PBE、副反应系数和条件稳定常数等知识,推导出一元强碱滴定二元弱酸(H2A)溶液的林邦滴定曲线方程,并用其推导出化学计量点pH的计算公式。
1 副反应系数和条件稳定常数
1.1H+的副反应系数
用NaOH滴定H2A第一级解离的H+的反应为OH-+H2A=HA-+H2O;用NaOH滴定H2A第二级解离的H+的反应为OH-+HA-=A2-+H2O。假设H2A第二级解离的H+参与了NaOH和H2A第一级解离的H+的滴定反应,则NaOH和H2A第一级解离出来的H+的滴定反应相当于把H+和OH-反应看成主反应[7],把H2A解离为H+和HA-的反应看成是H+发生的副反应,把HA-和OH-的反应看成是OH-发生的副反应:
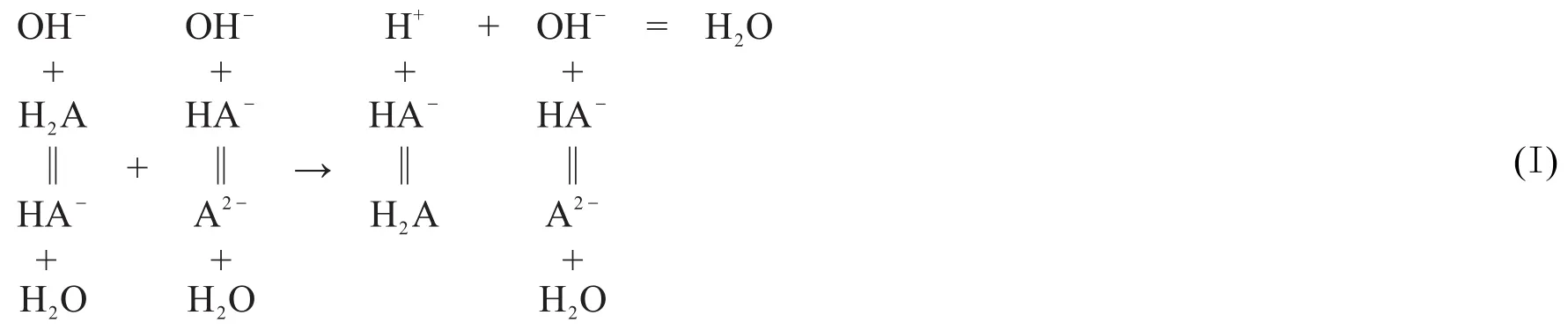
如果用 αH1(HA)表示第一化学计量点时 H+的副反应系数,则 αH1(HA)=[H′]/[H+]。因为1212所以
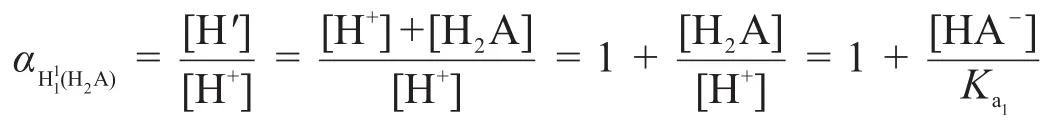

第一化学计量点时,H2A第一级解离的H+已经反应完全,滴定体系中主要是HA-,所以第一化学计量点后至第二化学计量点时,把H+和OH-反应看成是主反应,把HA-解离为H+和A2-的反应看成是H+发生的副反应:

所以[H′]=[H+]+[HA-],第二化学计量点时,H+副反应系数为:
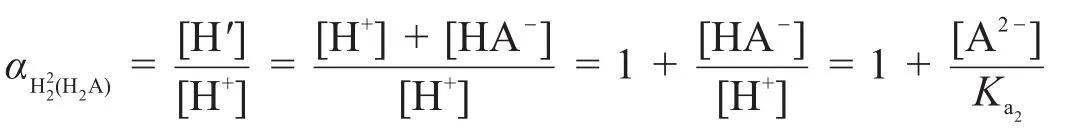

1.2OH-的副反应系数
因为[OH′]=[OH-]+[A2-],如果用表示第一化学计量点时OH-副反应系数的近似式,则
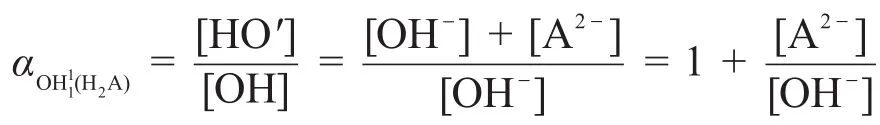

1.3滴定主反应的条件稳定常数
第一化学计量点时,滴定反应为:

条件稳定常数为:


第二化学计量点时,滴定反应为:
条件稳定常数为:


2 林邦滴定曲线方程及化学计量点的pHsp
2.1林邦滴定曲线方程
由文献[4,5]可知,滴定分数为:
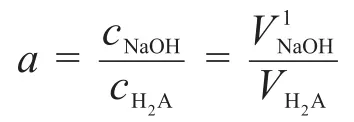
选择H2O和H2A为零水准,则PBE为:[Na+]+[H+]=[OH-]+[HA-]+2[A2-]。因为只有H2A解离为H+和HA-是H+的副反应,所以[H′]=[H+]+[H2A]。OH-只和HA-发生副反应生成A2-,所以[OH′]=[OH-]+[A2-]。故滴定开始至第一化学计量点时,溶液中同时存在以下计量关系:
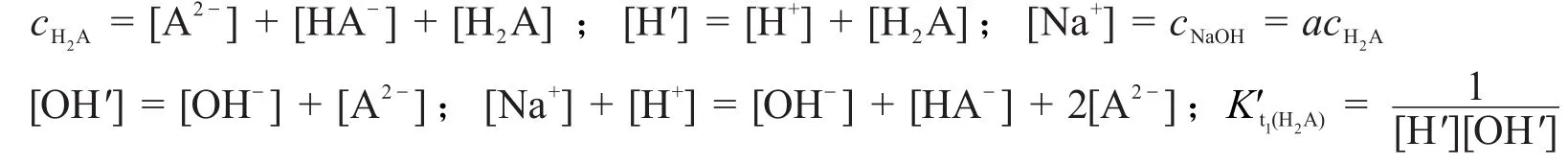
整理得滴定开始至第一化学计量点时的林邦滴定曲线方程为:

同理,在第一化学计量点后至第二化学计量点时,存在以下计量关系:

整理得第一化学计量点后至第二化学计量点时的林邦滴定曲线方程为:

2.2化学计量点的pHsp
2.2.1第一化学计量点的pHsp1

由文献[1]知,当时,有:



2.2.2第二化学计量点的pHsp2


如果将二元弱酸(H2A)看成是HA-和A2-的混合溶液,则以上公式还适用于一元强碱滴定混合一元弱酸(HA和HB)溶液的第一、第二化学计量点和计算公式。届时将公式中的和换成和和换成和即可。
3 结论
本文推导了一元强碱滴定二元弱酸(H2A)溶液的林邦滴定曲线方程,并用其推导出第一、第二化学计量点的和的计算公式,为用林邦理论统一四大滴定分析和用林邦滴定曲线方程解决酸碱滴定分析中的理论和实际问题做了一点尝试。
[1]武汉大学.分析化学.第5版.北京:高等教育出版社,2006.
[2]华中师范大学,东北师范大学,陕西师范大学,北京师范大学.分析化学.第3版.北京:高等教育出版社,2002.
[3]彭崇慧,冯建章,张锡瑜,李克安,赵凤林.分析化学.第3版.北京:北京大学出版社,1997.
[4]孟凡昌,蒋勉.分析化学中的离子平衡.北京:科学出版社,1997.
[5]孟凡昌,杨代菱.大学化学,2001,16(2),20.
[6]王园朝,包海峰.大学化学,2013,28(3),82.
[7]乔成立.大学化学,2015,30(2),64.
The Ringbom Equation for the Titration Curve of Diprotic Weak Acid by Monoprotic Base and pHspCalculation
QIAO Cheng-Li*
(School of Applied Technology,Qiqihar University,Qiqihar 161006,Heilongjiang Province,P.R.China)
The Ringbom equation for the titration curve of diprotic weak acid by monoprotic base was developed based on the proton balance equation,the mass balance equation,the side reaction coefficient,and the conditional stability constant.The calculation formulas for the first(pHsp1)and the secondstoichiometric point were deduced subsequently.
Acid-base titration; Side reaction coefficient; Conditional stability constant;Titration curve equation
O651;G64
10.3866/PKU.DXHX20160229
,Email:qiaocl123@163.com

