界面移动法测定离子迁移数实验的优化
吴舒婷 张惠芳 谭翊鑫 郑 欧 高绍康 李 奕 陈建中
(福州大学化学学院,福州350116)
界面移动法测定离子迁移数实验的优化
吴舒婷*张惠芳谭翊鑫郑欧高绍康李奕陈建中
(福州大学化学学院,福州350116)
在基础物理化学实验界面移动法测定离子迁移数中,针对传统实验方案所用镉电极存在的不足之处,改用铜电极进行了平行对比实验,发现采用铜电极的实验方案在保证实验数据有良好准确度的前提下,既能降低电极材料的毒性,也能降低实验相关设备的配置要求。
界面移动法;离子迁移数;电极;阳极材料
www.dxhx.pku.edu.cn
界面移动法测定离子迁移数是一个经典的物理化学实验项目。该实验旨在观察电解过程中的离子定向迁移现象,并通过时间、电流、体积等物理量的测定,求解出离子迁移数。由于实验内容与理论教学中电化学部分的知识点结合紧密,能够很好地让学生在实践学习中加深对课堂授课内容的认识与理解,是一项理论联系实际的物理化学实验教学项目。常规的测定离子迁移数实验有3种方法,即希托夫法、电动势法和界面移动法。其中界面移动法由于其测量数据最为精确[1,2],且具有装置简易、现象直观、重现性良好等特点,在国内各高校的理工科类物理化学实验教学中被广泛采用。
在教学实践中,笔者发现较多学生对该实验环节中所选用的阳极电极材料提出了替代的想法。其原因主要是目前使用的镉电极具有一定毒性[3]。然而受到实验装置及原理的制约,可用于替换镉电极的电极种类有限。2001年,赵燕萍等[4]提出用镍电极更换镉电极的实验方案,但由于金属镍多以合金材料出现,因此镍电极方案并未得到推广。本文通过考查各类常见金属电极的电极电势、相应离子的电迁移率及离子极限摩尔电导率,提出用铜电极代替镉电极的实验优化方案,并进行了对照试验,论证了该方案的可行性。
根据电化学原理,阳极的作用首先是发生氧化反应。为避免溶液中氯离子或水分子氧化形成气体(氯气或氧气)而阻断电路,实验原方案中采用了金属镉作为牺牲阳极材料,其在25°C酸性溶液中的标准电极电势为-0.40 V。尽管铜电极标准电极电势为0.34 V,略高于镉电极,但本实验采用直流输出电源提供电解池端电压,远大于上述两类电极的电极电势。另一方面,实验中氢离子与镉离子电迁移率的不同是界面形成的关键因素。查阅兰氏化学手册可知,等温条件下无限稀释水溶液中氢离子摩尔电导率远大于其他金属离子的摩尔电导率,换算为离子电迁移率也有相似规律。本文选取比较了几种金属离子与氢离子的相关数据,列于表1[5]。因此,从离子电迁移率角度考虑,铜电极与镉电极将在实验中发挥相类似的作用,在指示剂的显色作用下,显示出清晰可观测的界面。
除了从理论层面考察电极材料的要求以外,本文对电极材料的实用可行性也进行了比较分析。表2列出了镉、镍、铜3类电极的关键参数信息。从电极材质的毒理学以及市场售价角度考虑,在3类电极材料中,铜是较为理想的选择。而3种元素在电解后的离子导电行为也有所不同,以镍离子导电能力最差,铜离子导电能力最强[5]。在本实验中,随着电解反应的发生,阳极产生的金属离子将显著提高回路电阻。在实验要求测试电流恒定以便准确记录数据的情况下,端电压将大大提高。在经典的镉电极实验中,常需配备最高能够输出300 V电压的直流电源,方能满足学生在操作中完整记录至少6组实验数据的要求。因此可推测,若选择镍电极进行实验,则对于所配备直流电源的最高输出电压的要求将随之提高。反之,若选择铜电极作为离子迁移数测定实验中的阳极,由于铜离子良好的导电能力,可有效降低直流电源的最高电压输出要求。综合上述考虑,本文针对实验装置中镉电极存在的不足,采用铜电极替代,进行对比实验探究,取得了较好的实验效果。

表1 25°C时一些离子在无限稀释水溶液中的离子电迁移率(u)

表2 常见电极材料的部分参数对比
1 实验
1.1仪器和试剂
界面移动仪一套,直流电源,可变电阻,铜电极、镉电极、铂电极各一个,电流表一个,滴定管,秒表。
HCl溶液(配制浓度约0.1 mol·L-1,实际浓度用滴定法确定),NaOH,邻苯二甲酸氢钾,无水碳酸钠,酚酞、甲基红、甲基橙及甲基紫指示剂,上述试剂均为分析纯。去离子水。
铜电极的制作如图1所示,以粗铜线为原材料(直径约2 mm),截取长度约5 cm。用透明橡胶软管与迁移管衔接。由于铜线直径小于软管内径,故保留漆包铜线的漆包层,并套一层小口径橡胶软管,以保证衔接紧密无漏液。衔接软管采用透明管,便于学生在装溶液时观察电极附近是否存在气泡。
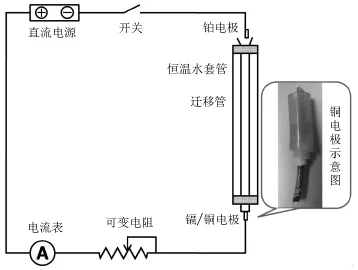
图1 界面法测定离子迁移数的实验装置示意图
铜电极的储存与保养:由于金属铜在潮湿环境下易发生锈蚀产生铜绿,故实验用毕需洗涤,浸泡于清洁的去离子水中。
1.2实验条件
实验在常温常压下进行,迁移管总体积为1 mL。
1.3实验步骤
在洁净的迁移管中装满添加了甲基紫指示剂的HCl溶液(不要留有气泡)。根据图1装置图连接电路。电路连接好后,调低直流电源的输出电压,闭合回路开关。通过调节输出电压使回路电流维持在4.00 mA。当界面到达0刻度线时开始计时,界面每移过0.10 mL记录一次时间,记录5-7次后,实验结束。
以铜电极作阳极,进行上述实验15次,相应实验编号为Cu1-Cu15;更换成镉电极,重复上述步骤(其余条件均相同)10次,相应实验编号为Cd1-Cd10。
为准确计算本实验中离子迁移数,对所用HCl溶液进行浓度滴定。根据实际情况,采用两种滴定法,分别如下:①以干燥的邻苯二甲酸氢钾滴定NaOH溶液,以酚酞为指示剂;后用该NaOH溶液滴定HCl溶液,以甲基红做指示剂。②以干燥的无水碳酸钠滴定HCl溶液,以甲基橙为指示剂。
2 结果与讨论
2.1实验现象讨论
铜电极作阳极时,电解进行1-2 min,迁移管阳极部出现清晰的紫色界面,阴极部有气泡冒出,界面向阴极移动。
镉电极作阳极时,电解进行1-2 min,迁移管阳极部出现清晰的浅紫色界面,阴极部有气泡冒出,界面向阴极移动。
实验编号Cu1、Cu2、Cd1的3组实验由同一实验小组用同一套仪器进行。实验中设置回路中可变电阻保持999 Ω,通过调节直流电压保持电流4 mA,考查完成实验所需电压值。观测到Cu1、Cu2的实验起始电压均为58 V,终止电压为209 V;Cd1实验起始电压为71 V,终止电压为277 V。
由上述现象可知,采集等量数据时,镉电极的工作电压远大于铜电极。由于我国民用电的额定电压为220 V,采用镉电极为阳极时,实验中需选择高压直流电源,其价格是常规直流电源的3倍左右。若将镉电极替换为铜电极,由于铜离子具有较好的导电能力,实验所需的直流电源可在220 V以内,因此不需要选择高压直流电源,这将有效降低实验教学的投入。此外,采用两种电极均可观察到迁移管内缓慢移动的清晰界面,说明在现象观察方面,两种电极均能满足实验教学的要求。
2.2实验数据分析与讨论
将实验采集的体积与时间等数据列表,根据界面移动法测定离子迁移数的计算公式
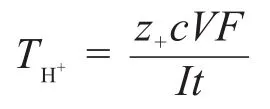
可求解离子迁移数,并对所得数据进行分析。由于实验采取的是多次测定界面迁移相同V所耗时t,故取平均值计算离子迁移数,并用相对标准偏差衡量多次测量的精密度。相似条件下的氢离子迁移数为0.8314(25°C,0.1 mol·L-1盐酸溶液)[1],本文采用相对误差分析结果,并用准确度衡量平行对比实验的测量结果。
如表3所示,采用镉电极作为阳极,进行了10组平行实验。应说明的是,由于本文所有实验数据均来自不同实验操作人员(学生),因此相对标准偏差浮动水平较大。这一现象在铜电极实验中也有出现,反映出学生的实验操作水平不一致,但总体偏差控制在3%以内。对学生所收集的实验数据进行分析可发现,在表3的10组实验中,所测离子迁移数与文献值的相对误差在0.1%-4.9%之间,总平均值为0.846,准确度0.020,能够较好地符合物理化学实验教学对误差控制的要求。表4为以铜电极为阳极的15组平行实验,相对标准偏差也控制在3%以内,与文献值的相对误差在-0.4%-5.5%之间,较镉电极实验组偏大。实验总平均值为0.833,准确度0.019,与镉电极实验组相近。

表3 采用镉电极作为阳极测定氢离子迁移数数据表
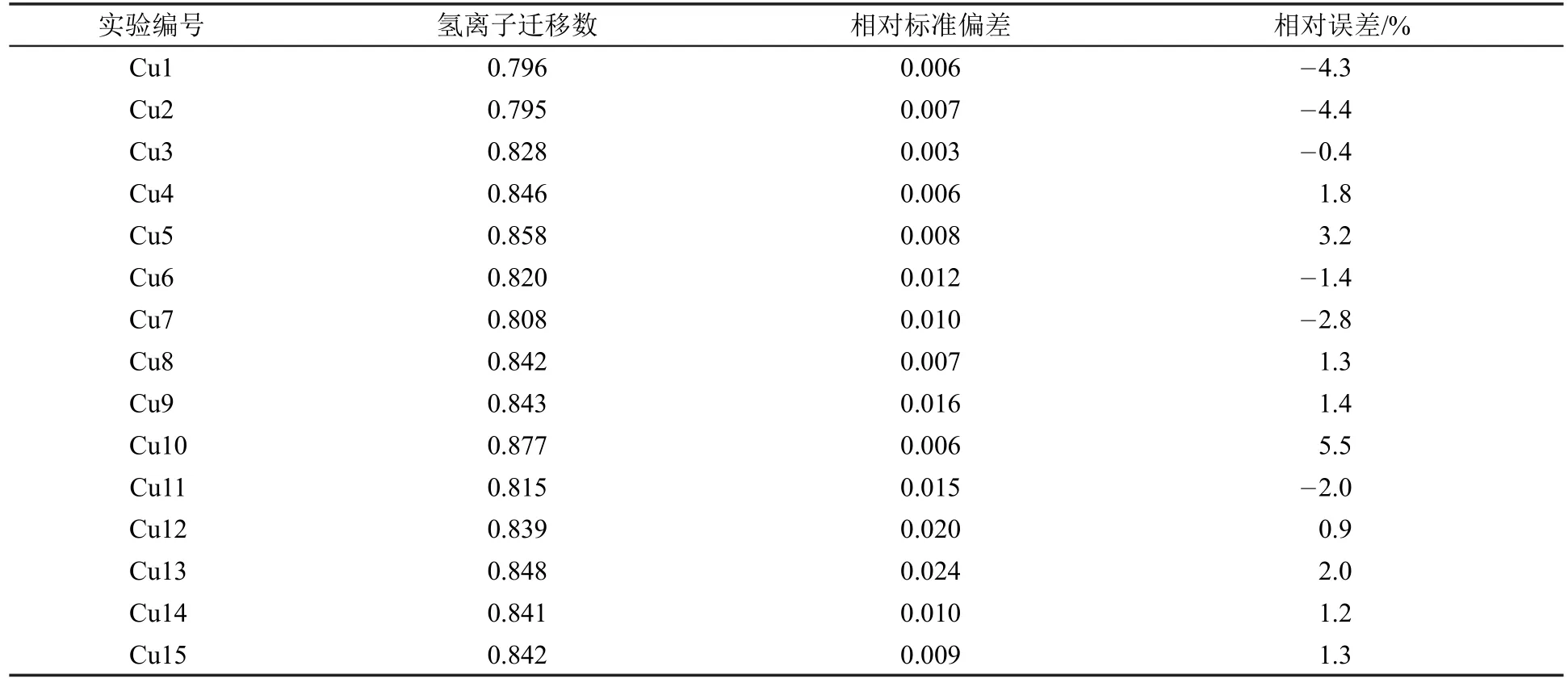
表4 采用铜电极作为阳极测定氢离子迁移数数据表
为比较考查两种电极平行实验中的误差大小,将上述实验测定的离子迁移数及相应的实验序号在直角坐标系中描点,用球的直径表示单组测量的相对标准偏差(图2)。如图2所示,两种电极所测定的实验值均随机分布于文献值附近,相对标准偏差也具有随机性,表明两种方法均能用于界面移动法测定氢离子迁移数。尽管从目前的数据看来,采用铜电极测定时,相对误差较大,相对标准偏差也较高,但从总体平均值0.833接近文献值,以及准确度0.019来看,应能符合实验教学的要求。
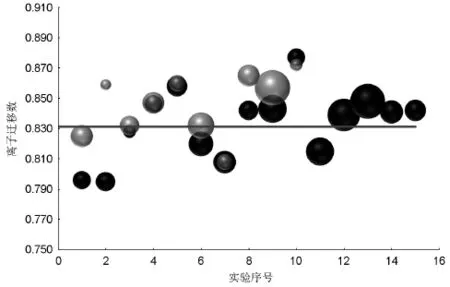
图2 离子迁移数测定值散点分布图
对于为何铜电极实验误差较大,笔者的考量从实验所涉物理量,即电流值、盐酸浓度、记录时间、迁移体积等展开。由于盐酸浓度为系统误差,故应在此排除。电流值的记录及波动对实验的影响并不会受电极更换有所改变,故也做排除。记录时间和迁移体积的判断均受到界面是否清晰所左右,而这是更换电极最可能产生影响的关键。然而,在铜电极实验中,由于析出的铜离子水解显弱酸性,仍能达到甲基紫的第3变色范围(蓝-紫,pH 2.0-3.0),故实验中可观测到离子定向迁移的清晰界面。因此,笔者推测铜电极实验误差总体略大于镉电极很可能与实验操作人员为随机采样的学生有关。毕竟在镉电极平行实验中也不乏相对误差较大的例子。
3 结论
在界面移动法测定离子迁移数的实验中,将阳极材料镉电极换成铜电极具有以下3个优点:①铜电极环境友好、无毒、廉价;② 根据实验测定的数据计算得到的离子迁移数,与原方案镉电极具有相当的实验误差,不影响实验教学中学生对知识点的掌握与实践能力的锻炼;③实验所需电源只需普通直流电源,不用配备昂贵的高压直流电源。
[1]MacInnes,D.A.;Longsworth,L.G.Chem.Rev.1932,11(2),171.
[2]岳可芬.基础化学实验(III)——物理化学实验.北京:科学出版社,2012.
[3]吴训伟.工业卫生与职业病,2000,26(4),254.
[4]赵燕萍,吴兆民,曾昊,崔萍.襄樊学院学报,2001,22(5),59.
[5]Speight,J.G.Lange′s Handbook of Chemistry,16th ed.;McGraw-Hill Professional Publishing:New York,2005.
Optimized Measurements of lon Transference Number by Moving Boundary Method
WU Shu-Ting*ZHANG Hui-FangTAN Yi-XinZHENG Ou GAO Shao-KangLI YiCHEN Jian-Zhong
(College of Chemistry,Fuzhou University,Fuzhou 350116,P.R.China)
Using the moving boundary method to measure the ion transference number is a basic physical chemistry experiment.To circumvent the shortcomings of chromium electrode in the traditional design,copper electrode was adopted.Comparing with the chromium electrode,replicate measurements showed that copper electrode presented good accuracy with the advantages of lowering the toxicity of electrode materials and the apparatus requirements.
Moving boundary method;Ion transference number;Electrode;Anode material
O64;G64
10.3866/PKU.DXHX20160224
,Email:shutingwu@fzu.edu.cn
教育部本科教学质量工程项目(国家级教学团队,教高函[2008]19号);福州大学本科高等教育教学改革工程;国家基础科学人才培养基金项目(J1103303)

