柚皮素对氧化应激所致成骨细胞凋亡的影响及机制研究
吴新涛 石晶 高乐才 吴新峰 吴文元 庞石磊
·论著·
柚皮素对氧化应激所致成骨细胞凋亡的影响及机制研究
吴新涛石晶高乐才吴新峰吴文元庞石磊
目的观察柚皮素对氧化应激导致的成骨细胞凋亡的影响,并探讨其机制。方法体外分离培养成骨细胞,细胞分空白对照组、单纯H2O2作用组、H2O2+0.1 μmol/L柚皮素组、H2O2+1 μmol/L柚皮素组、H2O2+10 μmol/L柚皮素组。MTT法检测成骨细胞活力;流式细胞术检测成骨细胞凋亡率;荧光显微镜观察活性氧(ROS)含量;比色法检测丙二醛(MDA)含量;Real time-PCR 和Western-blot检测凋亡相关蛋白Bcl-2、Bax、Caspase-3表达情况。结果与空白对照组比较,单纯H2O2处理组细胞活性明显降低,凋亡率及ROS、MDA含量明显增加;同时Bcl-2 mRNA和蛋白表达明显下调,Bax、Caspase-3 mRNA和蛋白表达明显上调(P<0.05)。 与单纯H2O2处理组比较,柚皮素预处理24 h能够明显增强细胞活性,降低细胞凋亡率及ROS、MDA含量,上调Bcl-2 mRNA和蛋白表达,下调Bax、Caspase-3 mRNA和蛋白表达,呈剂量依赖性(P<0.05)。结论柚皮素在氧化应激条件下能够促进成骨细胞增殖,抑制成骨细胞凋亡,其机制与上调Bcl-2表达,下调Bax、Caspase-3表达有关。
柚皮素;成骨细胞;氧化应激;凋亡
近年来,骨质疏松症发病率逐渐升高,已经成为影响人们生活质量的主要疾病之一[1]。传统观点认为雌激素缺乏是骨质疏松症发病的主要原因,然而补充雌激素并未明显改善骨质疏松症。越来越多的研究提出,氧化应激在骨质疏松症发病机制中发挥重要作用[2]。中草药柚皮苷属黄酮类物质,具有抗氧化、保护神经、治疗骨质疏松症等药理作用。柚皮素是柚皮苷的主要代谢产物,体外实验表明柚皮素对大鼠成骨细胞促骨形成活性优于柚皮苷[3,4]。然而,柚皮素促骨形成的具体机制尚不清楚。本研究利用体外培养的成骨细胞,观察柚皮素对成骨细胞增殖、凋亡、活性氧(ROS)、丙二醛(MDA)含量及凋亡相关蛋白Bcl-2、Bax、Caspase-3表达的影响,旨在阐明柚皮素防治骨质疏松症的具体分子机制。
1 材料与方法
1.1材料DMEM-H培养基、胎牛血清购自美国Gibco公司;兔抗鼠 Bcl-2、Bax、Caspase-3、β-actin多克隆抗体购自美国Santa Cruz 公司;细胞裂解液、辣根过氧化物酶标记的羊抗鼠IgG抗体、BCA蛋白浓度测定试剂盒、高灵敏度化学发光检测试剂盒购自北京康为世纪生物科技有限公司;Prime Script TM RT Master Mix(Perfect Real Time)反转录试剂盒购自日本Takara公司;Trizol、实时荧光定量试剂盒购自美国Promega公司。
1.2仪器Chemi DocTM XRS+化学发光凝胶成像系统(Biorad公司);头一回7300 型Real time-PCR扩增仪(美国ABI公司)。
1.3成骨细胞培养参照相关文献报道体外分离培养成骨细胞[5]。新生24 h大鼠处死后,75%乙醇浸泡10 min,无菌手术揭去头皮,分离颅盖骨,去除表面结缔组织,PBS清洗2~3次后置于无血清DMEM培养基中,组织剪剪碎颅盖骨,加入0.25%胰蛋白酶预消化30 min,加入含血清培养基终止消化。加入0.1% Ⅰ型胶原酶消化45 min,加入预冷PBS 终止消化。过滤后的消化液1 000 r/min 离心10 min,弃上清,培养液冲洗细胞,在37℃、5% CO2及饱和湿度条件下,将细胞悬液接种于含10%小牛血清的DMEM-H培养基中培养。待细胞生长至80%融合时根据需要进行相关指标的检测。
1.4观察指标及方法
1.4.1MTT法检测细胞活力:细胞消化后将悬液接种于96孔板中,调整细胞密度为1×104/孔。细胞分5组:空白对照组、单纯H2O2作用组(300 μmol/L)、H2O2+0.1 μmol/L柚皮素组、H2O2+1 μmol/L柚皮素组、H2O2+10 μmol/L柚皮素组。5组细胞均置于37℃、5% CO2培养箱中培养24 h。弃培养液,各组于第1,2,3,4天后每孔加入5 mg/L MTT,37℃孵育4 h,弃上清,每孔加入150 μl DMSO,于570 nm波长处测定吸光度值。
1.4.2流式细胞术检测细胞凋亡:细胞以1×105/孔接种于24孔板,给药1、2、3、4 d后培养48 h,胰酶消化细胞,用标记荧光素FITC的Annexin V和PI染色,1 h 内检测细胞凋亡率。
1.4.3荧光显微镜观察细胞ROS含量:细胞以5×104/孔的密度接种于放有玻片(多聚赖氨酸包被过夜)的24孔板中,给药后培养4 h,加入0.5 mmol/L MPP+培养48 h,之后加入10 μmol/L DCFH-DA,37℃培养箱中孵育20 min。用无血清的DMEM-H培养基洗3次。荧光显微镜拍照并测定荧光强度。
1.4.4比色法测定细胞MDA含量:细胞以2×105/孔的密度接种于6孔板中,给药后预培养4 h,加入 0.5 mmol/L MPP+培养48 h。按照MDA检测试剂盒说明书操作,比色法测定细胞MDA含量。
1.4.5Real time-PCR:Trizol提取细胞总RNA,按照试剂盒说明书加样进行逆转录反应,ABI 7300型荧光定量PCR仪扩增。由上海生工生物工程技术服务有限公司合成。用仪器自带的分析软件得到各样本、各基因扩增的Ct值,以β-actin为内参照基因,目的基因表达相对值RQ=2ΔΔCt。见表1。
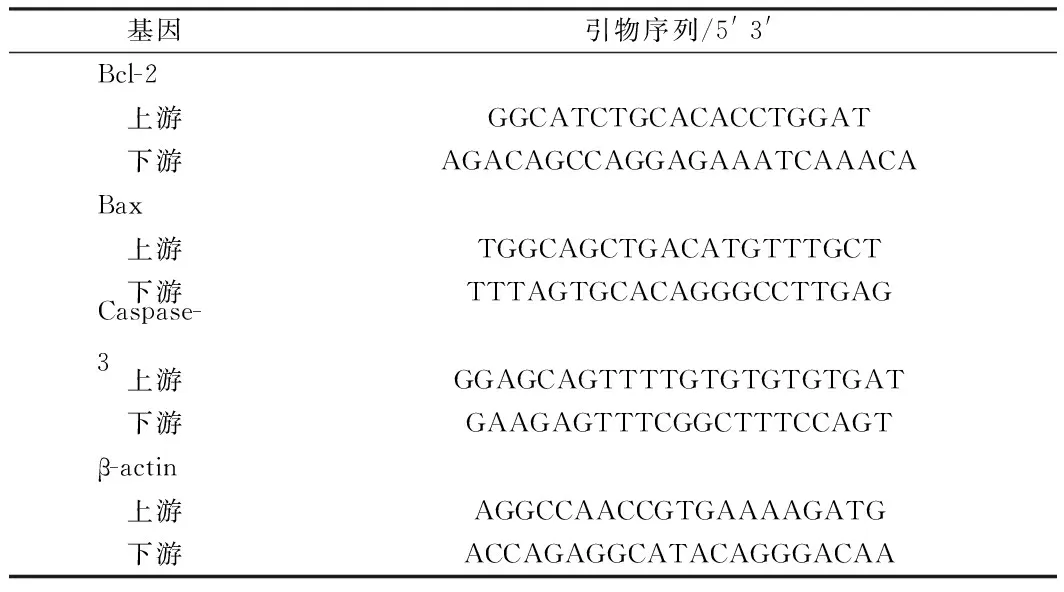
表1 Real time-PCR引物序列
1.4.6Western-blot:提取细胞总蛋白,半干法电泳转移至PVDF膜,10%脱脂奶粉封闭2 h。依次加入特异性一抗和辣根过氧化物酶标记的羊抗鼠IgG,化学发光法显色、定影。用UVP软件扫描测定蛋白条带IOD值,β-actin作为内参照,以目的蛋白与β-actin吸光度值的比值表示目的蛋白相对表达水平。

2 结果
2.1柚皮素在H2O2介导下对成骨细胞增殖的影响与空白对照组比较,单纯H2O2处理组成骨细胞数量明显降低,给予不同剂量柚皮素能够明显增加成骨细胞数量,差异有统计学意义(P<0.05),呈剂量依赖性。见表2。
2.2柚皮素在H2O2介导下对成骨细胞凋亡的影响与空白对照组比较,单纯H2O2处理组成骨细胞凋亡率明显增加,给予不同剂量柚皮素能够明显降低成骨细胞凋亡率,差异有统计学意义(P<0.05),呈剂量依赖性。见表3。
2.3柚皮素在H2O2介导下对成骨细胞氧化应激指标的影响与空白对照组比较,单纯H2O2处理组成骨细胞ROS、MDA含量明显增加,给予不同剂量柚皮素能够明显降低成骨细胞ROS、MDA含量,差异有统计学意义(P<0.05),呈剂量依赖性。见表4。

表2 柚皮素在H2O2介导下对成骨细胞增殖的影响 ±s
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05
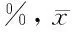
表3 柚皮素在H2O2介导下对成骨细胞凋亡的影响 ±s
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05
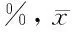
表4 柚皮素在H2O2介导下对成骨细胞氧化应激指标的影响 ±s
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05
2.4柚皮素在H2O2介导下对成骨细胞Bcl-2、Bax表达的影响与空白对照组比较,单纯H2O2处理组成骨细胞Bcl-2 mRNA和蛋白表达水平明显降低,Bax mRNA和蛋白表达水平明显增加,给予不同剂量柚皮素能够明显增加成骨细胞Bcl-2 mRNA和蛋白表达水平,降低Bax mRNA和蛋白表达水平,差异有统计学意义(P<0.05),呈剂量依赖性。见表5、6。


组别Bcl-2mRNABaxmRNA空白对照组2.89±0.432.45±0.32单纯H2O2处理组0.54±0.07*4.79±0.56*H2O2+0.1μmol/L柚皮素组0.97±0.13*#4.25±0.61*#H2O2+1μmol/L柚皮素组1.56±0.25*△3.67±0.52*△H2O2+10μmol/L柚皮素组2.03±0.34*☆2.98±0.43*☆
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05
2.5柚皮素在H2O2介导下对成骨细胞Caspase-3表达的影响与空白对照组比较,单纯H2O2处理组成骨细胞Caspase-3 mRNA和蛋白表达水平明显增加,给予不同剂量柚皮素能够明显降低成骨细胞Caspase-3 mRNA和蛋白表达水平,差异有统计学意义(P<0.05),呈剂量依赖性。见表7。

表6 柚皮素在H2O2介导下对成骨细胞Bcl-2、Bax蛋白表达的影响 ±s
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05

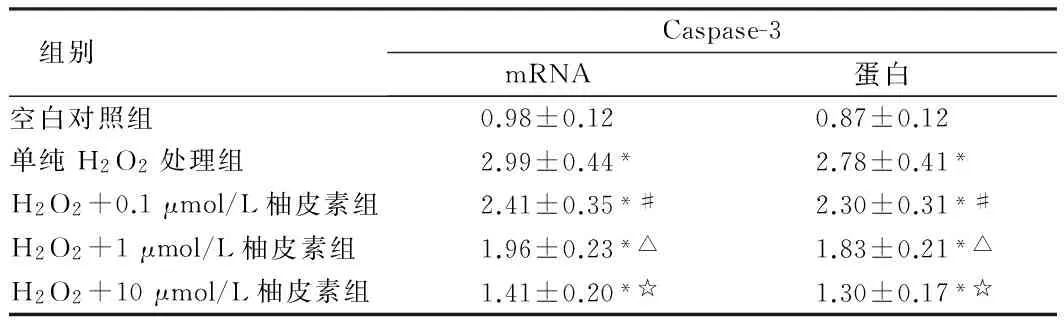
组别Caspase-3mRNA蛋白空白对照组0.98±0.120.87±0.12单纯H2O2处理组2.99±0.44*2.78±0.41*H2O2+0.1μmol/L柚皮素组2.41±0.35*#2.30±0.31*#H2O2+1μmol/L柚皮素组1.96±0.23*△1.83±0.21*△H2O2+10μmol/L柚皮素组1.41±0.20*☆1.30±0.17*☆
注:与空白对照组比较,*P<0.05;与单纯H2O2处理组比较,#P<0.05;与H2O2+0.1 μmol/L柚皮素组比较,△P<0.05;与H2O2+1 μmol/L柚皮素组比较,☆P<0.05
3 讨论
骨质疏松症是由于遗传、环境、雌激素缺乏等因素导致成骨细胞合成新骨不足或破骨细胞吸收旧骨过多的骨平衡过程失衡,最终导致骨骼完整性的破坏、骨量减少、骨密度降低[6]。研究显示,激素、炎性因子、生长因子通过影响成骨细胞和破骨细胞的增殖、分化和成熟影响骨重建过程。近年来多项研究表明,ROS介导的氧化应激在骨质疏松发病机制中占重要地位[7-9]。过多的ROS通过影响细胞因子、酶活性、受体配体的表达水平调控Wnt/β-catenin、PKCβ/p53/p66shc/JNK等信号通路,诱导与骨髓间充质干细胞(BMSCs)、成骨细胞、破骨细胞增殖、分化、凋亡相关基因的表达,最终造成骨吸收速率超过骨形成速率、破骨细胞吸收骨组织和成骨细胞形成骨组织的动态平衡过程失衡及骨质疏松症发生[10]。目前认为,成骨细胞与骨质疏松症发病密切相关,是骨质疏松症治疗领域研究的热点。采用药物干预体外培养的成骨细胞并探讨其分子机制是进行抗骨质疏松症并评价其药效学的重要手段。
Bcl-2家族是影响细胞凋亡的关键因素之一。其中Bcl-2分布于线粒体外膜、内质网上,参与调控与细胞凋亡有关的过程。Hawkins等[11,12]研究显示,Bcl-2过表达通过抑制钙离子跨膜转运、线粒体通透性及通透转换孔的形成,从而抑制凋亡进程。Bax定位于细胞质,是Bcl-2家族中发挥促凋亡作用的重要成员,其中 BH3是Bax发挥促凋亡作用的必须结构域,凋亡信息激活Bax后可通过末端疏水结构域锚固在线粒体膜上,改变线粒体通透性,从而促使细胞色素C、凋亡诱导因子和凋亡蛋白酶激活因子1的释放,进而激活Caspase系统及细胞凋亡进程[13,14]。Caspase-3属于Caspase蛋白家族,是凋亡效应子,能够被上游效应子激活作用于特异性底物,从而造成细胞形态和生化改变。研究发现,中草药柚皮苷能够对骨质疏松小鼠模型发挥一定程度保护作用,而柚皮苷经口服途径进入体内后的主要代谢物为柚皮素。体外实验表明柚皮素对大鼠成骨细胞也具有促骨形成活性,且较柚皮苷有所增加[3,4]。本研究在细胞水平观察柚皮素对氧化应激诱导的成骨细胞增殖、凋亡及凋亡相关蛋白表达的影响,结果显示,柚皮素在氧化应激状态下能够明显促进成骨细胞增殖、抑制成骨细胞凋亡、上调凋亡抑制蛋白Bcl-2 mRNA和蛋白表达、下调凋亡蛋白Bax、Caspase-3 mRNA和蛋白表达(P<0.05),呈剂量依赖性。
综上所述,柚皮素对氧化应激诱导的成骨细胞凋亡具有拮抗作用,其机制与上调Bcl-2表达、下调Bax、Caspase-3表达有关。本研究阐明了柚皮素促进成骨细胞增殖、抑制成骨细胞凋亡的可能机制,这不仅有助于认识骨质疏松症的发病机制,还揭示了中药柚皮素治疗骨质疏松症的分子机制。
1Kaku M,Rocabado JMR,Kitami M,et al.Royal jelly affects collagen crosslinking in bone of ovariectomized rats. Journal of Functional Foods,2014,13:398-406.
2周年,刘波,徐彭.氧化应激与骨质疏松症的研究进展.中国骨质疏松杂志,2014,20:1485-1489.
3Pang WY,Wang XL,Mok SK,et al.Naringin improves bone properties in ovariectomized mice and exerts oestrogen-like activities in rat osteoblast-like (UMR-106) cells.Br J Pharmacol,2010,159:1693-1703.
4Ang ES,Yang X,Chen H,et al.Naringin abrogates osteoclastogenesis and bone resorption via the inhibition of RANKL-induced NF-kappaB and ERK activation.FEBS Lett,2011,585: 2755-2762.
5许勇,陈伟珍,杜宁.槐角苷及染料木素对成骨细胞生物学特性的影响.中西医结合学报,2009,7:223-227.
6刘明,潘薇,陈德才.甲状旁腺激素治疗骨质疏松的研究进展.中华骨质疏松和骨矿盐疾病杂志,2012,5:151-156.
7Manolagas SC.From estrogen-centric to aging and oxidative stress: revised perspective of the pathogenesis of osteoporosis.Endocr Rev,2010,31:266-300.
8Almedia M,O’Brien CA.Basic biology of Skeletal Aging: Role of Stress Response Pathways.J Gerontol A Biol Sci Med Sci,2013,68:1197-1208.
9Almeida M.Aging mechanisms in bone.Bonekey Rep,2012,1:102.
10Monroe DG,McGee-Lawrence ME,Oursler MJ,et al.Update on Wnt signaling in bone cell biology and bone disease.Gene,2012,492:1-18.
11Hawkins BJ,Levin MD,Doonan PJ,et al.Mitochondrial complex II prevents hypoxic but not calcium- and proapoptotic Bcl-2 protein-induced mitochondrial membrane potential loss.J Biol Chem,2010,285:26494-26505.
12Ascens OA,Lumini-Oliveira J,Machado NG,et al.Acute exercise protects against calcium-induced cardiac mitochondrial permeability transition pore opening in doxorubicin-treated rats.Clin Sci (Lond),2011,120:37-49.
13Zeng KW,Liao LX,Zhao MB,et al.Protosappanin B protects PC12 cells against oxygen-glucose deprivation-induced neuronal death by maintaining mitochondrial homeostasis via induction of ubiquitin-dependent p53 protein degradation.Eur J Pharmacol,2015,751:13-23.
14Zhao YX,Cui M,Chen SF,et al.Amelioration of ischemic mitochondrial injury and Bax-dependent outer membrane permeabilization by Mdivi-1.CNS Neurosci Ther,2014,20:528-538.
Effects of naringenin on apoptosis of osteoblasts mediated by oxidative stress and its action mechanism
WUXintao,SHIJing,GAOLecai,etal.
DepartmentofOrthopedics,CangzhouHospitalsofIntegratedTCMandWesternMedicine,Hebei,Cangzhou061001,China
ObjectiveTo observe the effects of naringenin on apoptosis of osteoblasts mediated by oxidative stress, and to explore its action mechanism.MethodsThe osteoblasts were separated and cultured in vitro. The experiment was divided into 5 groups: blank control group,simple H2O2group, H2O2+naringenin low-does group (0.1μmol/L), H2O2+naringenin medium-dose group (1μmol/L) and H2O2+naringenin high-dose group (10μmol/L). The cell viabilities of osteoblasts were detected by MTT assay. The cell apoptosis rates were detected by flow cytometry.The levels of reactive oxygen species (ROS) were observed by fluorescence microscopy. MDA contents were measured by colorimetric technique. The expression levels of Bcl-2, Bax and Caspase-3 mRNA and protein were detected by Real time-PCR and Western Blot,respectively.ResultsAs compared with those in blank control group,the cell viabilities in simple H2O2group were obviously decreased,however, the cell apoptosis rates and the levels of ROS and MDA were significantly increased, meanwhile,the expression levels of Bcl-2 mRNA and protein were obviously down-regulated, however, the expression levels of Bax and Caspase-3 mRNA and protein were significantly up-regulated (P<0.05). As compared with those in simple H2O2group, the cell viabilities in naringenin groups pretreated for 24 hours were obviously increased, and the cell apoptosis rates and the levels of ROS and MDA were significantly decreased,moreover, the expression levels of Bcl-2 mRNA and protein were obviously up-regulated, however, the expression levels of Bax and Caspase-3 mRNA and protein were significantly down-regulated,with a dose-dependent manner (P<0.05). ConclusionNaringenin can promote proliferation of osteoblasts and inhibit apoptosis of osteoblasts mediated by oxidative stress, and its action mechanism may be correlated to up-regulating the expressions of Bcl-2 and down-regulating the expressions of Bax and Caspase-3.
naringenin;osteoblasts; oxidative stress; apoptosis
10.3969/j.issn.1002-7386.2016.19.008
061001河北省沧州中西医结合医院骨科(吴新涛、石晶、高乐才、吴文元、庞石磊);河北省盐山县人民医院外科(吴新峰)
R 681.4
A
1002-7386(2016)19-2915-04
2016-01-17)
项目来源:河北省中医药管理局科研计划项目(编号:2016267)

