基于高通量测序的微生物强化污泥减量工艺中微生物群落解析
宋云龙,张金松*,朱 佳,邵明非,邓仁健
基于高通量测序的微生物强化污泥减量工艺中微生物群落解析
宋云龙1,张金松1*,朱 佳2,邵明非1,邓仁健1
(1.哈尔滨工业大学深圳研究生院,土木与环境工程学院,广东 深圳 518055;2.深圳职业技术学院建筑与环境工程学院,广东 深圳 518055)
利用高通量测序技术对微生物强化原位污泥减量工艺中微生物群落进行解析.结果表明,外源菌剂的投加改变了活性污泥中微生物群落结构,菌剂的有效成分乳杆菌属和醋酸杆属在强化组中含量显著增加.科水平上的群落多样性分析显示:强化组厌氧区Siompson指数、Shannon指数和Pielou指数均不同程度升高,群落多样性增加.聚类分析显示,微生物群落按时间顺序明显聚为3簇,强化组厌氧区微生物群落随时间发生较大演变.主坐标分析显示,强化组和对照组微生物群落明显聚为2类,其厌氧区群落分别按照不同的方向演变,微生物强化和DO降低的协同作用是强化组群落演变驱动力,DO降低是对照组群落演变驱动力.典范对应分析显示显著影响微生物群落结构的环境因子依次为pH值、水温和DO.
高通量测序;微生物强化;水解酸化;群落解析
微生物强化技术在污水处理系统中主要用于去除难降解有机物[1-4],近年来由于我国污泥问题日益严峻[5-7],研究者尝试将微生物强化技术用于污泥的处理处置[8-9].微生物强化原位污泥减量作为一种新兴、高效的污泥减量技术受到广泛关注,并取得了显著的污泥减量效果[10-12],但是由于其减量机理尚不明确,因而尚未得到大范围内推广应用.现有的微生物强化污泥减量机理分析多停留在理化性质层面,而微生物强化对微生物群落结构的影响方面的研究较少.现有微生物群落分析多是依靠PCR-DGGE技术,仅通过电泳图谱中的几十个条带信息对微生物群落多样性进行定性或半定量的分析, 而DGGE技术对于群落中相对丰度低于1%的非优势物种检测效果甚微[13],难以从多个分类层对物种丰度和群落特征进行更全面深入的信息挖掘[14-16].以Illumina测序为代表的第2代高通量测序具有测序成本低、信息采集量大、适用性广等优点,成为近年来应用最广泛的测序技术[17-20],为深度解析活性污泥微生物群落提供了有力的支持.
课题组前期通过投加菌剂的方式对A/O工艺活性污泥进行微生物强化作用,取得了30%左右的污泥减量效果[21].在此基础上,进一步依托高通量测序平台Illumina-HiSeq2000,研究了低污泥浓度工况中外源菌剂的投加对活性污泥微生物群落结构的影响,从群落演变的层面探讨了A/O工艺中微生物强化原位污泥减量的机理,为微生物强化原位污泥减量技术的规模化推广应用提供理论依据.
1 材料与方法
1.1 A/O中试试验
1.1.1 中试装置 装置位于深圳市罗芳污水处理厂,整个系统为两套完全平行且独立运行的A/O工艺中试装置,模拟罗芳污水处理厂一期处理工艺,单台设备处理规模240m3/d,构造如图1所示,其厌氧1区、厌氧2区、好氧1区、好氧2区和沉淀池有效容积分别为12.5,25,22,22,30m3.
1.1.2 试验污水污泥 中试进水取自深圳罗芳污水处理厂一期工程的中间沉淀区,具体水质如下:pH值为6.25~7.68,均值7.03;COD为102~ 334mg/L,均值155mg/L;BOD5为47~135mg/L,均值67mg/L;总氮为21~52mg/L,均值32mg/L;氨氮为13~42mg/L,均值21mg/L;总磷为1.59~ 6.97mg/L,均值3.25mg/L.试验污泥取自深圳罗芳厂一期AA/O工艺好氧区.
1.1.3 菌剂投加及运行方式 菌剂投加量为日处理水量(240m3/d)的万分之四(96kg),投加点为厌氧2区,一次性投加.投加微生物菌剂的称强化组,未投加微生物菌剂称对照组.中试运行条件模拟罗芳污水处理厂的生产工况:反应体系MLSS维持在3500~4000mg/L,好氧区DO维持在3~5mg/L,厌氧区DO维持在0.05~0.15mg/L,污泥回流比为1~1.2,强化组和对照组污泥龄分别为28.04和17.99d,两组HRT均为8.15h,在保证出水达到GB18918-2002[22]规定的一级A标准的前提下尽量减少排泥.
1.2 试验方法
1.2.1 取样 取强化组和对照组厌氧2区的第3,10,21d的活性污泥,相应标记为d3-Y1、d3-Y2、d10-Y1、d10-Y2、d21-Y1、d21-Y2,取强化组和对照组好氧2区的第5、21d的活性污泥,相应标记为d5-H1、d5-H2、d21-H1、d21-H2.活性污泥样品经0.2mm玻璃纤维滤膜过滤后-80℃保存.
1.2.2 检测方法 用FastDNA®土壤试剂盒(MP Biomedicals,Illkirch,France)进行细菌组DNA提取.16S rRNA基因V6区序列采用引物对967F (CAACGCGAAGAACCTTACC)与1046R (CGACAGCCATGCANCACCT)进行扩增[23]. PCR条件:98℃变性2min,然后28个循环(98℃20s,55℃20s, 68℃1min),最后在68℃延伸5min.为减少PCR扩增前期的潜在错误,每DNA样品同步进行2个平行扩增,最后再进行混合与后续分析.扩增后采用2.0%的琼脂糖凝胶电泳对扩增产物进行验证.最后,PCR扩增产物采用纯化试剂盒(天根,北京)进行纯化,并采用光度法(NanoDrop-1000)测定产物浓度后混合样品,保证各样品核酸浓度基本相同.最后采用Illumina- HiSeq2000(深圳华大基因)高通量测序平台测序后进行群落解析.
1.2.3 多样性指数的计算 辛普森多样性指数(Simpson's diversity index,)[24]:
式中:p表示种的个体在群落中的比例;p2表示随机取2个个体为同种的概率.
香浓多样性指数(Shannon-Wiener,¢)[25]:
式中:表示总的物种数;p表示第个种占总数的比例.
Pielou均匀度指数(Pielou's evenness index,)[26]:
式中:¢为香农指数;是¢的最大值.
2 结果与讨论
2.1 微生物强化污泥减量效果及污水处理效能
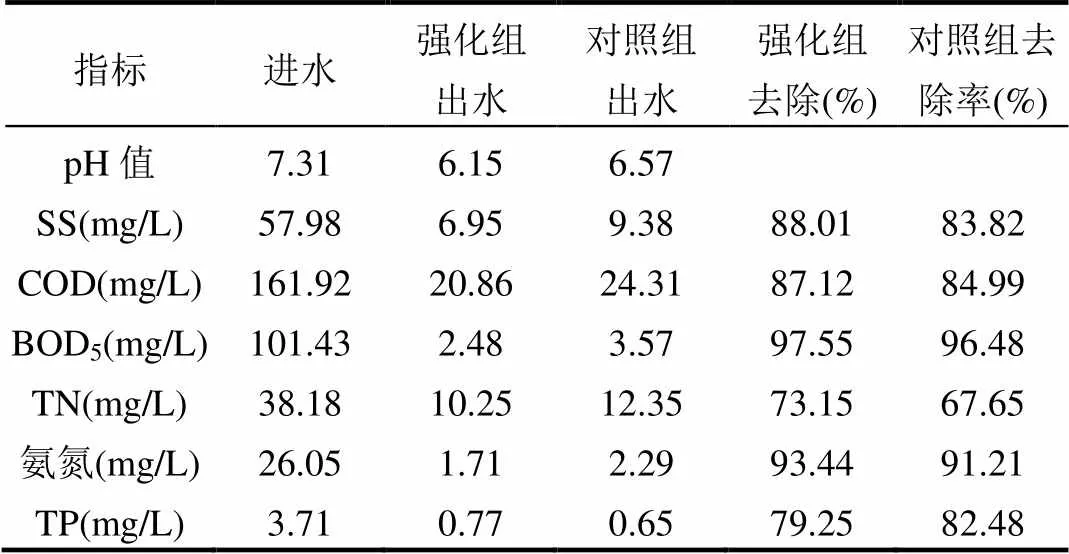
表1 微生物强化污水处理效果 Table 1 Pollutants removal efficiency by bioaugmentation
中试装置有效运行了30d,取得了良好的污泥减量效果.强化组和对照组的MLSS产率分别为0.36,0.49kgMLSS/kgCOD,MLVSS产率分别为0.19,0.26kgMLSS/kgCOD,MLSS和MLVSS减量率分别为26.24%和28.09%.微生物强化污水处理效果见表1,可以看出,投加菌剂后,强化组SS、COD、BOD5、TN、氨氮的去除效果得到不同程度的加强,但TP的去除能力略微下降.强化组和对照组均出水达到GB18918-2002一级A标准.
2.2 高通量测序对微生物群落的鉴定效率
本次测序各样品原始序列数分布比较均匀,除D21-H2较高之外,基本在10000条左右(表2).对原始DNA序列去除了古菌序列,并删除了错误序列,最终将各样品的DNA序列数统一为7341条.之后采用Uclust方法以及0.97的相似度对序列进行聚类,针对聚类获得的OTU采用First方法抽取代表性序列,将代表序列与Greengene数据库进行比对,完成对各OTU的注释.从而将各样本中每条序列鉴定到门、纲、目、科、属、种等不同的分类水平.
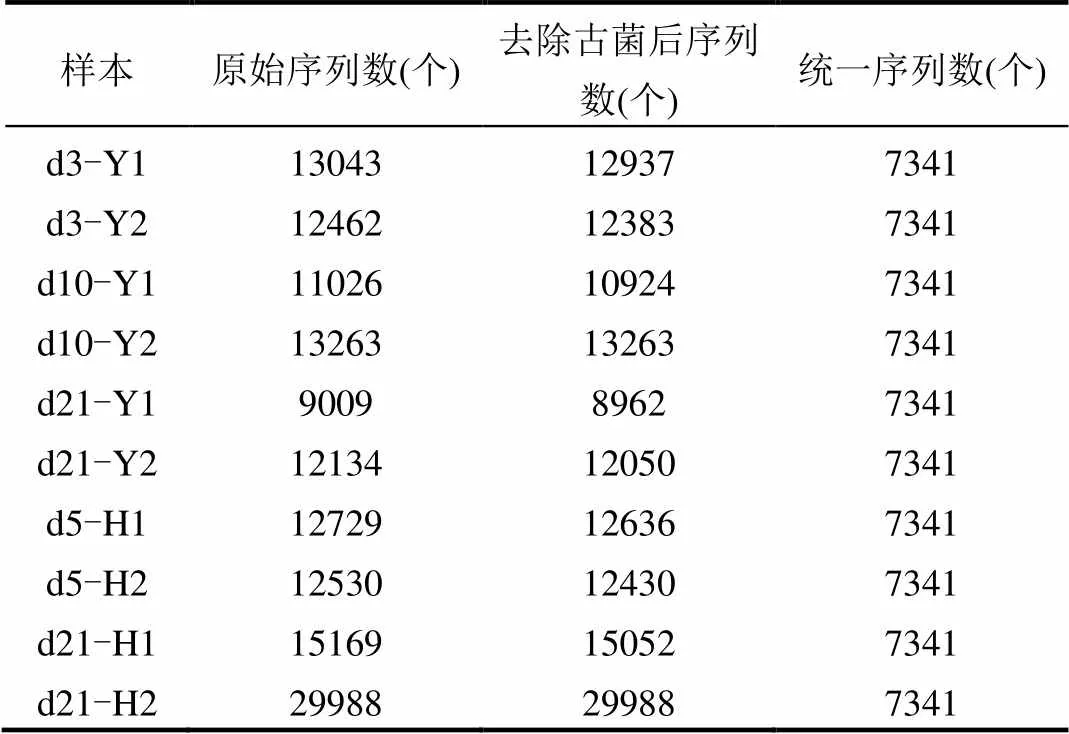
表2 各样品测序深度 Table 2 Sequence depth of each sample
注:可鉴定序列是指本次测序测得序列中与Greengene数据库已知物种序列相似度不低于97%的序列,低含量物种是指比例低于1%的可鉴定序列所对应的物种.
本次测序在门、纲、目、科、属、种水平上的鉴定率分别是98.76%、94.58%、87.56%、82.65%、51.14%和0.69%,在门、纲、目、科水平鉴定结果良好,对属水平也有一定鉴定效率,对种水平鉴定能力较差(表3).
2.3 微生物强化对群落组成的影响
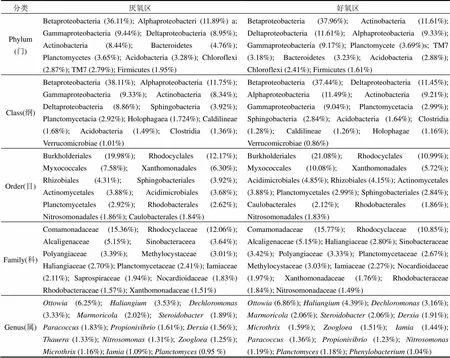
表4列举了A/O中试装置活性污泥中的优势微生物,按照相对丰度降序排列.厌氧区和好氧区在门水平上的优势微生物组成相种类相同,主要有变形菌门(Betaproteobacteria, Alphaproteobacteria, Gammaproteobacteria, Deltaproteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi),且按照丰度排序基本一致;在纲、目水平上,厌氧区和好氧区优势微生物组成相同,但按照丰度排序差异较大;在科、属水平上厌氧区与好氧区微生物组成种类基本相似,腐螺旋菌科(Saprospiraceae)和亚硝化单胞菌科(Nitrosomonadaceae)分别是厌氧区和好氧区的优势科,索氏均属(Thauera)和苯基杆菌属(Phenylobacterium)分别是厌氧区和好氧区的优势属;厌氧区和好氧区的各科属微生物丰度差异较大.
注:( )内为相对丰度.
微生物菌剂中最多的是厚壁门(Firmicutes),占细菌总数的53.48%,其次是变形门(Proteobacteria),占细菌总数的46.38%,其中对污泥水解酸化具有强化作用的主要是乳杆菌属()和醋酸杆菌属().乳杆菌属属于厚壁门(Firmicutes)、杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、乳杆菌科(Lactobacillaceae),醋酸杆菌属属于厚壁门(Firmicutes)、梭菌纲(Clostridia)、梭菌目(Clostridiales)、真杆菌科(Eubacteriaceae).乳杆菌属是异养菌,耐酸性,能发酵分解糖代谢,终产物中50%以上是乳酸[27],在污水污泥处理中有广泛的应用.Vellingiri等[28]利用驯化培养的嗜酸乳杆菌降解生活污水中总悬浮固体,同时对COD和BOD5都有很好的降解效果.Oh等[29]通过向厌氧发酵罐接种乳酸杆属强化初沉污泥水解酸化,SCOD增加59%以上,同时产生了醋酸、乳酸、丙酸、丁酸和戊酸等多种有机酸.醋酸杆菌属也是一类化能异养菌,耐酸性,能将乙醇氧化成醋酸,并可将醋酸和乳酸氧化成CO2、水和H2等[30].两种菌属在污水处理过程中的有机物水解酸化过程中都扮演着重要角色,常用作复合微生物菌剂的主要成分[31-32].对中试装置活性污泥高通量分析结果显示,第3,10,21d的强化组(对照组)厌氧区变形门分别为67.95%(64.71%)、66.96%(77.44%)、64.56%(74.66%),厚壁门分别为0.91%(1.37%)、2.39%(1.42%)、3.04%(2.01%).微生物强化使强化组的厚壁门含量增加了2倍多,变形门的增长受到抑制.属水平上第3,10,21d的强化组(对照组)厌氧区醋酸杆属相对丰度分别为3%(2%)、7%(2%)、8%(3%),乳杆菌属相对丰度分别为5%(3%)、10%(4%)、9%(3%).可见菌剂中的功能组分在强化组中都显著增长,并对活性污泥水解酸化起到了强化作用.
群落解析结果越接近真实,综合考虑分类层次和鉴定率,对科水平的数据进行深入解析.图2反映了A/O中试装置厌氧区和好氧区不同运行阶段的科水平的微生物群落组成,活性污泥中科水平微生物群落结构变化明显.强化组和对照组的厌氧区中高含量物种的总比例变化差明显.所占比例分别是71.80%、72.10%和69.99%,呈现出稳中微降的变化趋势;对照组高含量物种第3,10,21d所占比例分别是73.75%、75.03%和75.30%,呈现逐步升高的变化趋势.这说明外源菌剂的投加改变了强化组厌氧区微生物组成和分布.具体的,Comamonadaceae是A/O装置活性污泥中含量最多的微生物,强化组中的Comamonadaceae由第3d的15.49%降到第21d的12.23%,而对照组中Comamonadaceae基本不变;强化组中Sinobacteraceae由5.03%降低至3.01%,对照组Sinobacteraceae基本恒定;同样还有Alcaligenaceae、Haliangiaceae、Polyangiaceae和Saprospiraceae等在强化组中都明显减少,在对照组中基本不变.其中Alcaligenaceae是一类产碱的好氧菌,它在强化组中含量的减少,是由于外加菌剂中的乳酸杆菌和醋酸杆菌等酸性菌在强化污泥水解酸化时降低了体系的pH值,通过种间竞争的方式抑制了Alcaligenaceae的增殖.Nitrosomonadaceae是亚硝化单胞菌科,在有机氮转变成硝酸盐的过程中起着重要作用.Nitrosomonadaceae变化规律说明强化组对蛋白质等有机氮分解能力明显要强于对照组,这也是强化组的脱氮效果由于对照组的原因.
综上所述,菌剂中的微生物投加到活性污泥后通过两方面作用强化污泥减量,一是菌剂中乳杆菌属和醋酸菌属等功能微生物自身直接与污泥发生作用,强化了污泥水解酸化,减少污泥产量,二是通过分泌胞外物质(如抗生素)直接作用或通过改变生存环境(如pH值)等方式间接作用,促进或抑制反应体系中其它微生物的生长,改变原活性污泥中的微生物群落结构,影响了污泥产量.
2.4 微生物强化对群落多样性的影响
多样性指数和均匀度指数是反映微生物群落变化的综合量度,Siompson指数反映了群落内微生物多样性的概率,Shannon指数反映了群落多样性的高低,Pielou指数反映了群落的均匀程度,三者均是指数越大,微生物分布越均匀,多样性越高[24-26].图3反映了科水平上的微生物群落多样性变化,强化组厌氧区的Siompson指数随着运行天数增加而升高,由第3d的13.07升高到第21d的14.42,增加了10.33%,而对照组厌氧区的Siompson指数则是先降低后回升,到第21d变为11.91,各个时期Siompson指数均是强化组高于对照组;好氧区Siompson指数则是强化组降低,对照组升高,强化组Siompson指数均低于对照组.强化组厌氧区Siompson指数升高是由于外加菌剂中多种外源微生物的加入增加了其微生物的种类,并改变了各微生物相对含量;而对照组Siompson指数降低则是因为体系中活性污泥取自罗芳污水厂好氧池,进入中试装置厌氧区后由于pH值、DO和营养物质等生活条件的差异导致微生物群落发生小幅度调整,多样性降低.好氧区Siompson指数变化规律相反,这是因为菌剂中的功能微生物多是厌氧或兼性厌氧微生物,在好氧区难以大量增殖,对其多样性影响甚微. Shannon指数变化规律与Siompson指数相似.厌氧区的Pielou指数变化规律与Siompson指数相似,而两组好氧区Pielou指数波动较小,无明显差异.本试验微生物菌剂主要投加到厌氧区,其有效微生物经过适当时间的增殖并与土著微生物充分作用,抑制了部分土著微生物的增殖,使得强化组厌氧区多样性升高,由此改变微生物群落结构,增加了水解酸化菌的含量,并强化反应器中活性污泥的水解酸化,从而达到污泥减量的目的.
2.5 微生物强化对群落演变的影响
通过聚类分析研究了厌氧区和好氧区不同时期的微生物群落相似性(图4),发现活性污泥微生物群落在时间尺度上发生明显的演变,第3d和第5d的样品聚为一类,第10d和第21d的样品聚为一类,特别的,第 21d强化组厌氧区独成一类.空间尺度上强化组和对照组对比来看,其厌氧区变化差异明显:第3d的强化组和对照组距离最近,相似性最高;对照组第10d和第21d位于中间一支,与对照组第3d相比形成一定分化,d3-Y2与d21-Y2的差异为0.035;强化组厌氧区第3,10, 21d分别位于3个不同支,距离最远,差异最大, d3-Y1与d21-Y1的差异为0.13;第21d时强化组和对照组群落差异达到0.09.这说明相对于对照组厌氧区,强化组厌氧区落随时间的推移发生了更为明显的演变,而外源微生物强化正是这种群落变化的驱动力.
对厌氧区和好氧区不同时期的微生物群落进行了主坐标分析,由图5可知,强化组和对照组厌氧区的群落明显分为2个区域,对照组群落沿着坐标1方向演变,而强化组群落是沿着坐标1和坐标2对角线方向演变,并且强化组的演变梯度是对照组的近2倍.强化组和对照组污泥和进水来源相同,中试运行工况如DO、pH值、MLSS等均保持一致,有无菌剂投加是二者唯一的差异,因此可知微生物强化是强化组微生物群落沿着不同于对照组方向进行演变的主要因素.对照组活性污泥由罗芳厂一期AA/O工艺好氧区引入到中试装置后,该好氧污泥在对照组厌氧区由于DO等工艺参数的改变,其中微生物群落随之发生演变,即DO的降低(由3~5mg/L降低为不足0.5mg/L)是微生物群落沿坐标1方向的演变驱动力.而微生物强化是微生物群落沿坐标2方向的演变驱动力,强化组微生物群落在2个驱动力综合作用沿坐标1和坐标2对角线方向演变,并且箭头更靠近坐标2,说明微生物强化的驱动作用更强.两组好氧区的微生物群落在坐标1方向上演变较大,对照组在坐标2方向上基本无变化,强化组在坐标2方向上有小幅演变,这是因为微生物菌剂的有效组分是厌氧和兼性厌氧微生物,在好氧区无法大量繁殖,难以正常发挥作用.
选取水温、pH值、DO和SCOD、TP、TN、氨氮、硝酸盐氮8个指标,通过典范对应分析(Canonical Correspondence Analysis, CCA)研究科水平上微生物群落演变的关键影响因子.F1和F2的特征值分别为0.056和0.033,其解释率分别为48.12%和28.43%,总解释率为76.55%.pH值是微生物群落演变的最关键影响因子,其次是水温和DO,而SCOD、TP、TN、氨氮、硝酸盐氮的影响相对微弱.pH值的影响最大,说明外加菌剂的微生物强化通过影响强化组活性污泥pH值这一生存环境来改变期微生物群落演替方向,使得更多的水解酸化细菌在较低pH值环境中充分繁殖,强化了对活性污泥的水解酸化作用,达到污泥减量的目的.由于试验是在12月末到1月期间进行,水温波动幅度较大(8.9~17.9℃),对微生物群落演变产生较大影响.厌氧区DO为0.05~ 0.13mg/L,好氧区DO为3.09~3.75mg/L,DO的影响主要体现在厌氧区和好氧区微生物群落差异上.
3 结论
3.1 微生物强化使A/O中试装置的MLSS和MLVSS分别减少了26.26%和28.08%,有效减少了剩余污泥产量.强化组的SS、COD、BOD5、TN和氨氮等污染物的去除率增加,但总磷的去除率略微降低,出水水质可稳定达到一级A标准.
3.2 高通量测序对活性污泥微生物群落在门、纲、目、科水平鉴定结果良好,属水平上也有一定鉴定效率,种水平的鉴定效果较差.微生物菌剂主要成分是厚壁门的乳杆菌属和醋酸杆菌属,微生物强化使强化组活性污泥中厚壁门增加了2倍,乳杆菌属和醋酸菌属在活性污泥中属于低含量菌属,二者在对照组中含量基本不变,在强化组含量明显上升.
3.3 微生物强化使强化组厌氧区Siompson指数、Shannon指数和Pielou指数均不同程度升高,群落多样性增加.聚类分析显示微生物群落按时间顺序明显聚为3簇,强化组厌氧区微生物群落随时间发生较大演变.主坐标分析显示强化组和对照组群落明显聚为2类,其厌氧区群落分别按照不同的方向演变,微生物强化和DO降低的协同作用是其演变的推动力.典范对应分析显示显著影响微生物群落结构的环境因子依次为pH值、水温和DO.
3.4 微生物强化使得活性污泥微生物群落结构发生明显变化,菌剂通过直接与污泥作用强化污泥水解酸化,或通过改变生存环境(如pH值)等方式间接作用,促进或抑制反应体系中其它微生物的生长,改变原活性污泥中的微生物群落结构,减少污泥产量.
-chloroaniline slows bacterial species turnover rate in bioreactors [J]. Water Research, 2013,12,(47):7109-9119.
陈 雄,韦祎旸,李辉信,等.附着剑菌对三氯联苯的吸附及降解机制研究 [J]. 中国环境科学, 2015,35(5):1423-1428.
Chang L K, Ibrahim D, Omar I C. A laboratory scale bioremediation of Tapis crude oil contaminated soil by bioaugmentation of Acinetobacter baumannii T30C [J]. African Journal Of Microbiology Research, 2011,9(5):2609-2615.
侯 颖,王 飞,董维亮,等. Rhodococcus sp. T3-1菌株降解乙草胺的特性 [J]. 中国环境科学, 2013,33(10):1785-1790.
Zhu L L, Qiu L P, Zhang L X. Challenge and Development of Sludge Treatment and Disposal in China [J]. Applied Mechanics and Materials, 2014,8,(675-677):665-668.
Wang S B. Sludge Management and Its Development in China [J]. Applied Mechanics and Materials, 2013,11,(665-668):1299- 1302.
Vega E M, Hector G O. Optimizing chemical conditioning for odour removal of undigested sewage sludge in drying processes [J]. Journal Of Environmental Management, 2015,3(150):111- 119.
Murugesan K, Selvam A. Flocculation and dewaterability of chemically enhanced primary treatment sludge by bioaugmentation with filamentous fungi [A]. International Conference on Solid Waste-Innovation in Technology and Management[C]. 2014,9(168):198-203.
Wang Y, Qu P C H, Peng D C. Hydrolysis of excess sludge by bioaugmentation and nutrient removal from supernatant with low cost [C]//Proceedings of the 2011 International Conference on Remote Sensing, Environment and Transportation Engineering, 2011,6:4096-9.
李 俊.微生物菌剂对污水处理厂污泥减量的影响研究 [D]. 重庆:西南大学, 2008.
张海珍.MCMP-II多功能复合微生物制剂用于城市污水处理厂污泥减量的生产性试验研究 [D]. 重庆:重庆大学, 2008.
黄黎明.微生物制剂IBC强化SBR处理系统的研究 [D]. 广州:华南理工大学, 2012.
Muyzer G, Dewaal EC, Uitterlinden AG. Profiling of complex microbial-populations by denaturing gradient gel-electrophoresis analysis of polymerase chain reaction-amplified genes-coding for 16S ribosomal-rna [J]. Applied And Environmental Microbiology, 1993,59(3):695-700.
赵 鑫,刘一威,李晓东,等.微生物复合菌剂法污泥原位减量群落动态研究 [J]. 哈尔滨工程大学学报, 2015,36(3):839-845.
薛圆圆,孙宝盛,杜 江,等.贫营养条件下IAMBR污泥微生物群落结构的演变 [J]. 中国环境科学, 2015,35(3):839-845.
陈 燕,刘国华,范 强,等.不同溶解氧条件下A/O系统的除碳脱氮效果和细菌群落结构变化环境科学, 2015,36(7): 2610-2616.
Reuter J A, Spacek D V, Snyder M P. High-Throughput Sequencing Technologies [J]. Molecular Cell, 2015,3(58):586- 597.
Picard C, Fischer A l. Contribution of high-throughput DNA sequencing to the study of primary immunodeficiencies [J]. European Journal of Immunology, 2014,10(44):2854-2861.
Georgiou G, Ippolito G C. Beausang J. The promise and challenge of high-throughput sequencing of the antibody repertoire [J]. Nature Biotechnology, 2014,2,(32):158-168.
McAdam P R, Richardson E J, Fitzgerald J. High-throughput sequencing for the study of bacterial pathogen biology [J]. Current Opinion in Microbiology, 2014,6,(19):106-113.
佳,宋云龙,张金松,等.基于微生物强化的原位污泥减量中试研究 [J]. 给水排水, 2014,40(8):37-43.
GB18918-2002 城镇污水处理厂污染物排放标准 [S].
Turnbaugh P J, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins [J]. Nature, 2009,457(7228): 480–487.
Simpson E H. Measurement of diversity [J]. Nature, 1949, 163:688.
Hill M O. Diversity and evenness: a unifying notation and its consequences [J]. Ecology, 1973,54:427-431.
Pielou E C. The measurement of diversity in different types of biological collections [J]. Journal of Theoretical Biology, 1966, 13:131-144.
Zhang, Y X, Vadlani P V. Lactic acid production from biomass-derived sugars via co-fermentation of Lactobacillus brevis and Lactobacillus plantarum [J]. Journal of Bioscience and Bioengineering, 2015,6(119):694-699.
Vellingiri K, Ramachandran T. Isolation and Purification of Lactobacillus Acidophilus and Analyzing its Influence on Effluent Treatment [J]. International Journal of Engineering and Technology Innovation, 2015,1(5):66-74.
Oh M H, Lee, S M, Hong S H. Monitoring of Lactobacillus sp inoculated in the reactor to evaluate the solubilization efficiency of primary sludge [J]. International Biodeterioration & Biodegradation, 2013,11(85):603-607.
Demler M, Weuster-Botz D. Reaction Engineering Analysis of Hydrogenotrophic Production of Acetic Acid by Acetobacterium woodii [J]. Biotechnology and Bioengineering, 2011,2(108):470- 474.
YIN S, LI S. Ethanol-tolerant acetogenic microorganism composite bacteria used for anaerobic fermentation of medicine residue alcohol comprises Acetobacterium carbinolicum, Clostridium irregularic, Clostridium cellobioparum, and Clostridium glycolicum: China, 103555638-A [P].
Fan H, Qu H, Zhang L. Complex microbial agent useful for treating wastewater, contains Rhodopseudomonas palustris, Acetobacterium, Bacillus subtilis, Metallosphaera sedula, Metallosphaera prunae, Nitrosomonas, Lactococcus, and Flavobacterium: China, 104195090-A [P].
* 责任作者, 教授, zhangjinsong@waterchina.com
Analysis of microbial community in in-situ sludge reduction process by bioaugmentation using high-throughput sequencing technology
SONG Yun-long1, ZHANG Jin-song1*, ZHU Jia2, SHAO Ming-fei1, DENG Ren-jian1
(1.School of Civil and Environment Engineering, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China;2.School of Civil and Environmental Engineering, Shenzhen Polytechnic, Shenzhen 518055, China). China Environmental Science, 2016,36(7):2099~2107
High-throughput sequencing was used to parse the microbial community of activated sludge in an in-situ sludge reduction process. Microbial community structure shifted dramatically as the result of bioaugmentation. The abundance of and increased significantly in bioaugmentation group. Community diversity indices including Simpson index, Shannon index and Pielou index rised at different degrees in anaerobic zone of bioaugmentation group. Cluster analysis indicated that microbial communities were obviously grouped into three clusters in chronological order. In anaerobic zone of bioaugmentation group, the community structure shifted more obviously over time. Through principal coordinate analysis, communities of bioaugmentation group and control group were grouped into two distinct areas. Synergistic efforts of bioaugmentation and DO reduction were the driving forces of community shift in bioaugmentation group, while DO reduction was the driving force in control group. Canonical correspondence analysis showed that pH, water temperature and DO were the dominant environmental factors, which affected the microbial community structure significantly.
high-throughput sequencing;bioaugmentation;hydrolytic acidification;microbial community analysis
X172
A
1000-6923(2016)07-2099-09
宋云龙(1983-),男,山东威海人,哈尔滨工业大学博士研究生,主要从事污泥减量及其资源化利用的研究.
2015-11-06
国家高技术研究发展计划(863计划)项目(2009AA064704)

