凋亡诱导因子在阿尔茨海默病患者大脑中的表达及意义*
杨 梅, 任真奎, 禹文峰, 官志忠
(贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
·专题研究·
凋亡诱导因子在阿尔茨海默病患者大脑中的表达及意义*
杨梅, 任真奎, 禹文峰**, 官志忠
(贵州医科大学 分子生物学重点实验室, 贵州 贵阳550004)
目的: 了解凋亡诱导因子(AIF)在阿尔茨海默病患者(AD)脑组织中的表达及亚细胞分布。方法: 7例AD患者(AD组)和7例正常老年人(对照组)大脑组织标本,采用免疫组织化学染色法,记录并比较被检脑组织海马CA1、CA2、CA3、DG、内嗅皮质浅层(EC Ⅰ~Ⅲ)和深层(EC Ⅳ~Ⅵ)以及颞叶浅层(TC Ⅰ~Ⅲ)和深层(TC Ⅳ~Ⅵ)区AIF蛋白阳性表达细胞数,计算AIF总评分和AIF核转移分比。结果: 与对照组比较,AD组AIF蛋白在海马CA1、DG以及ECⅠ~Ⅲ区表达显著升高(P<0.05),在海马CA2、CA3、EC Ⅳ~Ⅵ及TC Ⅳ~Ⅵ区的表达无明显变化(P>0.05);AD组AIF细胞核转移分比在海马的CA1、CA2、CA3、DG区,内嗅皮质和颞叶皮质均显著高于对照组(P<0.05)。结论: AIF的细胞核转移可能是AD患者大脑中发生神经细胞凋亡的重要病理因素之一。
阿尔茨海默病; 脑; 海马; 细胞凋亡; 凋亡诱导因子
[Abstract]Objective: To explore the expression and subcellular distribution of apoptosis inducing factor(AIF) in the brain of patients with Alzheimer's disease(AD). Methods: Brain tissue were collected from 7 cases of AD patients(AD group) and 7 cases of healthy old people as controls(control group). Immunohistochemical staining was adopted to record the cell number of AIF protein positive expression in hippocampal CA1, Ca2, CA3 and DG area, in entorhinal cortex shallow layer (EC Ⅰ~Ⅲ) and deep layer(EC Ⅳ~Ⅵ) and temporal lobe shallow layer (TC Ⅰ~Ⅲ) and deep layer (TC Ⅳ~Ⅵ). The AIF total score and AIF nuclear transfer ratio were calculated and compared between the two groups. Results: Compared with control group, AIF expression in hippocampal CA1, DG and EC Ⅰ~Ⅲ area increased significantly in AD group(P<0.05) while AIF expression showed no significant change in CA2, CA3, EC Ⅳ~Ⅵ and TC Ⅳ~Ⅵ area in AD group(P>0.05). Compared with control group, AIF nuclear transfer ratios in hippocampal CA1, Ca2, CA3, DG area, entorhinal cortex layer and temporal lobe layer were significantly higher in AD group (P<0.05). Conclusion: The nuclear transfer of AIF may be one of the important pathological factors of neuronal apoptosis in the brain of AD patients.
[Key words]Alzheimer's disease; brain; hippocampus; apoptosis; apoptosis-inducing factor
阿尔茨海默病(Alzheimer’s disease,AD)是一种以进行性记忆和认知功能障碍为特征的中枢神经系统退行性疾病(Re),主要病理变化有大脑老年斑(senile plaque, SP)、神经纤维缠结(neurofibrillary tangles,NFTs)以及大量神经细胞丢失[1]。神经细胞丢失有凋亡、坏死和自噬3种方式,而AD大脑中神经细胞的丢失,则以凋亡为主[2]。细胞凋亡有2条途径,一条需要Caspase和Bcl家族参与,称为Caspase依赖性细胞凋亡;另一条不依赖于Caspase,称为非Caspase依赖性细胞凋亡。目前,对Caspase 依赖性细胞凋亡通路的分子机制已经有了比较明确的认识,但对非Caspase依赖性细胞凋亡通路的分子机制尚不明确。凋亡诱导因子(apoptosis inducing factor,AIF)是首个被发现的非Caspase依赖性细胞凋亡通路的执行分子,它在各种组织中广泛表达。研究证实,AIF的异常表达与诸多疾病均有相关性[3~8]。在正常生理条件下,AIF局限在线粒体膜,仅在线粒体表达;但在病理条件下,AIF从线粒体内膜上代偿性释放并转移至细胞核内,在细胞核内表达,出现AIF核转移。关于AIF在AD中的表达鲜有报道,其参与神经元细胞凋亡的具体机制亦不明确,本研究通过检测AD患者脑组织中AIF的表达情况,研究AIF和AD病理变化间的关系。
1 材料与方法
1.1样本
本研究得到加拿大魁北克省麦吉尔大学附属道格拉斯神经研究所伦理研究委员会的批准,人脑组织来源于加拿大魁北克脑库,已完成前期处理和Braak分期。患者死亡后运送至魁北克脑库尸检取样,左半球冰冻切成5 mm厚片, -80 ℃保存,右半球福尔马林固定,再分离海马、内嗅皮质、颞叶进行石蜡包埋备用。
1.2方法
1.2.1分组将7例AD病人的脑组织标本作为AD组,7例正常老年人的脑组织标本作为对照组。AD组男性5例,女性2例,年龄71~92岁,死亡到尸检时间(PMI)7.5~32 h,病人具有典型的神经病理学损害,Braak分期β-淀粉样蛋白聚集为C阶段,神经纤维的缠结为Ⅱ~Ⅵ;对照组男性3例,女性4例,年龄60~85岁,PMI为7.25~32.75 h,无痴呆病史,无脑神经病变,无完整的β-样淀粉蛋白聚集斑块和神经纤维的缠结。2组被检者性别、年龄和PMI比较,差异无统计学意义(P>0.05),具有可比性。
1.2.2免疫组织化学染色取海马、内嗅皮质、颞叶部位的组织石蜡包埋块,每个部位选取5个区域,连续做10张切片,并标明序号。脱蜡,TBS(Tris-HCl缓冲盐溶液)漂洗3次,5 min/次,滴加1%过氧化氢孵育30 min,以清除内源性过氧化物酶的活性。TBS漂洗3次,5 min/次,再放入煮沸的0.05 mol/L柠檬酸盐缓冲液中修复抗原。TBS漂洗3次,5 min/次,10%的山羊血清室温下封闭1 h,取相邻两张切片分别孵育一抗,用TBS做一张阴性对照,其他相邻的两张切片分布孵育1∶1 000的AIF兔抗人多克隆抗体(氨基酸593~613,Sigma,美国)以及1∶500的鼠单克隆抗NeuN抗体(Millpore,美国),4 ℃冰箱内孵育过夜(14~18 h)。TBS漂洗3次,5 min/次,滴加1∶200的二抗,羊抗兔或羊抗鼠IgG(Vector,美国),室温下孵育60 min,TBS漂洗3次,5 min/次,滴加已放置30 min的ABC复合物反应30 min,TBS漂洗3次,5 min/次,根据说明书加入DAB液(Vector,美国)显色3 min。蒸馏水冲洗5 min后,乙醇70%,90%,100%分别脱水5 min,二甲苯透明3次,1 min/次,中性树胶封片。
1.2.3结果判定通过数码相机连接Nikon Eclipse800显微镜获取图像。拍摄海马的CA1、CA2、CA3和DG、内嗅皮质(entorhinal cortex,EC)浅层(EC Ⅰ~Ⅲ)和深层(EC Ⅳ~Ⅵ)区以及颞叶(Temporal cortex,TC)浅层(TC Ⅰ~Ⅲ)和深层(TC Ⅳ~Ⅵ)区,参照文献[9]方法每个区域选取5个阳性区进行图像采集,用Image j软件计数AIF在不同位置表达的细胞数,计算AIF总评分和AIF核转移的百分比。(1)AIF总评分:按照文献[10-11]进行染色程度评分和AIF阳性细胞百分比评分,染色程度评分为未检测到AIF表达定义为0分,切片中AIF阳性细胞免疫染色低、中、强定义为1、2及3分;AIF阳性细胞百分比评分为切片AIF阳性细胞数量/相邻切片相应位置NeuN染色的神经元数量=AIF阳性细胞百分比,百分比0%~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3,76%~100%为4分;染色程度评分×AIF阳性细胞百分比评分,为0~12的AIF总评分。(2)AIF核转移的百分比=切片上细胞核染色阳性神经细胞数目/AIF细胞染色阳性的总数。
1.3统计学分析
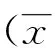
2 结果
2.1AIF评分
AIF主要在人脑组织的神经元细胞中表达。与对照组比较,AD组海马的CA1、DG以及EC Ⅰ~Ⅲ区,AIF评分显著升高(P<0.05),在海马CA2、CA3、EC Ⅳ~Ⅵ以及TC Ⅳ~Ⅵ区的表达无明显变化(P>0.05)。见图1、表1。
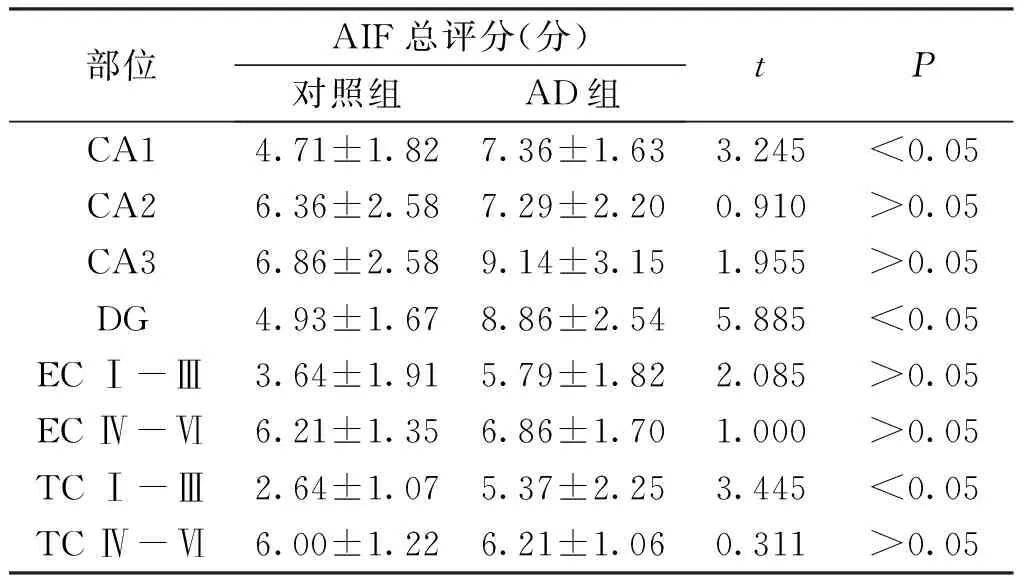
表1 两组被检者海马、内嗅皮质及颞叶皮质的AIF评分
2.2AIF核转移百分比
与对照组比较,AD组在海马CA1、CA2、CA3、DG、EC和TC的AIF细胞核转移百分比升高(P<0.05),见图2和表2。

表2 两组被检者海马各区、EC及TC的AIF核转移百分比
3 讨论
AD的主要病理变化是神经细胞外β-淀粉样蛋白聚集形成的老年斑,胞内Tau蛋白异常磷酸化形成的神经纤维缠结,以及颞叶和海马等部位大量神经元细胞丢失等。神经元细胞丢失到一定程度,便会损伤脑的功能[12]。大量的尸检报告中均发现AD脑组织中有明显的神经细胞凋亡现象。神经元细胞丧失在海马的CA1区达20%,在海马回中的EC达50%~60%,大脑TC处达50%[13]。AIF是一种具有凋亡诱导活性的蛋白质,其前体蛋白分子量为67 kDa,AIF成熟蛋白是分子量大小为62 kDa位于镶嵌在线粒体内膜的蛋白[14-15]。在正常生理条件下,AIF局限在线粒体膜之间,拥有核黄素结合域而具有氧化还原酶活性,可与FAD结合,参与氧化还原和清除呼吸机相关产生的自由基[16]。而在病理条件下,由于线粒体外膜病理通透性,成熟AIF进一步通过激活钙蛋白酶和/或组织蛋白酶加工成57 kDa的形式[17],从线粒体内膜上代偿性释放并转移至细胞核内,选择性地破坏大分子量的DNA核酸分子,导致细胞死亡。
AIF主要在脑组织的神经元细胞中表达。AIF评分的高低,取决于AIF免疫组化染色强度及AIF阳性细胞数占总的神经细胞数的百分比。本结果显示,与对照组比较,AD组海马的CA1、DG以及TC的Ⅰ-Ⅲ区,AIF评分显著升高(P<0.05),在海马CA2、CA3、EC和TC Ⅳ-Ⅵ区的表达无明显变化(P>0.05);这与文献报道[18]。 AIF参与了整个AD的病理过程,它的高表达具有双重作用,一方面可代偿性的对抗AD的病理性变化,比如对抗氧化应激和清除呼吸机产生的相关自由基;另一方面,AIF又可引起AD的氧化应激,AIF能促进凋亡的发生[18-21]。AD组在海马CA1、CA2、CA3、DG、EC和TC区的AIF细胞核转移百分比升高(P<0.05),说明在AD组和对照组各部位分区均出现了差异性,这也进一步证实了在AD的大脑神经细胞中发生了AIF核转移,AIF的核转移和AD的病理改变具有相关性,AIF从线粒体到细胞核的异位表达,导致神经细胞死亡,AIF是AD大脑中神经细胞丢失的重要病理因子之一[18]。
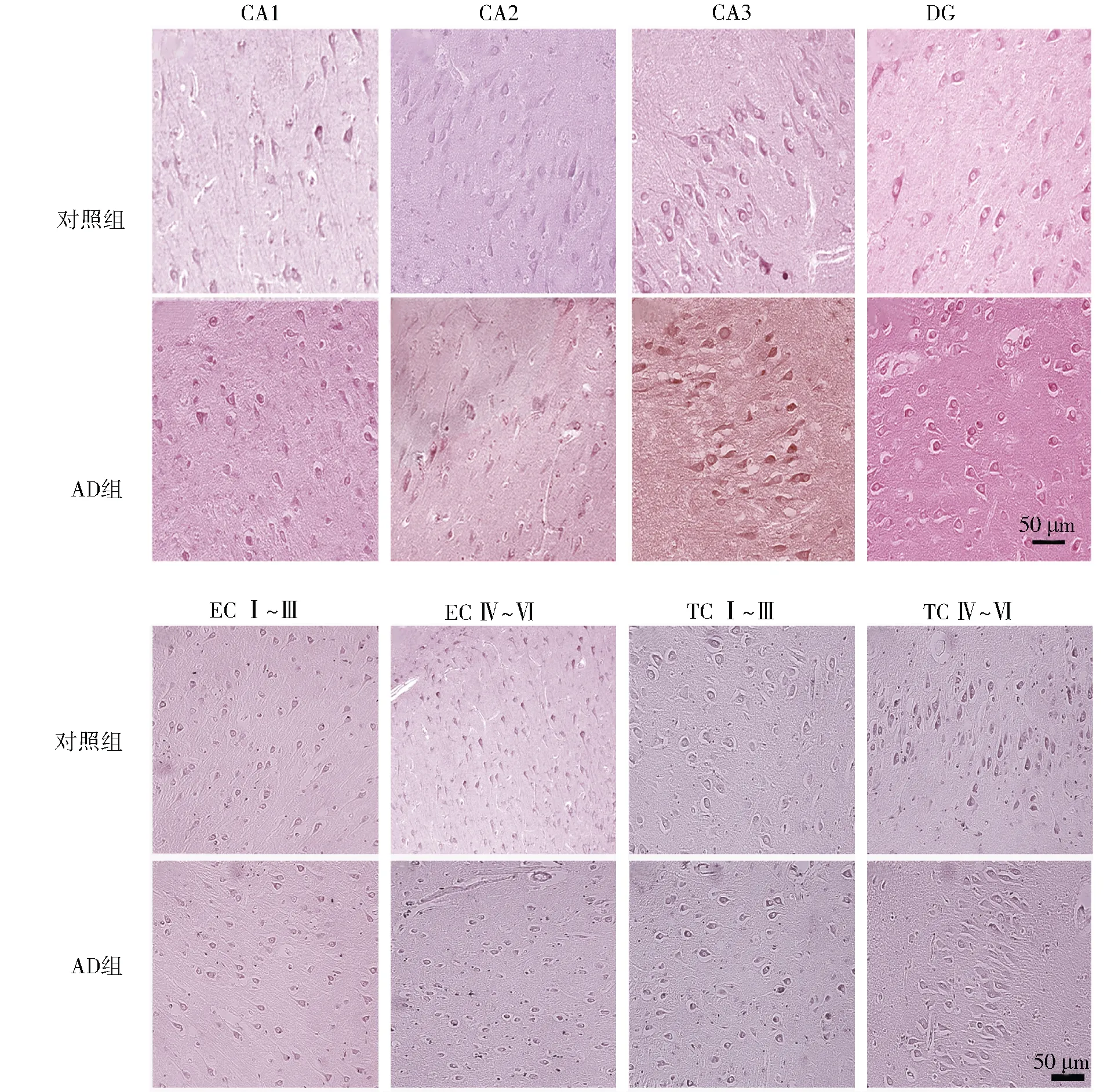
注:镜下100倍,标尺为50 μm图1 AIF蛋白在人脑海马、EC及TC区的表达(100×)Fig.1 AIF score in hippocampus, entorhinal and temporal cortices
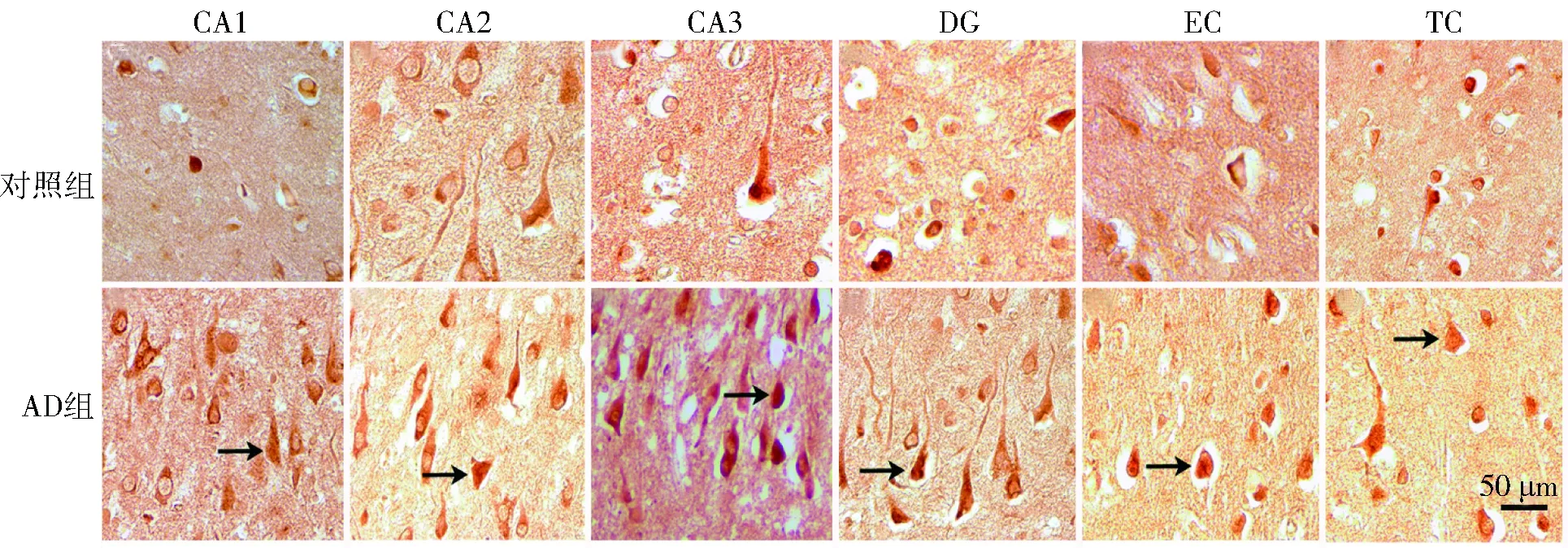
注:箭头所示为镜下所见AIF核染色阳性细胞图2 两组被检者海马各区、EC及TC的AIF核转移(200×)Fig.2 Nuclear AIF-ir in the CA1, entorhinal and temporal cortices
[1]何建军,罗玥佶.老年痴呆症的病因及发病机制研究进展[J].中国老年学杂志, 2014 (34):5924-5926.
[2]计德丽,李自如.细胞凋亡与阿尔茨海默病[J].内蒙古医学杂志, 2014 (3):296-300.
[3]刘敬东,张英. 凋亡诱导因子AIF在pSS患者唇腺中的异常表达[J]. 现代口腔医学杂志, 2015(4): 202-204.
[4]郭晓东,杨永平,楼敏,等. 凋亡诱导因子AIF在肝癌组织中的表达及临床意义[J]. 现代生物医学进展, 2011(3): 502-504.
[5]王占强,张鸿. 凋亡诱导因子与缺血性脑神经元凋亡[J]. 中国老年学杂志, 2011(1): 158-161.
[6]宋越,李俊,彭广福. HSP70与AIF在大肠癌中的表达及其临床意义[J]. 细胞与分子免疫学杂志, 2010(12): 1266-1267.
[7]王昌正,李英男,吴本俨,等. 凋亡诱导因子(AIF)在胃癌细胞和组织中的表达及意义[J]. 现代肿瘤医学, 2008(7): 1184-1186.
[8]周小波,何作云,于学军,等. AIF促进缺氧/复氧诱导的肥大心肌细胞凋亡的研究[J]. 解放军医学杂志, 2009(3): 262-266.
[9]Yu W, Guan ZZ, Bogdanovic N, et al. High selective expression of α7 nicotinic receptors on astrocytes in the brains of patients with sporadic Alzheimer's disease and patients carrying Swedish APP 670/671 mutation: a possible association with neuritic plaques[J]. Experimental Neurology, 2005(1): 215-225.
[10]Boddaert J, Kinugawa K, Lambert JC, et al. Evidence of a role for lactadherin in Alzheimer’s disease[J]. Am J Pathol, 2007(170):921-929.
[11]Herfs M, Hubert P, Kholod N, et al. Transforming growth factor-beta1-mediated Slug and Snail transcription factor up-regulation reduces the density of Langerhans cells in epithelial metaplasia by affecting E-cadherin expression[J]. Am J Pathol, 2008(172):1391-1402.
[12]张均田.神经元-触丢失与老年痴呆[J].神经药理学报, 2011(1):1-15.
[13]LeBlanc AC.The role of apoptotic pathways in Alzheimer's disease neurodegeneration and cell death[J]. Curr Alzheimer Res, 2005(4):389-402.
[14]Otera H, Ohsakaya S, Nagaura Z, et al. Export of mitochondrial AIF in response to proapoptotic stimuli depends on processing at the intermembrane space[J].EMBO J, 2005(24):1375-1386.
[15]Krantic S, Mechawar N, Reix S, et al. Apoptosis-inducing factor: a matter of neuron life and death[J]. Prog Neurobiol, 2007(81):179-196.
[16]Vahsen N, Cande C, Briere JJ, et al. AIF deficiencycompromises oxidative phosphorylation[J]. EMBO J, 2004(23):4679-4689.
[17]Polster BM, Basanez G, Etxebarria A,et al. Calpain I induces cleavage and release of apoptosis-inducing factor from isolated mitochondria[J]. J Biol Chem, 2005(280):6447-6454.
[18]Lee J, Cheon Y, Woo R, et al. Evidence of early involvement of apoptosis inducing factor-induced neuronal death in Alzheimer brain[J]. Anatomy & Cell Biology, 2012(1): 26.
[19]Williams TI, Lynn BC, Markesbery WR, et al. Increased levels of4-hydroxynonenal and acrolein, neurotoxic markers of lipid peroxidation, in the brain in Mild Cognitive Impairment and early Alzheimer’sdisease[J]. Neurobiol Aging, 2006(27):1094-1099.
[20]Zhu X, Lee HG, Perry G, et al. Alzheimer disease, the two-hithypothesis: an update[J]. Biochim Biophys Acta, 2007(1772):494-502.
[21]Savit BP, Jasneet KK, Hridesh B, et al.Role of apoptosis-inducing factor (Aif) in the T celllineage[J]. IJMR N, 2013(138):577-590.
(2016-01-31收稿,2016-06-30修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Expression and Significance of Apoptosis Inducing Factor in the Brain of Alzheimer's Disease
YANG Mei, REN Zhenkui, YU Wenfeng, GUAN Zhizhong
(KeyLabofMedicalMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
国家自然科学基金(81360199); 教育部科学技术研究项目(213032A); 贵州省国际科技合作项目[黔科合外G字(2013)7026号]
Email:wenfengyu2013@126.com
R34-33
A
1000-2707(2016)08-0869-05
10.19367/j.cnki.1000-2707.2016.08.001
**
网络出版时间:2016-08-23网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160823.1343.032.html

