谷氨酸棒杆菌中谷氨酰胺合成酶的克隆表达及固定化
曹慧萍, 郑 璞*, 唐云平, 徐志南
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.浙江大学 化学工程与生物工程学院,浙江 杭州310013)
谷氨酸棒杆菌中谷氨酰胺合成酶的克隆表达及固定化
曹慧萍1, 郑 璞*1, 唐云平2, 徐志南2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.浙江大学 化学工程与生物工程学院,浙江 杭州310013)
对谷氨酸棒杆菌(C.glutamicum)来源的谷氨酰胺合成酶进行腺苷酰化位点定点突变,并在大肠杆菌中进行异源表达,得到的重组酶活为6.215 U/mg。分离纯化重组突变酶后,对其固定化条件及固定化酶的性质进行研究。结果得到固定化条件为:以LX-1000EP树脂作为固定载体,载体量0.176 g/U、pH值8.0、温度30℃、吸附时间16 h。固定化酶活力达到3.658 U/g,酶活回收率达到67.17%。重组酶固定化后,反应最适温度没有变化,最适pH略向碱性偏移,储藏稳定性提高,转化谷氨酸生产谷氨酰胺的水平与游离酶相当,对50 mmol/L谷氨酸的转化率为92.83%,为酶法生产谷氨酰胺后续研究提供了参考。
重组谷氨酰胺合成酶,克隆表达,固定化,生物转化
谷氨酰胺合成酶 (glutamine synthetase,EC 6.3.1.2)催化铵离子和谷氨酸合成谷氨酰胺,同时消耗ATP。其生理功能主要是参与氮的同化和谷氨酰胺形成,为生物体合成多种氨基酸提供氮源,运输多余的铵离子。谷氨酰胺合成酶(GS)是生物体氮代谢的关键酶之一[1]。在体外,GS还用于酶促反应生产L-谷氨酰胺 (L-glutamine,L-Gln)和茶氨酸(N-ethyl-γ-L-glutamine)[2]。Tochikura[3]等最早提出用GS酶法生产L-Gln。1984年,Cardner等克隆了枯草芽孢杆菌(B.subtilis)中的GS基因glnA,并在大肠杆菌中进行了表达。GS酶法合成谷氨酰胺反应过程中需要ATP参与。Wakisaka等[4]利用谷氨酸棒杆菌来源的GS与酵母偶联,解决了谷氨酰胺合成酶ATP循环再生的问题,最后谷氨酰胺的产量可达54 g/L。在国内,酶法合成谷氨酰胺的研究日益增多,山东大学杨春玉等[5]从谷氨酸棒杆菌中提取了GS,并利用粗酶液转化谷氨酸合成谷氨酰胺,谷氨酰胺产量为7.1 g/L,谷氨酸转化率为94.8%。贲培玲等[6]在大肠杆菌中异源表达了来源于枯草芽孢杆菌的GS,并将提取的酶液与酵母耦联,利用该转化体系,谷氨酰胺产量达到27.6 g/L,谷氨酸转化率为94.5%。由于高浓度的NH4+会促进GS的腺苷酰化修饰程度增强,从而导致GS活性降低甚至丧失,因此黄星等[7]将谷氨酸棒杆菌中的glnA基因进行定点突变,将GS上的腺苷酰化位点Tyr405突变为Phe405,酶活提高了5倍,谷氨酰胺产量达到34.2 g/L。但利用GS酶法转化生成谷氨酰胺的水平总体比较低,游离的GS存在容易失活的现象[8]。游离酶在应用过程中存在稳定性差、易失活、酶与底物难以分离,不利于产物的回收与连续生产等缺点。
本文作者对来源于谷氨酸棒杆菌ATCC13761 的GS基因进行腺苷酰化位点的定点突变和克隆表达,并对重组突变酶(简称GS’)的固定化进行尝试[9],以期为酶法生产谷氨酰胺提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株及培养基 E.coli Rosetta(DE3),E.coli DH5α,谷氨酸棒杆菌 ATCC13761(C.glutamicum ATCC13761),质粒pET-28a(+),由作者所在实验室保存;LB培养基 (g/dL):蛋白胨1.0,酵母膏0.5,NaCl 1.0;pH 7.0。
1.1.2 酶、引物和主要试剂 扩增GS基因glnA的引物(见表1)和全质粒定点突变引物(见表2),由上海生工生物工程技术服务有限公司合成。表1中上、下游引物分别加入NcoⅠ和HindⅢ酶切位点(下划线标示),表2中加入定点突变位点(下划线标示)。限制性内切酶NcoⅠ和HindⅢ,Taq聚合酶,T4 DNA连接酶,甲基化酶DpnⅠ等分子生物学工具酶,购自大连TaKaRa公司。细菌基因组DNA提取试剂盒,PCR产物回收试剂盒及DNA凝胶回收试剂盒,购自上海生工生物工程技术服务有限公司。LX-1000HA树脂,LX-1000EP树脂,西安蓝晓科技有限公司产品。其他化学试剂均为进口或者国产分析纯试剂。
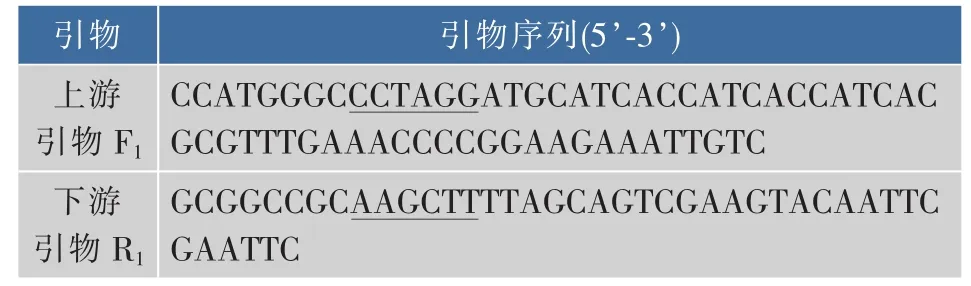
表1 克隆目的基因glnA的引物Table1 Primers for cloning of the target gene
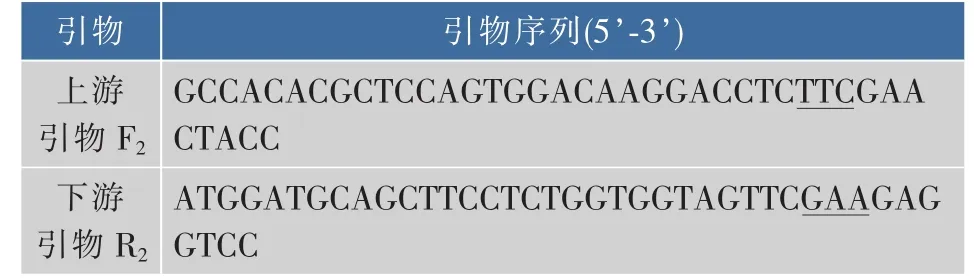
表2 全质粒定点突变glnA(Tyr405-Phe405)的引物Table2 Primers for site-directed mutagenesis of the target gene
1.2 方法
1.2.1 GS基因的克隆及表达载体的构建 利用细菌基因组DNA提取试剂盒提取谷氨酸棒杆菌ATCC13761基因组DNA,以该基因组DNA为模板,用表1中的F1和R1引物通过PCR扩增获得GS基因glnA。对PCR片段及载体pET28a(+)进行NcoⅠ和HindⅢ双酶切,用T4 DNA连接酶于16℃过夜连接后转化到DH5α感受态细胞中。转化液涂布于含卡那霉素50 μg/mL的LB平板上过夜培养,挑取转化子,37℃培养12~16 h后提取质粒。重组质粒pET28a(+)-glnA经NcoⅠ和HindⅢ双酶切鉴定并送至上海生工生物工程技术服务有限公司测序分析。
1.2.2 GS基因的定点突变 以重组质粒pET28a (+)-glnA为模板,用表2中的F2和R2引物通过PCR扩增全质粒,PCR产物经甲基化酶DpnⅠ处理去除原来的模板,处理后的产物经PCR回收试剂盒回收后,转化到DH5α感受态细胞中,转化液涂布于含卡那霉素50 μg/mL的LB平板上过夜培养,挑取转化子,37℃培养12~16 h后提取质粒,获得突变质粒pET28a(+)-glnA’并进行测序分析。
1.2.3 GS和GS’在大肠杆菌中的表达及 SDSPAGE分析 将重组质粒 pET28a(+)-glnA和pET28a(+)-glnA’分别转化到大肠杆菌 Rosetta (DE3)感受态细胞中,获得重组菌E.coli Rosetta (DE3)/pET28a(+)-glnA和E.coli Rosetta(DE3)/ pET28a(+)-glnA’,将重组菌接种至LB培养基(50 μg/mL卡那霉素,34 μg/mL氯霉素)中,于37℃、200 r/min振荡培养至OD600达到0.6~0.8左右,添加IPTG至终浓度为0.05 mmol/L,并于25℃进行诱导表达6~8 h。收集发酵液并于8 000 r/min离心10 min,菌体用预冷的0.1 mmol/L Tris-HCl(pH 7.0)缓冲液重悬后进行超声波破碎 (工作5 s,停7 s,40个循环,功率200 W),破碎液于10 000 r/min离心10 min,上清部分即为粗酶液。12 g/dL SDS-PAGE分析检测重组蛋白质表达情况。
1.2.4 重组蛋白质的纯化 收集经诱导表达的菌体,超声波破碎收集上清液。参照文献[10]的方法用镍柱纯化,并测定酶活。
1.2.5 GS’酶活的测定 按Spafio[11]方法测定谷氨酰胺合成酶的γ-谷氨酰基转移活性。定义在反应条件下,每分钟催化形成1 μmol/L γ-谷氨酰羟肟酸所需要的酶量定义为1个酶活力单位(U)。

式(1)中,R为回收率,ei为固定化酶的总酶活,Ei为用于固定的酶液的总酶活。
1.2.6 固定化材料的选择 在50 mL的锥形瓶装入10 mL稀释酶液(1.137 U/mL),分别加入等量的3 g LX-1000HA、壳聚糖微球、LX-1000EP,于25℃恒温振荡器中160 r/min振荡16 h,过滤得到固定化酶并用蒸馏水洗涤3次,晾干,测定固定化酶活和酶活回收率。
1.2.7 固定化条件的单因素实验 取5.683 U/mL的酶液2 mL置于50 mL的锥形瓶中,分别进行固定的载体用量(0.5~5.0 g)、温度(15~37℃)、缓冲液pH(6.5~9.0)和固定时间的单因素试验,反应体积10 mL。
1.2.8 温度和最适pH对固定化GS’的影响 将固定化酶和游离酶于 20、25、30、37、40、45、50、55、60℃下测定酶液活性,以所测的不同反应温度下最高酶活为100%,考查不同温度对固定化谷氨酰胺合成酶活性的影响。在pH为3.0~10.0(0.1 mol/L的柠檬酸缓冲液pH 3.0~7.0,0.1 mol/L的Tris-HCl缓冲液pH 6.5~9.0,0.1 mol/L的甘氨酸-NaOH缓冲液pH 7.5~10.0)的缓冲液中,测定固定化酶和游离酶活性,以所测的不同反应pH下最高酶活为100%,考查不同pH对固定化谷氨酰胺合成酶的影响。
1.2.9 固定化GS’的稳定性 将游离GS’和固定化GS’分别放入4℃和37℃的恒温箱中,定时取样测量这两种酶的酶活。
1.2.10 固定化谷氨酰胺合成酶催化合成谷氨酰胺在5 mL反应液中加入2 g的固定化GS’,于37℃恒温水浴锅中反应20 h,定时取样检测谷氨酸含量。反应液组成为 50~200 mmol/L谷氨酸钠,50~200 mmol/L氯化铵,50~200 mmol/L ATP和40 mmol/L氯化镁[5]。
2 结果与分析
2.1 GS的腺苷酰化位点定点突变及其表达
2.1.1 重组蛋白质GS和GS’在大肠杆菌中的表达源于谷氨酸棒杆菌的GS存在腺苷共价修饰,而腺苷酰化会使GS的活性降低或丧失,将GS的Tyr405定点突变为Phe405,可以去除腺苷酰化位点[7]。以谷氨酸棒杆菌 ATCC13761基因组DNA为模板,经PCR扩增获得目的基因glnA(1 460 bp),重组质粒pET28a(+)-glnA经酶切验证表明构建成功,见图1 (a),测序表明与GenBank 3345165序列一致。以质粒pET28a(+)-glnA为模板,进行全质粒定点突变,经过质粒PCR验证,见图1(b),再送上海生工公司测序,经过分子生物学软件分析,所得glnA’基因序列与NCBI上已有的C.glutamicum ATCC13761的glnA基因序列有很高的同源性,通过分析其核苷酸序列,扩增出的基因glnA’在Tyr405位点突变为Phe405位点,与黄星等[7]的报道一致。重组菌E.coli Rosetta(DE3)/pET28a(+)-glnA和 E.coli Rosetta (DE3)/pET28a(+)-glnA’经诱导表达,SDS-PAGE蛋白质分析,结果如图2所示。泳道1、2在45~66 kDa处有明显条带,说明glnA和glnA’基因已经表达。测定glnA表达的蛋白质GS酶活为1.261U/mg,glnA’表达的蛋白质GS’酶活为6.215 U/mg,定点突变后,重组菌表达蛋白质的酶活提高了4.929倍。
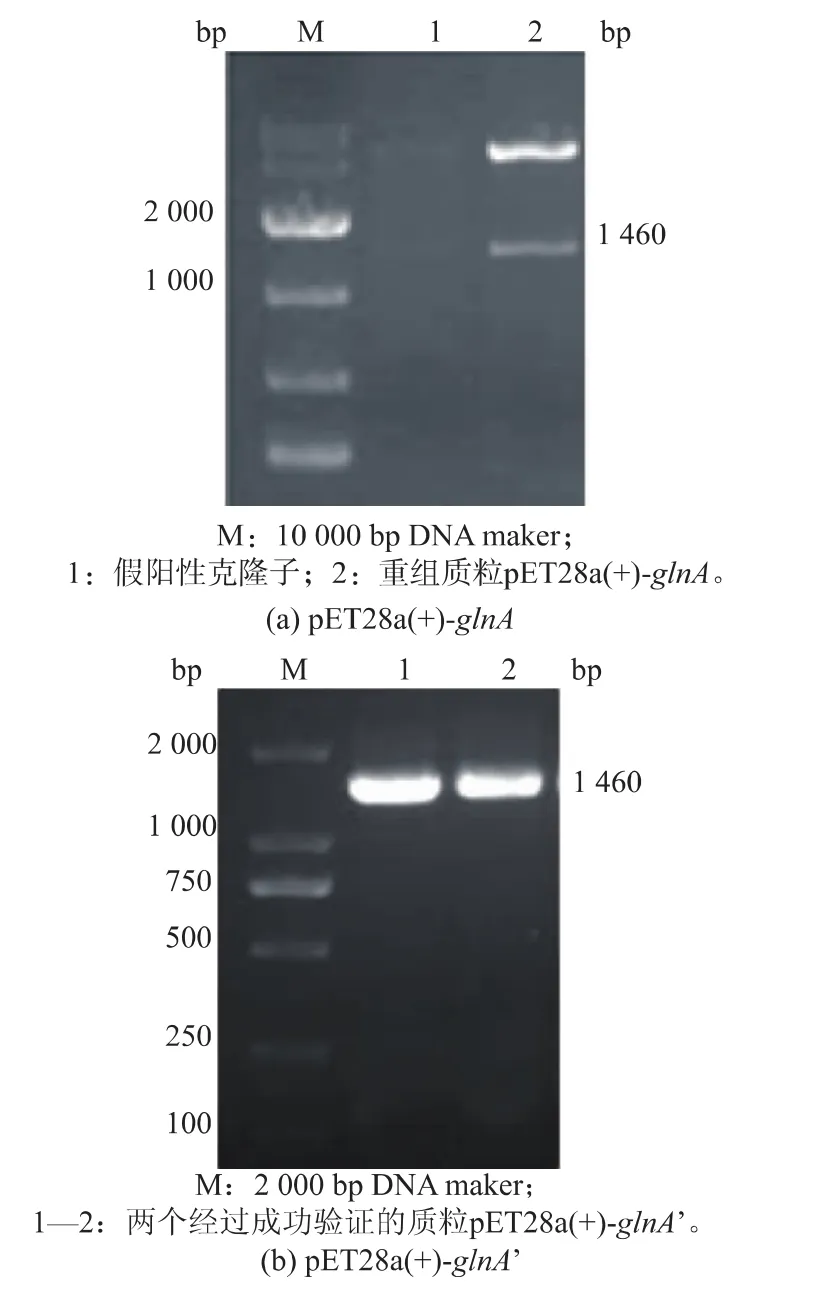
图1 重组质粒酶切pET28a(+)-glnA和PCR质粒pET28a (+)-glnA’鉴定Fig.1 Agarose gelelectrophoresis ofrecombinant pET28a (+)-glnA by enzyme digestion and pET28a(+)-glnA’by PCR
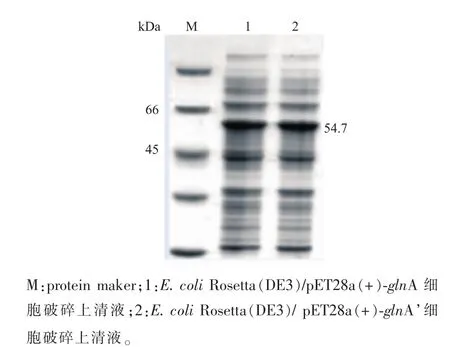
图2 glnA和glnA’表达电泳图谱Fig.2 SDS-PAGE of GS and GS’expression
2.1.2 重组蛋白质的纯化 经过诱导的重组E.coli Rosetta(DE3)/pET28a(+)-glnA’细胞破碎液上清液经过镍柱亲和层析,得到活性组分,用SDS-PAGE电泳分析纯化效果,如图3所示。重组的GS’经镍柱亲和层析后能获得单一蛋白质条带,纯化后得到酶液比酶活为26.4 U/mg,纯化前的细胞破碎上清液的比酶活为6.861 U/mg,蛋白质纯化倍数3.85倍。
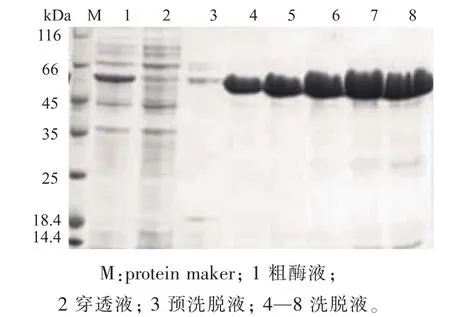
图3 纯化后GS’的SDS-PAGE电泳分析Fig.3 SDS-PAGE analysis of the purified GS’
2.2 重组GS’的固定化
2.2.1 固定化材料的选择 分别用LX-1000HA树脂、LX-1000EP树脂、壳聚糖微球对GS’进行固定化,结果如表3所示。3种固定化材料中LX-1000EP树脂固定化的效果最好。选取LX-1000EP树脂作为固定化材料,进行固定条件的确定。
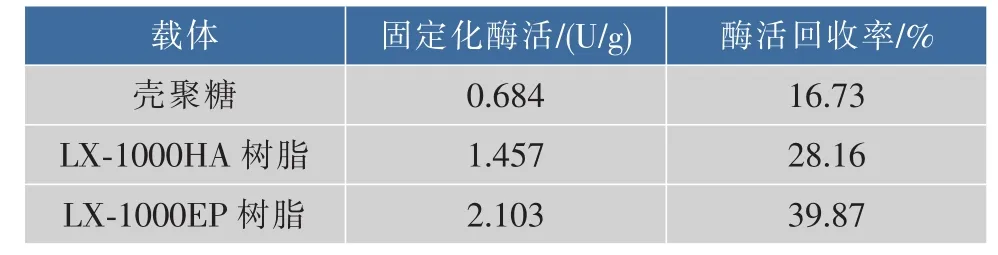
表3 3种载体固定化GS’的活力比较Table3 Compare of the GS’enzyme activity in three kinds of carries
2.2.2 GS’的固定化条件优化 温度增加会适当促进载体对于蛋白质的吸附,但温度过高又会使酶蛋白质易变性失活。图4(a)反映了温度对GS’固定化的影响,随着温度的升高,固定化GS’酶活和酶活回收率表现出先上升后降低的趋势,当温度为30℃时,酶活回收率以及固定化酶活力达到最高,分别为44.63%和2.214 U/g。在过酸或者过碱的环境下,GS’容易失活,图4(b)反映了固定化环境 pH对GS’的影响,随着pH增加,固定化GS’酶活和固定化酶活回收率也显示出先增后减的趋势,当pH 8.0时,分别达到最大为2.418 U/g和48.78%。载体用量单因素试验(图4(c))表明,固定化酶活随载体用量的递增而呈现出先平缓后降的趋势,酶活回收率呈现先增后减的趋势,对于1.137 U/mL的酶液,在载体用量为2.0 g时,固定化酶活和酶活回收率分别达到最大,为3.672 U/g和67.17%。酶固定化时间曲线如图4(d)所示,固定化酶活随时间的延长而逐步增加,在16 h固定化酶活达到最高3.658 U/g,此后固定化酶活相对稳定,说明载体吸附的酶量达到饱和,再延长时间也不提高酶活。GS’的固定化条件为:1 U酶液载体用量 0.176 g,固定化温度30℃,pH 8.0,时间16 h。
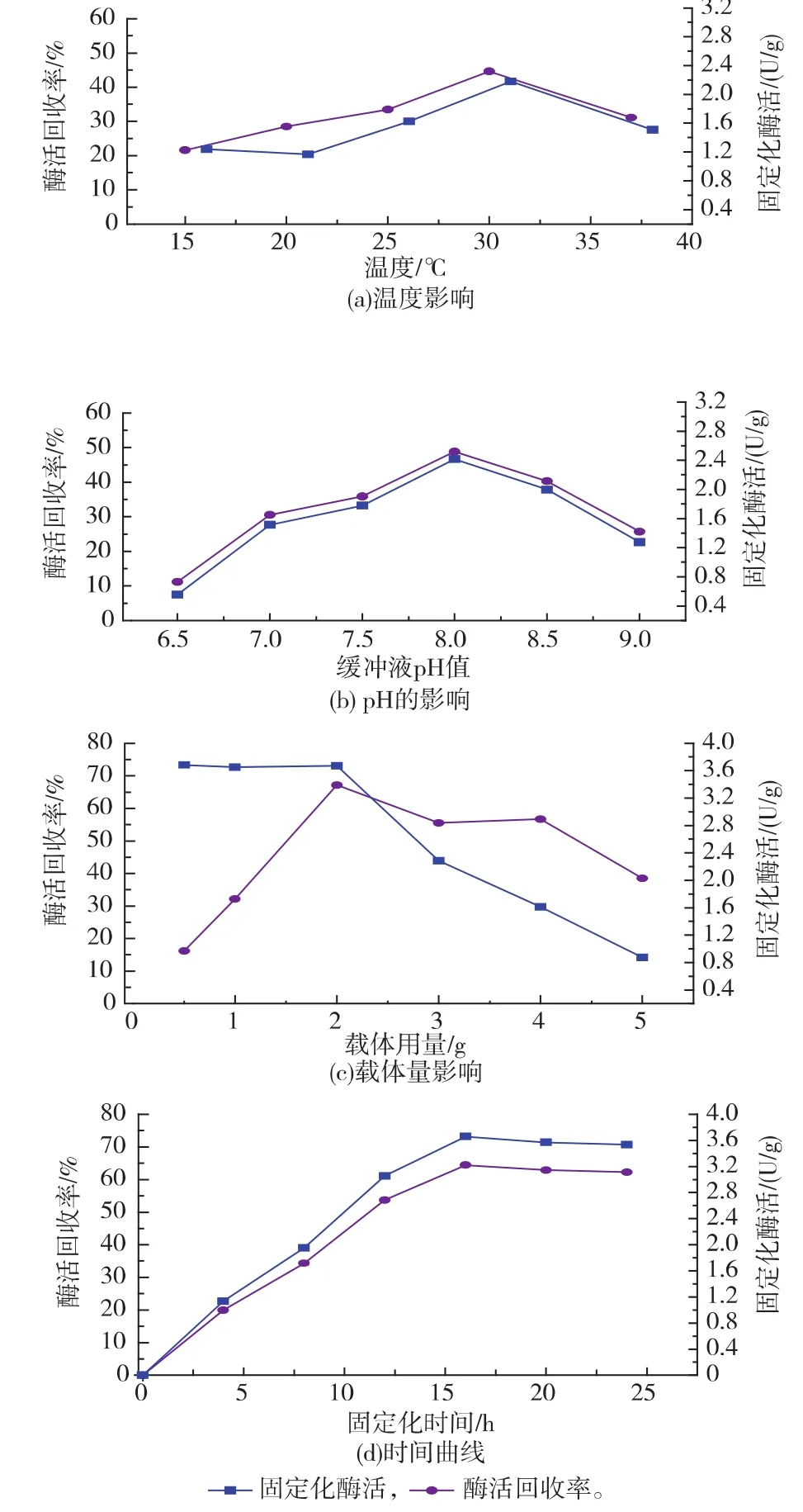
图4 固定化条件对GS’固定化的影响Fig.4 Effect of conditions for immobilization on activity of immobilzed enzyme
2.3 固定化GS’的性质
2.3.1 固定化GS’最适反应温度与pH值 考察固定化谷氨酰胺合成酶的最适反应温度。如图5所示,在20~45℃下随着温度的升高,酶活也逐渐升高;当温度高于 45℃,酶活开始下降,故最适反应温度为45℃。相比于游离GS’,固定化GS’的最适温度没有变化。在最适反应温度下,考察固定化谷氨酰胺合成酶的最适反应pH。由图6可知,固定化谷氨酰胺合成酶活性随pH的升高而升高,pH为8.0时酶活最高,即为最适反应pH;pH大于8.0,酶活逐渐降低,该固定化酶较适合在偏碱的环境中进行反应,在偏酸的环境中酶活容易丧失。相比于游离酶,固定化GS’的最适合pH发生了偏移。

图5 温度对游离酶和固定化酶活的影响Fig.5 Effect of temperature on the free enzyme and immobilized enzyme activity

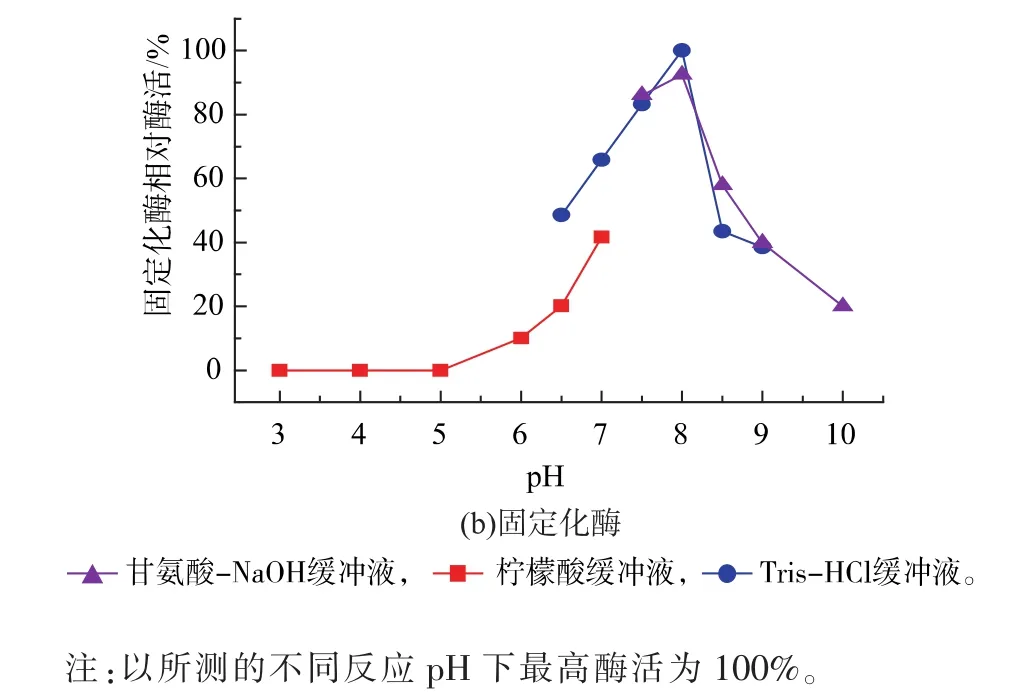
图6 反应pH对游离酶和固定化酶的影响Fig.6 Effect of buffer pH value on the free enzyme and immobilized enzyme activity
2.3.2 固定化GS’的稳定性 比较固定化GS’与游离GS’在4℃和37℃的稳定性,如图7(a)和图7 (b)所示,固定化GS’的稳定性明显优于游离GS’。在4℃保存一个月,固定化GS’剩余酶活为82.35%,而游离GS’酶活只有46.26%;在37℃下放置一周,固定化GS’剩余酶活为40.63%,而游离GS’酶活只有6.59%。说明谷氨酰胺合成酶利用LX1000-EP树脂固定后,其稳定性有显著提高。
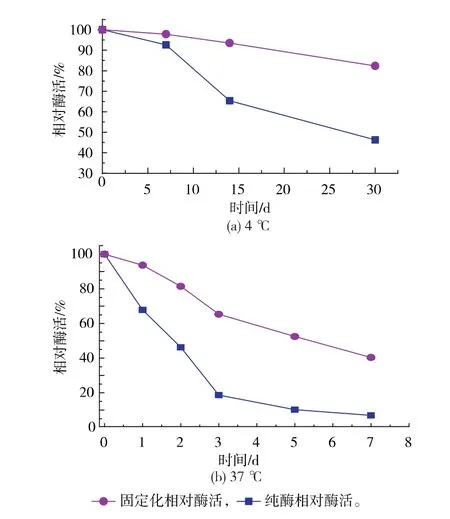
图7 固定化酶与游离酶的稳定比较Fig.7 Stability of the immobilized enzyme and free enzyme
2.3.3 固定化GS’酶法转化谷氨酰胺 固定化操作会对酶的催化性能产生影响,比较固定化GS’和游离GS’转化谷氨酸产谷氨酰胺的情况。如图8所示,固定化GS’与游离GS’的谷氨酸转化率皆随着底物浓度的升高而逐渐下降,并且通过比较可以看出两者转化规律一致,表明LX-1000EP树脂制备的固定化GS’可转化谷氨酸生成谷氨酰胺,且在低浓度底物的情况下,转化率较高。反应生成ADP对谷氨酰胺合成酶产生抑制[10],无法将更多的谷氨酸转化为谷氨酰胺。当底物浓度为50 mmol/L时,转化效果最好,固定化GS’在2 h反应趋于平衡,20 h转化后,转化率达到92.83%,谷氨酰胺的产量达到6.71 g/L。对于50 mmol/L谷氨酸进行固定化GS’反复利用转化实验,前5次谷氨酸转化率分别为 92.64%、93.73%、92.94%、93.31%和92.28%以上,第6次时因为酶活降低而只达到83.07%。说明该固定化酶具有回收再利用的可能性。
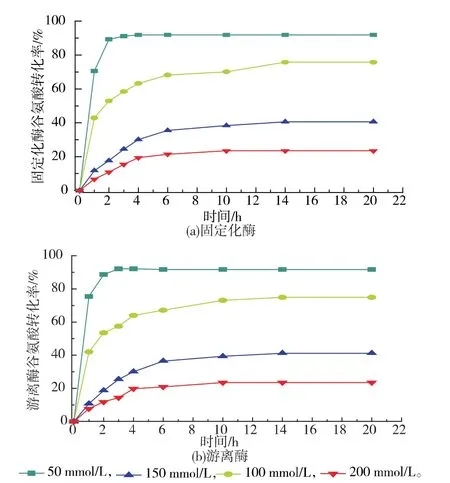
图8 反应时间对谷氨酸转化率的影响Fig.8 Effect of reaction time on conversion of GA
3 结语
从谷氨酸棒杆菌中克隆谷氨酰胺合成酶,并对该酶进行了定点突变,在大肠杆菌中进行诱导表达。选用LX-1000EP树脂固定化GS’,确定固定化条件为:对1 U酶液,载体用量0.176 g,固定化温度30℃,pH 8.0,吸附时间16 h,在此条件下固定化酶活达到3.658 U/g,酶活回收率达67.17%。固定化GS’的最适pH较游离酶发生偏移,储藏稳定性明显提高。固定化GS’转化50 mmol/L谷氨酸产谷氨酰胺6.71 g/L,转化率为92.83%。本文所述的固定化酶转化反应只是在低浓度底物条件下进行,后续利用外源ATP再生系统,并对转化条件优化,提高底物浓度,有望提高产物谷氨酰胺的浓度。
[1]LIU Qian,ZHANG Jiao,WEI Xiaoxing,et al.Microbial production of L-glutamate and L-glutamine by recombinant Corynebacterium glutamicum harboring Vitreoscilla hemoglobin gene vgb [J].Appl Microbiol Biotechnol,2008,77(6):1297-1304.
[2]YAMAMOTO S,WAKAYAMA M,TACHIKI T.Theanine production by coupled fermentation with energy transfer employing Pseudomonas taetrolens Y 30 glutamine synthetase and baker's yeast cells[J].Biosci Biotechnol Biochem,2005,69(4):784-789.
[3]KIMURA Akira,KIMURA Masao,TOCHIKURA Tatsurokuro.Occurrence of free base of phytosphingosine in candida intermedia[J].Agricultural and Biological Chemistry,1974,38(6):1263-1264.
[4]WAKISAKA S,OHSHIMA Y,OGAWA M,et al.Characteristics and efficiency of glutatmine production by coupling of a bacterial glutamine synthetase reaction with the alcoholic fermentation system of baker’s yeast[J].Appl Environ Microbiol,1998,64(8):2952-2957.
[5]杨春玉,马翠卿,许平,等.酶法转化谷氨酰胺[J].过程工程学报,2002,2(6):529-533. YANG Yuchun,MA Cuiqing,XU Ping,et al.Glutamine production by the enzyme method[J].The Chinese Journal of Process Engineering,2002,2(6):529-533.(in Chinese)
[6]贲培玲,郝佳瑛,张正平,等.酵母能量偶联酶法合成Gln体系的建立及条件优化研究[J],安徽农业科学,2009,37(10):4424-4426. BEN Peiling,HAO Jiaying,ZHANG Zhengping,et al.Study on establishment of enzymatic synthesis of gln by coupling yeast-energy system and optimization of conditions[J].Journal of Anhui Agri Sci,2009,37(10):4424-4426.(in Chinese)
[7]黄星,曾行,刘铭,等.谷氨酰胺合成酶腺苷酰化位点的定点突变和产胺的初步研究[J].过程工程学报,2008,8(1):135-139. HUANG Xing,ZENG Xing,LIU Ming,et al.Site-directed mutagenesis of putative adenylylation site of glutamine synthetase and glutamine production[J].The Chinese Journal of Process Engineering,2008,8(1):135-139.(in Chinese)
[8]张峰,王期,李桂兰,等.溶氧反馈—分批补料高密度培养枯草杆菌谷氨酰胺合成酶工程菌[J].南京师大学报(自然科学版),2010,33(2):96-103. ZHANG Fen,WANG Qi,LI Guilan,et al.High density fed-batch culture of Escherichia coli BL21/pET28b-glnA with DO Feed-back control of nutrient feeding[J].Journal of Nanjing Normal University(Natural Science Edition),2010,33(2):96-103.(in Chinese)
[9]沈淑英,管正洁,盛自华,等.氨基酸的酶法生产[J].天津微生物,1981(3):28-38. SHEN Shuying,GUAN Zhengjie,SHENG Zihua,et al.Amino acid enzymatic production[J].Journal of Tianjin Microbes,1981(3):28-38.(in Chinese)
[10]李业.谷氨酰胺合成酶的表达、纯化、酶学性质及腺苷化现象的研究[D].北京,清华大学化学工程系,2009.
[11]SHAPIRO B M,STADTMAN E R.Glutamine sythetase(Escherichia coli)[J].Methods Enzymol,1970,17(4):910-922.
Cloning,Expression and Immobilization of Glutamine Synthetase from Corynebacterium glutamicum
CAO Huiping1, ZHENG Pu*1, TANG Yunping2, XU Zhinan1
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.College of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310031,China)
The glutamine synthetase encoded gene of Corynebacterium glutamicum was cloned and mutated on polyadenylation sites,followed by heterogeneous expression in E.coli with high enzyme activity of 6.215 U/mg.The recombinant mutant enzyme(GS')was purified,and LX1000-EP resin was employed as the immobilization carrier.The results showed that the optimal conditions for immobilization were in the following:0.176 g carriers/1 U enzyme,pH 8.0,25℃and 16 h.Under the above conditions the highest bioactivity(3.658 U/g)of immobilized GS'was achieved with high active recovery rate of 67.17%.Compared with free enzyme,the immobilized GS has the same optimal temperature and stability,however the optimal pH was slightly increased.The immobilized GS has the same conversion rate of 92.83%when 50 mmol/L glutamate was added in the bioconversion system.This work is useful for further large-scale bioproduction of glutamine.
glutamine synthetase,expression,immobilization,bioconversion
Q 78
A
1673—1689(2016)08—0883—07
2015-02-13
郑璞(1966-),女,江苏无锡人,工学博士,教授,硕士研究生导师,主要从事发酵工程研究。E-mail:zhengpu@jiangnan.edu.cn

