水通道蛋白1在胆囊黏膜中的表达及临床意义
高 源, 朱春富, 张京平
(南京医科大学附属常州市第二人民医院 普外科, 江苏 常州, 213000)
水通道蛋白1在胆囊黏膜中的表达及临床意义
高源, 朱春富, 张京平
(南京医科大学附属常州市第二人民医院 普外科, 江苏 常州, 213000)
水通道蛋白1; 胆囊黏膜; 表达
胆囊炎是肝胆外科常见疾病,其主要病因为胆囊结石形成。胆囊炎主要病理表现为胆囊壁水肿,胆囊内胆汁淤积或结石形成[1]。水通道蛋白-1(AQP-1)主要参与黏膜内外水分的转运,有报道[2]称其表达同炎症、肿瘤的发生发展存在相关性。本研究探讨AQP-1与胆囊结石的相关性,现报告如下。
1 资料与方法
1.1一般资料
选取2015年10—12月南京医科大学附属常州市第二人民医院普外科接受胆囊手术切除的患者64例,其中胆囊结石45例,胆囊息肉19例。45例胆囊结石中,急性胆囊炎20例,慢性胆囊炎25例。男21例,女43例,平均年龄(39.15±14.65)岁。
1.2方法
免疫组化: 6 μm切片,石蜡固定标本,经二甲苯脱蜡,梯度酒精水化。经0.01 mol/L柠檬酸, 100℃下10 min抗原修复。3%的双氧水消除内源性过氧化物酶活性,一抗(1∶500 稀释, Abcam 公司,美国)4℃ 孵育过夜, PV9000 室温孵育, DAB显色,苏木素复染。5%胎牛血清代替一抗为阴性对照。
蛋白提取及 Western blot 检测:参照蛋白提取试剂盒(碧云天公司)说明书进行。40 μg蛋白上样后 80 V电泳,蛋白弥散后改为100 V继续电泳,约 2 h。250 mA, 恒流湿转,65 min。转膜结束后 5%BSA 封闭 2 h, 加入一抗(Abcam公司,美国)后4℃冰箱过夜。TBST洗膜3遍,每次15 min。 然后加入二抗后37℃恒温箱孵育, TBST 洗膜 3 遍,每次15min。显影液显影,凝胶成像仪获取图像。
PT-PCR: 总 RNA提取试剂盒、反转录试剂盒、SYBR Premix Ex TaqTM试剂盒(大连宝生物公司)。反转录PCR引物由英潍捷基公司合成。AQP-1上游引物: 5-CTGTGGGATTAACCCTGCTC-3; 下游引物: 5- GGTCTGTGAGGTCACTGCTG-3; GAPDH 上游引物: 5- ACAACTTTGGCATTGTGGAA -3; 下游引物: 5- GATGCAGGGATGATGTTCTG -3。由Labnet PCR仪完成扩增。反应条件: 95℃ 15 s 预变性,PCR 反应, 60℃ 20 s, 60℃ 20 s, 共40个循环。结果采用相对定量法分析。
1.3统计学方法
采用SPSS16.0软件进行分析,各组间AQP-1及AQP-8表达阳性率的比较采用χ2检验。 Western blot 图片用Image-J测灰度值; Western blot结果和RT-PCR结果均采用 Graphpad Prism5软件,行单因素方差分析检验作图。P≤0.05为差异有统计学意义。
2 结 果
免疫组化显示,有结石形成的胆囊黏膜中AQP-1表达阳性率为84%(38/45), 而在单纯胆囊息肉的胆囊黏膜中AQP-1未见明显表达。进一步Western Blot检验结果显示,结石形成的胆囊黏膜中AQP-1表达显著高于正常胆囊(图1)。针对AQP-1的mRNA检测同样存在上述表达差异(图2)。
3 讨 论
有报道[2-5]称AQP-1同时还表达于胆囊、多种肿瘤组织中,在肿瘤的发生发展中,其主要机制为促进肿瘤细胞的形态学改变,进而促进了肿瘤细胞浸润淋巴、血管等。Verkman等[6-10]通过对正常小鼠胆囊黏膜中AQP-1表达的研究阐述AQP-1广泛存在于小鼠黏膜层,其主要作用是向胆囊腔内分泌水分,然而这样的水分未改变胆汁成分,故认为AQP-1对胆囊结石形成无意义。本实验通过对正常状态、结石形成状态下胆囊黏膜内AQP-1的表达情况进行检测分析,结果显示结石形成的胆囊黏膜内AQP-1表达显著高于正常胆囊组,且慢性炎症组同急性炎症胆囊黏膜组之间无显著差异。针对AQP-1的mRNA表达测定同样存在上述表达差异。
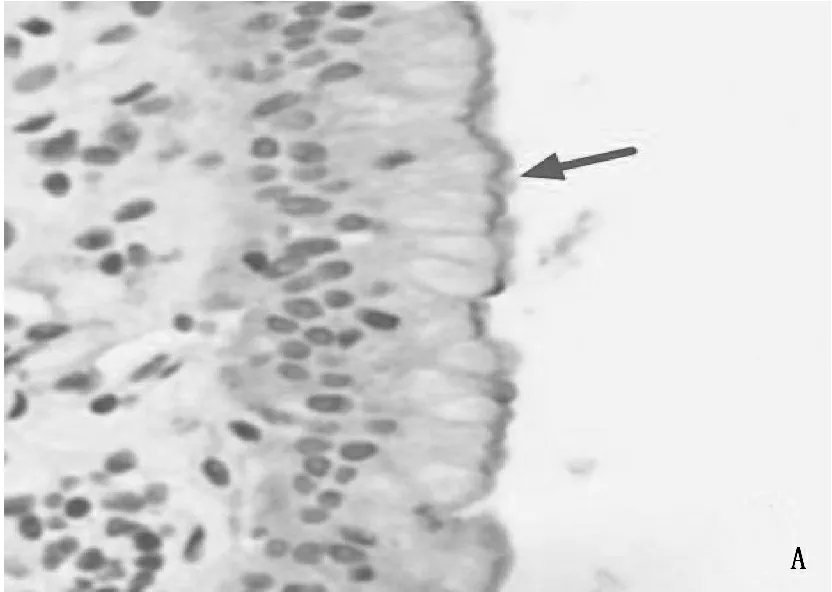
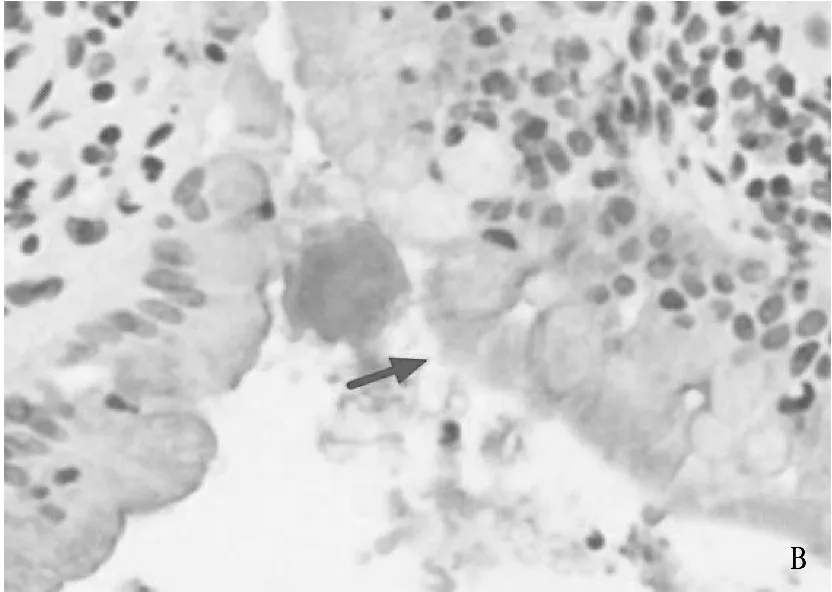

A. 在胆囊结石的胆囊黏膜表面表达阳性; B. 在胆囊息肉的胆囊黏膜表达阴性。图1 AQP-1及AQP-8在不同状态胆囊黏膜中的表达差异
AQP-1、AQP-8同时表达于胆囊黏膜内[11-12],AQP-1主要承载水的分泌功能,而AQP-8则充当水分的重吸收功能。AQP-1在结石性胆囊黏膜中到表达增多的可能机制如下: ① 当胆汁逐步黏稠层积,胆汁浓度增加,诱导黏膜内AQP-1表达增强,促进水分分泌,以达到稀释胆汁,减缓结石形成。② AQP-1表达增强、促进水分的分泌,使胆囊肿胀,胆囊收缩功能下降,致使胆汁层积,进而演变为结石形成。上述可能机制均表明AQP-1同胆囊结石形成存在一定的联系。
[1]Van Erpecum K J. Pathogenesis of cholesterol and pigment gallstones: an update[J]. Clin Res Hepatol Gastroenterol, 2011, 35(4): 281-287.
[2]Verkman AS. Aquaporins at a glance[J]. J Cell Sci, 2011, 124(Pt 13): 2107-2112.
[3]Wu Z, Li S, Liu J, et al. RNAi-mediated silencing of AQP1 expression inhibited the proliferation, invasion and tumor genesis of osteosarcoma cells[J]. Cancer Biol Ther, 2015: 1-9.
[4]Wei X, Dong J. Aquaporin 1 promotes the proliferation and migration of lung cancer cell in vitro[J]. Oncol Rep, 2015, 34(3): 1440-1448.
[5]Tan M, Shao C, Bishop J A, et al. Aquaporin-1 promoter hypermethylation is associated with improved prognosis in salivary gland adenoid cystic carcinoma[J]. Otolaryngol Head Neck Surg, 2014, 150(5): 801-807.
[6]Li L, Zhang H, Ma T, et al. Very high aquaporin-1 facilitated water permeability in mouse gallbladder[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296(4): G816-G822.
[7]Calamita G, Ferri D, Bazzini C, et al. Expression and subcellular localization of the AQP8 and AQP1 water channels in the mouse gall-bladder epithelium[J]. Biol Cell, 2005, 97(6): 415-423.
[8]刘笑玎, 原铭贞, 王司仪, 等. 水通道蛋白1、3、4和5与急性肺损伤关系的研究进展[J]. 吉林大学学报: 医学版, 2014, 40(5): 1119-1122.
[9]王从军, 王红, 王曼. 先天性肾积水患儿尿液水通道蛋白1表达的意义[J]. 中华实用儿科临床杂志, 2012, 27(11): 832-834.
[10]刘多谋, 黄鹤光, 周武汉, 等. 白细胞介素-1β对人脐静脉内皮细胞结构及水通道蛋白-1的影响[J]. 中华肝胆外科杂志, 2014, 20(2): 123-125.
[11]张霖, 王锦权. 水通道蛋白在急性肝损伤中的作用的研究进展[J]. 中华医学杂志, 2012, 92(16): 1148-1150.
[12]王吉. 水通道蛋白1在长期高糖腹膜透析液诱导的小鼠腹膜纤维化中的作用[D]. 吉林大学, 2016.
2016-04-15
江苏省常州市科技计划项目(CJ20140037)
张京平, E-mail: zjpcz2016@126.com
R 575.6
A
1672-2353(2016)17-193-02
10.7619/jcmp.201617074

