高载药量的恩曲他滨替诺福韦片处方优化研究
马宜明,贾德武,汤洁,罗倩雯,肖雷
(安徽医科大学第一附属医院药剂科,安徽 合肥 230022)
高载药量的恩曲他滨替诺福韦片处方优化研究
马宜明,贾德武,汤洁,罗倩雯,肖雷
(安徽医科大学第一附属医院药剂科,安徽 合肥230022)
目的研究一种高载药量的恩曲他滨替诺福韦复方片处方,优化其处方配伍方案。 方法在对国外上市制剂的处方工艺进行分析的基础上,进行稳定剂、填充剂、崩解剂、黏合剂的筛选和最终处方的放大验证,确定合理可行的处方工艺。结果以处方解析确定的高风险因素为考察指标,确定了高载药量的恩曲他滨替诺福韦片的处方:每片含恩曲他滨200 mg,富马酸替诺福韦二吡呋酯300 mg,预胶化淀粉60 mg,微晶纤维素100 mg,交联羧甲基纤维素钠30 mg,硬脂酸镁5 mg,95%乙醇为黏合剂。自制片与对照片质量比对结果一致。结论筛选的恩曲他滨替诺福韦复方片处方工艺合理可行,产品重现性和稳定性好。
恩曲他滨;替诺福韦;药物调剂
恩曲他滨(FTC)和富马酸替诺福韦二吡呋酯(TDF)均为核苷酸类逆转录酶抑制剂(NRTIs)。其中,TDF于2001年经美国FDA批准用于治疗人类免疫缺陷病毒(HIV)感染。由于治疗效果确切,适用性好,剂量合适,是多个治疗指南推荐使用的一线抗HIV药物。FTC于2003年经美国FDA批准上市,作用机制类似于拉米夫定,较拉米夫定抗病毒活性更好、安全性更高[1-4]。
HIV患者需要长期服用多种药物,由于主观和客观的原因,患者常常会在服药时间、剂量和疗程等方面出现不能按医嘱服药的情况,这种服药顺应性下降导致疗效和安全性下降的研究报告已很多见。因此,世界卫生组织(WHO)和美国食品药品监督管理局(FDA)等多个艾滋病抗病毒治疗指南均推荐使用复方制剂,减少服药次数、提高患者的顺应性[5]。
恩曲他滨替诺福韦片是高效抗反转录病毒联合治疗(HAART)的一线方案药物,由Gilead公司在美国批准上市,商品名为“Truvada”,尚未国产化。在对“Truvada”的调研中发现,由于该复方药物剂量较高(每片含FTC 200 mg和TDF 300 mg),“Truvada”片重达到1 g,对于部分患者,特别是国内患者存在难以吞服的问题。为增加患者的服药顺应性,本研究以Gilead公司的“Truvada”为对照品,在保证质量一致的基础上,改善片重,研发一种高载药量的片剂处方,并预期实现产品的工业化生产。
1 仪器与材料
DP30A单冲压片机(北京国药龙立科技有限公司);YD-35片剂硬度仪(天津市天大天发科技有限公司);RCZ-8M溶出试验仪(天大天发科技有限公司);ZB-2智能崩解仪(天大天发科技有限公司)。
恩曲他滨(安徽贝克联合制药有限公司,批号1410001,有效期2017年8月);富马酸替诺福韦二吡呋酯(安徽贝克联合制药有限公司,批号1406001,有效期2016年5月);微晶纤维素(安徽山河药用辅料股份有限公司);乳糖(DMV International);预胶化淀粉(安徽山河药用辅料股份有限公司);交联羧甲基纤维素钠(FMC Biopolymer);硬脂酸镁(安徽山河药用辅料股份有限公司);薄膜包衣预混剂(上海卡乐康包衣技术有限公司);95%乙醇(安徽安特食品股份有限公司);纯化水(自制);“Truvada”(美国吉利德公司,批号L117705D,有效期2016年9月)。
2 方法与结果
2.1检测方法
2.1.1溶出度取待测样品,照溶出度测定法(中国药典2010年版二部附录X C第二法),以0.1 mol·L-1盐酸溶液900 mL为溶出介质,转速为50 r·min-1,依法操作,在检测点时间,取溶液10 mL,用0.45 μm的滤膜滤过,精密量取续滤液2 mL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,高效液相法检测FTC、TDF的溶出量。
2.1.2含量及有关物质采用高效液相法检测FTC、TDF的含量和有关物质。
2.2对照品处方解析和自制品风险因素分析根据FDA对“Truvada”的审评资料,“Truvada”采用的辅料为乳糖、微晶纤维素、交联羧甲基纤维素钠(CMC-Na)、预胶化淀粉和硬脂酸镁,包衣材料为欧巴代包衣粉。处方解析:乳糖和微晶纤维素为填充剂,主要用于改善原料的可压性并有助于片剂的崩解;预胶化淀粉对容易水解的药物有保护作用,因为其本身可以优先吸附水分,从而减少原料与水分的接触,降低水解的发生,由于TDF对高湿不稳定,容易水解成单酯,因此使用预胶化淀粉作为稳定剂,同时预胶化淀粉还具有一定的填充和崩解作用;CMC-Na为崩解剂;硬脂酸镁为润滑剂。考察“Truvada”的性状、硬度、崩解时间、溶出和有关物质等各项质量指标,结果见表1。
通过对“Truvada”各指标的综合分析,确定目标产品开发中的风险因素:替诺福韦单酯是“Truvada”的主要有关物质,TDF遇湿热极易降解为替诺福韦单酯,在工艺制备过程中易发生降解,应将替诺福韦单酯做为高风险因素重点考察。目标产品为高载药量片剂,在保证与对照品质量一致的前提下需尽量减少辅料用量。减少辅料用量特别是填充剂用量,可出现颗粒的流动性、可压性等较差的问题,颗粒性质应作为高风险因素重点考察。按生物药剂学分类,FTC属于Ⅰ类药物,TDF属于Ⅲ类药物,在水中均有较高溶解性,“Truvada” 溶出检测结果表明其15 min释放可达90%以上。以15 min溶出大于85%为考察指标[6],即可说明产品溶出行为一致,因此溶出可作为低风险因素。根据分析结果,以高风险因素作为重点考察指标,进行处方的设计优化。

表1 “Truvada”质量指标测定结果
2.3稳定剂用量筛选以高风险因素替诺福韦单酯做为考察指标,考察预胶化淀粉对TDF的稳定效果。按处方1~4制备含有不同量预胶化淀粉的素片,置于40 ℃/75%RH恒温恒湿箱中加速10 d,高效液相法检测0 d和10 d时素片的有关物质,着重比较替诺福韦单酯的增幅,结果见表2。可见,未加入预胶化淀粉的处方(处方1)与其他各处方相比,替诺福韦单酯增幅最大,说明预胶化淀粉对本品确实有较好的稳定作用;处方3的预胶化淀粉用量,对片剂的稳定效果达到峰值,继续增加用量至处方4,替诺福韦单酯的增幅无显著变化,因此最终选择处方3的预胶化淀粉用量。
2.4填充剂用量筛选遵循在保证产品质量的前提下尽量提高载药量的原则,以高风险因素颗粒性质(包括休止角、压片外观)和素片质量(包括硬度、脆碎度和崩解时间)做为考察指标,进行填充剂用量的筛选,结果见表3。可见,由于载药量高,各处方颗粒流动性相对较差,但压片过程顺利,无裂片、黏冲等现象,可压性较好,且片重差异较小,认为颗粒流动性在可接受范围内。加入乳糖的处方(处方6、处方7)脆碎度增大,且造成崩解时间的延长,综合考虑认为单用微晶纤维素作为填充剂更为适合。比较不同微晶纤维素用量处方(处方5和处方8),各项指标差异无统计学意义,因此最终选择处方8的微晶纤维素用量。
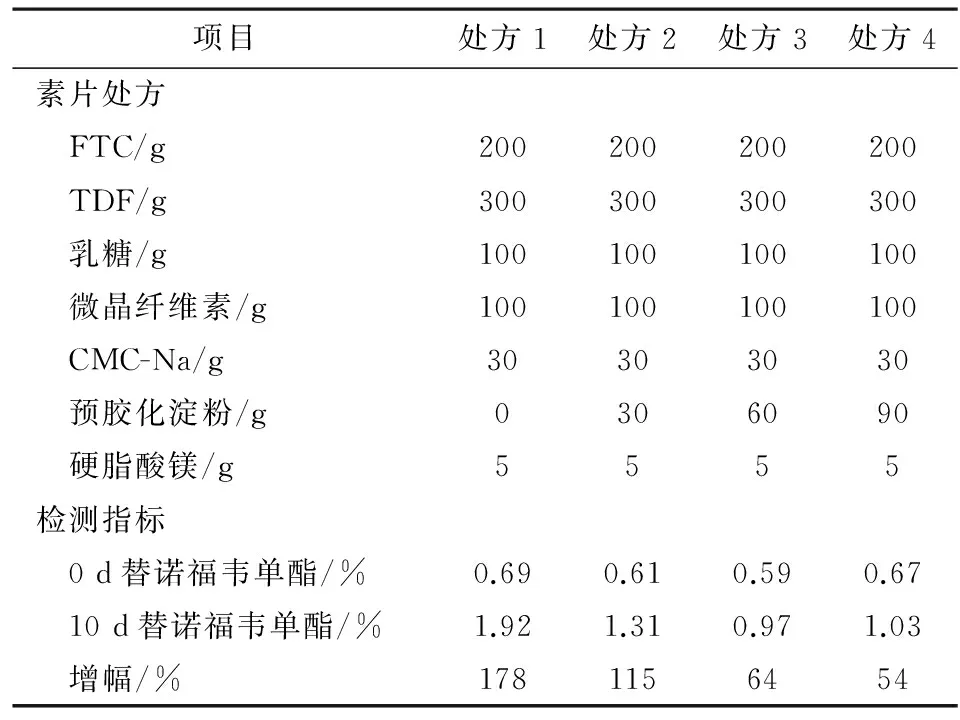
表2 稳定剂用量筛选试验结果

表3 填充剂用量筛选试验结果
2.5崩解剂用量筛选崩解剂的用量主要影响片剂的溶出速率,以15 min溶出为指标,考察崩解剂用量对溶出的影响,结果见表4。当崩解剂CMC-Na达到处方10用量时,15 min溶出量大于90%,与对照组相近,继续增加用量至处方11,溶出量无显著增加,因此最终选择处方10的崩解剂用量。
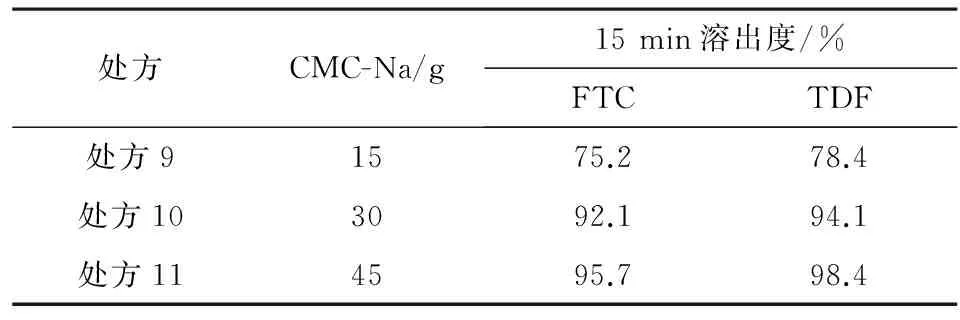
表4 崩解剂用量筛选试验结果
2.6黏合剂筛选在处方研发过程中发现,黏合剂中含水量的多少对产品的稳定性有较大影响,按处方12~14制备不同黏合剂的素片,置于40 ℃/75%RH恒温恒湿箱中加速10 d,高效液相法检测0 d和10 d时素片的有关物质,比较替诺福韦单酯的增幅,结果见表5。不同含水量的处方在0 d时替诺福韦单酯量差异无统计学意义,但加速放置后,含水量高的处方替诺福韦单酯大幅增加,提示本品在制粒过程中应严格控制水分。根据试验结果,最终选择95%乙醇作为黏合剂使用。

表5 黏合剂筛选试验结果

表6 产品验证结果
2.7产品验证根据以上试验结果确定的处方:每片含恩曲他滨200 mg,富马酸替诺福韦二吡呋酯300 mg,预胶化淀粉60 mg,微晶纤维素100 mg,交联羧甲基纤维素钠30 mg,硬脂酸镁5 mg,95%乙醇为黏合剂。该处方按常规湿法制粒方法操作,经过筛、混合、制粒、干燥、整粒、总混、压片、包衣等工序,进行实验室规模的放大,连续生产3批,每批2 500片。考察产品的重现性和稳定性,结果见表6。可见,本品与对照片“Truvada”性状、含量、溶出、主要杂质水平和加速稳定性等方面的检测结果相近,表明本品与对照品质量相近。
3 讨论
恩曲他滨替诺福韦片是抗逆转录病毒的一线用药,国内需求量大,但尚未实现产品的国产化。进口的原研片片型过大,不符合国内患者的服药习惯,造成国内患者服药顺应性低下。结合这一实际情况,开发了高载药量的恩曲他滨替诺福韦片,在与原研片保证质量一致的基础上,片重仅为原研片的70%,提高了国内患者的服药顺应性。研发结果证明,本品处方合理、工艺稳定,预期可进行进一步放大,实现产品的工业化生产。
[1]王芳菲,耿胜燕,何梅孜,等.恩曲他滨与替诺福韦的专利保护现状与市场应用前景分析[J].中国药物应用与监测,2014,11(5):318-321.
[2]吴立超,赵中夫,冯旭姣,等.关于恩曲他滨与拉米夫定治疗乙肝初治病人疗效研究[J].世界最新医学信息文摘,2016,16(7):80-81.
[3]周艳.替诺福韦酯联合拉米夫定治疗艾滋病合并乙型肝炎病毒感染的效果观察[J].河南医学研究,2016,25(4):746-747.
[4]丁天然,卢洪洲.替诺福韦抗病毒感染最新研究进展[J].世界临床药物,2014,35(8):453-457.
[5]沈银忠,卢洪洲.2011版艾滋病抗病毒治疗指南解读[J].世界临床药物,2012,33(3):183-187.
[6]牛剑钊,林兰,张启明,等.美国和日本溶出曲线相似性判定方法介绍[J].中国药物评价,2013,30(2):67-69.
Prescription development of high drug loading of emtricitabine tenofovir tablets
MA Yiming,JIA Dewu,TANG Jie,et al
(DepartmentofPharmacy,FirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
ObjectiveTo explore the formula of a high drug loading of emtricitabine tenofovir compound tablets,and to optimize its compatibility prescription program.MethodsBased on the analysis of the formulation and process of foreign drug,some pharmaceutical accessories were screened including stabilizers,fillers,disintegrants and binders,and the verification of the final amplification prescription was carried out in order to determine the reasonable and feasible prescription process.ResultsSome high-risk factors identified by prescription analysis were used as indexes,and then the prescription of high drug loading of emtricitabine tenofovir tablets was obtained,which was 200 mg emtricitabine,300 mg tenofovir disoproxil fumarate,60 mg pre-gelatinized starch,100 mg microcrystalline cellulose,30 mg cross-linked sodium carboxymethyl cellulose,5 mg magnesium stearate,and 95% ethanol as a binder in each tablet.The compared results between the tablets prepared by above-mentioned prescription and the reference sample were consistent.ConclusionsThe screened prescription process of emtricitabine tenofovir compound tablets was reasonable and feasible with high reproducibility and stability.
Emtricitabine;Tenofovir;Drug compounding
10.3969/j.issn.1009-6469.2016.08.015
2016-04-06,
2016-06-01)

