孝顺竹组培苗增殖培养影响因素探讨
李 佳 马晓月 张学英 高志民
(1 河北农业大学园艺学院 河北保定 071001 2 国际竹藤中心 国家林业局竹藤科学与技术重点开放实验室 北京 100102)
孝顺竹组培苗增殖培养影响因素探讨
李佳1马晓月1张学英1高志民2
(1 河北农业大学园艺学院 河北保定 071001 2 国际竹藤中心 国家林业局竹藤科学与技术重点开放实验室 北京 100102)
以孝顺竹组培苗为试材,研究了基本培养基、植物生长调节剂配比以及接种方式等对孝顺竹组培苗增殖培养的影响。结果表明,适宜孝顺竹增殖生长的培养基配方为MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1 g/L;对孝顺竹组培苗进行埋节处理可以提高增殖系数;同时孝顺竹组培苗去除顶梢后伤口下部竹节增大,有利于出现不定根,也可以提高增殖系数。
孝顺竹;组培苗;植物生长调节剂;增殖
孝顺竹(BambusamultiplexL.)别名慈孝竹、凤凰竹、蓬莱竹,属于禾本科(Poaceae)竹亚科(Bambuseae)箣竹属植物,为灌木型丛生竹。孝顺竹原产中国,主产于广东、广西、福建等省(区),山东青岛等地也有栽培,多生在山谷间、小河旁,是丛生竹中分布最北缘的竹种。
孝顺竹姿态飘逸、四季常绿,为历朝历代文人墨客所推崇,是高洁谦虚、至孝至诚的象征。孝顺竹具有较强的土壤层蓄水能力,具有固碳和净化空气的作用,是园林绿化中不可或缺的造景植物,被广泛用作绿篱和栅栏[1]。孝顺竹很少开花结实,传统的繁殖方法是母竹分株,竹秆、竹枝扦插或埋鞭、埋杆等,这些方法存在着消耗种竹多、种苗运输不便、劳动强度大、繁殖系数低、种苗质量差等诸多问题[2-3]。
生物技术是20世纪兴起的一项新技术,目前在植物育种上得到了广泛应用,但在竹子研究上的应用还不深入[4]。随着组织培养技术的日益发展,利用组培技术进行竹类植物的快速繁殖已经成为趋势,组织培养方法培育竹苗具有繁增殖系数高、质量均匀、脱毒复壮、便于运输等优点[5-6]。但是,竹子组织培养的发展比较缓慢,而中国作为竹子生产栽培与利用大国,从20世纪80年代以后才开始予以重视[7]。目前竹子组织培养存在繁殖系数低、容易褐化等诸多问题,还未能建立高效的再生体系,严重制约了组培快繁及基因工程育种的发展[8]。虽然已有关于孝顺竹愈伤组织及植株再生的研究报道[9],但对于孝顺竹组培苗增殖的研究却鲜有报道。本研究拟通过对孝顺竹组培苗增殖培养过程中的基本培养基选择、植物生长调节剂配比以及不同接种方式进行试验研究,以优化孝顺竹的组培快繁体系,同时为孝顺竹生物技术育种、转基因种苗的快速繁殖提供参考。
1 材料与方法
1.1 试验材料
孝顺竹茎段外植体采自国际竹藤中心安徽太平试验中心,经诱导分化后形成组培苗,用于增殖培养试验。
1.2 试验方法
1.2.1 不同基本培养基对增殖培养的影响
分别以1/2 MS培养基(附加蔗糖20 g/L,琼脂6 g/L)和MS培养基(附加蔗糖30 g/L,琼脂6 g/L)为基本培养基,另加活性炭1 g/L,6-BA浓度设为2.0 mg/L,pH值为5.8。接种材料培养在光照培养室内,温度为(25±2)℃,光照强度为1 500~2 000 Lx,光暗周期为12 h/12 h。接种40 d后,观察孝顺竹组培苗生长情况。
1.2.2 不同植物生长调节剂配比对增殖培养的影响
以MS培养基为基本培养基(附加蔗糖30 g/L,琼脂6 g/L),另加活性炭1 g/L,6-BA浓度设定为2.0 mg/L,NAA浓度设0、0.1、0.2、0.3、0.4、0.5、0.6 mg/L 7个处理,编号为1—7。NAA浓度设定为0.4 mg/L,6-BA浓度设1.0、2.0、3.0、4.0 mg/L 4个处理,编号为8—11。培养条件同上。40 d后,统计组培苗的增殖系数。增殖系数=总可分株数/接种株数。
1.2.3 上一代培养基对增殖培养的影响
将上述不同培养基处理的组培苗接入MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1 g/L的培养基中,培养条件同上,40 d后调查组培苗生长情况。
1.2.4 不同组培苗状态及接种方式对增殖培养的影响
将上一代孝顺竹组培苗在MS培养基中培养40 d后分株,取大小基本一致的有根及无根的组培苗,分别采用平放(相当于传统育种方式中的埋节处理)和直插2种方式接种于MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1 g/L培养基中;同时分株取大小基本一致的组培苗进行去除顶梢和保留顶梢处理,均采用直插方式接种于MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1 g/L培养基中,培养条件同上,接种40 d后调查组培苗增殖系数及生长状况。
2 结果与分析
2.1 不同基本培养基对增殖培养的影响
试验发现,以1/2MS培养基(附加蔗糖20 g/L,琼脂6 g/L)为基本培养基的组培苗生长细弱,颜色偏黄(图1),而以MS培养基(附加蔗糖30 g/L,琼脂6 g/L)为基本培养基的组培苗生长粗壮,颜色深绿(图2)。因此,认为孝顺竹组培苗继代培养的基本培养基为MS培养基(附加蔗糖30 g/L,琼脂6 g/L)比较适宜。

图1 1/2MS培养基继代苗

图2 MS培养基继代苗
2.2 不同植物生长调节剂配比对增殖培养的影响
NAA的不同浓度影响组培苗增殖系数,从试验结果(表1)可以看出,当6-BA浓度为2.0 mg/L、NAA浓度在0~0.6 mg/L范围内递增时,孝顺竹组培苗增殖系数随浓度的变化呈现先升高后降低的趋势。当NAA浓度为0.4 mg/L时,组培苗增殖系数最高,达到1.89,随NAA浓度继续上升,组培苗增殖系数反而降低,7个处理间的增殖系数差异显著(p<0.05)。组培苗的苗高和增殖系数具有相同的变化趋势,当NAA浓度为0.4 mg/L时组培苗苗高最高,平均为7.50 cm,且组培苗长势茁壮,植株整体为深绿色,根系发达。NAA浓度为0、0.1、0.2、0.5 mg/L的各处理间组培苗苗高无显著性差异。由此认为,当6-BA浓度为2.0 mg/L时,适宜孝顺竹增殖培养的NAA 浓度为0.4 mg/L。
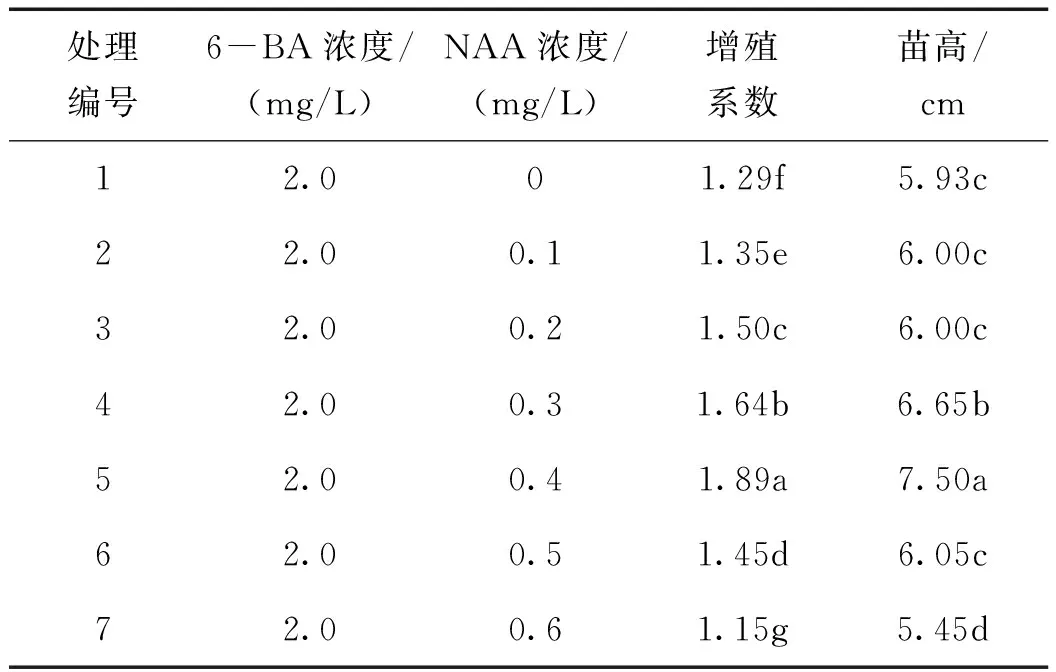
表1 NAA不同浓度对增殖培养的影响
注:采用Duncan多重比较法,同列不同小写字母表示在0.05水平差异显著;下同。
6-BA的不同浓度亦影响组培苗的增殖系数,从试验结果(表2)可以看出, NAA浓度为0.4 mg/L时,6-BA浓度在1.0~4.0 mg/L范围内递增,孝顺竹组培苗的增殖系数随浓度变化呈现先升高后降低的趋势。当6-BA浓度为2.0 mg/L时组培苗的增殖系数达到最大值,为1.99,显著高于其他处理;6-BA浓度继续上升,组培苗增殖系数反而降低。6-BA浓度为1.0 mg/L与3.0 mg/L处理间的增殖系数无显著性差异,但二者均显著高于4.0 mg/L处理。由此认为,当NAA浓度为0.4 mg/L时,适宜孝顺竹组培苗增殖培养的6-BA浓度为2.0 mg/L。
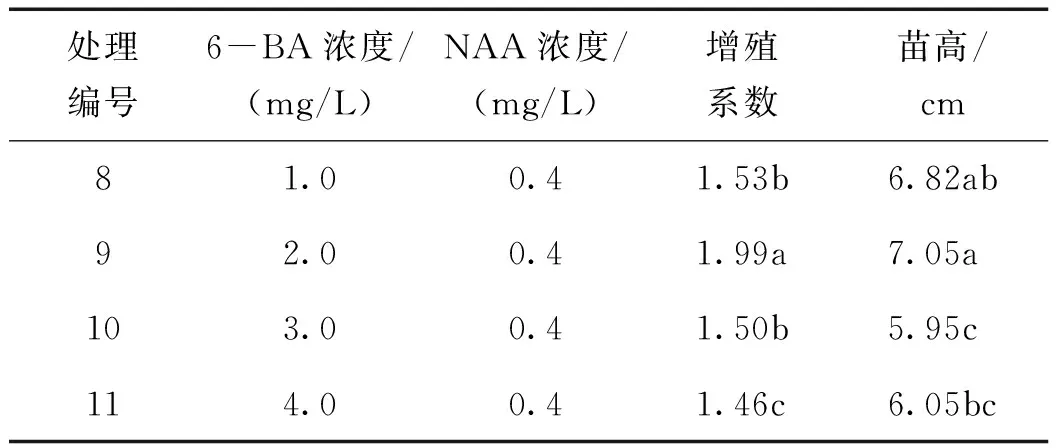
表2 6-BA不同浓度对增殖系数的影响
2.3 上一代培养基对组培苗增殖培养的影响
将上述编号为1—11的培养基中的组培苗接入MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1 g/L中,培养条件同上,培养40 d后,统计组培苗的增殖系数和生长情况并无明显差异,这表明在本试验所设定的不同植物生长调节剂配比对下一代组培苗生长无明显影响。
2.4 组培苗不同状态及接种方式对孝顺竹增殖培养的影响
在继代培养接种时,分割为单个芽且带有根的芽在继代培养基中较为容易成活,成长为丛芽,而不带根的芽则在继代培养基中逐渐变黄甚至死亡;平放与直插2种方式比较,直插接种芽增殖系数较高,叶深绿色,芽生长健壮,根系粗壮,须根多;平放式在节间可能出现不定根,进而产生新的植株,但是此法只适用于株高较高且靠近根部有突出竹节的竹苗,对于普通高度(4~6 cm)的组培苗,其叶片容易发黄老化从而无法形成丛生芽,导致其增殖系数较低。
将上一代组培苗在MS培养基中培养40 d后分株,取大小基本一致的芽苗进行去除顶梢和保留顶梢处理,均采用直插方式接种于MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+活性炭1g/L培养基中。接种40 d后调查发现,保留顶梢的组培苗生长正常,植株健壮,叶色深绿(图3);去除顶梢处理的组培苗生长情况与保留顶梢处理的组培苗无明显差异,但是去除顶梢处理的组培苗伤口下端竹节加大加粗,更易产生气生根,从而可以增加增殖系数(图4)。

图3 保留顶梢继代苗

图4 去除顶梢继代苗
3 小结与讨论
植物生长调节剂的种类和浓度是影响组织培养成功的关键,不同植物种所添加的植物生长调节剂种类和浓度不同。有关研究表明,MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+椰子汁100 ml/L适宜孝顺竹增殖生长[10],所以在本次试验中也进行了6-BA 和NAA 2种植物生长调节剂配比的研究。本试验结果表明,最适宜孝顺竹组培苗增殖生长的培养基是MS+6-BA 2.0 mg/L+NAA 0.4 mg/L+1 g/L活性炭,增殖系数可达1.99。试验结果与前人研究有差异,可能是因为不了解椰子汁的成分而未添加椰子汁,也可能由其他原因造成,有待于进一步试验研究。
在孝顺竹组织培养研究中,对于基本培养基、植物生长调节剂和接种部位选择等研究较多,但是关于芽苗状态及接种方式对增殖培养影响的研究却鲜有报道。通常情况下,组培苗中一些带根的芽在继代培养基中较为容易成活成长为丛芽,而不带根的芽则在继代培养基中因难以吸收培养基中的营养物质而死亡。参考竹子传统的繁殖方式埋节、埋秆、扦插等繁殖方式[11],本试验中对孝顺竹组培苗也进行了埋节继代培养,竹节处易出不定根从而可以提高增殖系数,但是此法只适用于株高较高且靠近根部有突出竹节的组培苗,其他竹苗则由于顶端优势,影响其正常生长,导致叶片老化变黄,竹秆弯曲细弱,停止生长甚至死亡。同时,试验中也对孝顺竹是否保留顶梢进行了研究,结果发现适当去除顶梢有利于伤口下端的竹节膨大,进而有利于产生气生根,提高增殖系数。
试验发现,孝顺竹组培苗在MS培养基中培养时,继代周期为30~60 d,随着培养时间的延长,增殖系数增加,但是在50 d之后增殖倍数增加的幅度开始变小,竹苗加粗而且开始出现叶片变黄的现象,培养时间为30 d,增殖系数较低,无法满足试验需求。因此认为,孝顺竹组培苗的培养时间最好控制在40~50 d。
[1]刘正娥, 朱颜, 楼崇. 大量元素组成对孝顺竹苗组培快繁的影响[J]. 竹子研究汇刊, 2012, 31(1): 47-51.
[2]张光楚, 王裕霞, 谭源杰, 等. 丛生竹的组培快繁技术[J]. 竹子研究汇刊, 2004, 23(1): 13-20.
[3]李蓉, 曾炳山, 何高峰, 等. 竹子组织培养的研究进展及趋势[J]. 安徽农业科学, 2008, 36(11): 4405-4407.
[4]赵元, 曹雄丽, 温培才, 等. 应用竹子组培苗快速培育竹林的研究[J]. 林业调查规划, 2012, 37(6): 132-133.
[5]徐强兴, 杨广超. 吊丝球竹的组培快繁技术研究[J]. 广东农业科学, 2007(2): 42-44.
[6]郭献煌. 竹子的组培繁殖技术[J]. 林业实用技术, 2006 (8): 27-28.
[7]刘晓光, 刘海英, 张东远, 等. 竹子生物技术育种研究进展[J]. 河北农业大学学报, 2002, 25(增刊1): 152-154.
[8]姚娜. 竹子组织培养与毛竹愈伤组织分化中基因表达分析[D]. 北京: 中国林业科学研究院, 2010.
[9]袁金玲, 顾小平, 李潞滨, 等. 孝顺竹愈伤组织诱导及植株再生[J]. 林业科学, 2009, 45(3): 35-39.
[10]李云海, 陈丽华, 杨娟, 等. 孝顺竹外植体适宜消毒方法及丛芽诱导培养基的筛选[J]. 云南农业科技, 2008 (2): 18-19.
[11]高志民, 谢锦忠. 竹子组织培养技术研究进展[J]. 世界竹藤通讯, 2013, 11(2): 1-6.
Influencing Factors to Proliferation Culture ofBambusamultiplexPlantletsinvitro
Li Jia1Ma Xiaoyue1Zhang Xueying1Gao Zhimin2
(1 College of Horticulture, Agricultural University of Hebei, Baoding 071001, Hebei, China 2 International Center for Bamboo and Rattan, Key Laboratory on the Science and Technology of Bamboo and Rattan,Beijing 100102, China)
Theinvitroplantlets ofBambusamultiplexwere selected as test materials to study the effects of the basic media, plant growth regulators and the inoculation methods on the plantlet proliferation culture.The results indicated that the suitable medium formula for the plantlet proliferation culture was MS + 6 - BA 2.0 mg/L + 0.4 mg/L NAA + activated carbon 1 g/L. The treatment of burying internodes into medium could increase the proliferation coefficient of the bamboo plantlets. Meanwhile, the removal of plantlet top could contribute to the enlargement of the nodes at lower parts, and thus induce the formation of adventitious roots, which could also lead to the improvement of proliferation coefficient.
Bambusamultiplex, plantletsinvitro, plant growth regulator, proliferation
林业公益性行业科研专项(编号:201504106)。
李佳,女,在读硕士生,从事果树生物技术研究。E-mail: lijia1203@163.com。
张学英,女,教授,硕士生导师,研究方向为果树生物技术。E-mail: zhangxueying1996@163.com。
高志民,男,研究员,博士生导师,研究方向为竹藤生长发育的分子基础。E-mail: gaozhimin@icbr.ac.cn。
10.13640/j.cnki.wbr.2016.04.002

