质谱检测泰乐菌素的方法研究进展
周秀锦,张 静,林维宣,王秋燕,周向阳
(1.舟山出入境检验检疫局,浙江舟山 316000;2.辽宁出入境检验检疫局,辽宁大连 116001)
质谱检测泰乐菌素的方法研究进展
周秀锦1,张 静1,林维宣2,王秋燕2,周向阳1
(1.舟山出入境检验检疫局,浙江舟山 316000;2.辽宁出入境检验检疫局,辽宁大连 116001)
广泛应用于医学和兽医学领域的泰乐菌素具有中谱抗菌功能和动物生长促进作用,在各种介质中的污染状况和环境行为备受关注,质谱检测技术由于具有高效、稳定、高灵敏度等特点,成为泰乐菌素检测的主要手段。重点介绍2011年以来不同基质中泰乐菌素的样品前处理方法,以及LC-ESI-MS/MS、LDTD-APCI-MS/MS、LC-SALDI-MS 、LC-Q-Orbitrap等各种质谱检测技术的研究进展,以期为同类研究提供一定的参考。
泰乐菌素;样品前处理;质谱;检测技术
随着社会的进步和人们生活水平的日益提高,人们对食品质量安全越来越重视。泰乐菌素是大环内酯类抗生素(macrolide antibiotics,MALs)中一类非常重要的抗菌化合物,同时也是一种重要的动物生长促进剂,广泛地应用于医学和兽医学等领域。随着研究的不断深入,泰乐菌素等大环内酯类抗生素的潜在危害逐渐被发现。泰乐菌素药物作为动物食品中的药物残留其检测技术也成为国内外研究的热点,而抗生素的发现和检测主要得益于检测技术的发展,液相色谱-质谱联用技术具有高灵敏度、高分辨率、低检出限等优点,该技术的应用使抗生素检测技术迈上了更高平台。笔者综述了2011年以来国内外泰乐菌素质谱检测技术,以期为同类研究提供一定的参考。
1 泰乐菌素样品前处理
自2012年以来,国内外对泰乐菌素研究较多的领域主要集中在畜禽[1-7]、蜂蜜[8]、水[9-11]、底泥[10]、粪便[12-14]、水产品[15-19]、婴儿食品[20]、尿液[21]、奶制品[22-23]等样品的分析。大环内酯类药物为弱碱性化合物,在酸性(pH<4.0)和碱性(pH>9.0)条件下均不稳定,且大环内酯类药物能与阳离子特别是那些含有Ca2+和Mg2+形成螯合物。以上多种基质样品的前处理多采取酸化乙腈和/或缓冲液提取,固相萃取柱净化和浓缩各种基质中的泰乐菌素,具体见表1。雷晓宁等[11]采用在40 ℃下用乙腈-磷酸盐缓冲溶液(pH 8.0)萃取5 min,循环3次,活性污泥样品中泰乐菌素的回收率达到80.8%~88.7%。Dickson LC等[19]在水产品试样中加入3颗9 mm钢珠和乙腈水,快速摇动5 min,离心后转移上清液提取,再用乙腈和磷酸缓冲液重复提取,不仅钢珠能再次破坏鱼虾组织,促进二次萃取溶剂完全渗透,磷酸缓冲液也可将螯合的泰乐菌素提取出来,获得较好的回收率。粪便样品多采用Mcllvaine缓冲液/EDTA缓冲液提取。万位宁等[14]比较了EDTA-McIlvaine 无机提取液、甲醇和乙腈有机提取液单独及混合使用时各目标物的回收率。结果发现,单独使用 EDTA-McIlvaine 提取液,可有效减少抗生素与粪便中金属离子螯合,但共提取杂质过多会干扰待测物出峰,并抑制质谱离子化过程,还易堵塞 SPE装置,或导致串联SAX柱过早吸附饱和,且单独使用有机溶剂时,同时检测的多种目标物回收率效果不理想,最终采用 EDTA-Mcllvaine缓冲液提取,再以甲醇混合乙腈进行提取的回收率较高。Berendsen B J等[13]比较了振荡和超声提取粪便样品中泰乐菌素,结果发现,超声提取效率并不优于振荡,由于振荡操作简单,批量处理作为首选。Morgan S等[12]用pH 5的McIlvaine和EDTA缓冲液与甲醇为提取液,25 ℃超声波提取15 min泰乐菌素,柠檬酸调整上层清液pH在5~4,Stratax-C柱净化,柠檬酸不仅能保持目标化合物的温度,并且去除了目标化合物与阳离子之间的离子键,降低基质干扰。田丰等[17]对比磷酸盐缓冲溶液、0.3% 偏磷酸-甲醇溶液、乙腈、Tris溶液和乙酸盐溶液提取5种大环内酯类药物,Tris溶液作为提取液时,5种大环内酯类抗生素的回收率在78.4%~99.1%范围;同时对Varian C18、Oasis HLB(500 g)、Oasis HLB(200 g)、MCX和 Bakerbond SPE C185种固相萃取柱的效率做了比较,Oasis HLB(500 g)固相萃取柱的效果最理想,这和万位宁等[14]、雷晓宁等[11]、王莹等[6]的选择一致。SPE C18柱常用于许多中等或低极性药物的净化,其净化机制主要是疏水作用,也有一定的阳离子交换作用,但是对复杂基质的样品净化效果不好;SPE SCX柱采用硅胶基苯丙磺酸填料物,兼有阳离子交换作用和疏水作用机制,采用其净化有一定的效果,但回收率并不理想;SPE HLB柱对极性化合物具有优异的保留能力,其相对保留容量比传统硅胶基质SPE吸附剂(如C18)较高。Morgan S等[12]则选择StrataX-C阳离子交换柱,调上清液pH在4~9,可去除粪便基质中大部分的干扰物质。QuEChERS方法是近年来国际上最新发展起来的一种多残留快速筛选的基质分散净化技术,是利用吸附剂填料与基质中的杂质相互作用,吸附杂质从而达到除杂净化的目的。Renata PL等[1]采用QuEChERS方法处理鸡肉样品,前处理过程非常快速、方便、廉价、有效、坚固耐用、安全,但他指出EDTA缓冲液和PSA共同提取鸡肉样品中的泰乐菌素,提取效率反而比乙腈差。Wei Jia等[22]优化了婴儿食品的提取步骤,认为乙腈-水(84∶16,V/V)是最适宜的提取溶剂,因为它能快速沉淀蛋白质,又与水有很好的互溶性,减少了脂溶性物质的提取,大大降低了基质干扰,提高了检测的灵敏度和回收率。
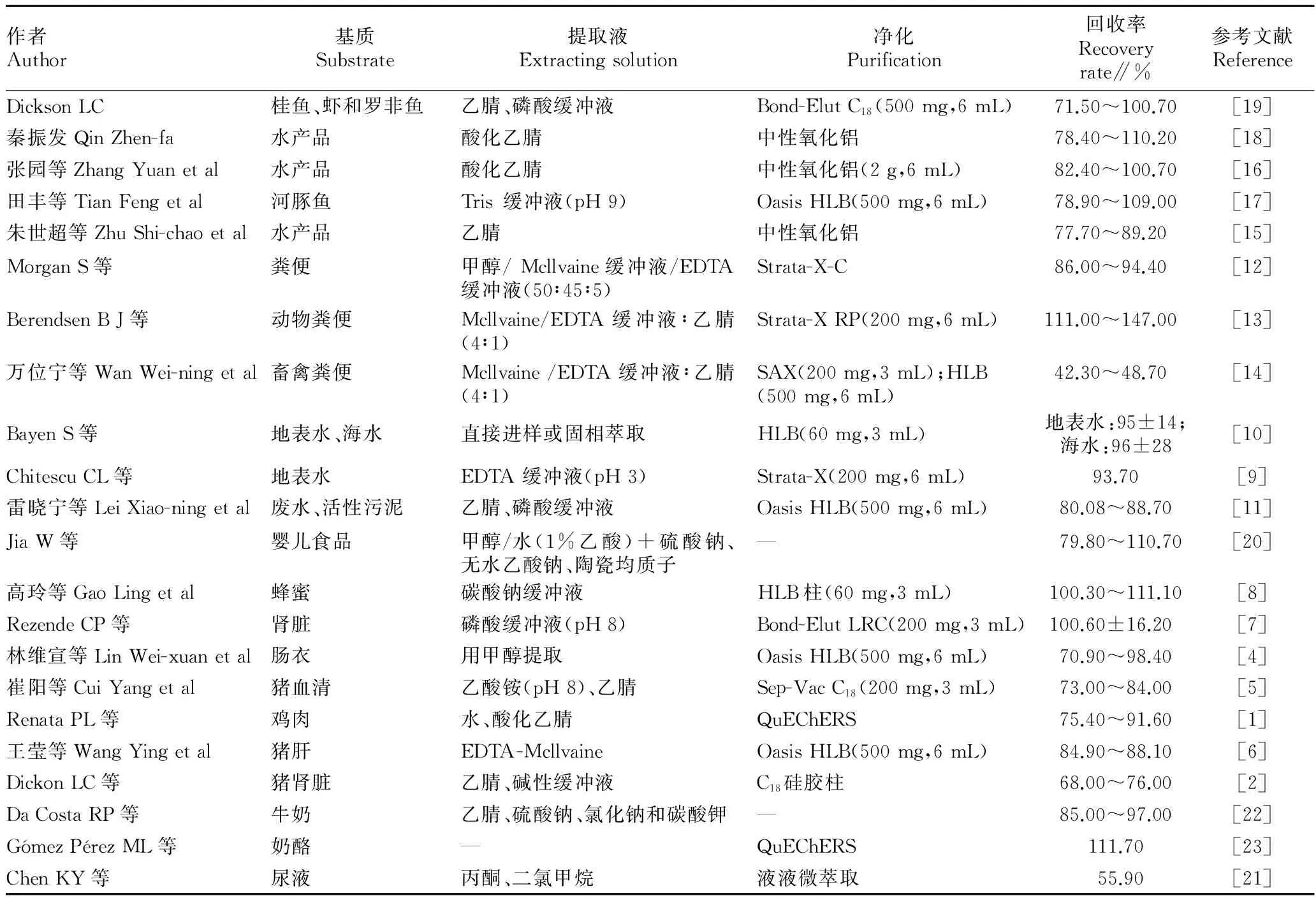
表1 不同基质中泰乐菌素的样品前处理方法及回收率
2 泰乐菌素质谱分析方法
2.1LC-ESI-MS/MS方法目前LC-ESI-MS/MS是检测基质中泰乐菌素常用的方法,但是该方法受耐盐能力较低及分析物必须以气态进入质量分析器等条件限制,在实际检测中需要优化色谱、质谱条件,以提供整体最佳的峰值形状,最大限度地提高方法的灵敏度和分辨率,主要色质谱参数具体见表2。Renata PL等[1]比较了甲酸水溶液-甲醇和甲酸水溶液-乙腈 2 种流动相的分离效果,结果显示,甲酸-乙腈作流动相时的响应值和峰形更好,朱世超等[15]在研究中得到同样的结论。雷晓宁等[11]则比较了乙酸铵-乙腈和乙酸铵-甲醇作为流动相的效果,结果发现使用10 mmol/L乙酸铵-乙腈作为流动相时的响应值和分离效果最佳[11]。Berendsen BJ等对比了Phenomenex Kinetex C18、Kinetex C18XB、Waters ACQUITY UPLC BEH C18、HSS-T3和Waters Cortecs C18质谱柱分离粪便中46种药物残留的效果,发现使用Kinetex C18XB色谱柱分离效果最好,两性化合物在其他4种质谱柱上显示峰形较宽,分离效果不佳[13]。Berendsen BJ等[13]、Dickson LC等[19]、朱世超等[15]为了在一定程度上消除基质效应的影响,根据试样制备相应的空白样品提取液作为标准液的稀释溶液,这使得标准品和样品液具有一样的离子化条件,降低基质效应。
ESI+模式下泰乐菌素以[M+H]+为分子离子峰,MRM 模式检测泰乐菌素,其定性和定量离子对为916/174、916/145和916/772。LC-ESI-MS/MS检测水产品中的泰乐菌素,方法的检出限和定量限分别为0.5~1.0 μg/kg和1.0~4.0 μg/kg;由于基质不同,LC-ESI-MS/MS检测其他基质中的泰乐菌素,方法的灵敏度和定量限各有不同,具体见表2。张园等[16]以罗红霉素为内标,先用乙腈提取,中性氧化铝柱净化,LC-ESI-MS/MS检测,检出限为 0.5 μg/kg,定量限为 1.0 μg/kg,回收率为 82.40%~100.70%;Bayen S等[10]无需样品前处理直接进样,LC-ESI-MS/MS分析了地表淡水和海水7种抗生素(磺胺嘧啶、磺胺甲基嘧啶、磺胺甲恶唑、磺胺二甲嘧啶、氯霉素、林可霉素、泰乐菌素)的检测结果,泰乐菌素的定量限为0.16 ng/L,但是直接进样会造成设备污染,增加维护保养频率和降低设备使用寿命[10]。

表2 不同基质中泰乐菌素的LC-ESI-MS/MS方法
2.2LDTD-APCI-MS/MS方法LDTD高速热解析化学电离源,是一种激光辅助的无接触、热解析化学电离质谱快速分析技术。LDTD与串联质谱(MS/MS)或高分辨质谱联用,利用高灵敏度的多反应离子检测(MRM)、快速正负离子切换及高灵敏度全扫描等功能,4~6 s内实现液体样品的定性和定量分析。LDTD-MS/MS保持了串联质谱的高选择性,增加了快速和极高分析通量的特点,适用于有大批量待检样品的生物医药分析、药物发现与开发、药品毒理研究、滥用药物检测、食品检测、环境污染物分析等领域。
Morgan S等[12]首次报道了LDTD-APCI-MS/MS方法分析粪便中甲氧苄啶、磺胺多辛、林可霉素和泰乐菌素的测定。McIlvaine缓冲液和甲醇作为提取剂,超声提取,阳离子交换柱固相萃取净化,选择反应监测模式检测。为避免检测过程中的基体效应,在粪便中添加甲氧苄啶、磺胺多辛、林可霉素和泰乐菌素药物残留500 μg/kg的目标分析物,正离子模式下优化了激光功率、激光模式、沉积量、载气流量和沉积溶剂等LDTD参数以提高检测信号强度。在APCI和ESI源下分别优化了泰乐菌素的MS/MS参数:916/174和916/772离子对,最优的激光能量设定在50%,最优的激光模式为2 s,0.5 s步幅内从0%变化到50%,由于泰乐菌素的较高分子量,保留时间设定为1 s。流动相为甲醇-水(90∶10,V/V)、进样量为3 mL时信噪比最高、基质效应最低。该方法的检出限为2.5~8.3 μg/kg,定量限为8.3~28.0 μg/kg,该方法已成功地应用于实际的粪便样本检测。
2.3LC-Q-Orbitrap方法Q-Orbitrap 是傅立叶变换质谱的一种,将高性能四级杆的母离子选择性与高分辨的准确质量数(HR/AM)Orbitrap检测技术相结合,提供优异性能和出色多功能性。Q-Orbitrap质谱仪能进行高精度的目标物或非目标物筛选,同时也能实现大范围的定性和定量分析检测。
Wei Jia等[20]采用超高效液相色谱-电喷雾四极Orbitrap高分辨质谱(UPLC-ESI Q-Orbitrap)同时筛选婴儿食品的包含泰乐菌素的333种农药和兽医药物残留,流动相为甲醇和FAC/甲酸铵,色谱柱为QC18柱,目标分析物的主要离子为[M+NH4]+,正、负离子模式全纪录色谱扫描。该方法通过2002/657/EC和SANCO/12571/2013的验证,方法的回收率为79.8%~110.7%,方法定量限为0.01~9.27 μg/kg。Chitescu CL等[9]采用固相萃取和LC-Q Exactive Orbitrap高分辨质谱筛选和确证多瑙河流域的67药物残留研究,75%的化合物回收率在85%~115%,10%的化合物回收率在65%~85%。正、负离子模式全扫描,m/z为200时的分辨率为70 000 FWHM,自动增益设定在3e6,进样时间设定在200 ms,扫描速率2次/s。泰乐菌素的扫描模式为正离子扫描,主要离子形式为[M+H]+,母离子m/z为916.526 4,主要子离子m/z为174.112 7、116.070 7和156.101 8,该方法中水样的基质效应抑制了泰乐菌素12%的响应值,方法检出限为9.7 ng/L,定量限为29.4 ng/L。
2.4LC-SALDI-MS方法 SALDI-MS是基于纳米材料的免有机基质的激光解吸离子化质谱,形成质子化、碱金属加成的[M+H]+、[M+Na]+、[M+K]+或脱氢得到[M-H]+等系列准分子离子,在质谱系统中得以分离和检测。分析中使用的起到能量转移作用的纳米材料在低分子量区间不会产生背景干扰峰,可以将分析对象由大分子扩展到小分子。另外,SALDI-MS还具有许多其他优点,如样品制备简单、信噪比高、耐盐性好、基底表面信号重复性好及可实现样品的定量分析等,是检测的新方法。
Chen KY等[21]采样液液微萃取-表面辅助激光解吸电离质谱检测了人体尿液中的大环内酯类抗生素,丙酮作为分散剂,二氯甲烷作为萃取溶剂,丙酮和二氯甲烷混合液快速加入样液中提取,离心收集下层提取液并吹干,胶体银溶液溶解残渣,表面辅助激光解吸电离质谱检测,该方法红霉素、螺旋霉素、替米考星和泰乐菌素的检测限(LOD噪声比为3)分别为在2、3、3和2 nmol/L,在线性范围内由于提取溶剂的极性低,红霉素、螺旋霉素、替米考星和泰乐菌素的回收率相对较低,分别为46.3%、48.2%、54.7%和55.9%,若采用有机溶剂和高极性或离子液体有机溶剂,或可提高回收率。DLLME技术不仅可有效地消除复杂的生物基质抑制效应,又能在10 min内完成尿液中大环内酯类抗生素的筛选。3结语
该研究主要对检测泰乐菌素的多种质谱分析方法进行了综述和介绍,但并不是所有的方法都是经过验证并用于定量分析,只能为新方法的开发奠定坚实基础。目前应根据样品基质种类、设备及分析目的建立快速、合适的前处理方法及快速、灵敏、准确、可靠的质谱分析方法,为可能引起公众健康安全危险的物质的监管提供技术支撑。
[1] RENATA P L,ROCO C R,ROBERTO R G,et al.Development and validation of a multiclass method for the determination of eterinary drug residues in chicken by ultra high performance liquid chromatography-tandem mass spectrometry[J].Talanta,2012,89:201-208.
[2] DICKSON L C,O’BYRNE C,CHAN W.A quantitative method for residues of macrolide antibiotics in porcine kidney by liquid chromatography/tandem mass spectrometry[J].J AOAC Int,2012,95(2):567-575.
[3] 班付国,胡兴娟,吴宁鹏,等.超高效液相色谱-串联质谱法测定猪肉中66种兽药残留的研究[J].中国兽药杂志,2014,48(6):40-51.
[4] 林维宣,陈溪,张宁,等.LC-MS/MS测定肠衣中7种大环内酯类抗生素残留量[J].食品研究与开发,2012,33(9):123-128.
[5] 崔阳,王冰,徐刚,等.超高效液相色谱-串联质谱法检测猪血清中泰乐菌素残留的建立[J].东北农业大学学报,2011,42(9):125-130.
[6] 王莹,张素霞,程林丽,等.超高效液相色谱-串联质谱法检测猪肝中乙酰异戊酰泰乐菌素残留[J].中国畜牧兽医,2011,38(10):224-227.
[7] REZENDE C P,SOUZA L F,ALMEIDA M P,et al.Optimisation and validation of a quantitative and confirmatory method for residues of macrolide antibiotics and lincomycin in kidney by liquid chromatography coupled to mass spectrometry[J].Food additives and contaminants,2012,29(4):587-595.
[8] 高玲,张丹,郭栋,等.高效液相色谱-质谱法检测蜂蜜中的大环内酯类药物残留[J].光谱实验室,2012,29(6):3568-3572.
[9] CHITESCU C L,KAKLAMANOS G,NICOLAU A I,et al.High sensitive multiresidue analysis of pharmaceuticals and antifungals in surface water using U-HPLC-Q-Exactive Orbitrap HRMS.Application to the Danube river basin on the Romanian territory[J].Science of the total environment,2015,532:501-511.
[10] BAYEN S,YI X,SEGOVIA E,et al.Analysis of selected antibiotics in surface freshwater and seawater using direct injection in liquid chromatography electrospray ionization tandem mass spectrometry[J].Journal of chromatography A,2014,1338:38-43.
[11] 雷晓宁,方小丹,鲁建江,等.HPLC-ESI-MS/MS检测典型废水与活性污泥中4种大环内酯类抗生素[J].分析测试学报,2013,32(6):715-720.
[12] MORGAN S,DANIEL M S S.Analysis of trimethoprim,lincomycin,sulfadoxin and tylosin in swine manure using laser diode thermal desorption-atmospheric pressure chemical ionization-tandem mass spectrometry[J].Talanta,2014,128:23-30.
[13] BERENDSEN B J,WEGH R S,MEMELINK J,et al.The analysis of animal faeces as a tool to monitor antibiotic usage[J].Talanta,2015,132:258-268.
[14] 万位宁,陈熹,居学海,等.固相萃取-超高效液相色谱串联质谱法同时检测禽畜粪便中多种抗生素残留[J].分析化学,2013,41(7):993-999.
[15] 朱世超,钱卓真,吴成业.水产品中7种大环内酯类抗生素残留量的HPLC-MS/MS测定[J].南方水产科学,2012,8(1):54-60.
[16] 张园,吴成业,赵春晖,等.液相色谱质谱联用法测定水产品中泰乐菌素残留方法的研究[J].南方水产科学,2013,9(2):57-62.
[17] 田丰,王飞,吕鹏,等.HPLC-ESI-MS/MS检测河豚鱼中5种抗生素残留的方法[J].食品科学,2012,33(18):206-210.
[18] 秦振发.水产品中泰乐菌素残留量的液质联用检测方法[J].南方农业,2014,8(18):162,170.
[19] DICKSON L C.Performance characterization of a quantitative liquid chromatography-tandem mass spectrometric method for 12 macrolide and lincosamide antibiotics in salmon,shrimp and tilapia[J].Journal of chromatography B,2014,967:203-210.
[20] JIA W,CHU X,LING Y,et al.High-throughput screening of pesticide and veterinary drug residues in baby food by liquid chromatography coupled to quadrupole Orbitrap mass spectrometry[J].Journal of chromatography A,2014,1347:122-128.
[21] CHEN K Y,YANG T C,CHANG S Y.Determination of macrolide antibiotics using dispersive liquid-liquid microextraction followed by surface-assisted laser desorption/ionization mass spectrometry[J].J Am Soc Mass Spectrom,2012,23(6):1157-1160.
[22] DA COSTA R P,SPISSO B F,PEREIRA M U,et al.Innovative mixture of salts in the quick,easy,cheap,effective,rugged and safe method for the extraction of residual macrolides in milk followed by analysis with liquid chromatography and tandemmass spectrometry[J].J Sep Sci,2015,38(21):3743-3749.
Research Progress of the Mass Spectrometry Detection Method of Tylosin
ZHOU Xiu-jin1, ZHANG Jing1, LIN Wei-xuan2et al
(1. Zhoushan Entry-exit Inspection and Quarantine Bureau, Zhoushan, Zhejiang 316000; 2. Liaoning Entry-exit Inspection and Quarantine Bureau, Dalian, Liaoning 116001)
Tylosin has a spectrum of antibacterial function and animal growth promoting effect, which is harm to humans and the environment, and arouses widespread attention.The mass spectrometry has become the major method for the determination of tylosin due to high efficiency, stability and sensitivity. In this research, we mainly introduced the sample pretreatment methods of tylosin in different substrates since 2011, as well as the research progresses of various mass spectrometry detection technologies, such as LC-ESI-MS/MS, LDTD-APCI-MS/MS, LC-SALDI-MS and LC-Q-Orbitrap. This research provides certain
for the further studies in similar works.
Tylosin; Sample pretreatment; Mass spectrometry; Detection technology
国家科技支撑项目(2012BAD29806);国家质检总局公益项目(201310140)。
周秀锦(1974-),女,河南周口人,高级工程师,硕士,从事食品质量安全及标准化研究。
2016-06-24
S 816.73
A
0517-6611(2016)23-031-04

