Wnt信号通路与心脏发育和心肌诱导分化
黄巧丽, 周 华, 李 涛
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
Wnt信号通路与心脏发育和心肌诱导分化
黄巧丽,周华,李涛
(浙江师范大学 化学与生命科学学院,浙江 金华321004)
Wnt信号通路是调控心肌细胞分化和心脏发育的重要信号通路.在哺乳动物中,迄今已发现19个分泌性Wnt蛋白,10个Frizzled受体和多个拮抗分子,显示Wnt信号家族效应广泛复杂.Wnt通路大致分为β-catenin依赖的经典通路和β-catenin非依赖的非经典通路,二者均在心脏发育中发挥重要的作用,广泛调控心肌细胞的增殖、分化、黏附、迁移和极化等.研究发现,Wnt信号通路在心肌细胞分化进程中存在明显的阶段特异性效应,呈现典型的双相性作用.通过小分子或转基因等调制Wnt信号通路,可有效提高体外多能干细胞向心肌的诱导分化效率.
Wnt信号通路;心脏发育;心肌诱导分化;干细胞
1 Wnt信号通路主要成员
Wnt信号通路的主要成员有:分泌性信号蛋白(Wnt)、跨膜受体、胞质蛋白及核内转录因子等.胞质蛋白包括散乱蛋白(disheveled,Dsh或Dvl)、β-连环蛋白(β-catenin)、结肠腺瘤样息肉病蛋白(APC)、糖原合成酶激酶3β(GSK3β)和轴蛋白(Axin).转录因子为T细胞因子/淋巴增强因子(Tcf/Lef)[1-2].
Wnt蛋白是一类分泌型糖蛋白,以旁分泌的形式激活不同的信号转导通路而在靶细胞内起作用.在哺乳动物细胞基因组中,目前已经鉴定出19个不同的Wnt基因.Wnt蛋白合成后需要进行翻译后修饰,包括N-连接的糖基化和脂酰化修饰,如棕榈酰化等,然后被分泌出细胞,通过旁分泌的形式与细胞膜上的受体相互作用而发挥其功能.根据作用机制不同,Wnt信号的传导被分为2类——经典通路和非经典通路.属于经典通路的Wnt分子包括Wnt1,Wnt2,Wnt3,Wnt3a,Wnt8和Wnt10a等;而非经典Wnt通路则包括Wnt4,Wnt5a,Wnt5b,Wnt6,Wnt7b和Wnt11等.
Wnt信号传导主要通过Frizzled受体实现,这是一类七次跨膜蛋白,胞外N端很长,含有一个保守的由10个半胱氨酸组成的结构域,被称为CRD(cysteine riched domain).分泌性Wnt信号分子与胞膜上Frizzled受体的CRD结构域结合,发挥信号转导功能.果蝇和线虫中已经鉴定出了4种Frizzled受体,而小鼠和人类中这类受体的数量已经达到了10种.不同的Fzd受体倾向激活不同的下游信号通路,或经典或非经典.也有研究认为单一类型的Fzd受体可以激活2个Wnt下游途径.低密度脂蛋白受体相关蛋白(LRP)则是Wnt通路的辅受体,已知如LRP5和LRP6,是一类单次跨膜蛋白,与Frizzled受体及Wnt配体组成三联体,启动下游信号,在Wnt/β-catenin的活化过程中发挥重要的作用.此外,还发现了非Frizzled受体,包括单次跨膜酪氨酸受体中的Ryk和Ror家族受体,前者通过Wnt抑制因子结构域、后者通过胞外区的CRD结构域与Wnt配体结合,发挥其功能[2].
此外,有很多内源性物质可以干扰Wnt信号通路,如DKK和SFRP.SFRP家族是分泌性卷曲相关蛋白,有与Frizzled同源的半胱氨酸富集区CRD,通过和Frizzled受体竞争或者直接和Frizzled受体结合,达到拮抗Wnt的目的.SFRP分子根据同源性分为3组.第1组:SFRP1,SFRP2和SFRP5;第2组:SFRP3和SFRP4;第3组:Sizzled和Crescent.其中,第3组成员在两栖动物、鱼和鸟类中出现,在哺乳动物中并没有相关报道[3].
β-catenin是Wnt经典通路的核心成分,由染色体3p21—22区的CTNNb1基因编码.β-catenin蛋白的一级结构包含150个氨基酸的N端、550个氨基酸中间连接臂和100个氨基酸的C端.N端是GSK3β磷酸化部位,介导降解作用;β-catenin的C端与核转录活性因子Tcf/Lef结合.正常功能状态下,大部分β-catenin被束缚在胞膜下与E-钙黏素(E-cadherin)结合,组成E-cadherin-β-catenin-α-catenin复合物,由α-catenin连接细胞骨架,参与细胞黏附;而其余部分与GSK3β,APC,Axin和酪蛋白激酶1(CK1)等共同形成的多聚蛋白复合物结合.β-catenin氨基端的第33,37和41位氨基酸分别被CKI和GSK3β顺序磷酸化,被磷酸化的β-catenin募集包含β-TrCP的E3泛素连接酶,使β-catenin发生泛素化,经泛素-蛋白酶体途径降解,从而使胞质内游离β-catenin维持较低的浓度.
2 Wnt信号通路主要活化方式
Wnt信号通路的主要活化方式分Wnt经典通路和Wnt非经典通路(见图1).
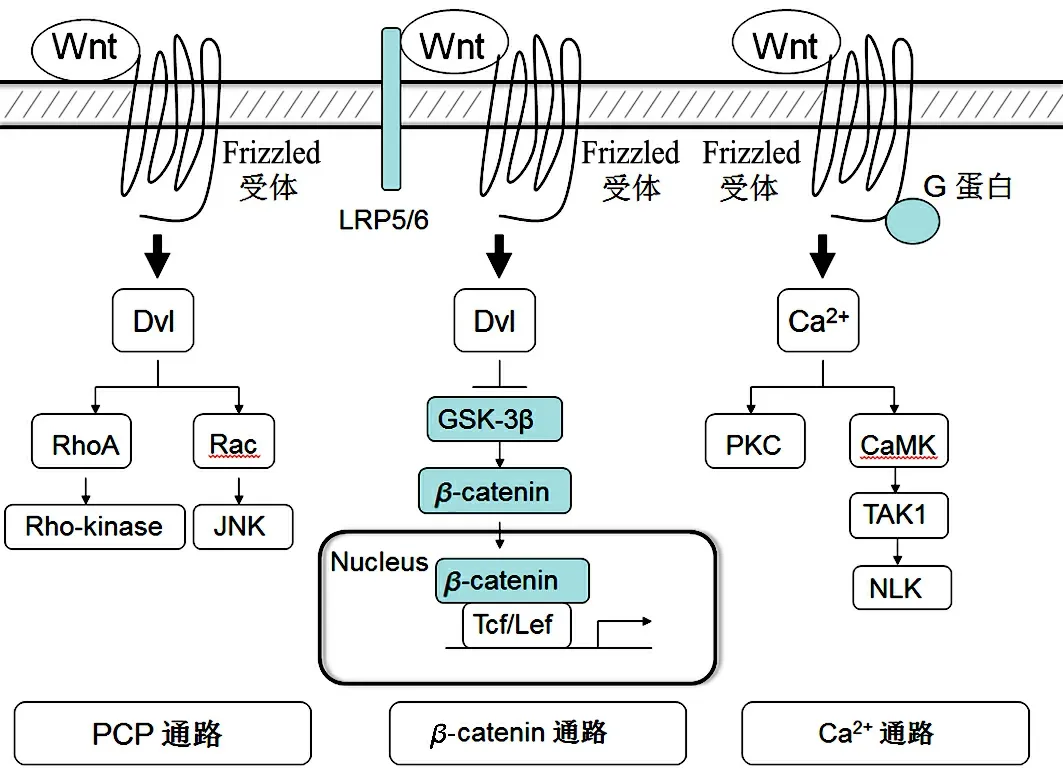
图1 Wnt信号通路激活模式图
2.1Wnt经典通路
经典Wnt/β-catenin通路,其最关键的特征是发生β-catenin胞浆内稳化和入核.当Wnt配体与细胞膜上的Frizzled受体及辅助受体LRP5/6结合时,胞浆内Dvl被募集,抑制GSK3β和CKI的活性,并通过固定Axin蛋白,拆解多蛋白复合物,解放被束缚的β-catenin,导致非磷酸化β-catenin在胞浆中富集,并入核结合到Tcf/Lef转录因子上形成转录复合体,开启靶基因的转录活化.AKT激酶亦可抑制GSK3β或直接磷酸化β-catenin,促其入核[4].静息期Tcf/Lef募集Goucho等抑制性分子结合于基因的启动子区,无法启动转录,靶基因处于沉默状态;β-catenin活化入核后,与Tcf/Lef分子相互作用,替代Goucho等抑制性分子,同时募集CBP/p300等转录活化子,协同激活下游靶基因的转录.Wnt经典通路的下游靶基因包括c-Myc,cyclinD1,BMP4,CD44,MMP7和IL-8等.Wnt经典通路的特点是无效应放大,但保证了信号的特异性.
2.2Wnt非经典通路
Wnt非经典通路通常与细胞骨架重排导致的细胞极性建立、细胞迁移和组织构型形成等有关.非经典通路又可分为Wnt/Ca2+通路和平面细胞极性(planar cell polarity,PCP)通路.Wnt/Ca2+通路活化时,Wnt分子与细胞表面的Frizzled受体结合,后者与异源三聚体的G蛋白偶联受体(GPCR)相连,而由G蛋白激活磷脂酶C(PLC),进一步激活下游通路使细胞内Ca2+浓度升高,进而激活Ca2+依赖的激酶,如蛋白激酶C(PKC)和钙调蛋白依赖性蛋白激酶II(CaMK II),以调节细胞运动和细胞黏附性.Ca2+浓度升高还可以激活钙调磷酸酶(CaN),后者可以使NFAT分子发生去磷酸化进而发生核转位,调控基因表达.PCP通路在果蝇翼翅中建立平面上皮细胞与临近细胞间的相对极性,并因此而得名,在哺乳动物的同系物是Wnt/JNK通路.该通路的主要特征为Wnt分子激活在经典通路中不发挥作用的Dvl蛋白DEP结构域,从而激活RhoGTP酶的家族成员(如RhoA,Rac和Cdc42),并进而激活下游效应分子,如JNK,PKC和Rho相关激酶(ROCK),主要调控细胞骨架重排和建立细胞极性,影响形态发生.同时,活化的JNK磷酸化下游转录因子ATF2及c-jun,以调控基因表达.
非经典Wnt信号通路与经典Wnt信号通路有很多的联系.有研究发现,Wnt5a可以通过Nemo样激酶抑制经典Wnt 信号通路中Tcf/Lef的转录活性[5].
3 Wnt信号通路与胚胎心脏发育和心肌诱导分化
在心脏发育过程中,Wnt分子及其受体呈高度异质性的时空表达,这提示Wnt信号在心脏早期发育中扮演着重要角色.Wnt信号通路几乎参与了心脏发育的所有阶段,即早期特化、心肌分化、心管环化、细胞迁移与扩增、腔室及瓣膜形成及传导系统构建等多个环节[6].干细胞向心肌分化的过程可按基因表达差异分成多个分化阶段,早期多能干细胞首先分化为BrachyuryT+中胚层细胞,继而分化为Mesp1+生心中胚层细胞,然后是表达心肌特异性转录因子的心肌前体干细胞最终发育为自发搏动的功能性心肌细胞.研究表明,Wnt通路在不同分化阶段作用不同[7].
3.1Wnt经典通路与心脏发育
关于Wnt经典信号具体是激活还是抑制心肌分化曾经存在激烈的争议,不同的实验模型得到的结论截然相反.在蛙胚和鸡胚模型,经典Wnt信号分子Wnt1和Wnt3a等在神经板和背侧神经管处的表达被认为是抑制该部位向心肌分化的主要原因.Wnt/β-catenin在前中胚层的活化抑制了生心新月区的形成,以及心肌特异性转录因子基因Nkx2.5和Gata4的表达.Wnt内源性拮抗分子Cresent和DKK1作为前内胚层的信号,通过封闭经典Wnt活性,可以诱导内胚层区产生异位心脏;在鸡胚中,外源Wnt3a和Wnt8刺激可以直接促进原条、后中胚层细胞分化为造血细胞[8-9].在爪蟾中,敲除Wnt6导致心脏结构扩大,同时SFRP1可以拮抗Wnt6的效应,促进心肌分化及正常心脏结构和大小尺寸的形成[10-11].在小鼠中,利用Cytokeratin-19启动子控制的Cre-Loxp重组技术,发现抑制β-catenin在咽弓内胚层的表达后会导致小鼠内胚层异位心脏的形成,提示经典Wnt信号可能抑制小鼠的心脏发育[12].但在果蝇中,Wnt经典信号却能够促进心脏的发育.在小鼠畸胎瘤细胞系P19CL6细胞中,加入Wnt3a蛋白或通过抑制GSK3β以激活经典Wnt通路,能够明显促进心肌特异转录因子Nkx2.5,Gata4,Mef2c和Tbx5的表达,促进跳动心肌的出现[13].
Natio等[14]提出经典Wnt信号对心脏发育调节具有双时相,开启了对Wnt信号新的认识.经典Wnt信号在胚胎干细胞(ES)分化的早期阶段诱导Sox17促进中胚层分化,早期抑制Wnt导致细胞向神经外胚层分化;在稍晚阶段激活经典Wnt信号则抑制骨形成蛋白(BMP)信号诱导,从而抑制心肌分化,驱动中胚层定向细胞分化为造血和血管细胞.在ES细胞心肌分化中,也可在分化早期检测到Wnt3a和Wnt8的诱导,早于心肌前体细胞特异的标志基因Nkx2.5和Gata4,而细胞进入生心中胚层阶段后即快速消失.在Wnt8和Dkk1转基因斑马鱼中的研究表明,Wnt经典信号在原肠形成前可促进中胚层细胞特化并转化为线性心管,而在原肠形成期则发挥抑制作用,参与心肌细胞的成熟,再次证实经典Wnt/β-catenin信号对心脏发育调节具有双时相性[15].显然,Wnt信号这种“早期促进,后期抑制”的发育阶段性作用在进化中高度保守.事实上,在心肌诱导分化中,包括BMP和Notch等在内的多个信号通路都有阶段特异性作用,心肌分化前期和晚期的作用往往截然相反.需要指出的是,Wnt家族成员众多,作用差异极大.例如,Wnt2虽然属于经典Wnt家族分子,但在ES细胞中却通过激活非经典通路促进心肌分化[16].
更精细的研究表明,经典Wnt在心肌诱导分化中的作用可以划分为至少4个时相[7].第1时相大致为早期诱导至BrachyuryT+中胚层阶段,经典Wnt信号发挥诱导增殖、促分化作用,其促分化的机制类似于促上皮间质转化,在胚胎内还可诱导细胞迁移汇聚成心管,同时中胚层转录因子Brachyury T本身即受Tcf/Lef的转录调控[17].第2时相为中胚层至Mesp1+生心中胚层,再至Isl1+Nkx2.5+阳性心肌前体细胞期.在该时相,经典Wnt信号主要发挥抑制作用.心肌前体细胞的迁移运动和生心新月区的形成也与Wnt3a介导的化学排斥效应相关[18].第3时相为Isl1+Nkx2.5+阳性心肌前体细胞自我扩增期,大致对应于体内第二生心区内的心脏前体细胞汇入线性心管,扩大心腔,经典Wnt此时再次发挥促分化、促增殖和促迁移的作用.比较而言,BMP信号是第一生心区的主要调控信号,调控Gata4,Mef2c和SRF等生心转录因子表达,而Wnt主要调控第二生心区[19-20].已证明β-catenin可直接调控Isl1和Nkx2.5表达,并且Wnt3a信号可诱导多个FGF分子(特别是FGF10和FGF20)促进Isl1+细胞的增殖[20-22].同时,Nkx2.5可上调Rspo3分泌蛋白表达,以激活Wnt经典通路,维持干细胞增殖[23].而Tbx20调控Lef1表达,参与了心内膜垫成熟和瓣膜细胞扩张[24].第4时相为心脏塑形的终末分化阶段,此时心肌细胞增殖停滞,经典Wnt信号起负性调控作用,抑制心肌结构和功能基因表达.
从机制角度说,Wnt经典通路分子在心肌分化进程中的表达活化受阶段特异性转录因子的调控.已知Tcf/Lef可调控BrachyuryT表达,但Brachyury T下游基因又包括Wnt3a,Axin2,FGF8和Mesp1等[25].因此,可以认为Wnt经典通路与中胚层分化标志物Brachyury T转录因子之间存在一个正性调控环.而生心中胚层分化标志基因Mesp1启动子上游也存在一个Tcf/Lef保守位点,受经典Wnt信号诱导[26];另外,Mesp1转录因子可上调内源性Wnt信号通路抑制剂DKK1的表达[27],这样又构建了一个负反馈网络来节制经典Wnt信号的活化.此外,在心肌细胞中特异表达的非编码小RNA分子,miR-1,可抑制Frizzled7受体分子的表达,因而可以在分化晚期抑制经典Wnt的激活[28].
3.2Wnt非经典通路与心脏发育
Wnt非经典通路对细胞黏附、迁移、心管形成、环化及腔室形成具有重要的作用.缺失Wnt11,Wnt5a,Wnt5b和Wnt4的模式生物将发生心管畸形等严重缺陷.在爪蟾的胚胎研究模型中,Wnt11在形成新月区的中胚层前侧部表达,抑制Wnt11表达能够阻断心肌早期分化标志基因Nkx2.5和Gata4的表达,并且干扰细胞迁移、融合和心管形成,导致心脏原基汇合障碍,最终引起双心畸形.在蛙胚和鸡胚的模型中,后中胚层过表达Wnt11能引起异位心脏的形成[29-30].小鼠发育模型中,Wnt5a和Wnt11对流出道的形成发挥重要功能,基因突变会导致流出道缺陷,如右心室双出口和主动脉干永存,表型与人类某些先天性心脏病非常类似[31].其原因主要是Wnt5a或Wnt11能够通过JNK途径影响流出道心肌及平滑肌成分的细胞骨架和细胞外基质的沉积.此外,Wnt5a和纤连蛋白也是重要的心肌细胞迁移趋化信号[32].在ES细胞的诱导分化体系中,Wnt11的表达时相与心肌特异基因表达的时相高度匹配,均在生心中胚层后逐步高表达,至搏动心肌出现,在所诱导的ES中持续表达Wnt11能够提高分化效率[33].
Wnt5a和Wnt11引发的下游事件包括Dvl及JNK,PKC信号通路的活化,敲除Dvl、阻断JNK或PKC通路能够抑制非经典Wnt激活引起的促心脏分化效应,而共激活JNK和PKC则能够促进心脏分化[34].转录因子NFAT是Ca2+/PKC/CaN的下游效应因子,在心肌分化中发挥着重要作用.不过,近期有研究发现,在心肌分化早期通过环孢素A抑制NFAT活化,可以提高心肌分化效率[35].结合Wnt5a和Wnt11的特异性表达时相,提示Wnt非经典通路对心肌分化可能也存在双时相性作用.
此外,Wnt5a和Wnt11对于第二生心区的形成至关重要,其主要机理可能是通过抑制Wnt经典通路的活化,特别是β-catenin的表达[36].在小鼠胚胎中,Wnt5a和Wnt11在第二生心区协同表达,同时敲除二者导致经典Wnt信号激活、心脏发育缺陷.Wnt11一方面通过激活JNK和PKC促进晚期心肌分化;另一方面可能通过激活Caspase-3,降解AKT及β-catenin以破坏经典Wnt通路[33-37].因此,Wnt非经典通路可能在经典通路激活的生心中胚层分化基础上接续促进晚期心肌分化进程.
4 基于Wnt信号通路的心肌诱导分化策略
综上所述,Wnt信号通路在心肌分化中具有典型的阶段特异性作用,经典通路表现为“先促后抑”,而非经典通路则在分化晚期通过抑制经典通路发挥促心肌分化的作用.基于以上研究发现,已衍生出不同的干细胞心肌诱导分化策略[38].例如:诱导早期加入GSK3β抑制剂(BIO,LiCl等)和CK1激酶抑制剂CHIR99021,通过抑制GSK3β和CK1以达到活化β-catenin介导的经典Wnt通路的作用[39];或者,在诱导早期加入重组Wnt3和Wnt3a蛋白等经典通路激活物[40].在诱导晚期可加入Wnt天然抑制物Cerberus,DKK1和SFRP分泌蛋白,或其他小分子化合物[41].Wnt小分子干扰物种类众多,如:姜黄素和CHC001可抑制β-catenin活化;imatinib和apigenin可增加β-catenin的质膜定位,抑制入核;ICG-001和FH535干扰β-catenin与Tcf/Lef1结合;IWP可抑制Wnt棕榈酰化修饰而干扰其产生.IWR被认为是Wnt通路的信号应答抑制剂[38].除特异性小分子抑制剂外,硫酸软骨素、维生素D3和DAPT等小分子也被发现可间接调控Wnt信号[42-43].这些小分子除可以增加心肌诱导效率外,KY02111等新型化合物还可提高终末分化细胞的成熟度,提高MLC2v+阳性心室肌细胞的产率[44-45].通过与BMP通路调制小分子的协同,Wnt调制物还可诱导特异的心外膜细胞[46].通过慢病毒转染过表达Wnt11,甚至可以促进间充质干细胞及骨骼肌卫星细胞向心肌分化[47-48].有趣的是,通过物理性旋转培养改变细胞间黏附,也可使ES细胞在形成拟胚体阶段活化Wnt经典通路,达到促进心肌分化的目的[49].除此之外,由于Wnt通路与BMP和Notch等其他通路存在复杂的交叉串话,其他通路的激动剂和抑制剂往往也会影响到Wnt分子的表达.此外,还可通过调制多条信号通路来诱导心肌分化.
5 小 结
Wnt信号通路分为经典通路和非经典通路,二者在心脏发育中发挥着重要作用.Wnt经典通路在原肠形成以前促进早期多能干细胞分化为中胚层细胞,为后续心肌分化的重要步骤,而在生心中胚层形成后则抑制心肌分化;而非经典通路在生心中胚层形成后抑制Wnt经典通路,接力促进心肌分化,并通过调节细胞极性和细胞黏附迁移,参与心脏形态的建立.通过调制Wnt信号,可有效控制干细胞的分化方向,定向诱导干细胞向心肌或其他细胞方向分化.
[1]Flaherty M P,Kamerzell T J,Dawn B.Wnt signaling and cardiac differentiation[J].Progress in Molecular Biology and Translational Science,2012,111:153-174.
[2]Kikuchi A,Yamamoto H,Kishida S.Multiplicity of the interactions of Wnt proteins and their receptors[J].Cell Signal,2007,19(4):659-671.
[3]金雅琼,贾竹青,周春燕.SFRP分子对心脏发育的影响[J].中国生物化学与分子生物学学报,2008,24(12):1103-1108.
[4]Luo Wen,Zhao Xia,Jin Hengwei,et al.Akt1 signaling coordinates BMP signaling andβ-catenin activity to regulate second heart field progenitor development[J].Development,2015,142(4):732-742.
[5]Ishitani T,Kishida S,Hyodomiura J,et al.The TAK1-NLK mitogen-activated protein kinase cascade functions in the Wnt-5a/Ca(2+) pathway to antagonize Wnt/beta-catenin signaling[J].Mol Cell Biol,2003,23(1):131-139.
[6]Gillers B S,Chiplunkar A,Aly H,et al.Canonical wnt signaling regulates atrioventricular junction programming and electrophysiological properties[J].Circ Res,2015,116(3):398-406.
[7]Gessert S,Kühl M.The multiple phases and faces of wnt signaling during cardiac differentiation and development[J].Circ Res,2010,107(2):186-199.
[8]Marvin M J,Di Rocco G,Gardiner A,et al.Inhibition of Wnt activity induces heart formation from posterior mesoderm[J].Genes Dev,2001,15(3):316-327.
[9]Schneider V A,Mercola M.Wnt antagonism initiates cardiogenesis inXenopuslaevis[J].Genes Dev,2001,15(3):304-315.
[10]Lavery D L,Martin J,Turnbull Y D,et al.Wnt6 signaling regulates heart muscle development during organogenesis[J].Dev Biol,2008,323(2):177-188.
[11]Gibb N,Lavery D L,Hoppler S.sfrp1 promotes cardiomyocyte differentiation inXenopusvia negative-feedback regulation of Wnt signalling[J].Development,2013,140(7):1537-1549.
[12]Lickert H,Kutsch S,Kanzler B,et al.Formation of multiple hearts in mice following deletion of beta-catenin in the embryonic endoderm[J].Dev Cell,2002,3(2):171-181.
[13]Nakamura T,Sano M,Zhou Songyang,et al.A Wnt- and beta-catenin-dependent pathway for mammalian cardiac myogenesis[J].Proc Natl Acad Sci USA,2003,100(10):5834-5839.
[14]Naito A T,Shiojima I,Akazawa H,et al.Developmental stage-specific biphasic roles of Wnt/beta-catenin signaling in cardiomyogenesis and hematopoiesis[J].Proc Natl Acad Sci USA,2006,103(52):19812-19817.
[15]Ueno S,Weidinger G,Osugi T,et al.Biphasic role for Wnt/beta-catenin signaling in cardiac specification in zebrafish and embryonic stem cells[J].Proc Natl Acad Sci USA,2007,104(23):9685-9690.
[16]Onizuka T,Yuasa S,Kusumoto D,et al.Wnt2 accelerates cardiac myocyte differentiation from ES-cell derived mesodermal cells via non-canonical pathway[J].J Mol Cell Cardiol,2012,52(3):650-659.
[17]Galceran J,Hsu S C,Grosschedl R.Rescue of aWntmutation by an activated form of LEF-1:regulation of maintenance but not initiation ofBrachyuryexpression[J].Proc Natl Acad Sci USA,2001,98(15):8668-8673.
[18]Yue Qiaoyun,Wagstaff L,Yang Xuesong,et al.Wnt3a-mediated chemorepulsion controls movement patterns of cardiac progenitors and requires RhoA function[J].Development,2008,135(6):1029-1037.
[19]Klaus A,Saga Y,Taketo M M,et al.Distinct roles of Wnt/beta-catenin and Bmp signaling during early cardiogenesis[J].Proc Natl Acad Sci USA,2007,104(47):18531-18536.
[20]Klaus A,Müller M,Schulz H,et al.Wnt/β-catenin and Bmp signals control distinct sets of transcription factors in cardiac progenitor cells[J].Proc Natl Acad Sci USA,2012,109(27):10921-10926.
[21]Lin Lizhu,Cui Li,Zhou Wenlai,et al.Beta-catenin directly regulates Islet1 expression in cardiovascular progenitors and is required for multiple aspects of cardiogenesis[J].Proc Natl Acad Sci USA,2007,104(22):9313-9318.
[22]Cohen E D,Wang Zhishan,Lepore J J,et al.Wnt/beta-catenin signaling promotes expansion of Isl-1-positive cardiac progenitor cells through regulation of FGF signaling[J].J Clin Invest,2007,117(7):1794-1804.
[23]Cambier L,Plate M,Sucov H M,et al.Nkx2-5 regulates cardiac growth through modulation of Wnt signaling by R-spondin3[J].Development,2014,141(15):2959-2971.
[24]Cai Xiaoqiang,Zhang Weijia,Hu Jun,et al.Tbx20 acts upstream of Wnt signaling to regulate endocardial cushion formation and valve remodeling during mouse cardiogenesis[J].Development,2013,140(15):3176-3187.
[25]Evans A L,Faial T,Gilchrist M J,et al.Genomic targets of Brachyury (T) in differentiating mouse embryonic stem cells[J].PLoS One,2012,7(3):e33346.
[26]Li Yongqing,Yu Wei,Cooney A J,et al.Brief report:Oct4 and canonical Wnt signaling regulate the cardiac lineage factor Mesp1 through a Tcf/Lef-Oct4 composite element[J].Stem Cells,2013,31(6):1213-1217.
[27]David R,Brenner C,Stieber J,et al.MesP1 drives vertebrate cardiovascular differentiation through Dkk-1-mediated blockade of Wnt-signalling[J].Nat Cell Biol,2008,10(3):338-345.
[28]Lu T Y,Lin Bo,Li Yang,et al.Overexpression of microRNA-1 promotes cardiomyocyte commitment from human cardiovascular progenitors via suppressing WNT and FGF signaling pathways[J].J Mol Cell Cardiol,2013,63:146-154.
[29]Pandur P,Lasche M,Eisenberg L M,et al.Wnt-11 activation of a non-canonical Wnt signalling pathway is required for cardiogenesis[J].Nature,2002,418(6898):636-641.
[30]Garriock R J,D′Agostino S L,Pilcher K C,et al.Wnt11-R,a protein closely related to mammalian Wnt11,is required for heart morphogenesis inXenopus[J].Dev Biol,2005,279(1):179-192.
[31]Sinha T,Li D,Théveniau-Ruissy M,et al.Loss of Wnt5a disrupts second heart field cell deployment and may contribute to OFT malformations in DiGeorge syndrome[J].Hum Mol Genet,2015,24(6):1704-1716.
[32]Moyes K W,Sip C G,Obenza W,et al.Human embryonic stem cell-derived cardiomyocytes migrate in response to gradients of fibronectin and Wnt5a[J].Stem Cells Dev,2013,22(16):2315-2325.
[33]Abdul-Ghani M,Dufort D,Stiles R,et al.Wnt11 promotes cardiomyocyte development by caspase-mediated suppression of canonical Wnt signals[J].Mol Cell Biol,2011,31(1):163-178.
[34]Sinha T,Wang Bing,Evans S,et al.Disheveled mediated planar cell polarity signaling is required in the second heart field lineage for outflow tract morphogenesis[J].Dev Biol,2012,370(1):135-144.
[35]Choi S C,Lee H,Choi J H,et al.Cyclosporin A induces cardiac differentiation but inhibits hemato-endothelial differentiation of P19 cells[J].PLoS One,2015,10(1):e0117410.
[36]Cohen E D,Miller M F,Wang Zichao,et al.Wnt5a and Wnt11 are essential for second heart field progenitor development[J].Development,2012,139(11):1931-1940.
[37]Bisson J A,Mills B,Paul Helt J C,et al.Wnt5a and Wnt11 inhibit the canonical Wnt pathway and promote cardiac progenitor development via the Caspase-dependent degradation of AKT[J].Dev Biol,2015,398(1):80-96.
[38]Verma V,Purnamawati K,Manasi,et al.Steering signal transduction pathway towards cardiac lineage from human pluripotent stem cells:a review[J].Cell Signal,2013,25(5):1096-1107.
[39]Laco F,Low J L,Seow J,et al.Cardiomyocyte differentiation of pluripotent stem cells with SB203580 analogues correlates with Wnt pathway CK1 inhibition independent of p38 MAPK signaling[J].J Mol Cell Cardiol,2015,80:56-70.
[40]Mehta A,Ramachandra C J,Sequiera G L,et al.Phasic modulation of Wnt signaling enhances cardiac differentiation in human pluripotent stem cells by recapitulating developmental ontogeny[J].Biochim Biophys Acta,2014,1843(11):2394-2402.
[41]Rai M,Walthall J M,Hu Jianyong,et al.Continuous antagonism by Dkk1 counter activates canonical Wnt signaling and promotes cardiomyocyte differentiation of embryonic stem cells[J].Stem Cells Dev,2012,21(1):54-66.
[42]Hlaing S M,Garcia L A,Contreras J R,et al.1,25-Vitamin D3 promotes cardiac differentiation through modulation of the WNT signaling pathway[J].J Mol Endocrinol,2014,53(3):303-317.
[43]Prinz R D,Willis C M,Van Kuppevelt T H,et al.Biphasic role of chondroitin sulfate in cardiac differentiation of embryonic stem cells through inhibition of Wnt/β-catenin signaling[J].PLoS One,2014,9(3):e92381.
[44]Minami I,Yamada K,Otsuji T G,et al.A small molecule that promotes cardiac differentiation of human pluripotent stem cells under defined,cytokine- and xeno-free conditions[J].Cell Rep,2012,2(5):1448-1460.
[45]Lian Xiaojun,Hsiao C,Wilson G,et al.Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling[J].Proc Natl Acad Sci USA,2012,109(27):E1848-E1857.
[46]Brenner C,Franz W M.Pluripotent-stem-cell-derived epicardial cells:a step toward artificial cardiac tissue[J].Cell Stem Cell,2014,15(5):533-534.
[47]Xiang Guosheng,Yang Qing,Wang Bing,et al.Lentivirus-mediated Wnt11 gene transfer enhances Cardiomyogenic differentiation of skeletal muscle-derived stem cells[J].Mol Ther,2011,19(4):790-796.
[48]He Zhisong,Li Hongxia,Zuo Shi,et al.Transduction of Wnt11 promotes mesenchymal stem cell transdifferentiation into cardiac phenotypes[J].Stem Cells Dev,2011,20(10):1771-1778.
[49]Kinney M A,Sargent C Y,McDevitt T C.Temporal modulation ofβ-catenin signaling by multicellular aggregation kinetics impacts embryonic stem cell cardiomyogenesis[J].Stem Cells Dev,2013,22(19):2665-2677.
(责任编辑薛荣)
The role of Wnt signaling pathway in cardiac development and cardiac differentiation
HUANG Qiaoli,ZHOU Hua,LI Tao
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
Wnt proteins had been shown to play multiple roles during cardiac differentiation and development. Until now, 19 Wnt ligands, 10 Frizzled receptors and several endogenous antagonists had been identified in mammals, suggested that the effect of Wnt signaling was immensely complicated. Wnt signaling were categorized into theβ-catenin dependent (canonical), andβ-catenin independent (non-canonical) pathways. Both signaling pathways played key roles in cardiac development, including cell division, differentiation, adhesion, migration, and polarity. Specifically, Wnt signaling exhibited biphasic effects on cardiac differentiation, depending on the stage of cardiomyogenesis. Therefore, modulating Wnt signaling by small molecules or genetic manipulation would be a useful way to efficiently generate cardiomyocytes from pluripotent stem cells.
Wnt signaling pathway; cardiac development; cardiac differentiation; stem cell
10.16218/j.issn.1001-5051.2016.03.017
收文日期:2015-05-28;2015-06-23
国家自然科学基金资助项目(31101057;31470082);浙江省自然科学基金资助项目(LY14C120001);浙江省公共创新平台实验动物项目(2014C37126)
黄巧丽(1990-)女,浙江嵊州人,硕士研究生.研究方向:分子发育生物学.
李涛.E-mail: litao@zjnu.cn
Q951
A
1001-5051(2016)03-0331-07

