桦褐孔菌多糖的硫酸化修饰及生物活性研究
张秋平,徐向群
(浙江理工大学理学院,杭州 310018)
桦褐孔菌多糖的硫酸化修饰及生物活性研究
张秋平,徐向群
(浙江理工大学理学院,杭州 310018)
研究探讨桦褐孔菌胞内、胞外多糖经过硫酸化修饰后其化学组成与生物活性的变化。利用水溶醇沉法提取了胞外多糖EPS和胞内多糖IPS。以EPS为样品,通过正交实验确定了最佳的硫酸化修饰条件为反应温度75℃,反应时间2.5h,反应摩尔比1∶2.5。在同样修饰条件下,胞外多糖取代度要高于胞内多糖取代度。桦褐孔菌胞内、胞外多糖经硫酸化修饰后,糖含量、蛋白质含量以及糖醛酸含量都有所降低,然而硫酸化修饰多糖展示出了更强的DPPH清除活性以及更低的IC50值。这表明桦褐孔菌胞外、胞内多糖经硫酸化修饰后,有效提高了抗氧化活性,利于其进一步开发利用。
桦褐孔菌;多糖;硫酸化修饰;抗氧化活性
0 引 言
桦褐孔菌(Inonotusobliquus)属于担子菌亚门,是一种非常珍稀且有着良好治疗效果的可食药用真菌,主要分布在北纬45°~50°的寒冷地区,如欧洲、亚洲和北美地区,是生长在寒带的木腐菌[1]。桦褐孔菌多糖是其主要的活性组分,有着多种生物功能,如抗肿瘤、抗氧化和免疫调节活性[2-4]。野生桦褐孔菌资源非常昂贵且稀缺。我们实验室研究报道了通过液体深层发酵桦褐孔菌能获得更多含量以及更高活性的胞外多糖[5-6],然而,桦褐孔菌多糖的溶解度偏低,从而影响其生物活性的发挥。
多糖的生物活性与其结构有着密切的关系,对多糖结构进行适当修饰是多糖领域研究的重点方向之一。多糖经硫酸化修饰后,不仅能加强其溶解性,而且能够改变多糖的结构,从而导致多糖生物活性的加强甚至产生新的生物活性[7-8]。一些研究报道了硫酸化修饰多糖展示了更强的抗氧化以及抗肿瘤活性[9],而对桦褐孔菌多糖硫酸化修饰的报道却很少。因此本研究期望通过正交实验确定桦褐孔菌多糖硫酸化修饰的最佳条件,并在最佳条件下对来源对照培养基的胞内、胞外多糖硫酸化修饰,分析比较胞内、胞外多糖经硫酸化修饰后,各自的化学含量、单糖组成、分子量以及抗氧化活性的变化,为进一步开发桦褐孔菌多糖提供理论基础。
1 材料和方法
1.1实验材料
1.1.1发酵培养胞内、胞外多糖
桦褐孔菌从徐州师范大学获得。液体菌种的培养:把保存在麦芽琼脂斜面的桦褐孔菌菌丝体接种于含有100 mL培养基的250 mL的锥形瓶中培养,培养基为:酵母浸膏2 g/L,蛋白胨3 g/L,葡萄糖20 g/L,KH2PO41 g/L,MgSO41.5 g/L,CaCl20.1 g/L,于28 ℃,150 r/min的培养箱中培养4~5 d。将培养好的液体菌种在超净台上用移液管分别接种于100mL对照培养基的250mL发酵瓶中,接种比例为10%(体积比)。将接种好的培养瓶于摇床中培养,培养条件为温度28 ℃,转速150 r/min,时间9 d,收集发酵液和菌丝体,分别提取胞外多糖和胞内多糖[10]。
1.1.2主要试剂
Tween 80,天津永大化学试剂有限公司;BCA试剂盒,上海索宝生物科技公司;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma公司;咔唑,常州中集化工有限公司;其他试剂均为国产分析纯。
1.2实验方法
1.2.1胞外多糖的提取
分别将发酵第9 d的培养基胞外液用滤纸进行抽滤,得到菌丝体和发酵液。菌丝体保留用于提取胞内多糖,发酵液于真空浓缩至原体积的1/4,加入4倍体积的95%的乙醇,充分搅拌,使多糖尽可能多的沉淀下来,与4 ℃的冰箱中静置过夜。沉淀用95%的乙醇反复冲洗,以除去参杂在其中的还原糖和小分子物质。然后在6500 r/min条件下离心,清除上清液,并冷冻干燥,得到了干燥的胞外多糖样品并留着备用,记为EPS。
1.2.2胞内多糖的提取
将发酵液抽滤得到的菌丝体用蒸馏水洗涤3次,直至洗涤后的蒸馏水为无色为止。将洗涤干净的菌丝体放置烘箱中烘干至没有水分,然后用研磨磨成粉末,将粉末置于离心管中并加入蒸馏水(蒸馏水∶菌丝体=1∶5),超声5 min(超声时间5 s,间隔时间3 s),混合液置于95 ℃的恒温水浴锅中加热2 h,离心收集上清液,再向离心管中的残渣加入蒸馏水,重复上面的操作,将两次收集的上清液合并,真空浓缩,加入4倍体积的95%乙醇并充分搅拌,放入4℃冰箱中静置过夜,用干净的95%的乙醇洗涤得到的沉淀多糖,然后在6500 r/min条件下离心并去除上清液,将得到的沉淀放入冷冻干燥机中干燥,最终得到的固体即为胞内多糖,记为IPS。
1.2.3硫酸化多糖的制备
本实验采用三氧化硫-吡啶法对桦褐孔菌多糖进行硫酸化修饰。考察了反应温度、反应时间以及三氧化硫-吡啶与多糖摩尔比3个因素对硫酸化修饰结果的影响。以对照培养基胞外多糖为样品,取代度(DS)为指标,每个因素选取了3个水平,其中温度为55、75 ℃和85 ℃;时间为1.5、2.5 h和3.5 h;摩尔比为1.0∶1.5,1.0∶2.5和1.0∶3.5,通过正交实验确定最佳的硫酸化修饰条件。
在最佳的硫酸化修饰条件下,分别对桦褐孔菌胞内、胞外多糖进行硫酸化修饰,其过程为:准确称取50 mg多糖样品,通过超声或加热搅拌使其溶解在35mL的甲酰胺溶液中,将制备好的硫酸酯化试剂加入其中。反应一段时间后,用冰水浴使其迅速降至室温,然后用2 mol/L的NaOH溶液调节pH至7~8。经透析袋透析48 h后,透析液于真空浓缩至原溶液体积的1/4,加入4倍体积95%的乙醇,4 ℃冰箱静置过夜,离心清除上清液,再冷冻干燥,所得固体即为桦褐孔菌硫酸化多糖,分别记为sEPS和sIPS。
硫酸多糖的取代度通过氯化钡明胶法测定[11],根据测得标准曲线计算硫酸基含量并根据以下公式计算取代度:
(1)其中:DS为硫酸多糖取代度;S为硫酸基百分含量。
1.2.4化学组成的分析
用苯酚-硫酸法测定各多糖EPS和IPS以及对应硫酸化多糖样品的糖含量。用BCA试剂盒测定各上述多糖以及各硫酸化多糖样品的蛋白含量。用硫酸-咔唑法测定各上述多糖以及硫酸化多糖样品的糖醛酸含量。
采用气相色谱分析多糖样品中单糖的组成,多糖以及硫酸化多糖的水解物和各单糖标准品通过糖腈乙酸酯法完成多糖的衍生化。气相色谱的分析条件为:采用的是石英毛细管柱SE-50, 30 m×0.25 mm,液膜厚度为0.25 μm,气化室温度260 ℃,FID检测器温度250 ℃,载气压力0.6 MPa,氢气压力0.65 MPa,空气0.50 MPa,分流比30∶1,进样量1 μL。程序升温,110 ℃保持2 min,在以3 ℃/min升温至180 ℃,保持5 ℃,然后5 ℃/min升温至220 ℃,保持2 min。
1.2.5分子量的测定
采用SEC-LLS法(size exclusion chromatography with laser light scattering)来测量多糖的分子量。该种方法不需要标准曲线,所以不依赖于未知样品的性质与结构,测量结果更为精确。测量操作步骤如下:准确称取储存好的多糖样品和硫酸化多糖样品2 mg,溶解于4 mL的0.2 mol/L的NaNO3溶液中,使浓度为0.5 mg/mL。进行测量之前,先将所有待测样品用0.2μm的微孔滤膜进行过滤,进样量为100 μL,检测器温度30 ℃,流动时间0.8 mL/min。
1.2.6FT-IR光谱分析
称取少量的干燥多糖样品,在1∶100的情况下与KBr充分混合,压成均匀的1mm的薄片。薄片通过Nicolet AVATAR 360 FT-IR光谱仪进行扫描测量,扫描范围4000~400 cm-1。
1.2.7DPPH自由基清除率的测定
DPPH自由基的测定了通过采用Yang等[12]的方法并做了一些改进,具体操作为:准确称取储存好的多糖样品并溶于蒸馏水中,配成浓度梯度0.5~5 mg/mL。于干净的试管中加入0.8 mL配置好的DPPH溶液(0.4 mmol/L),分别移取各浓度多糖2.4 mL加入试管中,并充分振荡摇匀,黑暗处静置30min,然后测定其吸光度并记为Ab1,样品对照组为以甲醇代替DPPH,加入各浓度多糖2.4 mL,反应后测定吸光度记为Ab2,对照组为0.8 mL的甲醇溶液与2.4mL的DPPH溶液反应记为Ab0。所有吸光度的值都是在517 nm下测得,DPPH自由基清除率按以下方程进行计算:
DPPH自由基清除率/%=
(2)
其中:Ab0—对照吸光度;Ab1—多糖样品吸光度;Ab2—样品对照组吸光度(反应体系中无DPPH)。
2 结果与分析
2.1硫酸修饰条件的优化
表1所示为正交实验结果,从表1中可以看出,5号试验的取代度最高为0.97,取代度最低的为1号试验,取代度为0.53。此外,通过极差分析可以得出,在温度、时间和反应摩尔比3个因素中,反应温度对取代度的影响最大,其次是反应摩尔浓度比,而反应时间对温度的影响最弱。
在多糖硫酸化修饰的反应研究中,反应温度和反应摩尔浓度比是影响硫酸化多糖取代度的两个主要因素。随着反应摩尔浓度比的增加以及反应时间的延长,取代度逐渐升高,而如果反应摩尔浓度比过高或者反应时间过长,多糖也许会被降解甚至碳化。当温度从55 ℃上升到75 ℃过程中,硫酸化多糖取代度明显上升,但当温度继续上升时,硫酸化多糖的取代度却开始下降,此外温度过高也许会导致多糖结构被破坏。因此综合所有因素,确定了最佳的多糖硫酸化修饰条件为温度75 ℃,时间2.5 h,反应摩尔浓度比为1.0∶2.5。
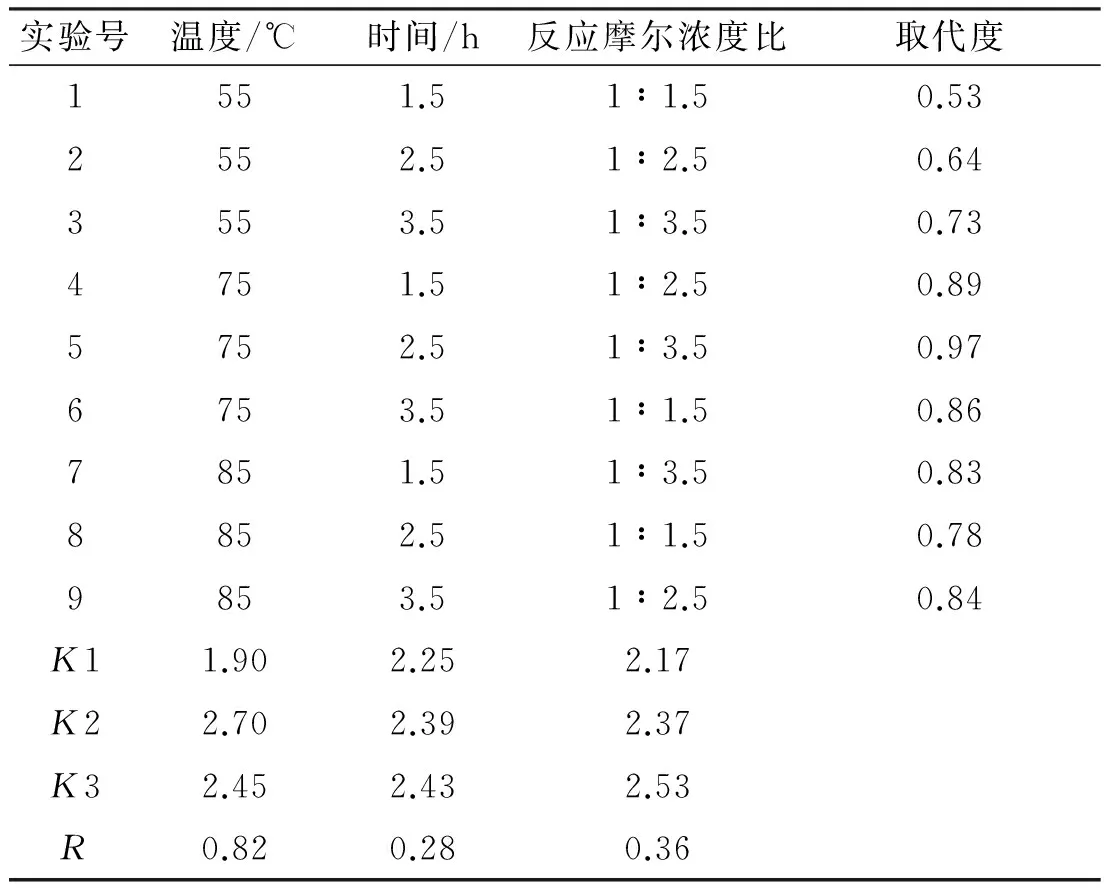
表1 正交实验结果表
注:K1为每一列中当温度为55℃,时间1.5h、摩尔比1.0∶1.5时各取代度之和;K2(K3)为每一列中当温度为75℃(85℃),时间2.5h(3.5h)以及摩尔比1.0∶2.5(1.0∶3.5)时各取代度之和;R为每一列中K1、K2和K3的极差。
2.2多糖以及硫酸化多糖的组成分析
表2所示为桦褐孔菌胞内、胞外多糖以及对应硫酸化修饰多糖的化学含量以及单糖组成。从表2中可以看出,IPS要比EPS有更高的糖含量,为45.71%,而糖醛酸和蛋白质的含量则较低。两种多糖经硫酸化修饰后,糖含量、糖醛酸含量以及蛋白质含量都有所下降,且其中蛋白含量下降的更明显,这可能由于蛋白质的稳定性差,在高温条件下容易变性而失活。所有多糖和硫酸化多糖样品都主要由甘露糖、葡萄糖和半乳糖组成,并且含有少量阿拉伯糖、木糖和鼠李糖。与EPS相比,IPS有更高含量的葡糖糖,其含量分别为40.2%和55.9%;经硫酸化修饰后,两种多糖中葡萄糖含量都明显增加;此外,sEPS和sIPS的取代度分别为0.85和0.65,表明在同样条件下,胞外多糖要比胞内多糖更容易发生硫酸化取代。
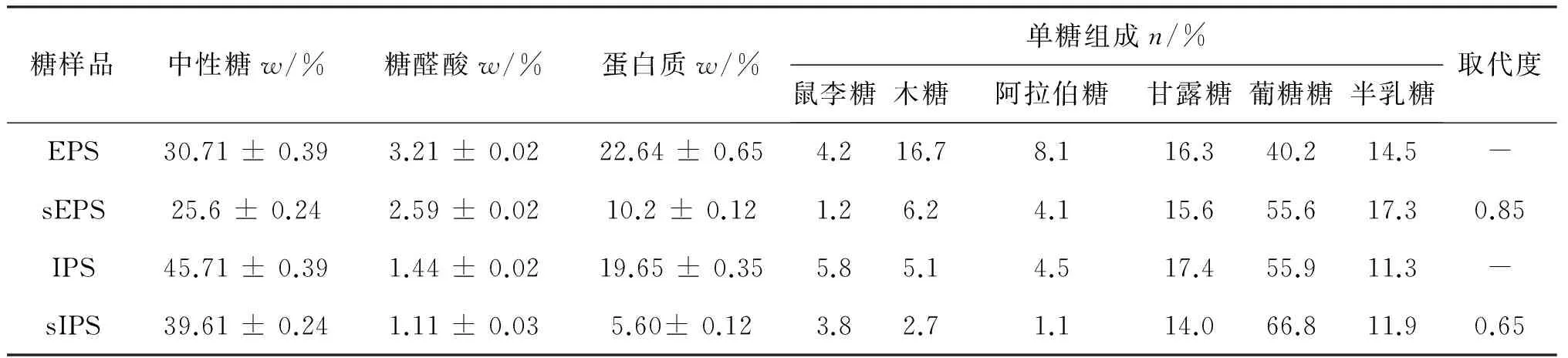
表2 桦褐孔菌多糖以及对应硫酸化多糖的化学含量和单糖组成
注:w/%表示为重量百分比;n/%表示摩尔百分比; -表示未发现。
2.3多糖的分子量
重均分子量(MW)和粘均分子量(MN)是影响硫酸化多糖生物活性的重要参数。从表3中可以看到,EPS和sEPS的MN值和MW值分别为42840、43566和45376、44986, 且EPS和sEPS的MW/MN的值都接近于1,表明多糖分散度小,分子形态分布较均一。
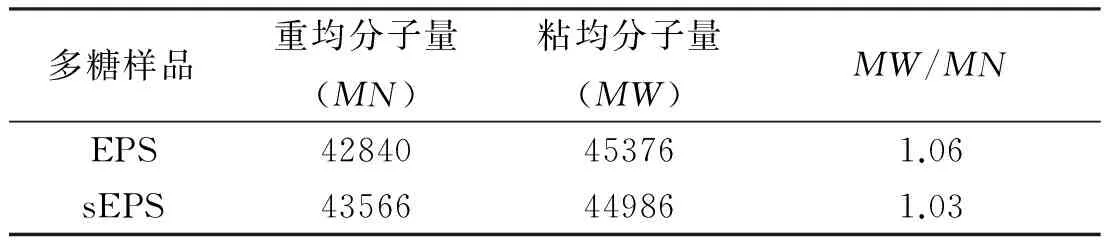
表3 桦褐孔菌多糖以及硫酸多糖的分子量
2.4多糖FT-IR分析
如图1所示为EPS和sEPS的红外光谱图,图1中3200~3600cm-1出现的宽峰为O-H伸缩振动;2940cm-1左右出现的峰是由-CH2中C-H的伸缩振动造成;1659cm-1左右出现的峰为多糖的水化峰;1391cm-1出现的峰是由C-H的弯曲振动造成;1032cm-1左右出现的峰是由糖类中C-O振动引起的。与EPS相比,sEPS出现了3个新的特征峰,其中1230cm-1和1146cm-1两个特征峰是由S=O的伸缩振动引起,另外一个809cm-1出现的特称峰是由C-O-SO3伸缩振动引起。3个新出现的特征峰可以表明硫酸取代的发生[13]。
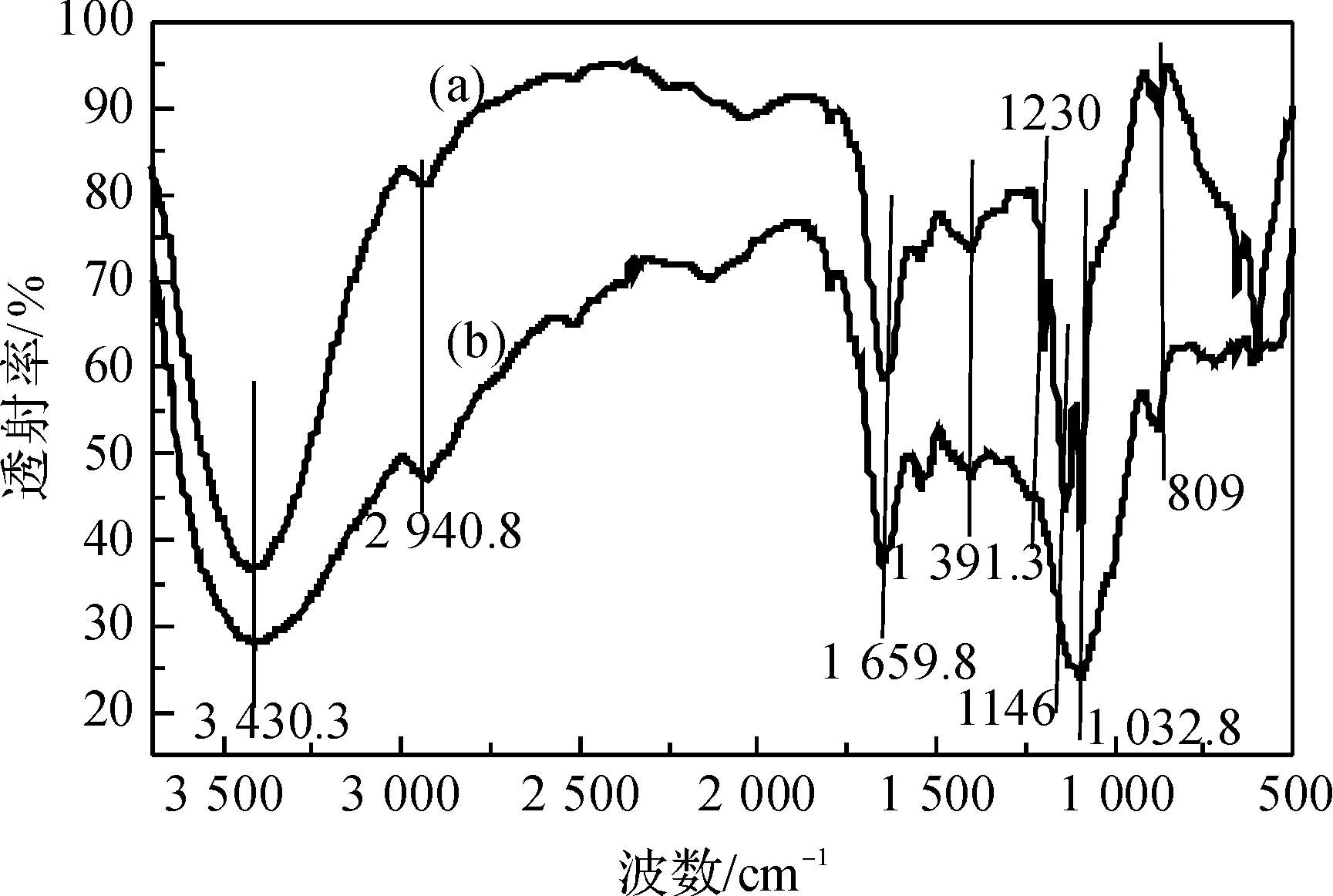
图1 来源对照培养基胞外多糖和对应硫酸多糖红外光谱图注:(a)为sEPS;(b)为EPS。
2.5DPPH自由基清除活性
DPPH是一种稳定的自由基,被广泛应用于评估天然产物的自由基清除能力。图2为桦褐孔菌胞外、胞内多糖以及对应硫酸化多糖的DPPH清除活性随溶度变化关系。从图2中可以看出,4种多糖EPS、sEPS、IPS和sIPS的自由基清除活性与溶度呈一定剂量关系,且在5mg/mL时达到最大值,分别为39.18%、42.26%、35.2%和45.1%。结果表明桦褐孔菌胞内、胞外多糖经硫酸化修饰后,有更强的DPPH清除活性,且从表4中可以看出,硫酸修饰多糖要比对应未修饰多糖有更低的IC50值。表明硫酸修饰多糖呈现更强的抗氧化活性。
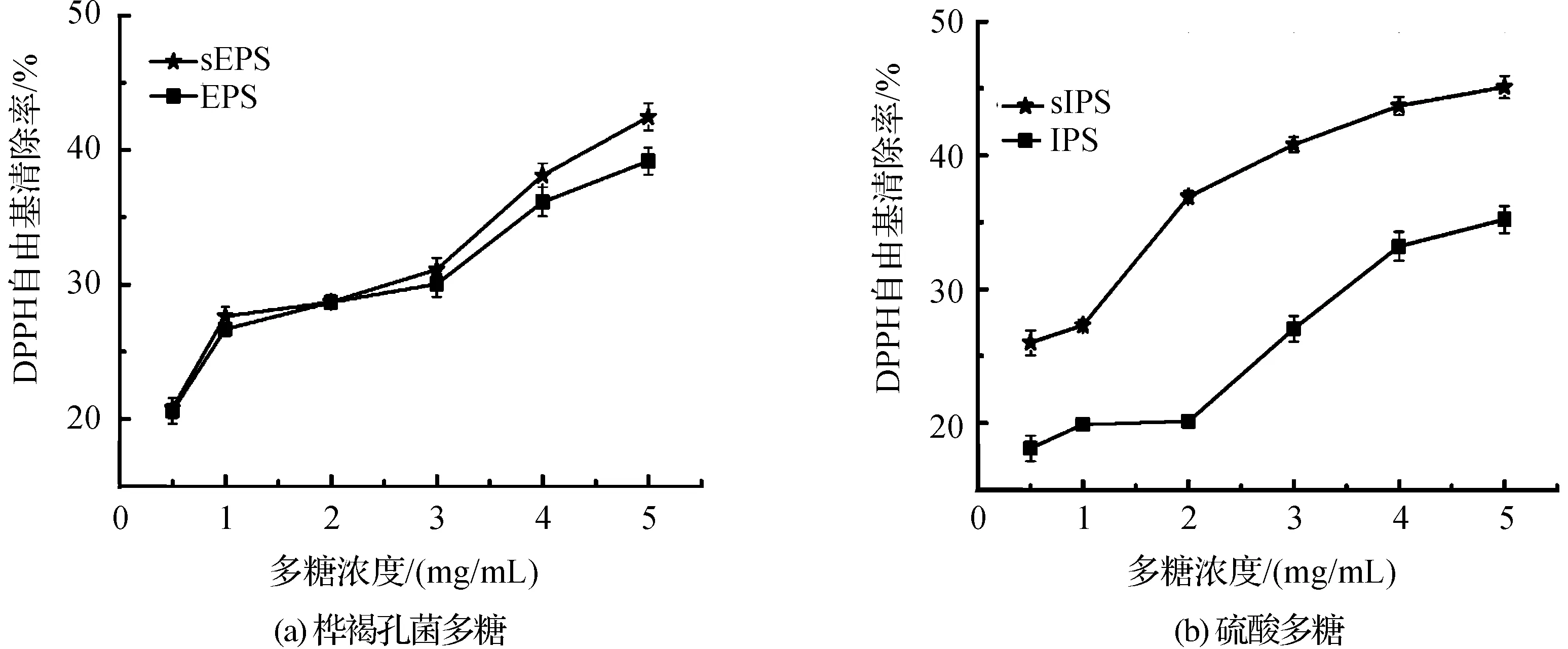
图2 桦褐孔菌多糖以及对应硫酸多糖的DPPH清除活性
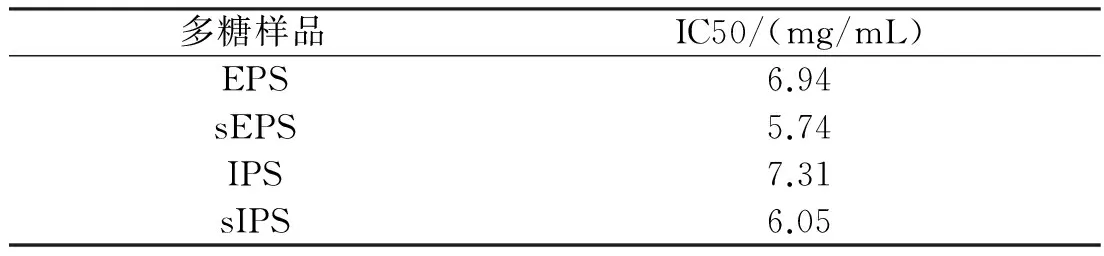
多糖样品IC50/(mg/mL)EPS6.94sEPS5.74IPS7.31sIPS6.05
3 结 论
本实验对来源对照培养基胞内、胞外多糖进行了硫酸化修饰,确定了最佳的硫酸修饰条件为温度75 ℃,反应摩尔浓度比1∶2.5以及反应时间2.5 h。在FT-IR光谱中,经硫酸化修饰后的多糖出现了两个新的特征峰,分别为1250和 810 cm-1,都是由S=O伸缩振动引起的,表明硫酸取代反应的发生。多糖样品经硫酸化修饰后,其分子量并未出现明显的变化,表明在硫酸化修饰反应过程中,多糖没有发生明显的降解。此外,与天然多糖相比,经硫酸化修饰后的胞内、胞外多糖显示出更强的DPPH自由基清除活性以及更低的IC50值,表明其抗氧化能力被加强了。这些结果表明硫酸化修饰能加强桦褐孔菌多糖的抗氧化活性。
[1] 黄年来.俄罗斯神秘的民间药用真菌-桦褐孔菌[J].中国食用菌,2002,21(4):7-8.
[2] FAN L P, DING S D, AI L Z, et al. Antitumor and immunomodulatory activity of water-soluble polysaccharide fromInonotusobliquus[J]. Carbohydrate Polymers,2012,90(2):870-874.
[3] DU X, MU H M, ZHOU S, et al. Chemical analysis and antioxidant activity of polysaccharides extracted fromInonotusobliquussclerotia [J]. International Journal of Biological Macromolecules,2013,62:691-696.
[4] WON D P, LEE J S, KWON D S, et al. Immunostimulating activity by polysaccharides isolated from fruiting body ofInonotusobliquus[J]. Molecules and Cells,2011,31(2):165-173.
[5] XU X Q, WU Y D, CHEN H. Comparative antioxidative characteristics of polysaccharide-enriched extracts from natural sclerotia and cultured mycelia in submerged fermentation ofInonotusobliquus[J]. Food Chemistry, 2011,127(1):74-79.
[6] XU X Q, LI J, HU Y. Polysaccharides fromInonotusobliquussclerotia and cultured mycelia stimulate cytokine production of human peripheral blood mononuclear cells in vitro and their chemical characterization [J].International Immunopharmacology,2014,21(2):269-278.
[7] CHEN S G, WANG J F, XUE C H, et al. Sulfation of a squid ink polysaccharide and its inhibitory effect on tumor cell metastasis [J]. Carbohydrate Polymers,2011,81(3):560-566.
[8] CHEN X, SIU K C, CHEUNG Y C, et al. Structure and properties of a (1→3)-β-d-glucan from ultrasound-degraded exopolysaccharides of a medicinal fungus [J]. Carbohydrate Polymers,2014,106(15):270-275.
[9] MA L S, CHEN H X, ZHANG Y, et al. Chemical modification and antioxidant activities of polysaccharide from mushroomInonotusobliquus[J]. Carbohydrate Polymers,2012,89(2):371-378.
[10] CHEN H, XU X Q, ZHU Y. Optimization of hydroxyl radical scavenging activity of exo-polysaccharides fromInonotusobliquusin submerged fermentation using response surface methodology [J]. Journal of Microbiology and Biotechnology,2010,20(4):835-843.
[11] MOJIACA K, ELSEY D, COONEY M J. Quantitative analysis of biofilm EPS uronic acid content [J]. Journal of Microbiological Methods, 2007, 71(1):61-65.
[12] YANG Z Y, TU Y Y, XIA H L, et al. Suppression of free-radicals and protection against H2O2-induced oxidative damage in HPF-1 cell by oxidized phenolic compounds present in black tea [J]. Food Chemistry,2007,105(4):1349-1356.
[13] WANG J L, GUO H Y, ZHANG J, et al. Sulfated modification, characterization and structurefation of the extracellular poArtemisia sphaerocephala polysaccharides [J]. Carbohydrate Polymers,2010,81(4):897-905.
(责任编辑: 许惠儿)
Studies on Sulfated Modification and Biological Activity of Polysaccharides ofInonotusObliquus
ZHANGQiuping,XUXiangqun
(School of Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
This research aims to discuss chemical composition and biological activity of intracellular and extracellular polysaccharides ofInonotusobliquusafter sulfated modification. extracellular polysaccharide (EPS) and intracellular polysaccharide (IPS) were extracted by water ethanol method. By using the EPS as the sample, the orthogonal experiments were applied to confirm the optimum modification conditions as follows: reaction temperature 75℃, reaction time 2.5 h, molar ratio 1∶2.5. Under the same modification conditions, the substitution degree of EPS was higher than that of IPS. The contents of sugar, uronic acid and protein of polysaccharides decreased after sulfated modification, while the polysaccharide modified by sulfation exhibited significantly stronger DPPH elimination activity and lower IC50 value. These show that sulfated modification can enhance the antioxidant activity of polysaccharides ofInonotusobliquus, and contribute to further development and utilization of polysaccharides.
Inonotusobliquus; polysaccharide; sulfated modification; antioxidant activity
10.3969/j.issn.1673-3851.2016.09.020
2016-02-05
浙江省自然科学基金项目(LY16B020013)
张秋平(1989-),男,江西新余人,硕士研究生,主要从事生物技术与生物化工方面的研究。
徐向群,E-mail:xuxiangqun@zstu.edu.cn
Q538
A
1673- 3851 (2016) 05- 0754- 05 引用页码: 090702

