水稻锌指蛋白基因OsSZP载体构建、遗传转化及功能分析
刘 莹, 玉晓红, 罗晓莉, 肖力玮, 刘永胜, 牛向丽
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009; 2.重庆大学 生命科学学院,重庆 400044)
水稻锌指蛋白基因OsSZP载体构建、遗传转化及功能分析
刘莹1,玉晓红2,罗晓莉2,肖力玮1,刘永胜1,牛向丽1
(1.合肥工业大学 生物与食品工程学院,安徽 合肥230009; 2.重庆大学 生命科学学院,重庆400044)
文章通过RNA干扰(RNA interference,RNAi)技术对水稻锌指蛋白基因OsSZP的功能进行分析。定量聚合链式反应(polymerase chain reaction,PCR)分析结果表明,通过RNAi技术可获得OsSZP表达水平明显降低的转基因株系。与野生型相比,OsSZP基因下调植株的秕谷率显著增加,花粉育性降低,表明锌指蛋白基因OsSZP对水稻雄配子发育具有调控作用。表达模式分析结果表明,OsSZP在水稻幼苗和成熟植株根中均不表达,在水稻花药中表达水平较高。此外,OsSZP基因的表达也受温度、光照的影响。
水稻;锌指蛋白;RNA干扰;育性
0 引 言
植物的生殖发育是在外部温度、光照和内部营养、激素等信号诱导下,多个基因表达途径相互作用的综合结果,涉及众多基因。在已经分离的植物开花调控和花器官发育基因中,锌指蛋白(zinc-finger protein)基因占有重要地位。在植物中,锌指蛋白形成一个较大的转录因子家族[1-2],因其具有可以结合锌离子的指状结构域-锌指结构域(zinc-finger domain)而命名,依据锌指结构域中半胱氮酸(C)和组氨酸(H)残基的数目和位置分为C2H2、C2HC、C2C2等亚类。其中,C2H2(Cys2/His2)型成员最多,也是研究最深入的一类。锌指蛋白中有单个或成簇出现的锌指结构域,依赖在长期进化过程中形成的锌指结构域的多变组合,使其不仅可以结合DNA,还可以结合RNA、蛋白质和脂类底物,甚至同一类锌指蛋白也显示出不同的结合特性。因此,锌指蛋白具有调控基因转录、染色质重构等多种生理功能[3-4]。同时,在植物进化过程中锌指蛋白家族成员也不断增加,有些锌指蛋白甚至是植物所特有的。如模式植物拟南芥有176个C2H2型锌指蛋白成员[5];在水稻基因组中鉴定了189个C2H2型[6]、68个CCCH型锌指蛋白候选基因[7],其中仅有部分锌指蛋白基因的生物功能被阐明,并发现它们参与调控植物各个时期的生长发育调控、胁迫应答等[8-10]。
在拟南芥菜开花诱导中处于核心地位的CONSTANS(CO)基因编码锌指蛋白转录因子在长日照条件下激活下游基因的表达促进开花;水稻中CO的同源基因Hd1也编码锌指蛋白转录因子,但与CO不同的是Hd1在短日照条件下,激活下游基因表达而促进短日植物水稻开花[11]。文献[12-13]在水稻中分离鉴定的锌指蛋白转录因子RID1,通过调控Hd1、RFT1等下游开花调控基因来影响水稻从营养生长向生殖生长的转化。在花粉发育方面,已发现矮牵牛有多个锌指蛋白在花药中特异表达,并呈现明显的先后顺序[14]。在拟南芥菜中PHD型锌指蛋白基因MALESTERILITY1 (MS1)是雄性不育基因,其功能是调控花粉和绒毡层的发育[15]。
水稻是我国第一大粮食作物,水稻产量对保障国家粮食安全具有举足轻重的作用。我国水稻育种以杂种优势利用为标志的第二次“绿色革命”,使水稻产量有了前所未有的突破,而杂交水稻育种三系法、两系法配套策略分别利用了核质互作不育系和光、温敏不育系而得以实现。另一方面,杂种不育又是水稻籼粳亚种远源杂种优势利用的主要障碍。因而,育性在水稻遗传育种研究中倍受关注[16]。
本研究分离了一个水稻锌指蛋白基因OsSZP(Oryza sativa sterile-related zinc-finger protein),通过RNA干扰(RNA interference,RNAi)技术下调OsSZP基因表达[17],利用农杆菌介导法转化获得转基因水稻。对转基因株系的表型分析显示,与野生型植株相比,OsSZP下调转基因植株花粉育性降低,表明OsSZP基因对水稻生殖发育具有调控作用。
1 材料与方法
1.1实验材料
克隆载体pEASY-Blunt Simple Cloning Vector、大肠杆菌(Escherichia coli)菌株DH5α购于北京全式金生物技术有限公司;pMD18-T Vector购于TaKaRa公司;pSK vectctor由本实验室保存;真核表达载体pHB由上海交通大学杨洪全教授实验室构建提供[18],本实验室保存;用于转基因的根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105 购于Clontech公司;水稻粳稻品种日本晴(Oryza sative L.ssp.japonica cv.Nipponbare)种子由本实验室提供。
RNA提取试剂Trizol购于Invitrogen公司;反转录酶ReverTraAce购于Toyobo公司;高保真DNA聚合酶PrimeStar、Taq DNA聚合酶、限制性内切酶XhoⅠ、BamHⅠ、Hind Ⅲ、Pst Ⅰ、EcoRⅠ、T4连接酶购于TaKaRa公司;质粒提取试剂盒EasyPure Plasmid MiniPrep Kit、琼脂糖胶回收试剂盒EasyPure Quick Gel Extraction Kit购于北京全式金生物技术有限公司;引物设计采用Primmer Premmier 5.0软件,由上海英骏生物技术有限公司合成。其余试剂均为进口分装或国产分析纯。
1.2实验方法
1.2.1OsSZP基因编码区扩增
根据水稻OsSZP基因序列(GenBank登录号:AK071104)设计OsSZP编码区扩增引物为:
5′-TCTCTCTCTAGTGAACTTGC-3′;
5′-AGGGTTCTGTATCTCCATCCAAC-3′。
从水稻日本晴叶片中提取总RNA,取1 μg总RNA合成第一链cDNA。聚合物链式反应(polymerase chain reaction,PCR)条件为:98 ℃ 2 min,98 ℃ 10 s,56 ℃ 10 s,72 ℃ 90 s,30个循环;72 ℃总延伸 5 min。PCR产物经胶回收与克隆载体pEASY-Blunt Simple Cloning Vector连接,转化DH5a感受态细胞,鉴定阳性克隆(命名为pEASY-OsSZP)送测序。
1.2.2水稻OsSZP基因表达模式分析
取野生型日本晴幼苗(生长28 d,根、茎、叶)和成熟植株(根、茎、叶、花药)不同组织以及在不同光、温条件下处理48 h (生长28 d植株,28 ℃,12 h光/12 h暗、10 ℃,12 h光/12 h暗、42 ℃,12 h光/12 h暗、42 ℃,24 h暗)叶片样品,液氮研磨后提取RNA,通过逆转录合成第一链cDNA。以水稻ACTIN为内参基因(GenBank登录号:X16280),利用半定量PCR分析OsSZP基因的表达情况。OsSZP引物为:
5′-CTCGAGGATCCTCGACTCCTTCGACGACCT-3′;
5′-AAGCTTAGGGTTCTGTATCTCCATCC-3′。
ACTIN引物为:
5′-AAGATCCTGACGGAGCGTGGTTAC-3′;
5′-CTTCCTAATATCCACGTCGCACTTC-3′。
PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 20 s,27个循环;72 ℃10 min (总延伸)。
1.2.3OsSZP基因RNAi载体构建
按照OsSZP基因序列设计引物,扩增用于构建RNAi载体的正、反向片段。正向片段引物为:
5′-CTCGAGGATCCTCGACTCCTTCGACGACCT-3′;
5′-AAGCTTAGGGTTCTGTATCTCCATCC-3′。
两端分别引入XhoⅠ、BamH Ⅰ和Hind Ⅲ酶切位点。
反向片段引物为:
5′-CTGCAGTCGACTCCTTCGACGACCT-3′;
5′-GAATTCAGGGTTCTGTATCTCCATCC-3′。
两端分别引入Pst Ⅰ和EcoR Ⅰ酶切位点。
以pEASY-OsSZP为模板,分别进行正、反向片段扩增。所获得的PCR产物连接于pMD18-T载体,连接产物转化大肠杆菌感受态,对重组质粒进行测序。将测序正确的正向片段经Xho Ⅰ、Hind Ⅲ酶切回收连接于pSK 质粒,反向片段经Pst Ⅰ、EcoR Ⅰ酶切回收连接于已连接上述正向片段的pSK 质粒,形成正、反向重复基因片段。然后利用BamH、Pst Ⅰ将正反向基因片段整体酶切插入植物表达载体pHB,构建35S-OsSZPRNAi载体,命名为pHB-SZPRI。通过冻融法转化农杆菌,获得带有pHB-SZPRI质粒的阳性农杆菌克隆,保存备用。
1.2.4水稻遗传转化
本实验水稻的转化采用农杆菌介导法[19-20]。水稻野生型日本晴成熟种子去壳,分别用75%乙醇溶液、25%次氯酸钠溶液进行表面消毒,接种于诱导培养基中28 ℃ 下暗培养诱导愈伤组织。愈伤继代2次后预培养4 d,用于农杆菌侵染。预培养愈伤在农杆菌菌液中侵染20 min,移入共培养基28 ℃ 下暗培养2 d,然后转入含潮霉素的选择培养基筛选抗性愈伤(潮霉素质量浓度依次为30、40、50 mg/L)。将抗性愈伤转入分化培养基,10~15 d后选取分化幼苗接于生根培养基中。待幼苗生长7~10 d后移入温室中炼苗,约21 d后移入温室培养。
诱导培养基:NB+2 mg/L 2,4-D,pH值为5.8~5.9;共培养培养基:NB+2 mg/L 2,4-D+100 μmol/L乙酰丁香酮,pH值为5.2;筛选培养基:NB+2 mg/L 2,4-D+250 mg/L羧苄青霉素+30~50 mg/L潮霉素,pH值为5.8~5.9;分化培养基:NB+10 mg/L KT+0.4 mg/L NAA+250 mg/L 羧苄青霉素,pH值为5.8~5.9;生根培养基:1/2 MS,pH值为5.8~5.9。
1.2.5OsSZP转基因植株鉴定
分别提取野生型、转基因植株基因组DNA,利用pHB载体所携带潮霉素抗性标记基因进行PCR扩增。引物为:
5′- TCGTTATGTTTATCGGCACTTTG-3′;
5′- GCGTCTGCTGCTCCATACAAG-3′。
分别取野生型、T3代RNA干涉转基因植株叶片,液氮研磨后提取RNA,反转录合成第一链cDNA。以水稻ACTIN基因为对照,进行OsSZP基因表达水平实时定量PCR分析。OsSZP引物为:
5′- GATCCTCATTGGCCCTACCC-3′;
5′-CCCTTCCTGTACTGCGACCC-3′。
ACTIN引物为:
5′-AGTGATTGCACCACCAGAAAGA-3′;
5′-CAGGACCAGATTCATCATACTCG-3′。
反应条件如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,40个循环。扩增后,65 ℃ 5 s,每个循环增加0.5 ℃,60个循环,进行溶解曲线分析。每个样品重复3次。PCR在Bio-Rad CFX 96上运行。
1.2.6OsSZP基因RNAi转基因植株表型分析
将所鉴定RNAi转基因株系(Ri-1~Ri-3)与同期生长野生型植株(n=15)的株高、分蘖数、每穗粒数、秕谷率等利用SPSS 12.0软件(P<0.05)进行测定比较。取颖花样品经固定、染色、脱水、透明、浸蜡、包埋、切片、贴片、脱蜡及染色,制备花粉囊组织切片。
2 结果与分析
2.1OsSZP基因克隆
高保真酶扩增OsSZP基因产物连接于pEASY-Blunt载体,测序结果与美国国家生物技术信息中心(national center of biotechnology information,NCBI)登录基因序列进行比对,确认得到OsSZP基因编码序列。经SMART 软件分析可知,OsSZP是C2H2型锌指蛋白基因,在其278~300位、324~357位、362~382位和388~410位氨基酸,共有4个锌指结构域。利用PLACE软件,对上游序列应答元件分析结果显示,OsSZP基因转录起始位点上游有花药特异调控元件AGAAA,并有多个光调控元件,如GATA、GRWAAW、GATAA、GGGCC等。
2.2OsSZP基因表达模式分析
OsSZP基因表达模式分析结果如图1所示。由图1可知,OsSZP基因在野生型日本晴幼苗、成熟植株的根中均不表达;在幼苗、成熟植株的茎、叶中有表达;在花药中表达量最高。此外,OsSZP基因在不同光、温生长条件下,与正常生长条件(28 ℃,12 h光/12 h暗)相比,低温(10 ℃,12 h光/12 h暗)、高温(42 ℃,12 h光/12 h暗)处理48 h后,OsSZP表达水平均稍有降低;与光照培养相比,高温暗培养(42 ℃,24 h暗)条件下OsSZP表达量明显降低。
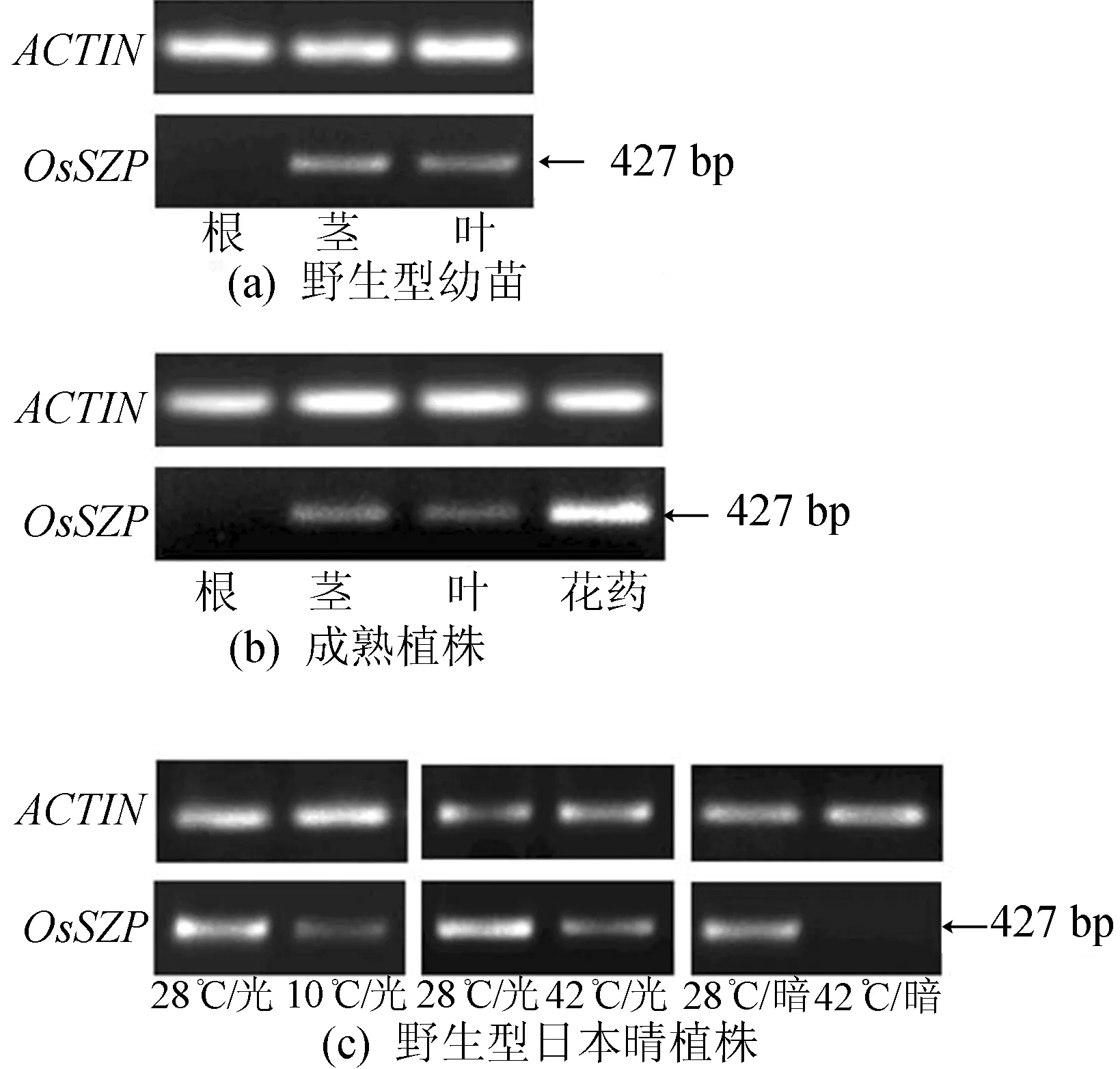
图1 OsSZP基因表达模式分析
2.3OsSZP 基因RNAi转基因植株鉴定
利用带有OsSZP基因正、反向重复片段植物表达载体pHB-SZPRI的农杆菌结构如图2a所示,通过农杆菌介导遗传转化方法,获得转基因植株。提取野生型、转基因植株基因组DNA,利用潮霉素抗性标记基因(Hpt)序列进行PCR扩增检测,结果如图2b所示,由图2b可知,鉴定转基因为阳性株系。对野生型、3个独立T3代转基因阳性株系(Ri-1~Ri-3)进行OsSZP基因表达水平分析,如图2c所示,由图2c可知,转基因植株中OsSZP基因较野生型明显降低,表明获得水稻OsSZP基因下调株系。
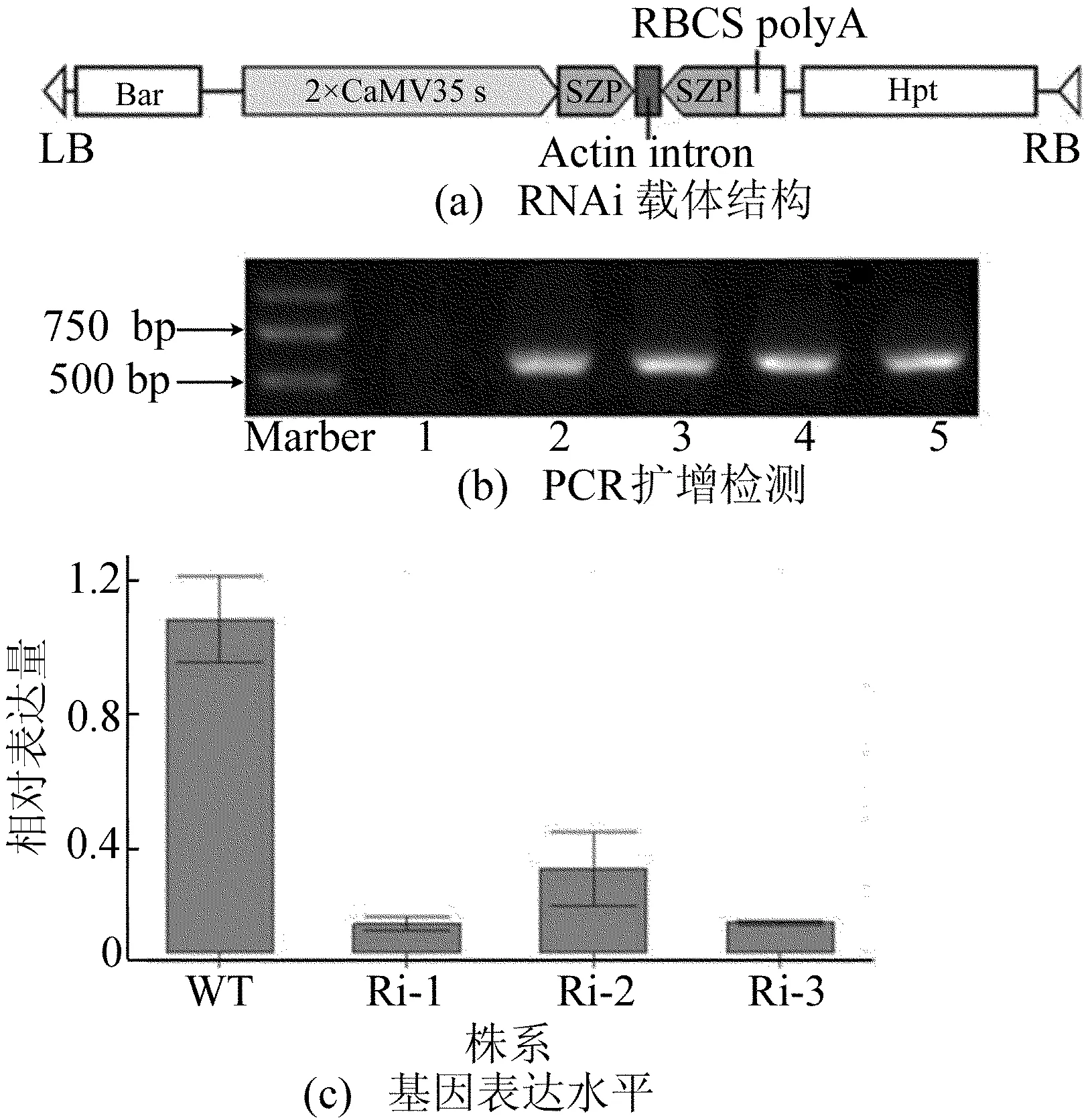
图2 OsSZP基因RNAi转基因株系鉴定
2.4转基因植株表型分析
转基因植株表型分析结果如图3所示。
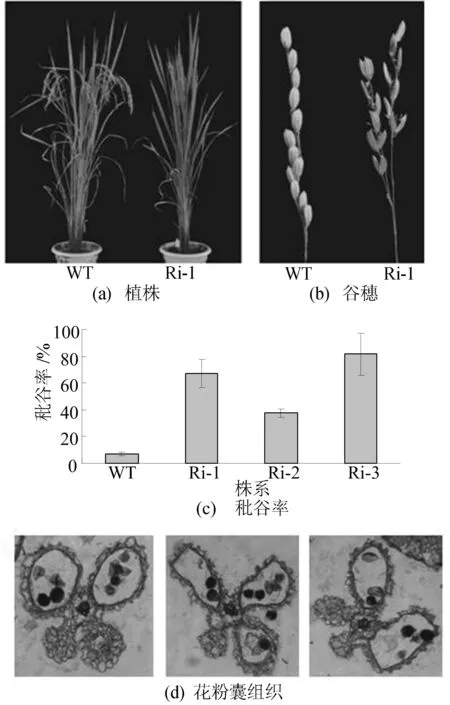
图3 OsSZP基因RNAi转基因植株表型
由图3可看出,与同期平行种植野生型日本晴秕谷率(7.3%)相比,各转基因株系秕谷率明显增高,分别为68.7%、40.6%和82.8%,且OsSZP基因下调程度与秕谷率的升高基本一致。花药组织切片显示,OsSZP基因下调植株中同一花药4个花粉囊发育不同步或败育,药室发育不全;成熟花粉形状不规则,染色不均匀。与野生型相比,转基因株系株高、分蘖数、每穗粒数无显著差异。
3 结 论
本研究对含有4个锌指结构域的C2H2型锌指蛋白基因OsSZP进行了克隆和RNAi,所获得OsSZP基因下调转基因植株花粉发育异常,秕谷率显著升高,表明OsSZP基因功能与水稻生殖发育相关。在对OsSZP进行过量表达时,获得表达量增加0.5~2.5倍T2代转基因株系(OX-1~OX-3),秕谷率未见明显差异,如图4a所示,而所得到过表达共抑制(co-suppression)株系(CS-1~CS-3)中OsSZP基因比野生型有所降低,育性下降,如图4b所示,秕谷率较野生型(7.3%)明显升高,分别为41.2%、56.8%、47.1%。
此外,在遗传转化过程中获得的转基因阴性株系秕谷率未见明显变化;育性较差的OsSZP基因RNAi下调植株授以野生型花粉时可以正常结实、发苗生长,进一步表明锌指蛋白基因OsSZP参与水稻生殖调控,对水稻雄配子发育具有负调控作用。

图4 过表达及共抑制转基因株系表型
在OsSZP基因下调转基因植株的稻穗中,出现7%~15%“假粒”现象,即子房自行发育膨大形成形似糙米,其内充满液体,没有胚和胚乳的囊体,如图5所示。这种假粒也出现在一些水稻雄性不育系中,被认为与雄性不育系子房孤雌发育有关,并受温度影响,当温度升高时假粒率也明显增加[21]。
与其他植物相似,由于生殖发育是攸关种群繁育的重要事件,在水稻中配子发育同样综合内外信号进行精细复杂的网络调控。锌指蛋白转录因子作为调控网络的重要部分,感受外部信号并在上游蛋白调控下进行转录表达。

图5 OsSZP基因下调转基因植株稻穗中的假粒现象
OsSZP基因上游有多个光调控元件,如GATA、GRWAAW、GATAA、GGGCC等,这与OsSZP基因在光、暗培养条件中表达情况及在水稻根中不表达的检测结果相符。此外,在OsSZP基因上游有花药特异调控元件AGAAA,以及在花器官发育中具有重要调控作用的MADS结构域蛋白[22]、AP2-like[23]和B3-like[24]蛋白的识别元件CWWWWWWWWG、CAACA。因此,可以推测OsSZP基因的表达受到上游花发育基因的调控,继而作为转录因子进一步调控其下游基因的表达,最后形成相应表型。因此,研究水稻锌指蛋白基因在生殖发育中的功能,并进一步揭示其分子机制,有助于开拓新的不育基因资源,为作物新品种培育与遗传改良提供基础。
[1]BROWN R S.Zinc finger proteins:getting a grip on RNA[J].Current Opinion in Structural Biology,2005,15(1):94-98.
[2]TAKATSUJI H.Zinc-finger proteins:the classical zinc finger emerges in contemporary plant science[J].Plant Molecular Biology,1999,39(6):1073-1078.
[3]LIU Liansen,WHITE M J,MACRAE T H.Transcription factors and their genes in higher plants:functional domains,evolution and regulation[J].European Journal of Biochemistry,1999,262(2):247-257.
[4]GAMSIAEGER R,LIEW C K,LOUGHLIN F E,et al.Sticky fingers:zinc-fingers as protein-recognition motifs[J].Trend in Biochemical Sciences,2007,32(2):63-70.
[5]ENGLBRECHT C C,SCHOOF H,BOHM S.Conservation,diversification and expansion of C2H2 zinc finger proteins in theArabidopsisthalianagenome[J].BMC Genomics,2004,5:39.
[6]Agarwal P,Arora R,Ray S,et al.Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis[J].Plant Molecular Biology,2007,65:467-485.
[7]WANG D,GUO Y,WU C,et al.Genome-wide analysis of CCCH zinc finger family in Arabidopsis and rice [J].BMC Genomics,2008,9:44-54.
[8]CIFTCI-YILMAZ S,MITTLER R.The zinc finger network of plants[J].Cellular and Molecular Life Sciences,2008,65:1150-1160.
[9]TAKATSUJI H.Zinc-finger transcription factors in plant[J].Cellular and Molecular Life Sciences,1998,54(6):582-596.
[11]YANO M,KATAYOSE Y,ASHIKARI M,et al.Hd1,a major photoperiod sensitivity quantitative trait locus in rice,is closely related to theArabidopsisflowering time gene CONSTANS[J].The Plant Cell,2000,12(12):2473-2484.
[12]KOZAKI A,HAKE S,COLASANTI J.The maize ID1 flowering time regulator is a zinc finfer protein with novel DNA binding properties[J].Nucleic Acids Research,2004,32(5):1710-1720.
[13]WU C,YOU C,LI C,et al.RID1,encoding a Cys Z-His2-type zinc finger transcription factor,acts as a master switch from vegetative to floral development in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(35):12915-12920.
[14]KAPOOR S,KOBAYASHI A,TAKATUSJI H.Silencing of the tapetum-specific zinc finger geneTAZ1 causes premature degeneration of tapetum and pollen abortion in petunia[J].The Plant Cell,2002,14(10):2353-2367.
[15]ITO T,NAGATA N,YOSHIBA Y,et al.ArabidopsisMALESTERILITY1 encodes a PHD-type transcription factor and regulates pollen and tapetum development[J].The Plant Cell,2007,19(11):3549-3562.
[16]胡骏,黄文超,朱仁山,等.水稻雄性不育与杂种优势的利用[J].武汉大学学报(理学版),2013,59(1):1-9.
[17]FIRE A,XU S Q,MONTGOMERY M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391:806-811.
[18]MAO J,ZHANG Y C,SANG Y,et al.A role for Arabidopsis cryptochromes and COP1 in the regulation of stomatal opening[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(34):12270-12275.
[19]HIEI Y,OHTA S,KOMARI T,et al.Efficient transformation of rice (OryzasativaL.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA[J].The Plant Journal,1994,6(2):271-282.
[20]张惠莹,张黎,李嵘,等.西南地区4个籼稻恢复系遗传转化植株再生体系研究[J].合肥工业大学学报(自然科学版),2013,36(12):1511-1517.
[21]谭学林.滇型杂交水稻雄性不育系子房孤雌发育的观察[J].云南农业大学学报,1989,4(1):82-83.
[22]黄方,迟英俊,喻德跃.植物MADS-box基因研究进展[J].南京农业大学学报,2012,35(5):9-18.
[23]MAES T,ZETHOF J,KARIMI M,et al.PetuniaAp2-like genes and their role in flower and seed development[J].The Plant Cell,2001,13 (2):229-244.
[24]LEVY Y Y,MESNAGE S,MYLNW J S,et al.Multiple Roles ofArabidopsisVRN1 in vernalization and flowering time control[J].Science,2002,297(5579):243-246.
(责任编辑闫杏丽)
Construction, genetic transformation and function analysis of a rice zinc-finger protein geneOsSZP
LIU Ying1,YU Xiaohong2,LUO Xiaoli2,XIAO Liwei1,LIU Yongsheng1,NIU Xiangli1
(1.School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2.School of Life Sciences, Chongqing University, Chongqing 400044, China)
The function of a rice zinc-finger protein geneOsSZPwas investigated by RNA interference(RNAi). The analysis results of quantitative polymerase chain reaction(PCR) and phenotype showed that the transgenic plants with significantly lowerOsSZPexpression level could be obtained by RNAi. TheOsSZPdown-regulated transgenic plants exhibited increased blasted rates and reduced pollen fertilities compared with wildtype, suggesting thatOsSZPfunctions as a regulator of male gamete development in rice. The expression pattern analysis results revealed thatOsSZPwas not expressed in roots of rice seedlings and mature plants, but showed higher level in rice anther. In addition, the abundance ofOsSZPwas also affected by temperature and light.
rice; zinc-finger protein; RNA interference(RNAi); fertility
2015-03-16;
2015-04-14
国家自然科学基金面上资助项目(30270031)
刘莹(1992-),女,安徽六安人,合肥工业大学硕士生;
刘永胜(1964-),男,重庆市人,博士,合肥工业大学教授,博士生导师;
10.3969/j.issn.1003-5060.2016.07.024
Q943.2;S511.03
A
1003-5060(2016)07-0988-06
牛向丽(1971-),女,河南周口人,博士,合肥工业大学研究员,硕士生导师.

