苯污染胁迫下室内植物叶绿素含量变化分析研究
鲁敏,景荣荣,赵洁,闫红梅,赵学明,丁珍
(山东建筑大学 艺术学院,山东 济南 250101)
苯污染胁迫下室内植物叶绿素含量变化分析研究
鲁敏,景荣荣,赵洁,闫红梅,赵学明,丁珍
(山东建筑大学 艺术学院,山东 济南 250101)
苯为室内空气污染的“三大隐形杀手”之一,严重威胁人们的生命健康,室内苯污染的生态治理已成为亟待解决的重要环境问题。室内植物对苯污染的抗性强弱与能力的研究与选择,是高效治理室内苯污染的基础和前提。叶绿素含量变化是评价室内植物对苯污染抗性强弱的重要依据之一。文章采用室内熏气实验,分析了9种常见室内植物在不同浓度的苯污染胁迫下植物体内叶绿素含量的变化,研究了室内植物对苯污染的抗性强弱。结果表明:植物种类、苯浓度及两者间的协同作用,对植物叶绿素含量变化的影响差异均达极显著水平;其中,苯浓度对植物叶绿素含量变化的影响更显著;在15、30和60 mg/m3浓度苯胁迫下,金边虎尾兰叶绿素含量分别降低5.43%、10.09%、19.33%,抗性能力最强;皱叶薄荷叶绿素含量分别降低12.81%、19.53%、35.18%,抗性能力最弱;在15 mg/m3浓度苯胁迫下,鸟巢蕨叶绿素含量降低5.92%,抗性能力次之;在30 和60 mg/m3浓度苯胁迫下,绿萝叶绿素含量分别降低了10.33%、19.86%,抗性能力次之;综合评定结果表明9种室内植物对苯污染抗性能力最强的是金边虎尾兰,其次为绿萝,皱叶薄荷为最弱。
苯污染;室内植物;叶绿素;抗性能力
0 引言
当代社会,随着经济迅猛发展,环境污染问题已成为共同关注的焦点。现代社会继“煤烟型”和“光化学烟雾型”污染期之后,正处在第三污染期—“室内化学污染”时期[1-2]。苯被称为“芳香杀手”,已被国际癌症研究机构(IARC)列入强致癌物的行列,为室内空气污染的“三大隐形杀手”之一,严重威胁人们的生命健康, 室内苯污染的生态治理已成为亟待解决的重要问题[3-4]。目前,对治理和净化室内苯污染的方法已有大量研究,在多种净化技术中,植物生态修复技术因具有绿色、经济、可持续、无二次污染等特点而成为净化修复室内化学污染的重要手段和根本途径[5-7]。
室内植物对苯污染的抗性强弱,对苯污染的高效治理至关重要[8-10]。植物叶绿素含量的变化是评价室内植物对苯污染的抗性能力的重要依据[11-12]。叶绿素是植物进行光合作用不可或缺的光合色素和物质基础[13]。苯污染胁迫下,气体通过叶孔进入植物体内,叶绿体结构遭到破坏,叶绿素合成受阻,含量减少,植物光合作用减弱。苯气体浓度越大,胁迫时间越长,植物叶片叶绿素含量下降越快[14-15]。研究通过对不同浓度苯污染胁迫下室内植物叶绿素含量的变化进行分析,综合评价室内植物对苯污染胁迫抗性的强弱,从而为生态修复技术的推广应用和室内受损生态系统的重建提供理论基础和科学依据。
1 材料与方法
1.1实验材料
实验于2012年8—11月在山东建筑大学市政与环境工程学院进行。选用的实验材料为9种常见室内观叶植物(见表1)。要求植物株型一致,均处于良好的生长状态;所用花盆大小、材质一致,盆土性质与用量相同;实验前擦拭植物叶片晾干;实验过程中用聚乙烯薄膜包扎花盆和盆土。

表1 实验植物种类
1.2实验设计
参照Wolverton博士的封闭舱装置[16];考虑到苯的性质相对较稳定,不易与其他物质发生反应,故采用厚度约8 mm的普通玻璃制作成尺寸为0.8 m×0.8 m×0.8 m的密封玻璃熏气箱;箱体的顶盖与箱体相互分离,便于实验植物的放入和取出;实验植物和试剂放入后用密封海绵胶带立即密封箱体与顶盖各接口,并将适量凡士林涂抹于密封胶带各接触面,以防漏气;箱体内放置小风扇,加快污染气体的均匀混合;放置温湿度计,记录箱内温度和湿度的变化。
设置15.00、30.00和60.00 mg/m33个浓度梯度,将9种实验植物随机区组,依次放入熏气箱内进行苯胁迫处理,24 h后取出,采集生长良好、位置一致的叶片测定植物叶片叶绿素含量,实验进行3次重复。
1.3指标测定方法
叶绿素含量参照浸提法进行测定,提取液为95%的乙醇和95%丙酮的混合液,按1∶1的体积混合而成[17-18]。
1.4统计分析方法
将不同植物种类和苯浓度作为影响实验植物生理指标变化的两个因素,记录实验所得数据,并用SPSS18.0软件等进行方差分析、多重比较分析(LSD)和差异显著性检验(齐次性检验)。对不同浓度苯污染胁迫下的9种植物叶绿素含量变化进行综合分析,并评定9种植物抗苯污染能力大小[19-21]。
2 结果与分析
不同浓度苯分别对9种室内植物胁迫24 h后,统计并分析植物体内叶绿素含量的变化,结果见表2。
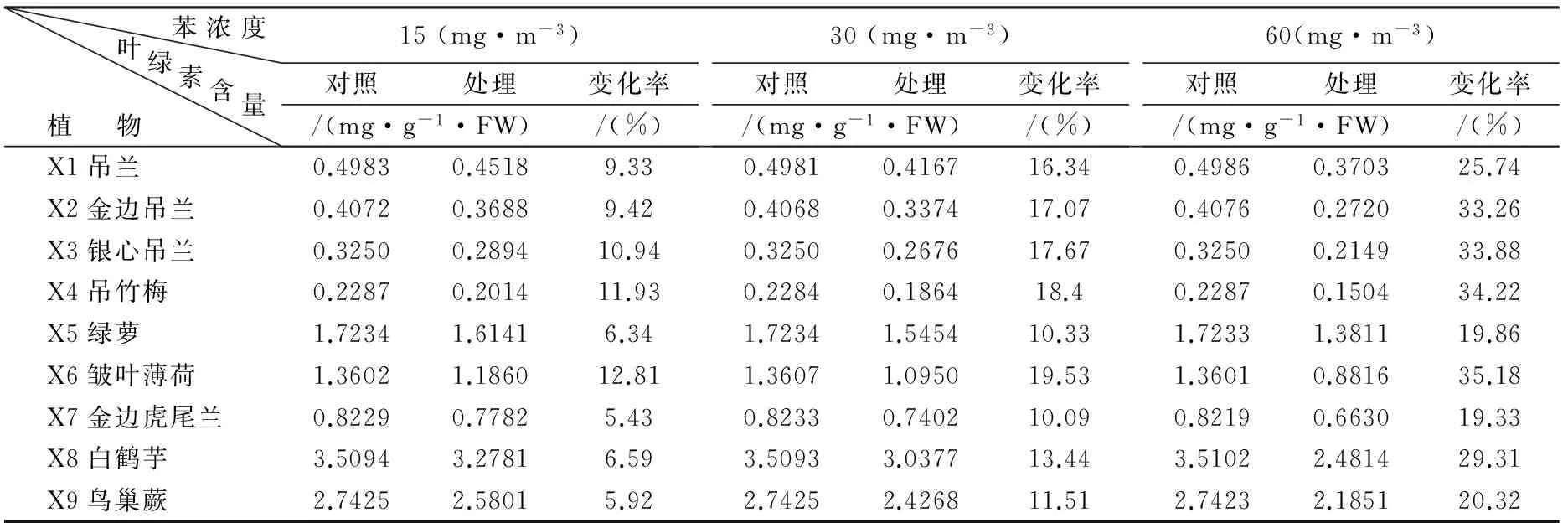
表2 不同浓度苯胁迫下实验植物的叶绿素含量变化
从表2可知,9种实验植物受不同浓度苯胁迫24 h后,叶绿素含量均出现不同程度的减少。以植物种类、苯浓度作为两个控制因素,对植物的叶绿素含量变化率进行双因素方差分析,结果见表3。
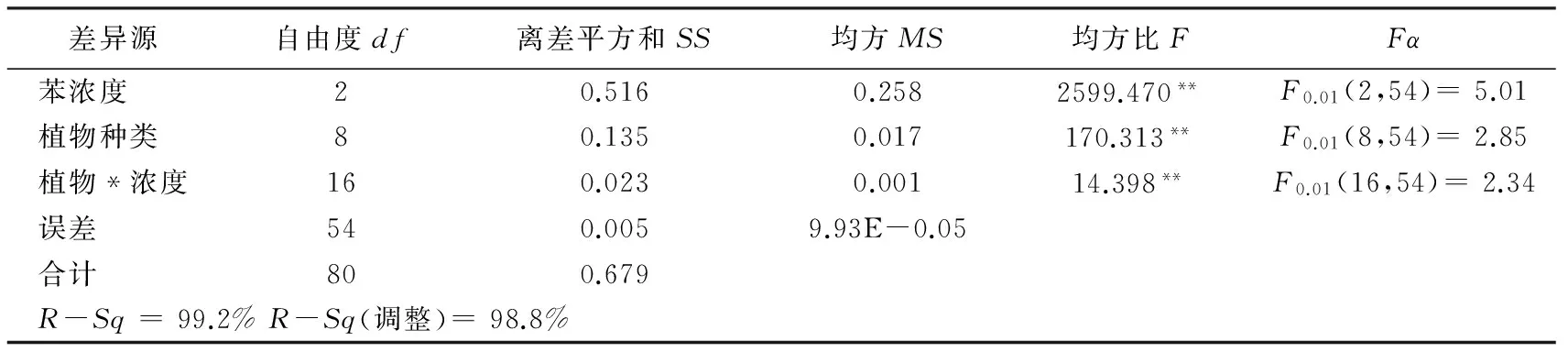
表3 不同浓度苯胁迫下植物叶绿素变化率方差分析
从表3可知,不同植物种类、苯浓度及其之间的协同作应,对9种实验植物叶绿素含量变化率的影响差异均达到极显著水平;F值2599.470>170.313,即植物种类、苯浓度两因素相比较,苯浓度对植物叶绿素含量变化的影响更为显著。
2.1在15 mg/m3苯胁迫下植物叶绿素含量变化结果与分析
在15 mg/m3浓度苯对实验植物胁迫24 h后,统计9种植物的叶绿素含量变化率,并进行单因素方差分析,结果见表4。

表4 15 mg/m3苯胁迫下植物叶绿素变化率方差分析结果
从表4可知, 15 mg/m3浓度苯胁迫后,植物种类的不同对叶绿素含量变化率的影响差异达到极显著水平;对叶绿素含量变化率的统计结果再进行多重比较分析,结果见表5。
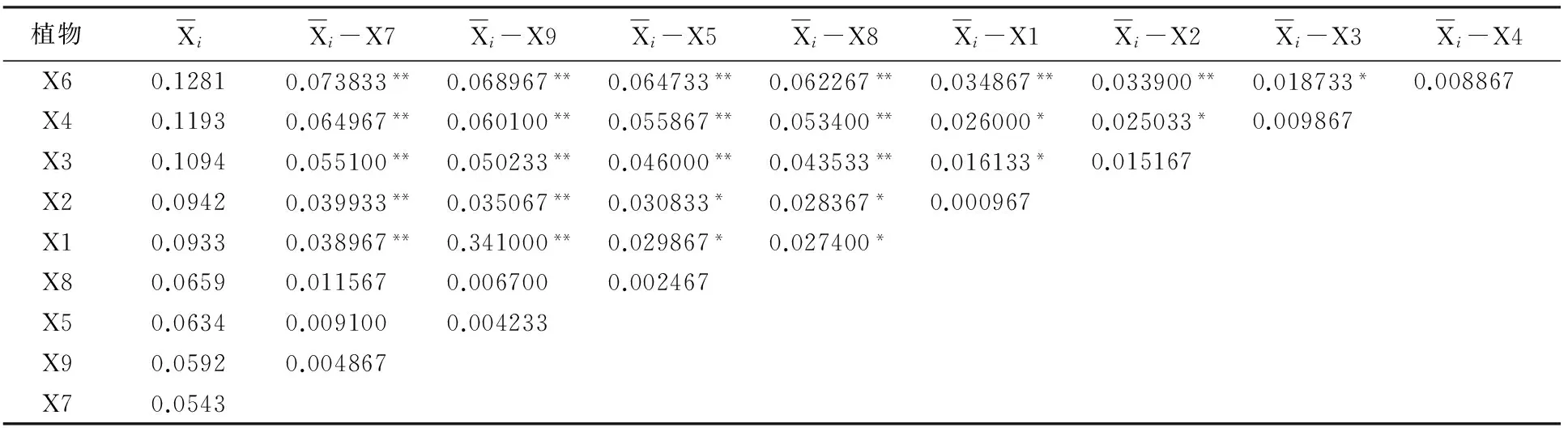
表5 15 mg/m3苯胁迫下植物叶绿素变化率多重比较结果
注:多重比较分析采用了LSD分析水平,下同
多重比较结果表明:在15 mg/m3的苯胁迫下,除金边虎尾兰(X7)、鸟巢蕨(X9)、绿萝(X5)、白鹤芋(X8)相互之间,金边吊兰(X2)与吊兰(X1)、银心吊兰(X3)之间,吊竹梅(X4)与银心吊兰(X3)、皱叶薄荷(X6)之间无显著性差异;吊兰(X1)与绿萝(X5)、白鹤芋(X8)、吊竹梅(X4)、银心吊兰(X3)之间,银心吊兰(X3)与皱叶薄荷(X6)之间,金边吊兰(X2)与绿萝(X5)、白鹤芋(X8)、吊竹梅(X4)之间存在显著差异外,其它植物种类之间的叶绿素含量变化差异也均能达极显著水平。
在15 mg/m3浓度苯对实验植物胁迫24 h后,9种植物体内叶绿素含量均发生一定程度的减少。其中,金边虎尾兰(X7)的叶绿素含量降低5.43%,变化最小,抗性能力最强;鸟巢蕨(X9)降低5.92%,抗性能力次之;皱叶薄荷(X6)的叶绿素含量降低12.81%,变化最大,抗性能力最弱。
以不同植物种类叶绿素含量变化来反映植物抗性强弱,对在15 mg/m3苯胁迫24 h后的9种实验植物的抗性能力进行大小排序为:金边虎尾兰(X7)>鸟巢蕨(X9)>绿萝(X5)>白鹤芋(X8)>吊兰(X1)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
2.2在30 mg/m3苯胁迫下植物叶绿素含量变化结果与分析
在30 mg/m3浓度苯对实验植物胁迫24 h后,统计9种植物的叶绿素含量变化率,并进行单因素方差分析,结果见表6。
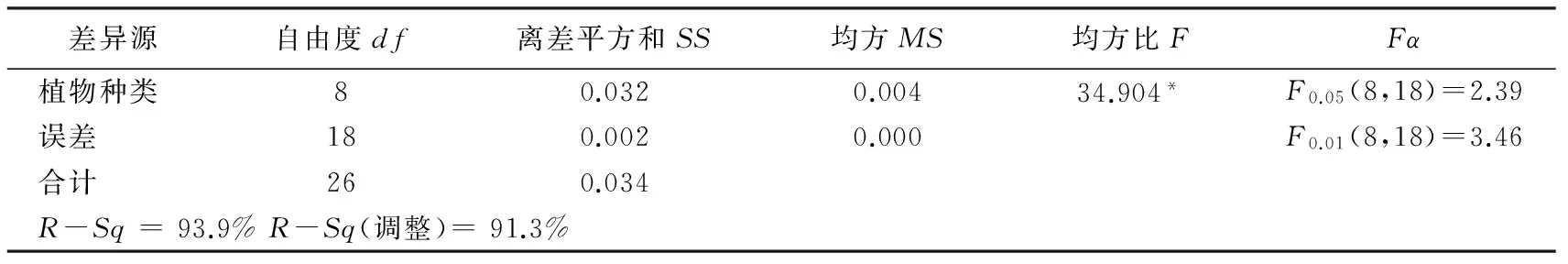
表6 30 mg/m3苯胁迫下植物叶绿素变化率方差分析结果
从表6可知,30 mg/m3浓度苯胁迫后,植物种类的不同对叶绿素含量变化率的影响差异达到极显著水平;对叶绿素含量变化率的统计结果再进行多重比较分析,结果见表7。
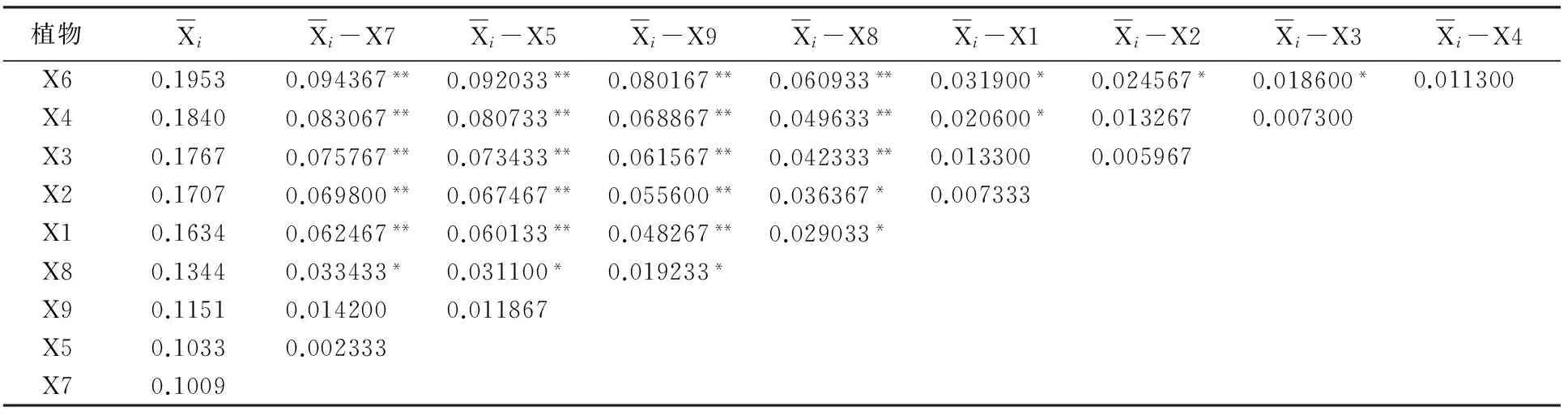
表7 30 mg/m3苯胁迫下植物叶绿素变化率多重比较结果
多重比较结果表明:在30 mg/m3的苯胁迫下,除金边虎尾兰(X7)、绿萝(X5)、鸟巢蕨(X9)相互之间,金边吊兰(X2)与吊兰(X1)、银心吊兰(X3)、吊竹梅(X4)之间,银心吊兰(X3)与吊兰(X1)、吊竹梅(X4)之间、吊竹梅(X4)与皱叶薄荷(X6)之间无显著性差异,白鹤芋(X8)与金边虎尾兰(X7)、绿萝(X5)、鸟巢蕨(X9)、金边吊兰(X2)、吊兰(X1)之间,皱叶薄荷(X6)与金边吊兰(X2)、银心吊兰(X3)之间,吊兰(X1)与吊竹梅(X4)、皱叶薄荷(X6)之间存在显著差异外,其它植物种类之间的叶绿素含量变化差异也均能达极显著水平。
在30 mg/m3浓度苯对实验植物胁迫24 h后,9种植物体内叶绿素含量均发生一定程度的减少。其中,金边虎尾兰(X7)的叶绿素含量降低10.09%,变化最小,抗性能力最强;绿萝(X5)降低10.33%,抗性能力次之;皱叶薄荷(X6)的叶绿素含量降低19.53%,变化最大,抗性能力最弱。
以不同植物种类的叶绿素含量变化来反映植物抗性强弱,对在30 mg/m3苯胁迫24 h后的9种实验植物的抗性能力进行大小排序为:金边虎尾兰(X7)>绿萝(X5)>鸟巢蕨(X9)>白鹤芋(X8)>吊兰(X1)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
2.3在60 mg/m3苯胁迫下植物叶绿素含量变化结果与分析
在60 mg/m3浓度苯对实验植物胁迫24 h后,统计9种植物的叶绿素含量变化率,并进行单因素方差分析,结果见表8。

表8 60 mg/m3苯胁迫下植物叶绿素变化率方差分析结果
从表8可知, 在60 mg/m3浓度苯胁迫后,植物种类的不同对叶绿素含量变化率的影响差异达到极显著水平;对叶绿素含量变化率的统计结果再进行多重比较分析,结果见表9。
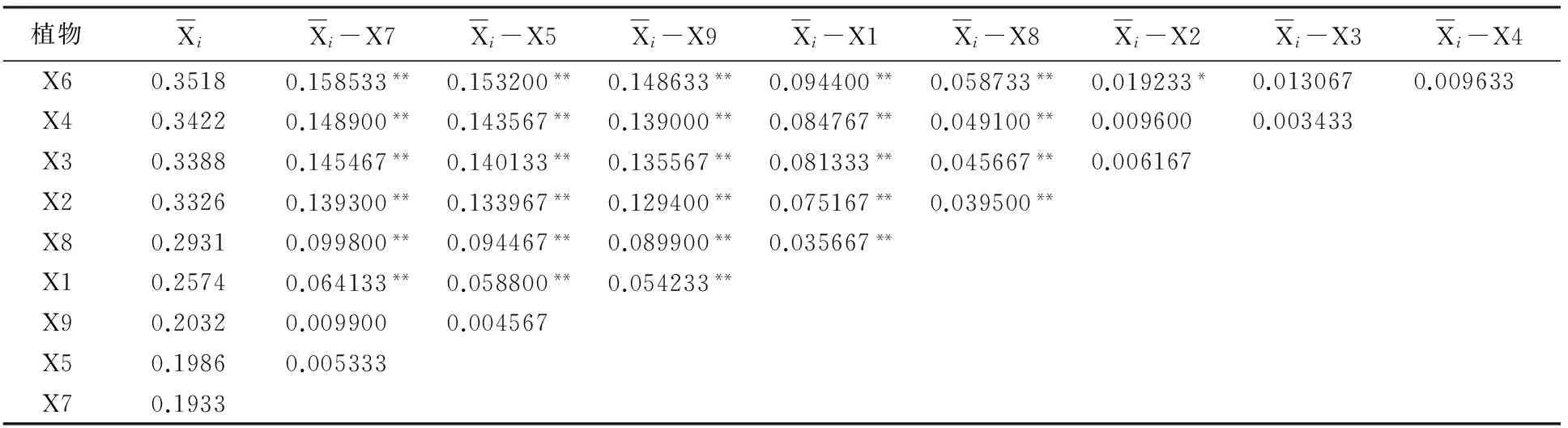
表9 60 mg/m3苯胁迫下植物叶绿素变化率多重比较结果
多重比较结果表明:在60 mg/m3的苯胁迫下,除金边虎尾兰(X7)、绿萝(X5)、鸟巢蕨(X9)相互之间,吊竹梅(X4)与皱叶薄荷(X6)、银心吊兰(X3)、金边吊兰(X2)之间,金边吊兰(X2)与银心吊兰(X3)之间无显著性差异,皱叶薄荷(X6)与金边吊兰(X2)之间存在显著差异外,其它植物种类间的叶绿素含量变化差异均达到极显著水平。
在60 mg/m3浓度苯对实验植物胁迫24 h后,9种植物体内叶绿素含量均发生一定程度的减少。其中,金边虎尾兰(X7)的叶绿素含量降低19.33%,变化最小,抗性能力最强;绿萝(X5)降低19.86%,抗性能力次之;皱叶薄荷(X6)的叶绿素含量降低35.18%,变化最大,抗性能力最弱。
以不同植物种类叶绿素含量变化来反映植物抗性强弱,对在60 mg/m3苯胁迫24 h后的9种实验植物的抗性能力进行大小排序为:金边虎尾兰(X7)>绿萝(X5)>鸟巢蕨(X9)>吊兰(X1)>白鹤芋(X8)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
3 结论
通过上述研究可知:
(1) 不同植物种类、苯浓度及两者间的协同作用,对9种实验植物叶绿素含量变化的影响差异均能达极显著水平;通过F值比较可以得出,苯浓度对植物叶绿素含量的影响更为显著。
(2) 在不同浓度苯胁迫下,9种实验植物的叶绿素含量均出现不同程度的下降。
① 在15 mg/m3浓度苯胁迫24 h后,不同植物的叶绿素含量变化存在极显著差异。其中,金边虎尾兰(X7)的叶绿素含量变化最小,降低5.43%,抗性能力最强;鸟巢蕨(X9)次之,降低5.92%;皱叶薄荷(X6)的叶绿素含量变化最大,降低12.81%,抗性能力最弱。对9种植物的抗苯污染胁迫能力进行大小排序为:金边虎尾兰(X7)>鸟巢蕨(X9)>绿萝(X5)>白鹤芋(X8)>吊兰(X1)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
② 在30 mg/m3浓度苯胁迫24 h后,不同植物的叶绿素含量变化存在极显著差异。其中,金边虎尾兰(X7)的叶绿素含量变化最小,降低10.09%,抗性能力最强;绿萝(X5)次之,降低10.33%;皱叶薄荷(X6)的叶绿素含量变化最大,降低19.53%,抗性能力最弱。对9种实验植物的抗性能力进行大小排序:金边虎尾兰(X7)>绿萝(X5)>鸟巢蕨(X9)>白鹤芋(X8)>吊兰(X1)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
③ 在60 mg/m3浓度苯胁迫24 h后,不同植物的叶绿素含量变化存在极显著差异。其中,金边虎尾兰(X7)的叶绿素含量变化最小,降低19.33%,抗性能力最强;绿萝(X5)次之,降低19.86%;皱叶薄荷(X6)的叶绿素含量变化最大,降低35.18%,抗性能力最弱。对9种实验植物的抗性能力进行大小排序:金边虎尾兰(X7)>绿萝(X5)>鸟巢蕨(X9)>吊兰(X1)>白鹤芋(X8)>金边吊兰(X2)>银心吊兰(X3)>吊竹梅(X4)>皱叶薄荷(X6)。
(3) 综合15、30和60 mg/m3浓度苯胁迫下9种实验植物叶绿素含量的变化表明:对苯污染抗性能力最强的植物是金边虎尾兰(X7),其次为绿萝(X5),皱叶薄荷(X6)为最弱。
[1]鲁敏,赵洁,冯兰东,等.室内苯污染的植物生态修复技术研究进展[J].山东建筑大学学报,2013,28(6) :551-556.
[2]鲁敏,赵学明,赵洁,等.室内苯污染胁迫下植物抗性的研究进展[J].山东建筑大学学报,2013,28(5) :457-463.
[3]令狐昱慰,黎斌,李思锋,等.3种观赏植物对室内甲醛污染的净化及生长生理响应[J].西北植物学报,2011,31(4) :776-782.
[4]鲁敏,刘功生,陈强,等. 9种耐荫观赏植物对室内甲醛污染生理抗性比较研究[J].山东建筑大学学报,2014,29(2) :111-117.
[5]刘栋,史宝胜,魏文欣.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报,2011,34(2) :66-70.
[6]何勤勤,周俊辉.盆栽植物对室内甲醛空气污染的净化研究进展[J].江西农业学报,2014,26(2):44-48.
[7]肖健,吴思政,聂东伶,等.甲醛胁迫对3种室内观赏植物的生理生化影响[J].湖南林业科技,2012,39(2) :45-48.
[8]梁琪惠,吴永胜,刘刚,等.Cr,As,Pb,Cd复合污染对茶树叶片酶活性和细胞膜透性的影响[J].南方农业,2012,6(7) :1-6.
[9]蔡宝珍,金荷仙,熊伟.室内植物对甲醛净化性能的研究进展[J].中国农学通报,2011,27(6) :30-34.
[10]陈佳瀛,邵勤龙,张佳慧,等.吊兰和常春藤对室内甲醛污染降解能力的研究[J].安徽农业科学,2013,41(15) :6829-6831.
[11]鲁敏,刘顺腾,赵洁.室内化学污染气体的植物监测研究进展[J].山东建筑大学学报,2013,28(1) :58-62.
[12]林丽仙,李惠华,张雪芹,等.甲醛对吊兰等植物细胞质膜相对透性和光合特性的影响[J].热带作物学报,2013,34(4) :719-726.
[13]周茜茜,陈成广,陈碧,等. 3种室内观赏植物对苯污染净化能力的研究[J].广东农业科学,2013,40(16) :143-146.
[14]张淑娟,黄耀棠.利用植物净化室内甲醛污染的研究进展[J].生态环境学报,2010,19(12) :3006-3013.
[15]孟国忠,季孔庶.室内空气污染的植物净化研究概述[J].林业科技开发,2013,27(4) :1-6.
[16]Wolverton B.C.,Wolverton J.D.. Plants and soil microorganisms: removal of formal dehyde, xylene, and ammonia from the indoor environment[J]. Journal of the Mississippi Academy of Sciences,1993,38(2) :11-15.
[17]王利英,杨振德,邓荣艳,等.几种园林植物对甲醛污染的反应研究[J].广西科学,2007,14(2) :163-166.
[18]刘栋,史宝胜,魏文欣.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报,2011,34(2) :66-70.
[19]胡羡聪,张德强,孔国辉,等.大气SO2、氟化物对植物生理生态指标的影响[J].热带亚热带植物学报,2003,11(4) :372-378.
[20]陆长根,盛宁,张衡锋.4种室内观赏植物对苯气体胁迫的反应[J].安徽农业科学,2008,36(34) :1486-1487.
[21]吴凯,周晓阳.环境胁迫对植物超微结构的影响[J].山东林业科技,2007(3) :80-84.
(学科责编:吴芹)
Analysis of indoor plant chlorophyll content in benzene pollution stress
Lu Min, Jing Rongrong, Zhao Jie, et al.
(School of Art, Shandong Jianzhu University, Jinan 250101, China)
Benzene has been known as one of the three invisible killers of indoor pollution, and is severely threatening human health, and the management of indoor Benzene pollution has become a major issue in improving indoor ecological environment. The indoor plants for adversity resistance to indoor Benzene, is essential to control benzene contamination efficiently. The research and choice of strength and ability of resistance of indoor plants to benzene pollution is the basis and premise of effective governance indoor benzene pollution. The change of the chlorophyll content of plants is one of the important bases to evaluate the ability of resistance to benzene contamination. The research does experiments with different concentrations of benzene stress for 9 plants with airtight fumigation method, by analyzing the changes in chlorophyll content under different concentrations of benzene pollution stress in plants, and does research on indoor plants resistant ability to benzene contamination. The results show that the influence of different plant species, benzene concentration and interaction between two factors on variation of the contents of chlorophyll have come to an extremely significant level; the effects of benzene concentration on plant physiological indexes’ changes is more significant;Sansevieriatrifasciatavar. laurentii has the highest resistance against benzene pollution under benzene stress of 15 mg/m3, 30 mg/m3and 60 mg·m-3, which respectively is 5.43%, 10.09% and 19.33%; Melissaofficinalis, the lowest, which respectively is 12.81%, 19.53% and 35.18%; under benzene stress of 15 mg/m3,Neottopterisantiqueis the second to resist benzene pollution; under benzene stress of 30 mg/m3and 60 mg/m3, the second isScindapsusaureun. The physiological indexes ofSansevieriatrifasciatavar. laurentii has the strongest resistance to benzene pollution, followed byScindapsusaureun, and the weakest isMelissaofficinalis.
benzene pollution; indoor plants; chlorophyll; resistance ability
2016-01-13
国家自然科学基金重点项目(20337010);住房和城乡建设部科技计划项目(2012-K6-5);山东省住房和城乡建设厅科技计划项目 (2011YK046)
鲁敏(1963-),女(满族),教授,博士,主要从事室内化学污染、污染大气和污水的植物净化与修复技术及吸污防污植物的选择与应用等方面的研究. E-mail:lumin@sdjzu.edu.cn
1673-7644(2016)01-0001-06
X171.4,X173
A
——吊兰

