电解液组成对CO2电化学还原效率的影响
王倩倩,陈承镇,张志盼,程振民
华东理工大学化学工程联合国家重点实验室,上海 200237
电解液组成对CO2电化学还原效率的影响
王倩倩,陈承镇,张志盼,程振民
华东理工大学化学工程联合国家重点实验室,上海 200237
为了考察电解液组成(溶剂和支持电解质)对CO2电还原效率的影响,以金属银为工作电极,在三电极电解槽中进行了恒电位电解及循环伏安扫描实验。结果表明:相比于二甲基甲酰胺(DMF)和甲醇,用乙腈作溶剂时产物CO法拉第效率最高;强酸作为阳极液支持电解质可以降低CO2还原过电位并提高CO部分电流密度;离子液体作为阴极液支持电解质可以全面提高CO2还原效率。研究不同离子液体的催化行为,发现离子液体中阳离子部分对CO部分电流密度的影响比阴离子的影响更明显,进一步证实了咪唑阳离子对还原CO2起主要催化作用。
二氧化碳 电化学还原 一氧化碳 电解液组成
CO2在大气中含量增加是气候变暖、环境恶化的重要原因。CO2资源化利用是解决这些问题的有效途径。在多种催化固定CO2的方法中,电化学还原为CO具有选择性好、操作便捷和产品价值高等优点,因而受到广泛关注[1]。对于电还原CO2为CO,只有当电流密度大于200 mA/cm2,CO法拉第效率(FECO)大于90%,CO能量效率(EE)大于50%时,该反应在经济上才是切实可行的。然而,在常压下通常很难同时满足以上要求。尽管人们已经发现金属银片对目标产物CO具有较高选择性(约为80%),并且改变银的几何形态,将其制备成纳米孔银或者纳米银颗粒,还可以获得更高的CO法拉第效率(大于90%),但是电解过程中,电流密度低,只有5~20 mA/cm2,有待进一步提高[2-4]。目前国内外的研究主要集中在电极材料开发方面,但对于电解液方面的研究较少。本工作选用对CO具有高选择性的银片作为工作电极,具体考察了溶剂和支持电解质对电还原CO2效率的作用,确定了最佳的电解液组成。另外,近来研究人员发现使用室温下离子液体(RTIL)作为支持电解质可以高效催化CO2电还原为CO[5],但是目前对其催化机理方面的研究较少,本工作还将对离子液体催化机理做一定探究。
1 实验部分
1.1实验步骤
常压下使用CHI 660e电化学工作站进行循环伏安扫描(CV)和恒电位电解(CPE)实验。所有实验均在三腔室三电极密封电解槽中进行,阳极室与阴极室间用Nafion 117®阳离子交换膜(杜邦公司)隔开,参比电极室与工作电极室间用鲁金毛细管连接。循环伏安扫描和恒电位电解实验中使用的工作电极分别为银盘(∅3mm)和银片(1cm×1cm,纯度大于99.9%),辅助电极为铂片(1.5cm×1.5cm,纯度大于99.9%),参比电极为饱和甘汞电极(SCE)。实验使用的有机溶剂有乙腈(AN)、甲醇(MeOH)及二甲基甲酰胺(DMF),纯度大于99%;支持电解质有四正丁基六氟磷酸铵(TBAPF6)、硫酸(H2SO4)、磷酸(H3PO4)及室温离子液体(RTIL),纯度大于99%。
CV扫描和CPE实验前先向电解液中通45min的高纯N2除去溶解氧,随后通45min的高纯CO2至溶液饱和。电解装置流程图如图1所示。对于CV实验,起始电位定义为电流达到还原峰值电流 5%或 10%时的电位值。对于CPE实验,在CO2饱和的阴极电解液中进行,恒定电解电位为-2.1 V并当通过电量达到50 C时停止实验。CPE实验结束后,阴极室电解槽顶部气体用气相色谱进行分析(GC-900C,天辰)。

图1 电解装置流程Fig.1 The flow chart of electrolysis devices
1.2参数计算
还原产物法拉第效率计算公式为[6]:

式中:FE为法拉第效率;F为法拉第常数,其值为96 485 C/mol;z为交换电子数;n为产物的物质的量,mol;Q为总电量,C。
产物部分电流密度计算公式如下:

式中:CD为电流密度,mA/cm2;t为电解时间,s;A为电极面积,cm2。
生成速率计算公式:

式中:R为生成速率,mol/(m2.h)。
2 结果与讨论
2.1溶剂筛选
在电催化还原 CO2的实验中,所选电解液溶剂应当具有电化学窗口宽、化学稳定性好和对 CO2溶解度大等性能。分别向3种常用有机溶剂(MeOH,DMF和AN)中加入0.1 mol/L TBAPF6支持电解质后配成3种电解液,其CPE实验结果见表1。由表可知,CO法拉第效率按下面溶剂顺序依次为:MeOH最小,DMF次之,AN最大,而H2的法拉第效率按此顺序递减。因此,AN作为溶剂时产物CO的选择性最高。为了探究溶剂的影响,首先进行了CV扫描实验,但扫描结果发现CO2起始还原电位在质子性溶剂MeOH中最正,即CO2在MeOH中还原过电位最低。说明此时热力学并不是影响还原产物分布的决定因素。由表2可知,CO2在AN中的溶解量几乎为其在MeOH中的5倍,并略微大于在DMF中的量,这与CO法拉第效率在不同溶剂中的大小顺序一致。另外,有研究发现[7]:低温条件下CO2在甲醇中的溶解量大幅度提高,并由此造成电解产物中CO含量显著增加。因此,本实验结果与低温下CO选择性增加的原因类似,随着溶液中CO2浓度的增加,CO2被还原的机会可能性大大提高。另外,由于甲醇羟基位上的氢活性较高,容易在阴极发生极化反应,因此甲醇作为溶剂时,电解产生的大量氢气可能源于甲醇自身的分解[4]。综上所述,选择AN作为阴极电解液溶剂较合适。

表1 不同有机溶剂中CPE实验结果Table 1 Results of CPE experiments in various solvents

表2 25℃时不同溶剂的CO2溶解度[8]Table 2 CO2solubility in various solvents at 25℃
2.2支持电解质影响
2.2.1阳极液支持电解质
阴极液为0.1 mol/L TBAPF6乙腈溶液,分别考察以H3PO4和H2SO4作为阳极液支持电解质对反应的影响。同样在-2.1 V下进行CPE实验,由图2的CV曲线可见,在该电位下电极上几乎没有电流流过(曲线1),说明0.1 mol/L TBAPF6乙腈溶液是电化学稳定的,电解结果见表3。
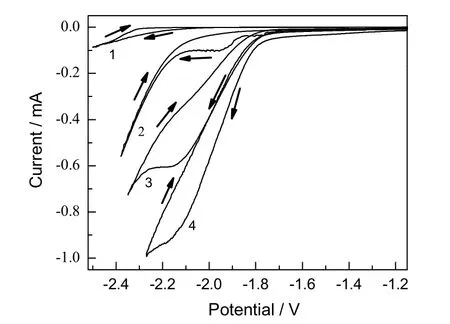
图2 不同阳极电解液时银盘电极上的CV曲线Fig.2 CV curves recorded on Ag disc electrode with various anolytes

表3 阴极液为TBAPF6乙腈时不同阳极液CPE实验结果Table 3 Results of CPE experiments using various anolytes and TBAPF6/AN as catholyte
对比使用0.1 mol/L的TBAPF6乙腈溶液作为阳极液的电解结果,使用磷酸水溶液作为阳极液后,H2法拉第效率明显增加,而若将0.5 mol/L的H3PO4水溶液替换为0.5 mol/L的H2SO4水溶液,该值进一步增加。此外,由图2的CV曲线可知,若将阳极液同样按上述顺序更换,还原峰电流不断增加,还原起始电位逐渐向正方向移动。因此,CPE实验及CV实验结果都表明,增加阳极液质子性能有利于加快整体反应进程。本实验体系,在电场的作用下,阳极室的质子能够透过阳离子交换膜迁移到阴极室,增加阴极液的质子能力,如果阳极液供质子能力非常弱,那么质子的迁移过程将非常困难,而当阳极液为酸性水溶液时,质子迁移能力将大大增强。因此用酸性水溶液(尤其是强酸水溶液)作为阳极液时,电解过程中Ag电极附近质子较多,进而可能影响了还原产物分布。反应式(4)~(6)为电催化反应过程中CO和H2的生成机理。由公式(4)和(6)可见,CO2和H+离子从Ag电极处得到第一个电子还原是同时进行的竞争反应,因此若电极附近H+浓度增加而CO2浓度不变,应该更有利于反应(6)的进行,于是H2生成机会增加。
CO生成机理:
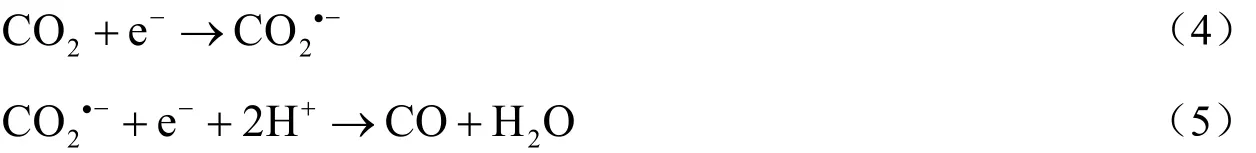
副反应:

由表 3可知,虽然 CO的法拉第效率随着阳极液质子性能增加而略微下降,但其部分电流密度(CDCO)却大幅度上升。这一方面是由于随着阳极液质子能力增强,CO2还原起始电位向正方向移动(见图2),即CO2转化过电位大大降低,根据马库斯等式,这将强化CO2还原速率[9];另一方面,H+作为反应(5)和(6)的反应物,其浓度的增加也将加速反应。这些都使得电解过程中总电流密度显著增加,故CDCO相应增加。
2.2.2阴极液支持电解质
以浓度为0.5 mol/L的H2SO4水溶液作为阳极电解液,研究以咪唑型离子液体(IL)作为阴极液支持电解质对反应的影响,结果见图 3。由图可知,随着阴极液中 1-乙基-3-甲基咪唑四氟硼酸盐(EMIMBF4)的浓度由0增加到0.5 mol/L,产物CO的法拉第效率由77%上升到94%,而H2法拉第效率由9%降到2%。为了进一步探究EMIMBF4起作用的原因,对其进行CV扫描实验,结果见图4。由图可知,阴极液中加入0.5 mol/L的EMIMBF4后,CO2的还原起始电位减少了0.23 V(曲线1和2),即整个还原体系的过电位大大降低,当EMIMBF4存在时,CO在热力学上更加容易生成。这是由于电解过程中吸附在电极表面的咪唑阳离子EMIM+与CO2形成了稳定的配合物[EMIM-CO2],该配合物的产生提供了一条更容易生成CO的能量途径[10]。另外,吸附在电极表面的咪唑阳离子阻止H+在Ag电极表面吸附,导致H2被抑制。

图3 CO和H2法拉第效率随EMIMBF4浓度变化曲线Fig.3 Changes of FE of CO and H2with the concentration of EMIMBF4

图4 加入离子液体前后Ag盘电极上CV曲线Fig.4 CV curves recorded on the Ag disc electrode in the absence and presence of RTIL, respectively
不同离子液体对CO部分电流密度的影响结果见图5。由图可知,CDCO在BMIM+型离子液体中的值明显大于其在EMIM+中的值,而若保持阳离子部分不变,电流密度变化较小。由CO部分电流密度的差别可以看出咪唑型离子液体对电还原CO2为CO的影响主要归功于其咪唑阳离子部分(MIM+)。
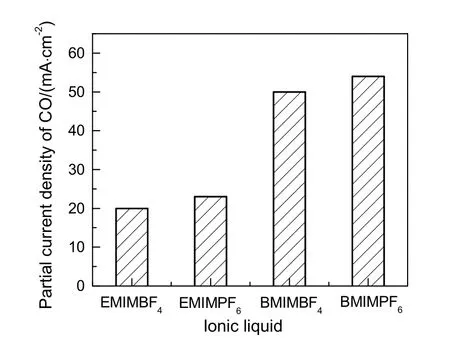
图5 不同离子液体对CO部分电流密度的影响。Fig.5 Effect of various ionic liquid on the partial current density of CO

图6 不同EMIMPF6与BMIMPF6物质的量之比的二元混合物的CO2还原曲线Fig.6 The curves of CO2reduction with different molar ratio of EMIMPF6to BMIMPF6
根据Rosen等[10]提出的表面催化机理,CO2的电还原效率应与咪唑阳离子在Ag电极表面上的吸附量有关。因此,BMIM+阳离子催化效果优于EMIM+的原因可能是BMIM+在银电极表面的吸附量大于EMIM+。由于相关研究已经报道阳离子在电极表面的吸附量与CO2还原峰电流绝对值几乎呈正比例关系[11],因此,进行了不同物质的量之比的EMIMPF6与BMIMPF6作为电解质时的线性伏安扫描实验,结果见图6。由图可知:在相同浓度下,BMIMPF6作为支持电解质时的CO2还原峰电流绝对值(曲线4)大于EMIMPF6时的值(曲线1),间接说明了阳离子BMIM+在银表面的吸附量大于EMIM+;CO2还原峰电流增速与BMIMPF6浓度增量正相关,因此阳离子在电极表面的吸附量随着BMIMPF6含量的增加而增加。另外,在保持离子液体总浓度为0.5 mol/L不变的情况下,若将EMIMPF6和BMIMPF6按不同物质的量之比混合作为阴极液支持电解质,其对CO2还原产物的影响结果见表4。由表可知,CDCO值同样随着二元混合物中BMIMPF6含量的增加而增加,进一步说明CO2电还原效率可能与咪唑阳离子吸附量有关。
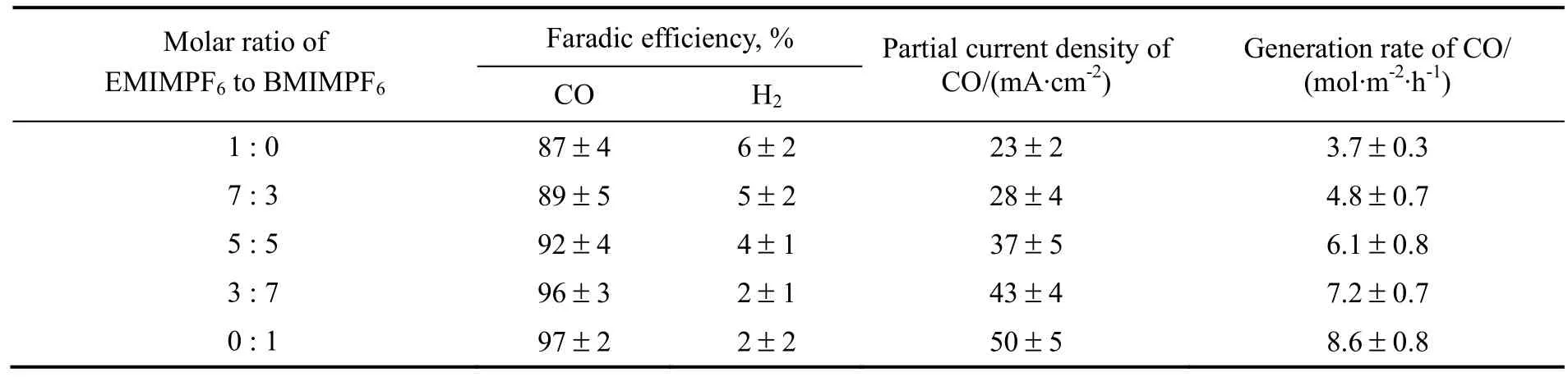
表4 不同EMIMPF6与BMIMPF6物质的量之比的二元混合物对CO2还原产物的影响Table 4 Results for CO2reduction under different molar ratio of EMIMPF6to BMIMPF6
2.3离子液体催化机理
CO2在离子液体存在下的电还原反应遵循EC类型反应机理,即先得电子后进行化学反应[12]。此外,近来较多文献报道发现咪唑阳离子能够被一电子还原为咪唑卡宾,该中间体易与CO2发生亲核反应[13,14],因此,Rosen等[10]提出的配合物可能是由咪唑卡宾和CO2加合而成。为了探究该加合物生成的可能性,进行了循环伏安扫描实验,结果见图7。由图可知,在不含离子液体的N2饱和阴极液中,CV图上未出现氧化峰(曲线1),而加入离子液体后,在电位-0.25 V处出形成了一个明显的氧化峰(曲线 2),该峰的形成应与离子液体有关。这主要是由于电化学还原过程中产生了不稳定的咪唑卡宾,其容易被氧化回初始的咪唑阳离子状态,进而形成氧化峰。然而,在CO2饱和条件下,该峰消失(曲线3),说明不稳定的咪唑卡宾与CO2反应形成了稳定不易被氧化的加合物[14]。上述结论进一步证明吸附在电极表面的 EMIM+阳离子能够被还原,并且还原产物能与 CO2反应形成中性配合物[EMIM-CO2]。基于此,与激发态吡啶作用类似[15],咪唑卡宾在与CO2作用过程中可能经历了亲核加成-消除反应,使得电子能够通过内部传递从咪唑环转移到CO2上形成EMIM+稳定的CO2.-中间体,进而再还原为CO(见图8)。总之,与大多催化剂作用相同,离子液体主要作用便是提供一条更容易生成激发态CO2.-阴离子的能量途径。

图7 乙腈阴极液中银盘电极上CV曲线Fig.7 CV curves recorded on Ag disc electrode in AN

图8 EMIM+催化还原CO2为CO 过程Fig.8 Process of CO2electroreduction to CO with the catalytic of EMIM+
3 结 论
通过筛选溶剂和支持电解质,优化了电解液组成,提高了CO2电还原效率。在使用乙腈作为阴极液溶剂,硫酸作为阳极液支持电解质,离子液体EMIMBF4作为阴极液支持电解质时,目标产物CO法拉第效率大于90%,CO部分电流密度(CDCO)大于20 mA/cm2。调控离子液体组成,保持其阴离子部分不变,将咪唑阳离子EMIM+替换为BMIM+,CDCO从约20 mA/cm2增加到50 mA/cm2左右,若只改变阴离子部分并没有引起明显的电流密度变化,因此咪唑阳离子起主要催化作用。进一步探究EMIM+催化机理,结果表明,电解过程中,EMIM+能够被一电子还原,还原产物咪唑卡宾能够与CO2反应形成中性配合物[EMIM-CO2],从而降低了CO2还原活化能。
[1]Delacourt C, Ridgway P L, Kerr J B, et al. Design of an electrochemical cell making syngas (CO+H2) from CO2and H2O reduction atroom temperature[J]. Journal of the American Chemical Society, 2008, 155 (1):B42-B49.
[2]Appel A M, Bercaw J E, Bocarsly A B, et al. Frontiers, opportunities, and challenges in biochemical and chemical catalysis of CO2fixation[J]. Chemical Reviews, 2013, 113 (8):6621-6658.
[3]Hori Y. Electrochemical CO2reduction on metal electrodes[M]. New York:Modern Aspects of Electrochemistry, 2008:89-189.
[4]Lu Q, Rosen J, Zhou Y, et al. A selective and efficient electrocatalyst for carbon dioxide reduction[J]. Nature Communications, 2014, 5:1-6.
[5]Rosen B A, Salehi-khojin A, Thorson M R, et al. Ionic liquid-mediated selective conversion of CO2to CO at low overpotentials[J]. Science, 2011, 6056 (334):643-644.
[6]Jhong H R, Ma S, Kenis P J A. Electrochemical conversion of CO2to useful chemicals:current status, remaining challenges, and future opportunities[J]. Current Opinion in Chemical Engineering, 2013, 2(2):191-199.
[7]Kaneco S, Liba K, Ohta K, et al. Electrochemical reduction of CO2at an Ag electrode in KOH-methanol at low temperature[J]. Electrochemical Acta, 1998, 44:573-578.
[8]Jitaru M. Eletrochemical carbon dioxide reduction:fundamental and applied topics[J]. Journal of University of Chemical Technology and Metallurgy, 2007, 42(4):333-344.
[9]Rosen B A, Zhu W, Kaul G, et al. Water enhancement of CO2conversion on silver in 1-ethy-3-methylimidazolium tetrafluoroborate[J]. Journal of the Electrochemical Society, 2013, 160(2):H138-H141.
[10]Rosen B A, Haan J L, Mukherjee P, et al. In situ spectroscopic examination of a low overpotential pathway for carbon dioxide conversion to carbon monoxide[J]. Journal of Physical Chemistry C, 2012, 116 (29):15307-15312.
[11]Niu D, Wang H, Li H, et al. The effect of the alkyl chain length of the tetraalkylammonium cation on CO2electroreduction in an aprotic medium[J]. Electrochemistry Communications, 2015, 52:58-62.
[12]Niu D, Wang H, Li H, et al. Roles of ion pairing on electroreduction of carbon dioxide based on imidazolium-based salts[J]. Electrochimica Acta, 2015, 158:138-142.
[13]Feroci M, Chiarotto I, Forte G, et al. Stability and CO2capture ability of electrogenerated N-heterocyclic carbene in parent 1-butyl-3-methylimidazoliun ionic liquid (BMIm-X):the role of X-[J]. Chemelectrochem, 2014, 1(8):1407-1414.
[14]Hanc-Scherer F A, Montiel M A, Montiel V, et al. Surface structured platinum electrodes for the electrochemical reduction of carbon dioxide in imidazolium based ionic liquids[J]. Physical Chemistry Chemical Physics, 2015, 17(37):23909-23916.
[15]Cole E B, Lakkaraju P S, Rampulla D M, et al. Using a one-electron shuttle for the multielectron reduction of CO2to methanol:kinetic,mechanistic, and structural insights[J]. Journal of the American Chemical Society, 2010, 132(33):11539-11551.
Effects of Electrolyte Solution Composition on Efficiency of CO2Electrochemical Reduction
Wang Qianqian, Chen Chengzhen, Zhang Zhipan, Cheng Zhenmin
State Key Laboratory of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China
In order to investigate the effects of solvent and supporting electrolyte on the electroreduction of CO2, the constant potential electrolysis (CPE) and cyclic voltammetry (CV) experiments were conducted on Ag electrode in a three-electrode electrolytic cell. The results showed that the Faradic efficiency of CO obtained in acetonitrile was the highest compared to those in methanol and DMF. The overpotential of CO2reduction decreased and the partial current density of CO(CDCO) increased when strong acid was used as the supporting electrolyte in the anolyte. The overall efficiency of CO2reduction was further enhanced when the ionic liquid (IL) was used as the supporting electrolyte in the catholyte. Comparing the performances of various ionic liquids on CO2reduction, it was found that the cationic group in IL had much more significant impact on the value of CDCOthan that of the anionic group. Based on these observations, it could be confirmed that it was the imidazole cation that played the major catalytic role .
carbon dioxide; electrochemical reduction; carbon monoxide; electrolyte solution composition
O646;X701
A
1001—7631 ( 2016 ) 04—0359—07
2016-03-26;
2016-07-05。
王倩倩(1990—),女,硕士;程振民(1967—),男,教授,通讯联系人。E-mail:zmcheng@ecust.edu.cn。
中央高校基本科研业务费专项资金(WA1113008)。

