野生黄精的多糖含量测定及提取工艺研究
徐兵兵,倪 穗
(宁波大学 海洋学院,浙江 宁波 315211)
野生黄精的多糖含量测定及提取工艺研究
徐兵兵,倪 穗*
(宁波大学 海洋学院,浙江 宁波 315211)
采用3,5-二硝基水杨酸法(DNS法)测定了宁波四明山区野生黄精的多糖含量,并对水煎煮法提取黄精多糖的工艺进行优化。通过单因素实验获得了提取温度、提取时间、液料比对黄精多糖得率的影响;在单因素实验的基础上采用L9(34)正交试验优化黄精多糖提取工艺。研究结果表明,宁波野生黄精多糖的含量为25.09%;各因素对黄精多糖得率的影响不同,液料比对黄精多糖得率的影响最大,其次是提取温度和提取时间。黄精多糖最佳提取工艺为:提取温度为80 ℃,提取时间为2 h,液料比为20∶1,在该条件下,黄精多糖得率为27.43%。为黄精多糖的开发利用奠定了理论基础。
野生黄精;多糖;含量测定;提取工艺
黄精(PolygonatumsibiricumRed.)别名老虎姜、鸡头参,为百合科(Liliaceae)黄精属(Polygonatum)的多年生草本植物,是中国传统的中药,属于药食同源性中草药[]。黄精的根状茎黄白色,味稍甜,肥厚而横走,直径达3 cm,由数个或多个形如鸡头的部分连接而成为大头小尾状,节明显,节部生少数根。其根茎供药用,《中华人民共和国药典》(2000年版,一部)收载的黄精来源于百合科黄精属的黄精、多花黄精(P.cyrtonemaHua.)和滇黄精(P.kingianumColl.et Hemsl.)的干燥根茎[2]。传统医药认为,黄精性平、味甘,具有补肾益精、滋阴润燥之功效,用于滋补强身和治疗肾虚精亏、肺虚燥咳以及脾胃虚弱之证,是中医常用药物之一[3]。
黄精在我国分布广,主要分布在我国的西南、东北、内蒙古以及安徽、浙江等地。但黄精的适应性较差,生境选择性强,喜生于土壤肥沃、表层水分充足、荫蔽、上层透光性充足的林缘、灌丛和草丛或林下开阔地带[4]。黄精根茎的化学成分主要有黄精多糖、甾体皂苷、维生素和多种对人体有用的氨基酸等。其中多糖是黄精根茎中的主要成分,含量最高,但由于生存环境的差异,各地产的黄精其多糖含量有所不同,如泰山生黄精为 12.56%,安徽生黄精为 9.92%,泰山熟黄精为7.36%,浙江生黄精为8.54%[5]。现代医学研究表明黄精多糖具有抗衰老作用、抗肿瘤作用、增强免疫力、降血糖、降血脂及抗氧化损伤等作用[6-8]。
由于黄精多糖具有多种生物活性,且无明显毒副作用,使得黄精成为天然的药物和保健食品。随着对黄精应用研究的不断深入,黄精多糖的用途大大拓宽,除药用而外,还可加工成食品、饮料、保健品、护肤品等。近年来,各地黄精的多糖含量测定及提取方法研究仅见零星报道,鲜有对宁波地产的野生黄精进行研究。本文采用3,5-二硝基水杨酸法(DNS法)[9]测定了宁波四明山区野生黄精的多糖含量,并对水煎煮法提取黄精多糖的工艺进行优化,以期为宁波的野生黄精开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
黄精块根采挖于浙江宁波的四明山区。块根清洗后于60 ℃烘干,粉碎过40目筛,4 ℃保存备用。
苯酚、氢氧化钠、亚硫酸钠、乙醇、酒石酸钾钠、3,5-二硝基水杨酸、盐酸、葡萄糖等购于国药集团化学试剂有限公司,均为分析纯。
1.2仪器与设备
TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;L600台式低速离心机(湖南湘仪实验室仪器开发有限公司)、AL104电子天平(梅特勒-托利多仪器有限公司)、HH-S4数显恒温水浴锅(金坛市医疗仪器厂)。
1.3研究方法
1.3.1葡萄糖标准液的配制
准确称取100 mg的无水葡萄糖置于100 mL的容量瓶中,溶解并稀释至刻度,混匀,得标准溶液。
1.3.2DNS显色剂的配制
甲液:溶解2.3 g苯酚于5 mL、10% NaOH溶液中并稀释到23 mL,在此溶液中加入2.3 g Na2SO3;乙液:称取85 g酒石酸钾钠加入100 mL 10%的NaOH中,再加入293 mL、1%的3,5-二硝基水杨酸溶液。将甲乙溶液相混合,即得黄色溶液,贮于棕色试剂瓶,室温下阴暗处放置7~10 d后使用[10]。
1.3.3DNS法测定黄精多糖含量
标准曲线的绘制:依次精密量取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL浓度为1 mg·mL-1葡萄糖标准液,分别置50 mL容量瓶中,利用蒸馏水补水至2 mL,再精密加入1.5 mL DNS试剂,混匀,于沸水浴中煮沸5 min,取出立即冷却,加水至刻度,摇匀。测定其在500 nm下吸光度值,绘制标准曲线。
样品溶液的制备及多糖含量的测定:分别取0.5 g烘干黄精粉末两份于锥形瓶中(样品液1、样品液2),样品液1加入10 mL浓度为6 mol·L-1的盐酸与15 mL的蒸馏水摇匀,样品液2加入25 mL的蒸馏水摇匀,水浴加热30 min。冷却后,样品液1加1滴酚酞指示剂,用10% 氢氧化钠溶液中和至微红色,过滤后,滤液定容至100 mL备用。样品液2直接过滤,滤液定容至100 mL备用。平行移取样品液1、2各3份,每份2 mL,按照上述方法测定吸光度值,由标准曲线方程计算多糖含量。多糖含量计算公式:
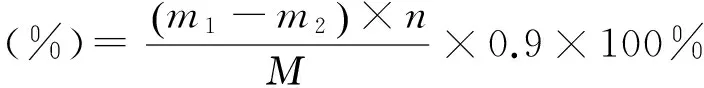
式中:m1为样品液1转换为葡萄糖的质量(mg),m2为样品液2转换为葡萄糖的质量(mg),M为黄精粉末质量,n为稀释倍数,0.9为葡萄糖对多糖的校正系数。
1.3.4黄精多糖的提取工艺优化
1.3.4.1黄精多糖提取[11]
精确称取黄精粉末5.0 g加入到烧杯中,按照一定的液料比为向烧杯中加入蒸馏水,将烧杯放置在一定温度的恒温水浴锅中提取一定时间,提取结束后趁热抽滤,得到滤液,将滤液合并并浓缩至20 mL,缓慢加入乙醇,并迅速搅拌至含醇量达80%,离心10 min,过滤后取沉淀,干燥后得到黄精粗糖,精确称重记录多糖得率。每组实验进行3次,结果取平均值。
1.3.4.2 单因素实验
影响多糖得率的因素主要是提取时间、浸提比、提取次数、温度、pH 值、溶剂和搅拌等[12]。通过单因素实验,分别考察提取温度、提取时间、液料比多黄精多糖得率的影响[13]。提取温度对黄精多糖得率的影响:精确称取黄精粉末5.0 g,在提取时间为2 h,液料比为20∶1的条件下,考察不同提取温度(50、60、70、80、90、100 ℃)对黄精多糖进行提取;提取时间对黄精多糖得率的影响:精确称取黄精粉末5.0 g,在液料比为20∶1,提取温度为80℃的条件下,考察不同提取时间(1、2、3、4、5、6 h)对黄精多糖进行提取;液料比对黄精多糖得率的影响:精确称取黄精粉末5.0 g,在提取时间为2 h,提取温度为80 ℃的条件下,考察不同液料比(5∶1、10∶1、15∶1、20∶1、25∶1、30∶1)对黄精多糖得率的影响。
1.3.4.3正交试验
在单因素实验的基础上,选择提取温度、提取时间、液料比作为变量,以黄精多糖得率为考察指标,按照L9(34)正交实验设计得到的黄精多糖提取工艺因素水平表如表1所示。
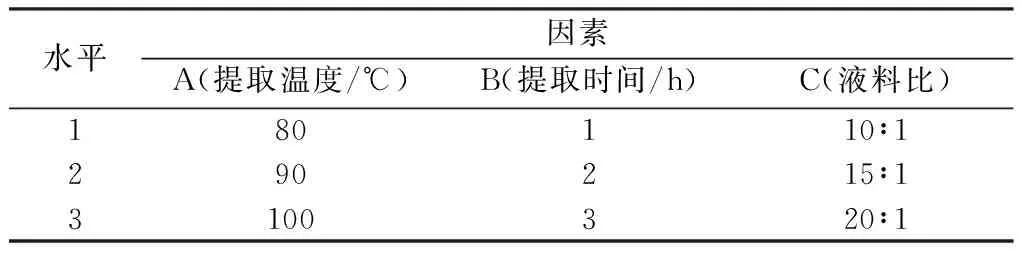
表1 正交试验因素水平表
2 结果与分析
2.1野生黄精的多糖含量
葡萄糖标准曲线如图1所示。由图1可见,拟合得到的标准曲线方程为y=0.478 4x-0.021 6,相关系数R2=0.999 7,葡萄糖在500 nm处,0.2~1.4 mg范围内与吸光度值呈良好的线性关系。

图1 葡萄糖标准曲线
根据上述标准曲线,计算所得的黄精多糖含量为25.09%。
2.2黄精多糖的提取工艺优化
2.2.1提取温度对黄精多糖得率的影响
在液料比为20∶1、提取时间为2 h的条件下,不同的提取温度对黄精多糖提取的影响见图2。

图2 温度对黄精多糖得率的影响
从图2可见,随着提取温度上升,黄精多糖得率逐渐升高,这是因为多糖的溶解度随着温度的升高而增大,在提取温度为50~90 ℃范围内,黄精多糖的溶解性对温度具有较高的敏感性,表现出明显的增幅变化。但当提取温度大于90 ℃时,多糖得率反而随温度的升高反而缓慢降低,所以提取温度应选择90 ℃为宜。
2.2.2提取时间对黄精多糖得率的影响
在液料比为20∶1,提取温度为80 ℃的条件下,不同的提取时间对黄精多糖提取的影响见图3。
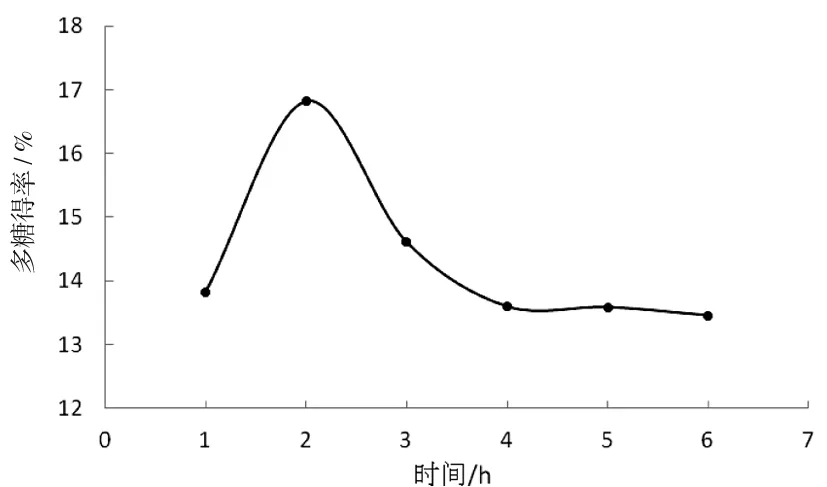
图3 时间对黄精多糖得率的影响
如图3所示,提取时间在1~2 h范围内,多糖得率迅速上升,2 h时多糖得率达到最大值;而提取时间大于2 h多糖得率随提取时间的增大反而下降,在4~6 h多糖得率基本保持不变,根据实验结果,选择2 h为最佳提取时间。
2.2.3液料比对黄精多糖得率的影响
在提取温度为80 ℃,提取时间为2 h的条件下,不同液料比对黄精多糖得率的影响见图4。
从图4可见,随着液料比的增加,多糖得率逐渐升高。原因可能是液料比上升,溶剂体积增大,多糖易扩散于溶剂中,当液料比为15∶1时,多糖得率最高,随后多糖得率有所下降。因此,黄精多糖提取适宜的液料比为15∶1。

图4 液料比对黄精多糖得率的影响
2.2.4正交试验结果
在单因素实验的基础上,选择液料比、提取温度、提取时间作为变量,以黄精多糖得率为考察指标,按照L9(34)正交实验设计得到的黄精多糖提取工艺因素水平表进行实验,对黄精多糖的提取工艺条件进行优化,结果如表2所示。
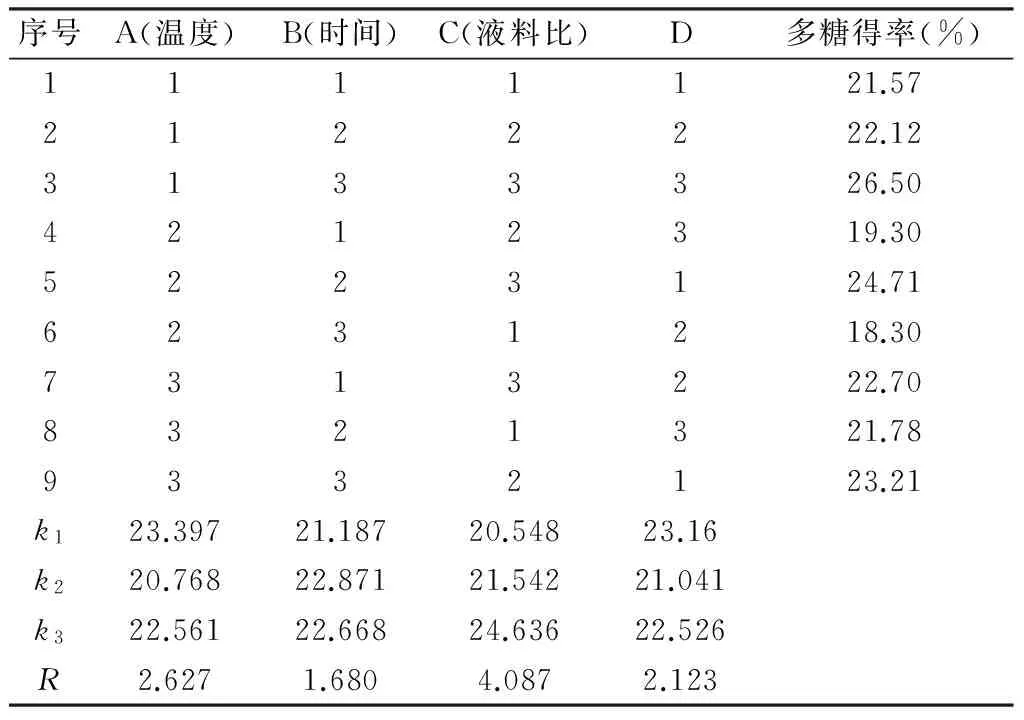
表2 正交试验结果及分析
据表2,因素组合为A1B3C3时多糖得率最大。对于A因素有k1>k3>k2,表明提取温度为80℃时提取率最高;对于B因素有k2>k3>k1,表明提取时间为2 h时最好;对于C因素有k3>k2>k1,表明液料比为20∶1时提取率最高。
综上所述,3个因素的最优组合是A1B2C3,即提取温度为80 ℃、提取时间为2 h、液料比为20∶1。根据极差分析,影响多糖得率主次因素排序是:C>A>B,即液料比>提取温度>提取时间。根据方差分析[14],液料比对多糖得率有显著影响,属于主要影响因素,提取温度与提取时间对多糖得率无显著影响,属于次要因素。
2.2.5验证试验
正交实验所得的最优水平和直观分析的最优水平不一致,因此进行优化试验,在正交试验所得的最优水平条件下对黄精多糖进行提取,所得的黄精多糖得率为27.43%,结果高于直观分析的多糖得率,表明此优化工艺可行[15]。
3 结论与讨论
采用DNS法对宁波四明山区野生黄精中的多糖含量进行测定,结果表明:宁波野生黄精多糖含量为25.01%。传统的多糖含量的比色测定方法主要是苯酚-硫酸法、硫酸-蒽酮法[16]。这两种方法只能测定样品中的总糖含量,样品中存在单糖影响实验效果,若不能完全除去单糖,容易使得测得的数据偏大,且操作繁杂,DNS法测多糖含量时,只需同时测定总糖与单糖的含量,两者之差则为准确的多糖含量。该法操作简单、快速、灵敏度高、杂质干扰较小[17]。
通过单因素实验研究了液料比、提取温度、提取时间对黄精多糖得率的影响,在单因素试验的基础上通过L9(34)正交试验得到水煎煮法提取黄精多糖的最优工艺条件:液料比20∶1,提取温度为80 ℃,提取时间为2 h,在该条件下,黄精多糖得率为27.43%。水煎煮法提取黄精多糖的过程中,液料比是影响多糖提取的主要因素。在提取过程中用80%乙醇醇沉用以除去单糖,低聚糖,苷类及生物碱等成分,避免杂质成分影响实验结果,实验结果相对真实准确。提取后的黄精多糖生物活性尚待进一步研究。
[1]刘庆华,刘彦辰.实用植物本草[M].天津:天津科技出版社,1998.
[2]中华人民共和国卫生部药政管理局.中国药品生物制品检定所.现代实用本草[M].北京:人民卫生出版社,1997:721.
[3]庞玉新,赵政,袁媛,等.黄精的化学成分及药理作用[J].山地农业生物学报,2003,6(10):80-83.
[4]田启建,赵政.黄精属植物种类识别及资源分布研究[J].现代中药研究与实践,2007,21(1):18-21.
[5]王晓丹,田芳,史桂云,等.不同产地黄精中多糖含量的比较[J].泰山医学院学报,2008,29(9):657-658.
[6]张峰,高群,孔令雷,等.黄精多糖抗肿瘤作用的实验研究[J].中国实用医药,2007,2(21):95-96.
[7]马志茹,袁倬斌.电化学法研究黄精及枸杞子对活性氧自由基的清除作用[J].中国药学杂志,1999,34(10):665-667.
[8]张庭廷,夏晓凯,陈传平,等.黄精多糖的生物活性研究[J].中国实验方剂学杂志,2006,12(7):42-45.
[9]熊艺花,李婧,黄松,等.DNS法对三七总多糖含量测定[J].亚太传统医院,2011,7(7):7-9.
[10]冯雪,张曜武,曹炳星,等.DNS法测定红松松塔多糖含量的研究[J].中国林副特产,2013,6(3):32-35.
[11]王冬梅,宋旭辉,李娟丽,等.卷叶黄精多糖提取分离工艺研究[J].西北农林学院学报,2006,21(6):158-161.
[12]方积年,丁侃.多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[13]侯双菊,林超群, 鲁坚,等.黄精多糖提取工艺的试验研究[J].安徽化工,2006 (4):20-22.
[14]于立芬.数理统计方法[M].上海:上海科学技术出版社,1985:173.
[15]马丽春, 魏凤玲.蒲公英提取工艺优选[J].中国中药杂志,2005,30(13):995-997.
[16]张志君,孙伟,李永亮,等.3,5-二硝基水杨酸联合苯酚-浓硫酸法测定不同产地黄精中多糖含量[J].中国实验方剂学杂志,2012,6(18):106-109.
[17]王丽娜,陈水钫,张兵,等.3,5二硝基水杨酸法测定多糖含量的研究进展[J].吉林医药学院学报,2009,4(30):232-234.
Content Determination and Extraction Process of Polysaccharides from WildPolygonatumsibiricum
Xu Bingbing, Ni Sui*
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
In this article, DNS method was adopted to determine the content ofPolygonatumsibiricumpolysaccharides and the process of water extracting was optimized. This effects of liquid-material ratio, extraction temperature and extraction time ofPolygonatumsibiricumpolysaccharides yield were investigated by the single factor experiment, and the parameter of extracting was determined by four-factor and three levels orthogonal experiment. The result indicates that the content of Ningbo wildPolygonatumsibiricumpolysaccharide is 25.09%; the various factors have different influences on the extraction, and the liquid-material ratio has the greatest impact, followed by extraction temperature and extraction time. Results show that the optimum process parameters are liquid-material ratio 20∶1,extraction temperature 80℃, and extraction time 2 h. In this condition,Polygonatumsibiricumpolysaccharides yield is 27.43%. This research provides a scientific basis for the further development and utilization ofPolygonatumsibiricumpolysaccharides.
wildPolygonatumsibiricumRed.; polysaccharides; determination of content;extraction process
10.3969/j.issn.1006-9690.2016.04.005
2016-01-28
宁波市农业科技攻关项目(2014C10059);慈溪市农业与社会发展项目(CN2014004)。
徐兵兵(1994—),男,本科生,研究方向:植物生物技术。E-mail: 1286624023@qq. com
倪穗,女,教授,研究方向:植物生物技术。E-mail: nisui@ nbu.edu. cn
R284.2
A
1006-9690(2016)04-0019-04

