分光光度法测定盐水中微量碘
黄静静,郭礼波
(四川大学化工学院,四川 成都 610064)
分光光度法测定盐水中微量碘
黄静静,郭礼波
(四川大学化工学院,四川 成都 610064)
介绍了分光光度法测盐水中微量碘浓度、控制反应时间和酸度,结果显示稳定准确。关键词:盐水;碘;分光光度法;测定
在离子膜氯碱生产中,为保护离子膜必须严格控制进电解槽的二次盐水的质量,其中碘含量是一个重要的指标。因为盐水中的碘离子在电解槽环境中会被氧化成高碘酸根,并与Na+、Ba2+、Ca2+、Mg2+等离子 (即使其浓度极低)生成不溶的高碘酸盐化合物,在膜中沉积下来,随着时间的迁移对膜造成不可逆的损害,降低电流效率,最终缩短膜的使用寿命,造成巨大的经济损失,因此,必须控制在1×10-6以下。但在相关的国家和行业标准中没有规定盐水中碘离子的测定方法。本文研究了采用分光光度法对盐水中微量碘进行测定的具体步骤和条件,通过酸度和反应时间的控制,建立了简便的操作程序,结果稳定可靠。
1 试验部分
1.1方法原理
过量溴水使盐水中的I-氧化形成,用甲酸钠除去过量的溴,加入过量的碘化钾还原生成的,析出的单质碘与淀粉形成蓝色吸附物,在一定的条件下其吸光度与盐水中的碘含量成正比,通过标准曲线方程进行定量计算。
反应式如下:
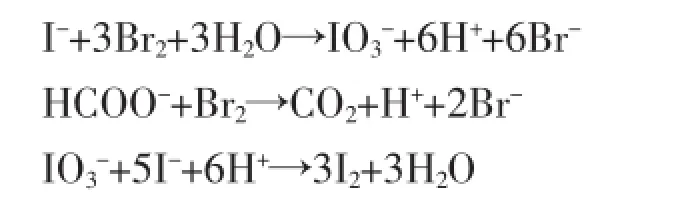
1.2试剂及材料
(1)乙酸钠溶液:pH值=4.6;(2)磷酸;
(3)甲酸钠:100 g/L溶液;(4)碘化钾:50 g/L溶液;
(5)饱和溴水:在市售3%溴水中加入少量溴素(可在瓶底见到深色溴素),保存在深色玻璃瓶中;
(6)淀粉指示剂:5 g/L溶液;
(7)碘标准储备溶液:ρ(I-)=1 mg/mL;
将基准碘酸钾置于(110±2)℃的烘箱内干燥2 h至恒重,准确称取0.843 2 g,溶解于水后移至500 mL容量瓶中,定容,摇匀;
(8)碘标准工作溶液:ρ(I-)=10 μg/mL;
准确移取碘标准储备溶液5 mL于500 mL容量瓶内,用纯水稀释至刻度,摇匀,保存于棕色瓶中。
1.3仪器设备
HACH分光光度计DR3800型,配套吸收池。
1.4工作曲线绘制
取6个50 mL烧杯,分别加入0.0 mL、0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL碘标准工作溶液,加入约30 mL纯水,摇匀。其碘含量分别为0 μg、4 μg、8 μg、12 μg、16 μg、20 μg。
分别加入乙酸钠溶液1mL,摇匀后滴加溴水2滴(至溶液的浅黄色不褪为止)。等待2 min后,加入甲酸钠溶液1 mL,充分摇匀,等待5 min后,滴加磷酸调节溶液pH值为2.1~2.5,摇匀,等待2 min。加入碘化钾溶液1 mL,摇匀,加入淀粉溶液1 mL,摇匀,无损移至50 mL容量瓶中,定容。
将分光光度计波长调至575 nm,以纯水调整零点,用配套吸收池测定系列标准溶液的吸光度值,得到工作曲线方程:m(I-)=k×A(μg)。
1.5试样测定步骤
称取约10 g盐水试样,原盐试样称取约5 g再加入约30 mL水溶解,按照标准曲线绘制步骤中“加入乙酸钠溶液……”以下的步骤处理。同时用约30 mL纯水进行空白试验。显色后,以纯水调整仪器零点,测出空白溶液和试样溶液的吸光度值。
1.6分析结果的表述
试样中碘含量ω(以I计,μg/g)按下式计算:
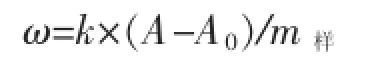
式中:k—标准曲线的斜率,μg;A—试样溶液的吸光度值;A0—空白溶液的吸光度值;m样—称取试样的质量,g。
2 结果与讨论
2.1氧化剂与还原剂的选择
氧化剂的选择考虑了氧化性和过量氧化剂的处理。在微酸性溶液中溴水氧化碘离子生成碘酸根,过量的溴用甲酸钠很容易除去。也可采用次氯酸钠,但用草酸来除去过量次氯酸钠时效果不理想,需要加热,对结果稳定性影响较大。过量的甲酸钠(约为0.03 mmol/L)对结果没有影响。
2.2酸度与反应时间的影响
碘-淀粉显色体系的稳定性不是很理想,采用分光光度法时重点需要研究酸度条件的控制。在本方法中每步都必须严格控制好pH值,这是保证准确性的关键因素。
试样首先加入乙酸钠缓冲溶液,使溶液呈微酸性,pH值约4.6。因为在碱性溶液中,溴水会发生歧化反应,生成溴酸根离子,不会被甲酸钠除去,但是会氧化加入的碘化钾析出碘,造成结果偏高。酸性太强的话,溴水只能将碘离子氧化成碘,造成结果不稳定。
加入甲酸钠除去过量的溴时,反应时间必须保证5 min以上,否则溴未除尽,会在加入碘化钾后析出大量的碘,导致实验失败。另一个关键是加入碘化钾之前用磷酸来调节溶液的酸度,且pH值必须控制在2.0~2.5,此时淀粉跟碘的显色反应最稳定,吸光度能长时间保持稳定不变(30 min以上)。如果酸性太强,会出现吸光度值随时间增大的现象。而酸性不够的话,显色反应几乎不发生,而在逐渐降低pH值时吸光度逐渐增大,最后在pH值2.0~2.5时保持稳定。
实验证明,采用磷酸调节酸度非常适宜。若用硫酸,会出现吸光度缓慢增大的现象,结果不稳定。
2.3波长的选择
碘-淀粉显色的灵敏度很高,适宜检测微量的碘。近年来,用先进的分析技术(如X射线、红外光谱等)研究碘跟淀粉生成的蓝色物,证明碘和淀粉的显色除吸附原因外,主要是由于生成包合物的缘故。构成直链淀粉的α-葡萄糖分子缩合形成长长的螺旋体,每个葡萄糖单元都仍有羟基暴露在螺旋外,碘分子跟这些羟基作用,使碘分子嵌入淀粉螺旋体的轴心部位,称之为包合物。淀粉跟碘生成的包合物的颜色,跟淀粉的聚合度或相对分子质量有关。在一定的聚合度或相对分子质量范围内,随聚合度或相对分子质量的增加,包合物的颜色的变化由无色、橙色、淡红、紫色到蓝色。在本方法的实际情况中,出现了一个意想不到的现象,用基准碘酸钾配制的标准溶液显色后呈现纯蓝色,而原盐试样溶液则在蓝色中带有明显的红紫色。吸收曲线显示都在560~580 nm有一个吸收峰,标准溶液的最大吸收波长在578 nm,试样溶液的最大吸收波长约在565~570 nm,波峰较平缓。因此,综合考虑后选择试验波长为575 nm,见图1。
2.4工作曲线绘制
为了保证工作曲线与盐水试样的性质一致,在系列标准溶液中添加一定量的氯化钠。但实验数据显示加入与盐水相当浓度的氯化钠和直接用纯水稀释并没有什么区别,表1中第一次和第二次的数据为添加了氯化钠,第三次和第四次为直接用纯水。
从表1可以看出,在碘含量为0~20 μg,线性良好,相关系数均在0.998以上,工作曲线见图2。
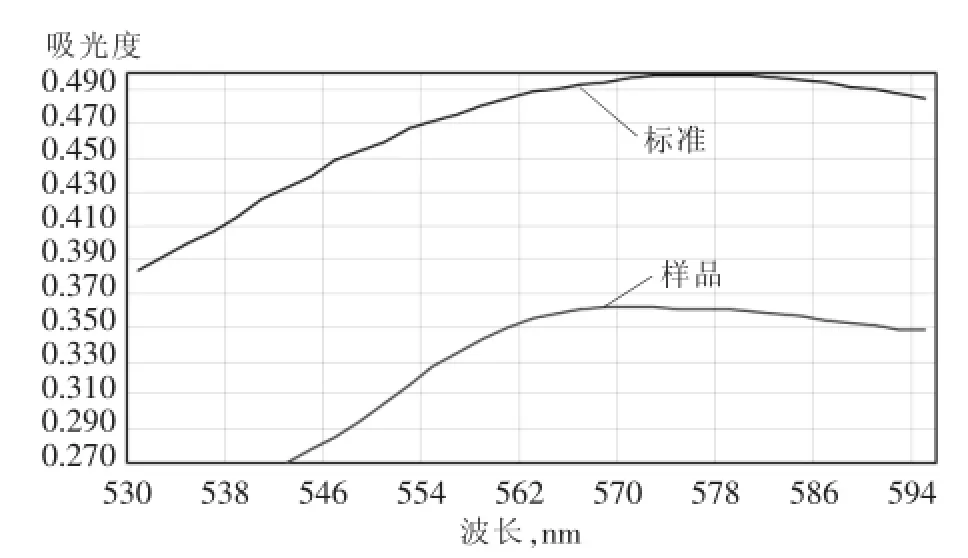
图1 标准与试样溶液的吸收曲线
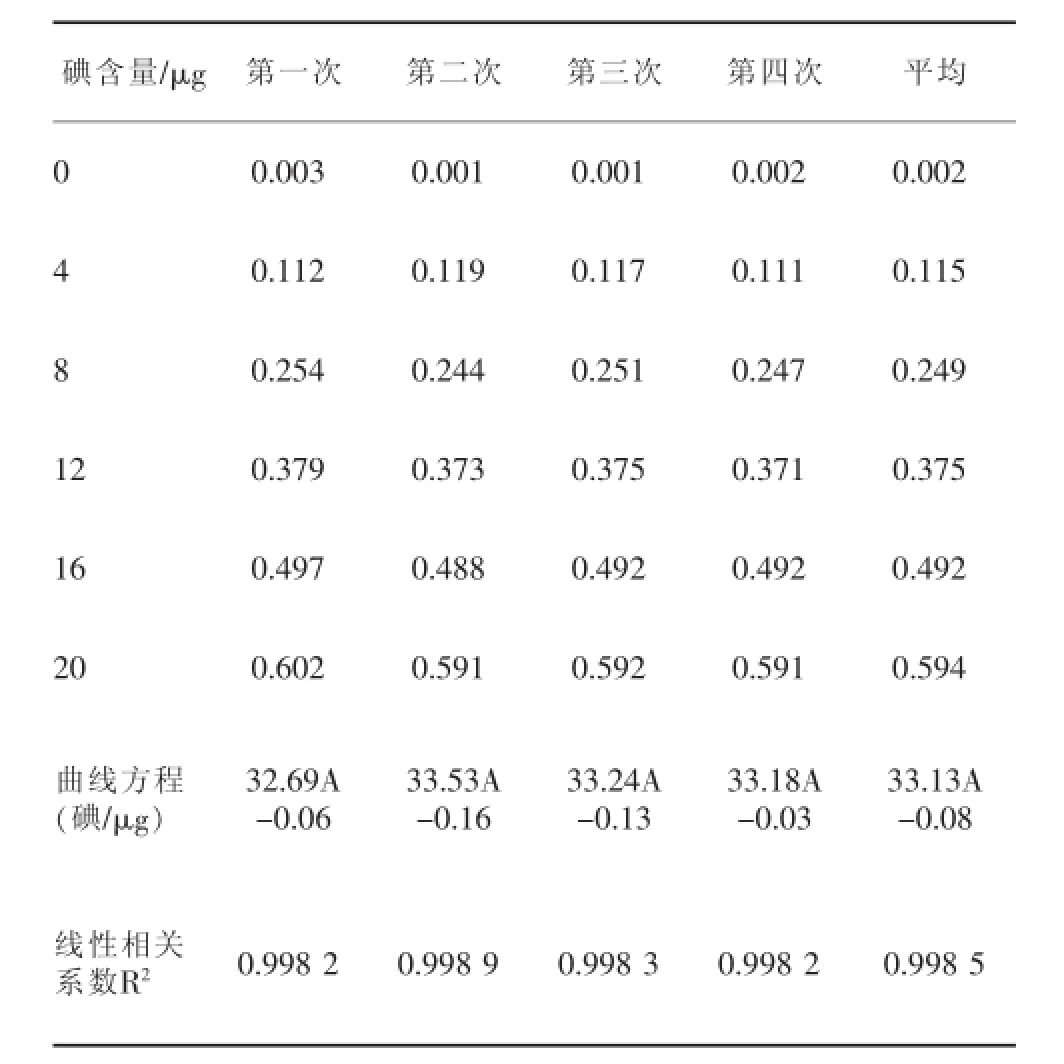
表1 工作曲线数据
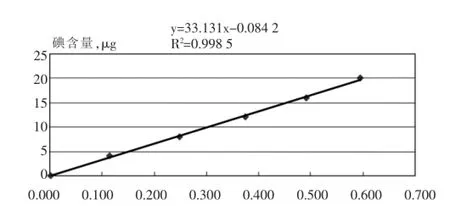
图2 工作曲线
2.5方法的精密度
按照本方法确定的实验条件,只要严格控制在规定范围中,能够取得良好的重现性和精密度。试样进行重复测定结果见表2。
由表2可见,本方法稳定性良好。
2.6方法的准确度
为了检查本方法的准确度,对不同浓度的盐水试样进行了加标回收试验。在每个试样中加入10 μg碘,测定结果见表3。
可见,回收率达到97%~104%,令人满意。

表2 精密度数据
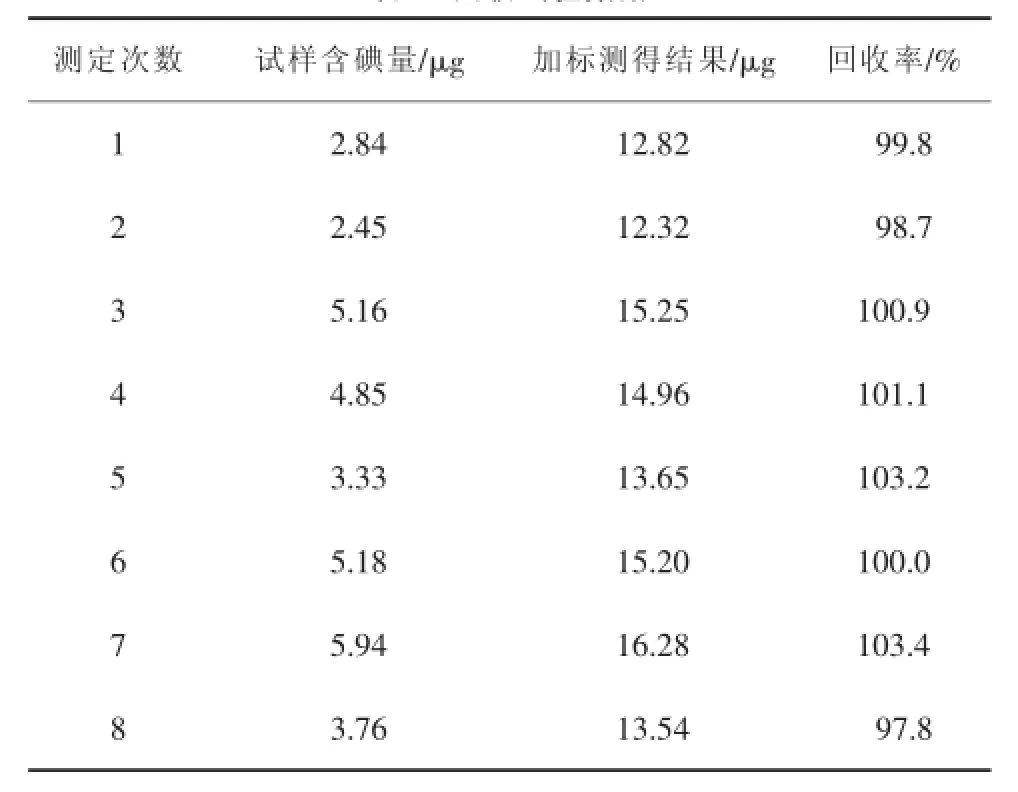
表3 回收试验数据
另外,由表3取盐水样邮寄至上海杜邦(中国)公司进行了对照。该公司是离子膜专业生产和研究机构,对照结果见表4。
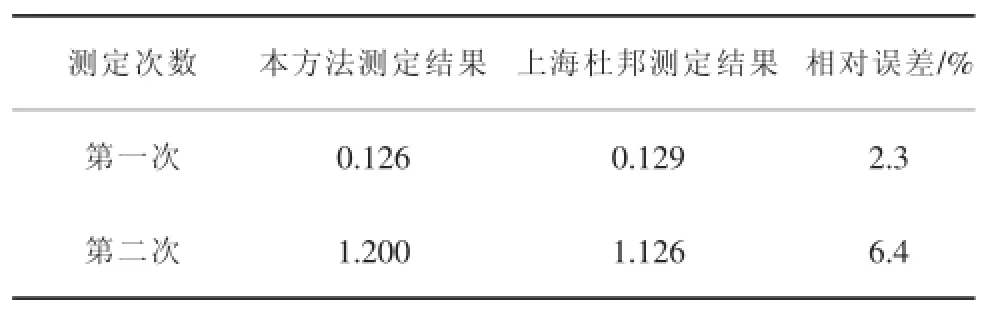
表4 准确度验证数据
由表4可见,准确度令人满意。
3 结论
本方法利用实验室比较常规的分析仪器和试剂,快速稳定地测定盐水中微量碘含量,分析周期约为30 min,精密度和准确度完全能满足生产要求,在原材料质量控制和进槽盐水是否需要置换的判断上提供了准确可靠的数据,对离子膜的高效运行起到了不可小觑的作用。
Spectrophotometric method of determination of trace iodine in brine
HUANG Jing-jing,GUO Li-bo
(Sichuan Uniwersity,School of Chemical Engineering,Chengdu 610064,China)
Spectrophotometry to measure trace iodine concentration in the brine,control the reaction time and acidity,stable and accurate results.
brine;iodine;spectrophotometric;determination
TQ075+.3
B
1009-1785(2016)07-0035-03
2016-04-17

