动态监测微小残留病对急性白血病预后的临床意义
吴玉玲,汪福康,汪 琼,汪 勇,余 超,徐友善,王立鼎,吴晋安,章赛芜(黄山市人民医院血液科,安徽245000)
动态监测微小残留病对急性白血病预后的临床意义
吴玉玲,汪福康,汪琼,汪勇,余超,徐友善,王立鼎,吴晋安,章赛芜△(黄山市人民医院血液科,安徽245000)
目的探讨监测微小残留病(MRD)在急性白血病(AL)复发预测及指导临床治疗中的意义。方法选取2011年1月至2013年12月该科收治的36例初治AL患者,共采集160份骨髓液及外周血液标本,利用四色多参数流式细胞术(FCM)进行MRD检测。以CD45/SSC设门,选用2~3组四色抗体组合,从首次诱导化疗结束,每1~3个月进行MRD检测1次,动态监测MRD水平的变化与AL复发之间的相关性。结果按诱导治疗第1次结束时的MRD水平分为三组:MRD>1×10-2组 (22例)、MRD为1×10-4~1×10-2组 (6例)、MRD<1×10-4组 (8例)。MRD>1×10-2组复发率[81.8% (18/22)]明显高于MRD<1×10-4组[12.5%(1/8)],差异有统计学意义(P=0.003),而MRD为1×10-4~1×10-2组复发率[50.0% (3/6)]与MRD<1×10-4组比较,差异无统计学意义(P=0.059)。MRD<1×10-4预后良好。另30例检测外周血和骨髓MRD的AL患者中,外周血MRD>1×10-214例,MRD为1×10-4~1×10-27例,MRD<1×10-49例;骨髓MRD>1×10-28例,1×10-4~1× 10-210例,<1×10-412例。结论AL患者MRD阳性比形态学复发出现时间早,因此,动态监测MRD对AL预测复发和指导个体化治疗有重要意义。
肿瘤,残余;白血病;急性病;预后;流式细胞术
急性白血病(acute luekemia,AL)是一组起源于造血干/祖细胞的恶性克隆性疾病,有高度异质性。随着现代医学的发展,AL的诊断和治疗水平一直在不断提高,急性髓系白血病(acutemyeloid luekemia,AML)的完全缓解率可达50%~80%,5年无病生存率可达20%~40%[1],大多数患者最终会面临复发,其根源主要是体内残留的白血病细胞[2]。微小残留病(minimal residual disease,MRD)是指AL患者经由骨髓移植治疗或诱导化疗,达到临床和血液学完全缓解之后,在其体内仍残存着微量白血病细胞的一种状态。目前,已有许多报道显示,多种基因与AL的预后相关,可起到预测预后的作用,如NPM1、FLT3-ITD、CEBPA基因等,某些基因甚至与AL早期复发有关,如IKZF1基因,但这对于基因突变阴性的患者并不适用[3]。因此,在AL临床缓解期间进行准确定量MRD对有复发风险的患者是至关重要的,而且动态监测MRD对病情有更准确的评估,避免对治疗反应好的患者治疗过度、对病情凶险的患者治疗强度不足。目前监测MRD的主要方法是流式细胞术(FCM)和实时荧光定量聚合酶反应(FQ-PCR)。本研究采用FCM监测MRD,并进行动态观察以指导临床治疗。
1 资料与方法
1.1一般资料选取2011年1月至2013年12月在本科初治的AL患者36例,其中男20例,女16例;年龄19~75岁;急性髓系白血病(除M3)28例,急性淋巴细胞白血病8例。
1.2主要试剂抗体购自美国BD公司。20种四色荧光(FITC、PE、Perc-CY5.5、APC)标记的主要单抗如下:(1)髓系:CD33、CD117、CD13、CD14、CD15、cMPO、CD11b;(2)T淋巴细胞系:cCD3、CD5、CD7;(3)B淋巴细胞系:CD10、CD19、CD20、CD22、CD23、cCD79a;(4)NK细胞:CD56;(5)非特异性早期标记:CD34、HLA-DR、CD38、CD45。
1.3方法
1.3.1标本采集第1次诱导缓解治疗后,抽取患者骨髓标本,涂片6~8张进行骨髓细胞形态学分析,另抽取3~5mL骨髓用肝素抗凝,24 h内进行流式细胞学数据采集,患者定期巩固化疗,每1~3个月进行MRD检测。其中30例患者在疾病过程中分别至少一次行外周血和骨髓MRD检测。
1.3.2标本标记利用四色荧光(FITC、PE、Perc-CY5.5、APC)直接标记法标记。依照初次免疫分型而选择2~3组四色荧光抗体组合,分别放在试管中,试管上标记所加的荧光抗体。每一个试管分别加入待测荧光标记的抗体20μL、骨髓液或外周血细胞悬液100μL,摇匀。室温遮光孵育15min后加入溶血剂摇匀,避光放置10min,再加入磷酸盐缓冲液(PBS)洗涤,以1 500 r/min的速度离心5min,弃去上清,即可上机检测。
1.3.3流式细胞仪分析采用美国BD公司FACSCALIBUR型流式细胞仪采集数据,激光波长为488、633 nm,采用EXP3.2V1.2B软件进行多重设门颜色示踪法对获取的数据进行分析。如果在筛选时白血病细胞出现的区域内有细胞呈现,那么以这些残存的白血病细胞所占骨髓或外周血单个核细胞总数的比例作为MRD值;多个抗体组合时以数值最大者作为MRD值。
1.4统计学处理应用SPSS 16.0统计软件进行数据分析,分类变量采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
2 结 果
2.136例AL患者首次诱导化疗后MRD水平及各组间复发率比较跟踪36例患者进行动态MRD检测1~3年,首次诱导MRD>1×10-2组22例,18例在3~9个月内复发;MRD为1×10-4~1×10-2组6例,3例在8~12个月内复发;MRD<1×10-4组8例,1例在14个月时复发。MRD>1×10-2组复发率明显高于MRD<1×10-4组,差异有统计学意义(P=0.003),而MRD<1×10-4组复发率较MRD为1×10-4~1×10-2组低,但差异无统计学意义(P= 0.059)。见表1。
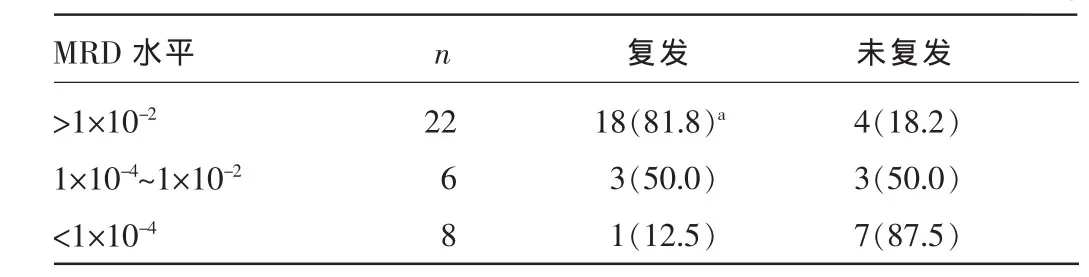
表1 36例AL患者首次化疗后MRD水平及各组间复发率比较[n(%)]
2.2形态学完全缓解时MRD的提前判断准确性对本次研究的36例患者进行动态检测发现,形态学呈现完全缓解状态时,MRD<1×10-4组预后良好(复发率仅为12.5%),MRD>1×10-2组预后差(复发率高达81.8%),提示有高风险复发可能性,对于MRD为1×10-4~1×10-2组(复发率为50.0%),提示有复发倾向,建议每月检测。
2.330例AL患者化疗后外周血与骨髓MRD水平30例患者中,外周血MRD>1×10-214例,MRD为1×10-4~1×10-27例,MRD<1×10-49例;而骨髓检测情况略有不同:骨髓MRD>1×10-28例,MRD为1×10-4~1×10-210例,MRD<1×10-412例。
3 讨 论
目前,AL的缓解率、长期生存率虽明显提高,但仍有较多的患者发展为复发/难治性白血病,其治疗难度和风险大幅提高。因此,减少AL缓解后再复发,早期预测复发风险并采取相应的干预措施显得尤为重要。近年来,许多报道显示,MRD水平与AL预后相关,可提示早期复发[4]。而MRD的监测可从细胞遗传学、分子遗传学及免疫学水平进行。由于细胞遗传学及免疫学检测的阳性率较低,且白血病的发病本质应追溯至分子水平,因此分子水平的监测更精确[5]。但FQ-PCR成本高,主要是对已知基因突变的监测,而FCM相对FQ-PCR成本低,操作方便,且在临床上应用广泛,因此本研究主要采用FCM进行MRD检测。
AL与MRD关系的研究首先由德国研究组进行,其研究表明,在成人急性淋巴细胞白血病患者治疗的第1年内9个时间点MRD与预后的关系中,多个时间点MRD对疾病复发具有预测价值;之后的多项研究表明,诱导治疗后MRD>10-3是一个强烈的独立预后因素,均提示疾病复发[6-7]。本研究通过动态监测发现,首次完全缓解后MRD<10-4是预后良好的指标,但当MRD水平持续大于10-2时复发风险明显增高,复发前MRD水平均大于10-2,MRD复发早于形态学复发。因此,不妨把MRD作为监测白血病复发的独立指标。另外有研究显示,诱导及巩固治疗后MRD水平与AL患者的临床预后有关,而且二者比较,巩固治疗后MRD水平对其有着更大的影响[8]。大量研究证实,AL患者MRD水平是独立的预后指标,MRD<10-4是当前国际上公认的预后好的标志[9-10]。
San Miguel等[11]的研究发现,诱导治疗后MRD高于5×10-3的患者复发率明显增高,而强化治疗后MRD>2×10-3也可以作为阈值区分低危组及预后不良组。而Buccisano等[12]研究结果显示,巩固化疗后MRD监测更加有意义,用FCM测得MRD高于3.5×10-4的患者复发率明显升高。MRD监测对AML的疗效和预后判断有着非常重要的意义[13]。
随着血液学的发展,目前国际上推荐对白血病的治疗宜遵循个体化治疗原则,故根据MRD水平等进行危险分层,然后制订治疗方案,使有高度复发倾向的患者在治疗初期得到更及时、有效的治疗,可有效减少疾病复发,提高治愈率,而对于低风险组(MRD<10-4),给予强度低的治疗以提高其生存质量。因此,MRD水平测定对AL有多重临床意义:(1)判断预后及复发;(2)危险度分层评估;(3)指导个体化治疗;(4)移植前后风险评估。
AML患者MRD监测手段多样,包括染色体核型、荧光原位杂交、FQ-PCR等技术,其中FCM应用范围最广,准确性及敏感性均较高。但是关于MRD的监测还有一些不一致的观点,如检测技术和抗体选择等,不同实验室采用方法及抗体选择不一。而在临床上,AL本身具有高度异质性,FCM如何更好地做到个体化,今后还需做进一步的探讨,对于MRD的认识仍需进一步加深,现有研究使用外周血检测MRD能否替代骨髓检查有待进一步证实[14]。
[1]Jin J,Wang JX,Chen FF,etal.Homoharringtonine-based induction regimens for patientswith de-novo acutemyeloid leukaemia:amulticentre,open-label,randomised,controlled phase 3 trial[J].Lancet Oncol,2013, 14(7):599-608.
[2]张志向,柴忆欢,何海龙,等.急性淋巴细胞白血病患儿骨髓微小残留病检测的临床意义[J].实用儿科临床杂志,2010,25(15):1133-1135.
[3]Mrózek K,MarcucciG,Paschka P,etal.Clinical relevance ofmutations and gene-expression changes in adult acutemyeloid leukemia with normalcytogenetics:are we ready for a prognostically prioritized molecular classification[J].Blood,2007,109(2):431-448.
[4]Graubert T,Walter MJ.Genetics ofmyelodysplastic syndromes:new insights[J].Hematol Am Soc Hematol Educ Program,2011,2011:543-549.
[5]陈果,张曦.微小残留白血病检测在急性髓系白血病治疗及预后判断中的意义及研究进展[J].国际输血及血液学杂志,2013,36(2):133-135.
[6]Brüggemann M,Raff T,Flohr T,et al.Clinical significance ofminimal residual disease quantification in adult patientswith standard-risk acute lymphoblastic leukemia[J].Blood,2006,107(3):1116-1123.
[7]Holowiecki J,Krawczyk-KulisM,Giebel S,etal.Statusofminimal residual disease after induction predicts outcome in both standard and high-risk Ph-negativeadult acute lymphoblastic leukaemia.The Polish Adult Leukemia Group ALL 4-2002MRD Study[J].Br JHaematol,2008,142(2):227-237.
[8]KernW,Bacher U,Haferlach C,etal.The roleofmultiparameter flow cytometry for diseasemonitoring in AML[J].BestPract Res Clin Haematol,2010,23(3):379-390.
[9]Dworzak MN,Fröschl G,Printz D,et al.Prognostic significance andmodalitiesof flow cytometricminimal residualdiseasedetection in childhood acute lymphoblastic leukemia[J].Blood,2002,99(6):1952-1958.
[10]吴铭,孙雄飞,徐肇明等.基于细胞表型异常的流式细胞术检测急性前体B细胞白血病微小残留病[J].中国实验血液学杂志,2005,13(4):557-562.
[11]San Miguel JF,VidrialesMB,López-BergesC,etal.Early immunophenotypical evaluation ofminimal residual disease in acutemyeloid leukemia identifiesdifferentpatient risk groupsandmay contribute to postinduction treatmentstratification[J].Blood,2001,98(6):1746-1751.
[12]Buccisano F,Maurillo L,Gattei V,etal.The kinetics of reduction ofminimal residual disease impacts on duration of response and survival of patientswith acutemyeloid leukemia[J].Leukemia,2006,20(10):1783-1789.
[13]Venditti A,Buccisano F,Del Poeta G,et al.Level ofminimal residual disease after consolidation therapy predicts outcome in acute myeloid leukemia[J].Blood,2000,96(12):3948-3952.
[14]钟旭姝,兰菲,崔旭,等.初发急性髓系白血病诱导化疗后外周血MRD早期检测与临床疗效的关系[J].中国实验血液学杂志,2013,21(1):57-61.
读者·作者·编者
关于论文“讨论”的基本要求
现就有关论文中讨论的基本要求介绍如下:(1)讨论应围绕论文的主题及中心内容,阐明本论文研究的原理和概念;(2)分析结果中各种数据或现象的理论根据;(3)对结果的理论或实践意义进行科学评价,但应与主题和结果紧密联系;(4)客观、恰当地评价研究成果的应用价值,指出结果的可能误差;(5)指出存在的问题,提出新的研究方向或展望,给读者以启迪;(6)用语应精炼,避免对前文内容、方法与结果的过多重复;(7)应重点突出,主次分明。
本刊编辑部
Clinical significance of dynam ically monitoring m inimal residual disease in prognosis of acute leukem ia
Wu Yuling,Wang Fukang,Wang Qiong,Wang Yong,Yu Chao,Xu Youshan,Wang Liding,Wu Jin′an,Zhang Saiwu△(Departmentof Hematology,Huangshan Municipal People′sHospital,Anhui245000,China)
ObjectiveTo investigate the clinical significance of dynamicallymonitoring theminimal residual disease (MRD)in predicting the recurrence and guiding the clinical therapy ofacute leukemia(AL).Methods36 casesof initial AL in the hematology departmentofour hospital from January 2011 to December 2013 were selected and their bonemarrow and periph eralblood specimenswere collected fordetectingMRD by using the4-colormultiparameter flow cytometry(FCM).The2-3 groups of4-colorantibodies combination were selected with CD45/SSC asgating,theMRD detection was performed once per1-3months after the end of the first induction chemotherapy,moreover the correlation between the change ofMRD levelwith AL recurrence was dynamicallymonitored.ResultsThe caseswere divided into 3 groups according to theMRD level after the end of the first induction therapy:MRD>1×10-2group(22 cases),MRD 1×10-4-1×10-2(6 cases)and MRD<1×10-4(8 cases).The recurrence rate in the MRD>1×10-2group was 81.8%(18/22),which was significantly higher than 12.5%(1/8)in the MRD<1×10-4group,the differencewas statistically significant(P=0.003),which in theMRD 1×10-4-1×10-2group was50.00%(3/6),showing no statistical difference compared with the MRD<1×10-4group(P=0.059).The prognosis in MRD<1×10-4was better.Among other 30 cases of AL for detecting peripheral blood and bonemorrow MRD,14 cases had peripheral blood MRD>1×10-2,7 cases had peripheral blood MRD1×10-4-1×10-2,9 caseshad MRD<1×10-4,8 caseshad bonemorrow MRD>1×10-2,10 caseshad bonemorrow MRD 1× 10-4-1×10-2and 12 cases had bonemorrow MRD<1×10-4.ConclusionThe MRD positive in AL patientsappears early than the morphology recurrence,therefore,dynamicallymonitoring MRD has an importance significance to predict the AL recurrence and guide the individualized therapy.
Neoplasm,residual;Leukemia;Acute disease;Prognosis;Flow cytometry
10.3969/j.issn.1009-5519.2016.02.009
A
1009-5519(2016)02-0185-03
吴玉玲(1981-),主治医师,主要从事血液病临床诊疗工作。
,E-mail:530272323@qq.com。
2015-08-04)

