厌氧氨氧化脱氮工艺研究进展
王永磊,刘宝震,张克峰
(山东建筑大学 市政与环境工程学院,山东 济南 250101)
厌氧氨氧化脱氮工艺研究进展
王永磊,刘宝震,张克峰
(山东建筑大学 市政与环境工程学院,山东 济南 250101)
厌氧氨氧化菌厌氧氧化自养生物脱氮技术在降低污水处理能耗,实现污水能量回收利用方面应用前景极大。良好的污泥停留时间和稳定的亚硝酸盐供应制约厌氧氨氧化技术在污水处理中的应用,两者都与厌氧氨氧化菌参与硝化亚硝化反应的菌群活性影响因素有关。文章综述了温度、pH值、有机物等影响厌氧氨氧化菌活性因素的最新研究进展,从微生物角度研究了厌氧氨氧化颗粒污泥和生物膜形成的影响因素和获得良好污泥停留时间的方式,阐明了亚硝化和部分反硝化两个稳定可行的亚硝酸盐供给方式,通过研究厌氧氨氧化菌和亚硝酸盐氧化菌生长因素,阐释了部分反硝化机理,对主流生活污水处理系统中应用厌氧氨氧化工艺的可能和挑战进行了展望。
生物脱氮;厌氧氨氧化菌;亚硝化;部分反硝化;影响因素
0 引言
生物脱氮工艺是污水脱氮、控制水体富营养化的主要方式之一。传统的生物脱氮工艺包括硝化反应和反硝化反应两个过程。氨先被氧化成亚硝酸盐,然后在好氧的环境中亚硝酸盐被氧化为硝酸盐,接着反硝化菌利用有机物提供的电子,将硝酸盐还原成氮气。在整个过程中,氨氧化菌(AOB)和亚硝酸盐氧化菌消耗大量氧气,反硝化菌消耗大量有机物。目前我国城镇污水处理的目标以脱氮除磷为主,但许多城镇污水有机物含量偏低,在实际污水处理中为了提高脱氮效率,往往需要外加有机碳源。因此,无机自养生物脱氮技术受到越来越多的关注,国内外学者普遍认为无机自养生物脱氮技术是一项可持续污水处理技术。目前,能实现无机自养脱氮的技术有无机自养反硝化脱氮技术,光能自养系统脱氮技术和厌氧氨氧化脱氮技术[1-3]。这些技术中,厌氧氨氧化技术在污水处理能量自给乃至能量外供方面最有发展前景[3]。
厌氧氨氧化细菌以亚硝酸盐做为电子受体氧化氨氮,以二氧化碳作为碳源。亚硝化和部分反硝化反应可为厌氧氨氧化反应提供亚硝酸盐。由此,污水中生物氮的去除可以通过亚硝化/厌氧氨氧化技术和部分反硝化/厌氧氨氧化技术实现。与硝化反硝化过程相比,亚硝化厌氧氨氧化过程是一个可持续过程。除了厌氧氨氧化反应外,亚硝化也是一个无机自养反应。因此,亚硝化厌氧氨氧化是一个完全的无机自养脱氮反应。相较于硝化反硝化反应,亚硝化厌氧氨氧化反应的有机物消耗量减少100%。节省下的有机物可以被用来产生甲烷,提高污水中能量的回收利用[3]。
部分反硝化/厌氧氨氧化过程包含硝化、部分反硝化和厌氧氨氧化。与硝化反硝化过程相比,部分反硝化/厌氧氨氧化的需氧量降低45%,因为只有一部分氨被氧化成硝酸盐。该反应过程中,对有机物的需求量降低了79%。最终,部分反硝化/厌氧氨氧化反应过程的生物产生量降低,即减少了剩余污泥量,这也就降低了剩余污泥的处理处置费用。基于以上分析,部分反硝化/厌氧氨氧化反应可能是最有发展前景的生物脱氮过程。
利用厌氧氨氧化技术进行生物脱氮的污水处理工程已经超过100多个,大部分都是针对高浓度含氮废水处理方面。Strass污水处理厂利用亚硝化/厌氧氨氧化工艺处理废水,污水厂能量消耗从2.66 kWh/(kg-N)降低到1.50 kWh(kg-N)[4]。但是废水处理系统的氮负荷率仅为总氮负荷率的20%,因此如果能在主流处理系统中应用厌氧氨氧化工艺,将会节约更多的能源。同时,自养脱氮的厌氧氨氧化过程节省下的有机物可以用来产生生物沼气(甲烷),提高能量循环利用。为了促进该技术向主流处理工艺的发展,文章综述了利用厌氧氨氧化进行生物脱氮的污水处理技术。
1 污水处理系统中的厌氧氨氧化反应
厌氧氨氧化反应是在热力学公式和营养物质的基础上推测出来的,并于20世纪90年代中期在Delft工业大学的污水处理中试试验中被证实其真实存在。厌氧氨氧化反应是在厌氧条件下氧化氨,并以亚硝酸盐为电子受体产生N2的反应。该反应中厌氧氨氧化菌固定CO2,是一个无机自养反应[5]。
1.1厌氧氨氧化菌的形态和新陈代谢
厌氧氨氧化菌AAOB是分支较深的一种细菌,它属于浮霉状菌目(Planctomycetales)下的厌氧氨氧化菌科(Anammoxaceae) 。目前文献报道的Anammox有5个属:Candidatus Brocadia, Candidatus Kuenenia, Candidatus Jettenia, Candidatus Scalindua and Candidatus Anammoxoglobus。前三个属分离自污水处理厂构筑物和实验室生物反应器中,第四种分离自海水环境中[5-6]。厌氧氨氧化菌在不同属之间存在巨大的系统差异,但它们的新陈代谢和细胞结构相似。厌氧氨氧化菌细胞内含有一种密集的透过性低的有膜细胞器厌氧氨氧化体(Anammoxosome),氨和亚硝酸盐在该细胞器中转换化为氮气,反应过程中有中间产物羟氨(NH2OH)和联氨(N2H4)生成[7]。在厌氧氨氧化菌中还发现了阶梯烷膜脂,Kartal等认为该物质有助于联氨(N2H4)的积聚,也被用作鉴定厌氧氨氧化菌的生物学标志[5]。厌氧氨氧化菌的这种独特生理结构能够使其在低基质浓度环境中存活,这也能解释在多种生态环境甚至低氮装置中能分离出厌氧氨氧化菌的原因[6]。
在实验室中,利用生物反应器,根据化学计量和物料衡算提出了厌氧氨氧化反应可能的总反应方程由式(1)表示为
(1)
1.2影响厌氧氨氧化菌在污水处理装置中生长的关键因素
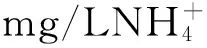
1.2.1温度
温度是影响厌氧氨氧化菌活性的重要环境因素之一。厌氧氨氧化菌的活化能与AOB(63~72 kJ/mol)相似,可以在6~43 ℃的环境中生存。但当温度低于15 ℃或者高于40 ℃时,厌氧氨氧化的反应速率会急剧下降[9-10]。但也有实验证实,在一个处理低浓度废水的厌氧氨氧化反应器中,16 ℃时氮的去除率也比较高(2.28 kgN/m3/d )[11]。最近,Laureni等的研究发现,在一个市政污水预处理反应器中,厌氧氨氧化的活性会从29 ℃时的0.465 kg-N/(m3·d),降低到12.5 ℃的0.046 kg-N/(m3·d)[12]。并且随着温度从 2.5 ℃升高到31.2 ℃,氮的去除率会缓慢提高;当温度降低时,去除率会急剧下降。1.2.2溶解氧浓度
传统观点认为,当氧的浓度在0.032 mg/L时厌氧氨氧化活性就会暂时受到抑制,并能在厌氧的环境下恢复,但是在一步厌氧氨氧化反应器中观察到,氧气与厌氧氨氧化菌的细胞接触前,会被微生物的呼吸作用消耗掉。在把氧作为控制条件的反应器中,或者逐渐增加反应器中氧的含量,厌氧氨氧化菌可以与好氧细菌(AOB和AOA)共生。这样消耗了反应器中的氧气,同时也消耗了对AOA和AOB有毒性的亚硝酸盐,并在厌氧氨氧化菌、AOA和AOB的协同作用下达到脱氮的目的[13]。通过步进式反应器,厌氧氨氧化菌群能逐步适应8 mg/L溶解氧浓度的环境,并且在长时间的曝气后,厌氧氨氧化菌最大活性也只有微小的降低[13]。最近的研究发现,厌氧氨氧化菌能在传统的市政污水处理好氧反应器中生存,甚至当氧含量超过2 mg/L时也能存活[6]。这一发现也证明,在厌氧氨氧化处理污水工艺中,氧的抑制作用是可以有效降低或者消除。
1.2.3pH值
厌氧氨氧化过程是一个消耗H+的过程,过高或过低的pH值都会影响反应的正常进行。Puyol等在密封的血清瓶中接种厌氧氨氧化污泥,发现进水pH值为7.2~7.6时污泥活性较大[14]。鲍林林等采用上向流厌氧氨氧化生物滤池在常温、低基质浓度条件下进行反应,发现最适的进水pH值为6.7~8.5,pH值从6.0升至7.5时,厌氧氨氧化速率逐渐提高;但当pH值继续升至9.5时,厌氧氨氧化速率会不断下降[15]。现在普遍认为厌氧氨氧化的最适pH值在7.8~8.0 之间。
1.2.4底物浓度
氨和亚硝酸盐是厌氧氨氧化菌的主要底物,当两者同时存在时,厌氧氨氧化菌的活性较强。Lotti等的研究发现,浓度低于500 mg/L的铵和硝酸盐不会对厌氧氨氧化菌的活性产生抑制作用,但是亚硝酸盐对厌氧氨氧化菌Anammox有较强的抑制作用[16]。根据Blackburne等和Hendrickx等的研究,发现污水中氨的浓度相对较低,一般小于100 mg/L,并且在水处理装置中,回流的活性污泥或者内循环的水会稀释污水的浓度[9,17]。因此,一般情况下污水中的亚硝酸盐(<20 mg/L)不会对厌氧氨氧化菌产生抑制作用。在污水处理反应器中,亚硝酸盐浓度是影响厌氧氨氧化菌活性的一个重因素[3]。因此,利用厌氧氨氧化技术实现生物脱氮,需要提高底物中亚硝酸盐浓度。可以通过传统的亚硝化反应提高亚硝酸盐浓度,也可以采用新型的部分反硝化实现。
1.2.5有机物
厌氧氨氧化菌是以CO2为主要碳源的自养型微生物[3,11]。充分的无机碳源能够促进厌氧氨氧化菌的生长,并能提高厌氧氨氧化的活性。通常认为有机物质会抑制厌氧氨氧化菌的活性。在实际的污水中,有机物、无机物和厌氧氨氧化菌是共存的,高浓度的有机物是限制厌氧氨氧化应用的因素之一。因此,在含有有机化合物的污水中配置混合厌氧氨氧化菌群非常必要[18]。在这样一个以厌氧氨氧化菌为基础的混合处理系统中,厌氧氨氧化反应和反硝化的共存竞争完成氮的去除,并且在反硝化作用和细胞溶解作用下,厌氧氨氧化对有机物的耐受性增强[19]。Jenni等的研究也证明,在维持高污泥龄的情况下,厌氧氨氧化菌可以在高C/N比的污水中与异养菌共存[8]。在部分反硝化-厌氧氨氧化工艺中,反硝化菌利用厌氧氨氧化反应生成的硝酸盐,氧化污水中的COD,同时提供厌氧氨氧化反应所需的亚硝酸盐。但是在这个混合系统中由于反硝化菌世代时间短和细胞溶解作用,厌氧氨氧化菌很容易失活甚至突然种群消失[6]。因此,找到一个稳定的以厌氧氨氧化菌为基础的混合反应系统,并研究该系统的脱氮影响因素是未来的一个研究方向。
1.2.6污泥龄
污泥龄高于厌氧氨氧化菌世代时间两倍时,厌氧氨氧化菌在污水处理反应器中才能稳定存活,其在厌氧氨氧化反应器中倍增时间是15~30 d[20]。最近在低浓度废水研究中发现,29 ℃时启动厌氧氨氧化反应器,最短的倍增时间为18 d。温度降低到12.5℃时,倍增时间延长到了79 d[12]。在对传统污水处理装置的研究证明,厌氧氨氧化菌能在市政污水处理装置的不同单元,污泥龄在2~20 d范围内存活[6]。在30 ℃SRT为3 d也能启动厌氧氨氧化反应器[20]。经过驯化厌氧氨氧化菌富集会加快,甚至在低浓度市政废水处理装置中,以及更广泛的生态环境中,厌氧氨氧化菌不再被视作世代时间长的微生物。但当污泥停留时间从12 d降低到3 d时,亚硝酸最大体积的去除率会从1293±15 mgN/L/d降低到503±8 mgN/L/d[20]。所以,合适的SRT是提高厌氧氨氧化工艺脱氮率的关键因素之一。
1.2.7盐度
盐度对厌氧氨氧化菌活性有抑制作用。Kartal等人研究发现,厌氧氨氧化菌对盐度的耐受极限值是75 g/L的NaCl[21]。也有实验证明,即使长期驯化,淡水分离出的厌氧氨氧化活性污泥也不能用于处理盐浓度高于30 g/L的污水[22]。高盐度显著抑制厌氧氨氧化活性,这种抑制具有可逆性。突然降低无机盐负荷对厌氧氨氧化菌的影响更严重,且厌氧氨氧化菌耐盐性也与污泥浓度成函数关系。一定频率的NaCl冲击负荷驯化下,厌氧氨氧化菌在60 g/L的NaCl冲击下仍有活性[23]。经过驯化可以提高厌氧氨氧化菌耐盐性。高盐浓度会改变厌氧氨氧化菌新陈代谢方式和细胞结构,而投加152 mg/L的Ca2+浓度的钙可以防止聚集的厌氧氨氧化菌颗粒细胞的溶解和变形[24]。投加三甲基乙内酯等盐溶液相容性溶质也可以提高厌氧氨氧化菌在高盐浓度环境下的适应性[25]。
1.3生物膜或颗粒污泥中的厌氧氨氧化菌
生物膜和颗粒污泥是提高厌氧氨氧化菌停留的有效方式[26]。一般认为,厌氧氨氧化菌生物膜的形成经过三个阶段:微生物积聚,厌氧氨氧化菌群形成,富含厌氧氨氧化菌颗粒污泥形成。细菌用过胞外聚合物使自身的移动迟缓或粘附在接触物表面,这是颗粒污泥和生物膜形成的一个重要机理。由此可以发现,胞外多聚物(EPS)在颗粒污泥和生物膜形成中起到至关重要的作用,并能帮助维持两者结构。细菌的胞外分泌物是一个可控参数。本文综述厌氧氨氧化污水处理工艺中的控制参数,实际中的控制参数包括较低的氮浓度(<100 mg-N/L)和低温(20 ℃或者在冬季低温时)。
高进水流量有利于提高厌氧氨氧化菌颗粒污泥或生物膜法处理低浓度废水的效果,但出水中氮的浓度较高。另一方面,增加进水流量会加大水力剪切力,胞外多聚物(EPS)含量也会相应增加[9]。这和轻微超负荷或是增加填料促进胞外多聚物分泌,或缩短颗粒周期产生的效果一样[27]。过量的底物营养会促进胞外多聚物的分泌,有利于细菌的存活和生长[28]。SRT也是一个重要的影响因素,为了防止生物量的流失,SRT要大于16.4 d。延长SRT能增加胞外多聚物的粘附力,提高聚合体的牢固性[23]。
低温废水中厌氧氨氧化菌的生长率也较低,相应的厌氧氨氧化颗粒形成率也较低[9]。相较于高温,低温时流体的粘性和密集型会增大,这也会造成厌氧氨氧化颗粒污泥的流失。根据斯托克斯规律可以推算出厌氧氨氧化菌颗粒沉降速度的降低。在低温环境中,细菌自我保护机能会使微生物自溶现象过度发生,通过这种方式可以减轻处理系统的压力[29]。但是这也会增加水流的粘度和密度。采用降低HRT的方法,可以降低因流体粘度和密度增加造成的生物量流失[30]。综上建议选择在夏季启动厌氧氨氧化颗粒污泥反应器。
漂浮的厌氧氨氧化颗粒也会造成厌氧氨氧化菌的流失[31]。胞外多聚物(EPS)的过量分泌会阻塞厌氧氨氧化颗粒内部的气体通道,气体难以在颗粒内部释放,颗粒的浮力会因此增加[30]。解决办法是控制颗粒的尺寸。有研究人员测量了流动态和固着态的颗粒直径,其平均尺寸分别在2.92和0.63 mm[31]。有研究根据理论公式推算悬浮颗粒和固着颗粒直径的临界值是1.35 mm[32]。当颗粒直径在1.0~1.5 mm时其活性最强,并在生物膜顶部1mm处的检测到厌氧氨氧化菌活性[30]。综上所述,为了避免厌氧氨氧化颗粒漂浮,其直径要控制在2.20 mm以下。如果颗粒漂浮发生,应当捕获漂浮的颗粒,断成小块后,在重新放回到厌氧氨氧化反应器中[30]。
2 亚硝化
亚硝酸盐和氨是厌氧氨氧化菌的基底。氨是污水中主要的氮化合物,稳定的亚硝酸盐是厌氧氨氧化工艺脱氮的关键。亚硝化是氨氧化成亚硝酸盐的过程。亚硝化/厌氧氨氧化工艺已经在高浓度含氮废水处理系统中成功应用[18]。所以,在污水处理系统中亚硝化是为厌氧氨氧化细菌提供充足亚硝酸盐的可行方式[3,11]。
2.1亚硝化机理
在传统的硝化反应中,氨氧化菌(AOB)氧化氨为亚硝酸盐,亚硝酸盐氧化菌(NOB)再把亚硝酸盐氧化成硝酸盐。要实现亚硝化即亚硝酸盐的富积,就要在短时间内抑制亚硝酸盐氧化菌的活性,且时间过长会导致亚硝酸盐氧化菌在污水处理系统中的流失[33]。亚硝酸盐富积表明亚硝酸盐氧化菌(NOB)生长活性低于氨氧化菌(AOB)。经过长时间的控制污泥停留时间,亚硝酸盐氧化菌的种群数量会减少[2]。抑制或限制亚硝酸盐氧化菌(NOB)生长的方式有高温、控制污泥龄、高浓度的氨、高盐度和低溶解氧浓度。最近的研究也证实了溶解氧浓度、交替缺氧好氧环境和游离的亚硝酸对NOB生长有抑制作用,曝气时间也能控制AOB和NOB的生长。有关这方面的内容将在接下来的章节概述。
2.2影响亚硝酸盐氧化菌(NOB)生长因素的最新研究进展
2.2.1溶解氧浓度(DO)
氧是亚硝酸盐氧化菌(NOB)和氨氧化菌(AOB)的底物之一,限制氧的浓度会降低NOB和AOB的生长率。AOB(KO2,AOB)氧的莫诺半饱和常数低于NOB(KO2,NOB)(见表1)[34-35]。也就是说AOB较于NOB对氧更有亲和力。实验研究发现当控制硝化反应器的溶解氧浓度小于1.0 mg/L时,AOB的增长率是NOB的2.6倍[36]。在连续流前置反硝化生活污水中试处理反应器中,溶解氧浓度维持在0.4~0.7 mg/L时,亚硝酸盐的富集率能高于95%[37]。相反,Wett等的研究发现亚硝酸盐很难富集,并且当反应器的温度长时间维持在较低情况下,KO2, AOB比KO2, NOB高很多[38]。这也就解释了为什么在长期溶解氧浓度偏低情况下硝化螺旋菌的数量会比硝化杆菌的数量增长显著。Regmi等的研究结论发现,硝化螺旋菌是K-对策型微生物,即有特定生长速率低但较高的底物亲和力的特点,而硝化杆菌的生态模式是r-对策型(特定生长率高且底物亲和力低)[39]。因此在溶解氧浓度较低时,硝化螺旋菌获取氧的能力比硝化杆菌强[40]。由此也可以解释前文所诉KO2, NOB高于KO2, AOB的原因可能是由硝化杆菌造成。
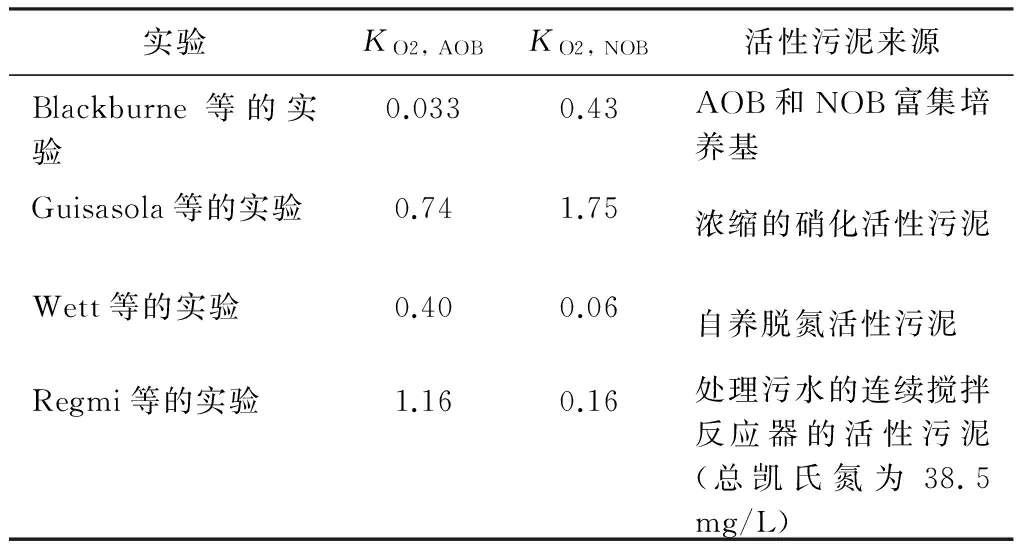
表1 文献中记载的不同实验中KO2, NOB和KO2, AOB的值
2.2.2交替缺氧好氧环境
交替缺氧好氧环境有利于冲刷亚硝酸盐氧化菌(NOB)并强化亚硝化反应[39,41]。交替缺氧好氧环境会造成短暂的缺氧环境,有助于控制NOB的生长。在缺氧段后硝酸盐产生的延迟时间长于氨的转化[41-42]。Kornaros等研究发现在生成硝酸盐时的延迟时间是缺氧干扰时间(1.5~12 h)的函数[42]。而也有涵盖15~60 min缺氧阶段的实验证实延迟时间不取决于厌氧阶段的扰动。这些研究结果的差别可能是由于时间较长的缺氧阶段(1.5~12 h)不仅降低了微生物的新陈代谢,甚至开始使NOB衰变。也有研究发现硝酸盐生成量取决于空气流动率[41]。
厌氧条件下,亚硝酸盐可以被还原为氮气;这一过程是在含有有机物的条件下由有机异养反硝化菌或者厌氧氨氧化菌在含有过量氨的条件下完成。因为亚硝酸盐的含量是有限的,所以NOB、有机异养反硝化菌和厌氧氨氧化菌之间对底物的持续竞争,会降低NOB的生长率[43]。虽然交替缺氧好氧已经被成功应用在高含氮废水和生活污水的处理中,但是在废水处理系统中如何控制交替缺氧好氧条件的特点达到冲刷NOB的目的依然有待研究。
2.2.3曝气时间
好氧条件下氨氧化菌(AOB)氧化氨为亚硝酸盐,亚硝酸盐氧化菌(NOB)在把亚硝酸盐氧化成硝酸盐。亚硝酸盐的氧化总是比氨的氧化延后。如果曝气能提前关闭或者在氨全部被氧化完成的准确时间关闭曝气,反应器中会留有一些残余的亚硝酸盐。这是因为在缺氧条件下,亚硝酸盐被NOB的进一步氧化可以不进行。所以相较于恒定曝气时间,有规律的控制曝气时间会降低NOB的生长速率。较长时间的控制曝气时间会减少NOB的种群数量[33]。在生活污水处理中,经常通过测量氧化还原电位、溶解氧浓度和pH的方法监测氨氧化反应的完成,并以此控制曝气时间来实现亚硝化。Blackburne等用SBR反应器处理生活污水,利用测量溶解氧控制曝气时间,使亚硝酸盐富集率达到80%[17]。在一个SBR中试实验中,利用基于测定鼓风机频率和pH的新型曝气时间控制方法成功实现硝化反应,亚硝酸盐富集率达到90%,该反应在低温(11 ℃)条件下也能进行[44]。最近有学者研发了监测NH4+-N浓度的传感器,可以用来控制曝气时间[39]。
2.2.4游离亚硝酸盐(FNA)抑制作用
好氧条件下氨氧化菌(AOB)对游离亚硝酸(FNA)的耐受性要比NOB强(见表2),FNA对AOB和NOB合成代谢的抑制作用强于对分解代谢的作用[45]。Torà等研究发现在总有机碳量有限的情况下,FNA对AOB的抑制作用会加强[46]。有研究者在用缺氧/好氧反应器处理高含氨生活垃圾填埋渗出液时,在游离氨FA和游离亚硝酸盐FNA共同作用下抑制NOB活性,成功实现反硝化反应且亚硝酸盐累积率高于90%[47]。

表2 不同实验中游离亚硝酸盐(FNA)对氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)的抑制情况
在最新的有关游离亚硝酸盐(FNA)产生抑制效果的研究(见表2),Vadivelu等和Wang等发现在厌氧条件下FNA对亚硝酸盐氧化菌(NOB)和氨氧化菌(AOB)有灭活性,且对NOB的灭活性更强[48-49]。这一发现也催生出一种新的在污水处理反应器中实现亚硝化的工艺,即大量的活性污泥通过厌氧侧流反应单元回流,并且污泥在侧流反应单元中经过FNA的处理。在生活污水处理系统中应用该工艺,亚硝化反应可以迅速的完成且亚硝酸盐累积率高于80%[48]。同时通过FNA在侧流反应器中对污泥进行处理,也会降低污泥产量。Law等人综合考虑FNA处理污泥的试剂成本和给污水处理厂增加的氮负荷,提出应该从污水处理厂高浓度含氮废弃液如厌氧消化液中回收FNA[50]。
2.3污水处理系统中完成亚硝化的方法
在污水处理系统中通过参数控制很难触发亚硝化反应。抑制和冲刷亚硝酸盐氧化菌(NOB)需要交替缺氧好氧、游离亚硝酸盐(FNA)抑制和曝气时间控制等几个方法的结合。在一个用SRT反应器处理市政污水的中试反应中,研究人员采用控制曝气时间、交替缺氧好氧和控制污泥停留时间相结合的方法,获得了稳定的反硝化反应,且平均亚硝酸盐累积率超过95%[51]。在亚硝化/厌氧氨氧化预处理生活污水反应器中,通过控制曝气时间和使用间歇性曝气获得交替缺氧好氧条件,成功抑制了NOB的生长[43]。Wang等在用SBR工艺处理合成生活污水时,利用FNA处理部分回流污泥和控制污泥停留时间的方法,快速触发亚硝化反应并且亚硝酸盐累积率高于80%[48]。
以上所有的研究都是基于SBR反应器。在处理污水时反应器会持续搅拌,伴随控制COD流入量、交替缺氧好氧条件和控制SRT实现NOB冲释[39]。在中试实验和处理厂持续推流进水,应用交替缺氧好氧、控制污泥停留时间,也都监测到亚硝酸盐的富集。
生物强化技术即在污水处理系统中投加含有更多AOB的亚硝化污泥也是一种简单易行的提高亚硝酸盐富集的方法。从处理高含氮废水的侧流单元如厌氧消化液中可以获得亚硝化污泥[11,38]。但是如何提高该技术的操作稳定性、氨的去除率和目标菌种的生长速率有待进一步的研究。
3 部分反硝化
传统的氮去除方法通过反硝化反应把亚硝酸盐还原成氮气,NO和N2O等一系列的还原过程都分别需要硝酸盐还原酶、亚硝酸盐还原酶、一氧化氮还原酶和一氧化二氮还原酶。在硝酸盐还原过程中,亚硝酸盐作为主要中间产物频繁累积[52]。由此也提供了另外一种为厌氧氨氧化提供亚硝酸盐的方式——部分反硝化。
3.1引发亚硝酸盐富集的环境因素
由于亚硝酸盐还原酶和硝酸盐还原酶的活性差异,亚硝酸盐相较硝酸盐还原率低,就会会造成亚硝酸盐的富集。反硝化时很多环境因素会造成亚硝酸盐富集,如C/N比、碳源类型、pH值、温度、硝酸盐浓度、氧浓度和有毒化合物[52-53]。
在碳源有限的条件下,由于亚硝酸盐还原酶和硝酸盐还原酶之间对电子供体的竞争,亚硝酸盐很容易富集。在醋酸盐富足、匮乏交替条件下进行部分反硝化实验发现,易生物降解有机物和硝酸盐的比为2.5是一个理想化的亚硝酸盐富集条件,亚硝酸盐富集率达到71.7%[52]。而也有研究认为电子供体竞争会发生在高有机物和硝酸盐比(COD/NO3-N)条件下,当COD/NO3-N从1.0增长到15.0时,会观察到亚硝酸富集量的增长[54]。
反硝化时碳源的类型也会影响亚硝酸盐的积累。葡糖糖会明显促进亚硝酸盐累积[54]。在一个控制反硝化实验中,将假单细胞菌D6在三种不同的碳源(葡萄糖、醋酸盐和柠檬酸)中培养。实验发现使用间接代谢碳源(葡萄糖)会有更高的亚硝酸盐累积量[53]。
酶对pH值有特异性反应,每一种酶只有在特定的pH值时才会有最高的活性。因此pH对亚硝酸盐还原酶和硝酸盐还原酶的影响效果是不同的。在Glass等的反硝化实验中,当pH值分别为7.5、8.5、9.0时亚硝酸盐积累增长量达到最大[55]。而也有实验表明当硝酸盐量为40 mg/L时亚硝酸盐在低pH值比高pH值的累积率高。
Saez等研究了杀虫剂应用在培养ATCC 19367 脱氮付球菌时对反硝化的影响[56]。在培养基上加入乐果和杀扑磷等有机磷杀虫剂后经过72 h的培养,能检测到高浓度NO2-N。以上研究表明,杀虫剂会对亚硝酸盐积累率的提高产生消极影响。反硝化菌在溶解氧浓度较低的环境中,亚硝酸盐的积累对亚硝酸盐和硝酸盐还原酶的合成和活性产生抑制作用。
3.2污水处理中和部分反硝化有关的微生物
微生物种群也会影响反硝化过程中亚硝酸盐的积累量。Martienssen等的实验中,用三种硝酸盐还原菌测试他们还原硝酸盐和亚硝酸盐的相对能力[57]。第一组是仅还原硝酸盐为亚硝酸盐的兼性厌氧菌;第二组是硝酸盐和亚硝酸盐都能还原但是没有亚硝酸盐累积的细菌,并且其亚硝酸盐还原率总是高于硝酸盐还原率;第三组的细菌能还原硝酸盐和亚硝酸盐,但是其硝酸盐还原能力与短暂的亚硝酸盐积累量有关且亚硝酸盐还原率低于硝酸盐还原率[57]。
另一个实验用三种从污水处理反应器中分离出的反硝化菌(Paracoccusdenitrificans,Pseudomonasstutzeri,andPseudomonasaeroginosa)研究其硝酸盐反硝化模式。在相同生长条件下Paracoccusdenitrificans不能使亚硝酸累积;Pseudomonasstutzeri将硝酸盐全部转换成亚硝酸盐并把亚硝酸盐还原成氮气;Pseudomonasaeruginosa还原硝酸盐为亚硝酸盐且有短暂的亚硝酸累积[53,55-59]。几种反硝化菌的亚硝酸盐累积能力见表3。
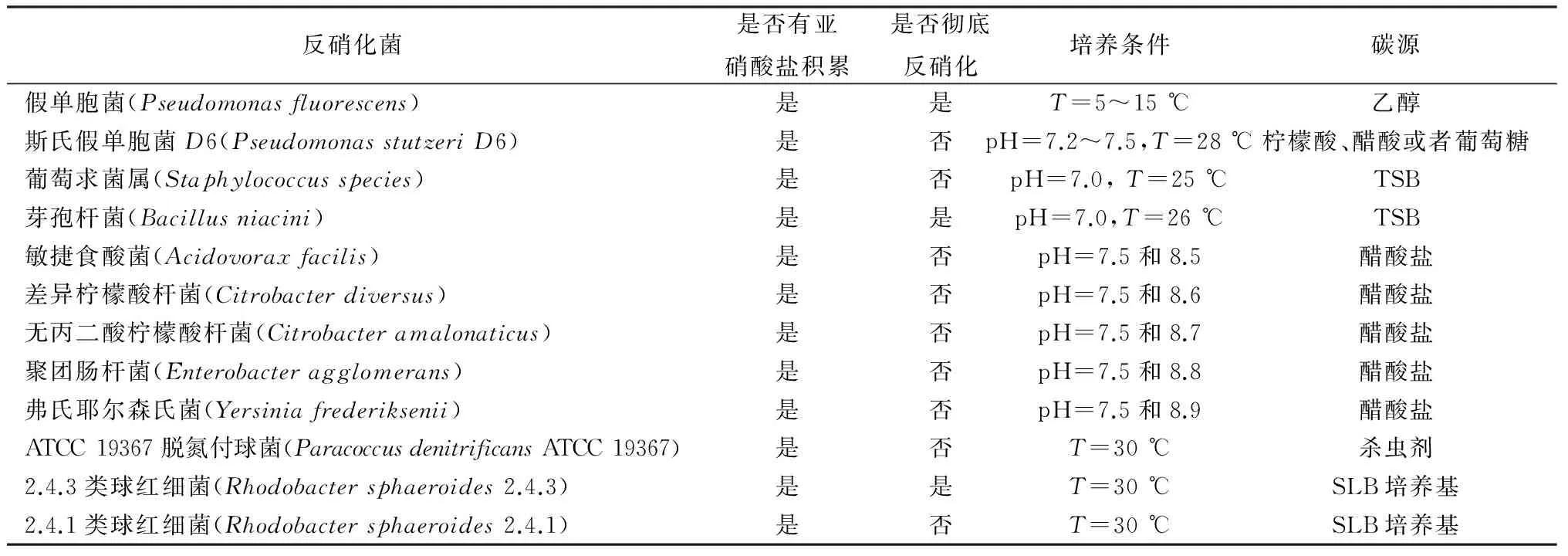
表3 不同种类反硝化菌反硝化作用积累亚硝酸盐的情况
最近有学者探究了三种接种污泥(SA,SA-A-O,SA-A)的亚硝酸积累特性,研究了不同反硝化菌落亚硝酸盐积累效果[52-54]。SA污泥取自处理生活污水的缺氧和好氧高污泥龄小试反应器的厌氧区;SA-A-O取自有较高脱氮除磷效率的厌氧/缺氧和好氧反应器;SA-A取自以污泥发酵为碳源的厌氧污泥发酵耦合缺氧反硝化反应器。实验结果表明,SA和SA-A-O在反硝化时出现短暂的亚硝酸盐积累;SA-A有很强的亚硝酸盐积累特性,且硝酸盐全部转换为亚硝酸盐前其硝酸盐-亚硝酸盐转换率达到80%。在假定微生物菌落控制反硝化且仅把硝酸盐还原成亚硝酸盐,只有C/N比会影响实验结果[19]。
3.3反硝化反应亚硝酸盐的积累
如果反硝化反应不能在合适的时间停止,积累的亚硝酸盐会被还原成氮气。因此需要实时控制环境因素实现亚硝酸盐积累量最大化。实时控制即控制pH和氧化还原电势(ORP)广泛应用在监测反硝化彻底完成。反硝化过程通常简化为两步模型,即第一步NO3-N还原为NO2-N;第二步NO2-N被还原成N2。只有在第二步即亚硝酸盐还原为氮气时会生成OH-。也就是说,在亚硝酸盐含量最大值这一点会对应pH值曲线上一个转折点。在亚硝酸盐量达到最大值点(称为A点)之前会逐渐观察到pH值变化。随后,亚硝酸盐还原反应称为主要的化学反应,随着OH-的生成pH值曲线会急剧上升,直到亚硝酸盐消耗完(称为B点)。通常B点被用来表征亚硝酸盐消耗点[51]。要想实现亚硝酸盐最大积累量,需要在出现A点时终止反应。
ORP也能作为一个表征硝酸盐亚硝酸盐还原过程的参数。NO3-N║NO2-N和 NO2-N║N2的ORP计算值分别为0.43和0.956V。这两个值很明显,所以在亚硝酸盐达到峰值后可以明显观察到ORP值突然降低,称降低点为“亚硝酸盐谷”[47]。
长期操作反硝化过程会得到稳定的高亚硝酸盐积累率。经过108 d的控制后,反硝化过程中亚硝酸盐积累量稳定在80%[19]。在一个225 d不同C/N比的控制实验中再次认证了该实验结论[60]。综上所述,部分反硝化是一个比较可行的为厌氧氨氧化提供亚硝酸盐底物的方式。
4 厌氧氨氧化工艺在主流污水处理系统中的应用
Strass污水处理厂是知名的能量自给且能源外供的污水处理厂。Strass污水处理厂采用了亚硝化/厌氧氨氧化侧流处理工艺。在主流污水处理系统中应用厌氧氨氧化工艺以提高脱氮效率,投加的厌氧氨氧化颗粒污泥来自侧流处理系统,并使用旋流分离器延长污泥停留时间。旋流分离器可以从剩余污泥中分离出高密度小颗粒污泥。出水中可以观察到亚硝酸盐积累。厌氧条件下控制温度20 ℃可以完成氨的去除。但是模拟实验表明在NOB最大生长率时对其抑制比较困难,即使进行生物强化作用如增加AOB和AMK(一种亚硝酸盐竞争物)抑制效果也不明显。采用间歇曝气即营造短暂缺氧环境是一种有效的抑制NOB的方法[38]。
新加坡樟宜回用水处理厂采用分段进水活性污泥工艺(SFAS),总的污泥停留时间为5天。该回用水处理厂日处理水量80万m3,水温在28~32 ℃之间小幅波动。处理厂初沉池出水中37.5%的氮通过厌氧氨氧化反应去除,27.1% 的氮通过传统的硝化反硝化反应去除。与新加坡其他回用水处理厂相比,樟宜回用水处理厂SFAS工艺能耗降低了10%~30%。在曝气池中观察到亚硝酸盐积累率为76%,这表明有亚硝化在进行,且AOB为优势菌群而NOB受到抑制,这也为后续的厌氧氨氧化过程成提供了较充足底物和合适的条[61]。樟宜回用水处理厂较高的亚硝酸盐积累率主要是因为其处理水的较高温度和较短的曝气区停留时间(2.5 h)。反应器中厌氧氨氧化菌含量为105~106copies/mL且它们的大部分基因组序与Candidatus Brocadia sp.40菌相近。有研究表明在30 ℃污泥停留时间为3 d时,在反应器中能发现Candidatus Brocadia sp.40菌[20]。以上的研究结果说明在30 ℃时,厌氧氨氧化菌可以在传统污水处理反应器中存活。
5 展望
良好的厌氧氨氧化菌污泥停留时间是在污水处理系统中使用厌氧氨氧化技术脱氮的前提,形成厌氧氨氧化生物膜或厌氧氨氧化菌颗粒污泥可以提高污泥停留时间。甚至在30 ℃时厌氧氨氧化菌也能在絮状污泥中富集。目前对于厌氧氨氧化菌颗粒污泥填料的研究较少,可以从不同的填料形态研究对污泥停留时间的影响。
如何抑制NOB生长和实现稳定的亚硝酸盐积累是制约厌氧氨氧化技术在污水处理中应用的关键因素,尤其是低温时如何避免NOB对厌氧氨氧化抑制作用和亚硝酸盐有效积累有待进一步的研究。
在为厌氧氨氧化菌提供稳定的亚硝酸盐方面,部分反硝化是最有应用前景的一种方式。在污水处理系统中,部分反硝化工艺能提高厌氧氨氧化工艺的氮去除率,因为反硝化过程能实现稳定的亚硝酸盐积累,为厌氧氨氧化菌提供充足的底物。
厌氧氨氧化工艺在Strass污水处理厂和樟宜回用水处理厂中的应用显示了该工艺在污水处理方面的巨大潜能,但是要想在更多的污水处理厂中应用该工艺,还有很多问题亟待解决,如提高亚硝酸盐积累率和低温时保持厌氧氨氧化菌活性等。部分反硝化反应的亚硝酸积累率较亚硝化反应稳定,是较为可行的为厌氧氨氧化菌提供亚硝酸盐的方式。
[1]Liu C. , Zhao D. , Yan L.,etal. . Elemental Sulfur formation and Nitrogen removal from wastewaters by autotrophic denitrifiers and anammox bacteria[J]. Bioresource Technology, 2015, 191: 332-336.
[2]Regmi P. , Holgate B. , Fredericks D. ,etal. . Optimization of a mainstream nitritation-denitritation process and anammox polishing[J] . Water Science and Technology, 2015,72(4):632-642.
[3]Kartal B., Kuenen J. G. , Loosdrecht M. V. . Sewage treatment with anammox[J]. Science, 2010, 328(5979): 702-703.
[4]Schaubroeck T. , Clippeleir H. D. , Weissen B. N. ,etal. . Environmental sustainability of an energy self-sufficient sewage treatment plant: Improvements through DEMON and co-digestion[J]. Water Research, 2015, 74: 166-179.
[5]Kartal B. , Niftrik L. V. , Keltjens J. T. ,etal. . Chapter 3-Anammox—growth physiology, cell biology, and metabolism[J]. Advances in Microbial Physiology, 2012, 60(60): 211-262.
[6]Wang S. , Peng Y. , Ma B. ,etal. . Anaerobic ammonium oxidation in traditional municipal wastewater treatment plants with low-strength ammonium loading: widespread but overlooked[J]. Water Research, 2015, 84: 66-75.
[7]Strous M. , Pelletier E. , Mangenot S. ,etal. . Deciphering the evolution and metabolism of an anammox bacterium from a community genome[J]. Nature, 2006, 440(7085): 790-794.
[8]Jenni S., Vlaeminck S. E. , Morgenroth E. ,etal. . Successful application of nitritation/anammox towastewater with elevated organic carbon to ammonia ratios[J]. Water Research, 2014, 49(2): 316-326.
[9]Hendrickx T. G. , Wang Y. , Kampaman C. ,etal. . Autotrophic Nitrogen removal from low strength waste water at low temperature[J]. Water Research, 2012, 46(7): 2187-2193.
[10]Zhu G. , Peng Y. , Li B. ,etal. . Biological removal of Nitrogen from wastewater[J]. Reviews of Environmental Contamination & Toxicolog, 2008, 192: 159-195.
[11]Ma B. , Wang S. , Zhang S. ,etal. . Achieving nitritation and Phosphorus removal in a continuous-flow anaerobic/oxic reactor through bio-augmentation[J]. Bioresource Technology, 2013, 139(7): 375-378.
[12]Laureni M. , Weissbrodt D. G. , Szivak I. ,etal. . Activity and growth of anammox biomass on aerobically pre-treated municipal wastewater[J]. Water Research, 2015, 80: 325-336.
[13]Liu S. , Yang F. , Xue Y. ,etal. . Evaluation of Oxygen adaptation and identification of functional bacteria composition for anammox consortium in non-woven biological rotating contactor[J]. Bioresource Technology, 2008, 99(17): 8273-8279.
[14]Puyol D. , Carvajal-arroyo J. M. , Li G. B. ,etal. . High pH (and not free ammonia) is responsible for Anammox inhibition in mildly alkaline solutions with excess of ammonium[J]. Biotechnology Letters, 2014, 36(10): 1981-1986.
[15]鲍林林,赵建国,李晓凯,等.常温低基质下pH值和有机物对厌氧氨氧化的影响[J].中国给水排水,2012(13):38-42.
[16]Lotti T. , Star W. D. , Kleerebezem R. ,etal. . The effect of nitrite inhibition on the anammox process[J]. Water Research, 2012, 46(8): 2559-2569.
[17]Blackburne R. , Yuan Z. , Kller J. . Demonstration of Nitrogen removal via nitrite in a sequencing batch reactor treating domestic wastewater[J]. Water Research, 2008, 42(8-9): 2166-2176.
[18]Lackner S. , Gilbert E. M. , Vlaeminck S. E. ,etal. . Full-scale partial nitritation/anammox experiences—An application survey[J]. Water Research, 2014, 55(10): 292-303.
[19]Cao S. , Wang S. , Peng Y. ,etal. . Achieving partial denitrification with sludge fermentation liquid as Carbon source: the effect of seeding sludge[J]. Bioresource Technology, 2013, 149(4): 570-574.
[20]Lotti T. , Kleerebezem R. , Abelleira-pereira J. M. ,etal.. Faster through training: The anammox case[J]. Water Research, 2015, 81: 261-268.
[21]Kartal M. B. , Koleva M. , Aksov R. ,etal.. Adaption of a freshwater anammox population to high salinity wastewater[J]. Journal of Biotechnology, 2006, 126: 546-553.
[22]Liu C. , Yamamoto T. , Nishiyama T. ,etal. Effect of salt concentration in anammox treatment using non woven biomass carrier[J]. Journal of Bioscience & Bioengineering, 2009, 107(5): 519-523.
[23]Ma C. , Jin R. C. , Yang G. F. ,etal. . Impacts of transient salinity shock loads on Anammox process performance[J]. Bioresource Technology, 2012, 112(1): 124-130.
[24]Xing B. S. , Guo Q. , Yang G. F. ,etal. . The properties of anaerobic ammonium oxidation (anammox) granules: Roles of ambient temperature, salinity and Calcium concentration[J]. Separation & Purification Technology, 2015, 147: 311-318.
[25]Mu L. , Peng Y. , Wang S. ,etal. . Enhancement of anammox activity by addition of compatible solutes at high salinity conditions[J]. Bioresource Technology, 2014, 167(3): 560-563.
[26]Ma B. , Peng Y. , Zhang S. ,etal. . Performance of anammox UASB reactor treating low strength wastewater under moderate and low temperatures[J]. Bioresource Technology, 2012, 129C(2): 606-611.
[27]Liu Y. , Tay J. H. . The essential role of hydrodynamic shear force in the formation of biofilm and granular sludge[J]. Water Research, 2002, 36(7): 1653-1665.
[28]Sharghi E. A. , Bonakdarpour B. . The study of organic removal efficiency and halophilic bacterial mixed liquor characteristics in a membrane bioreactor treating hypersaline produced water at varying organic loading rates[J]. Bioresource Technology, 2013, 149(12): 486-495.
[29]Barbzr W. P. , Stuckey D. C. . The use of the anaerobic baffled reactor (ABR) for wastewater treatment: a review[J]. Water Research, 1999, 33(7): 1559-1578.
[30]Chen J. , Ji Q. , Ping Z. ,etal. . Floatation and control of granular sludge in a high-rate anammox reactor[J]. Water Research, 2010, 44(11): 3321-3328.
[31]An P. , Xu X. , Yang F. ,etal. . Comparison of the characteristics of anammox granules of different sizes[J]. Biotechnology & Bioprocess Engineering, 2013, 18(3): 446-454.
[32]Lu H. F. , Zheng P. , Ji Q. X. ,etal. . The structure, density and settlability of anammox granular sludge in high-rate reactors[J]. Bioresource Technology, 2012, 123(3): 312-317.
[33]Lemaire R. , Marcelino M. , Yuan Z. . Achieving the nitrite pathway using aeration phase length control and step-feed in an SBR removing nutrients from abattoir wastewater[J]. Biotechnology & Bioengineering, 2008, 100(6): 1228-1236.
[34]Blackburne R. , Yuan Z. , Keller J. . Partial nitrification to nitrite using low dissolved Oxygen concentration as the main selection factor[J]. Biodegradation, 2008, 19(2): 303-312.
[35]Guisasola A. , Jubany I. , Baeza J. A. ,etal. . Respirometric estimation of the Oxygen affinity constants for biological ammonium and nitrite oxidation[J]. Journal of Chemical Technology & Biotechnology, 2005, 80(4): 388-396.
[36]Tokutomi T. . Operation of a nitrite-type airlift reactor at low DO concentration[J]. Water Science & Technology a Journal of the Intern, 2004, 49(5-6): 81-88.
[37]Ma Y. , Peng Y. , Wang S. ,etal. . Achieving Nitrogen removal via nitrite in a pilot-scale continuous pre-denitrification plant[J]. Water Research, 2009, 43(3): 563-572.
[38]Wet B. , Omari A. , Podmirseg S. M. ,etal. . Going for mainstream deammonification from bench to full scale for maximized resource efficiency[J]. Water Science & Technology, 2013, 68(2): 283-289.
[39]Regmi P. , Miller M. W. , Holgate B. ,etal.. Control of aeration, aerobic SRT and COD input for mainstream nitritation/denitritation[J]. Water Research, 2014, 57(5): 162-171.
[40]Liu G. , Wang J. . Long-term low DO enriches and shifts nitrifier community in activated sludge[J]. Environmental Science & Technology, 2013, 47(10): 5109-5117.
[41]Gilbert E. M. , Agrawal S. , Brunner F. ,etal.. Response of different nitrospira species to anoxic periods depends on operational do[J]. Environmental Science & Technology, 2014, 48(5): 2934-2941.
[42]Kornaros M. , Dokianakis S. N. , Lyberatos G. . Partial nitrification/denitrification can be attributed to the slow response of nitrite oxidizing bacteria to periodic anoxic disturbances[J]. Environmental Science & Technology, 2010, 44(19): 7245-7253.
[43]Ma B. , Bao P. , Wei Y. ,etal. . Suppressing Nitrite-oxidizing bacteria growth to achieve Nitrogen removal from domestic wastewater via anammox using intermittent aeration with low dissolved Oxygen[J]. Scientific Reports, 2015, 5.
[44]Gu S. , Wang S. , Yang Q. ,etal. . Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH[J]. Bioresource Technology, 2012, 112(3): 34-41.
[45]Vadivelu V. M. , Keller J. , Yuan Z. . Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched Nitrosomonas culture[J]. Biotechnology & Bioengineering, 2006, 95(5): 830-839.
[46]Tora J. A. , Lafuente J. , Baeza J. A. ,etal. .Combined effect of inorganic Carbon limitation and inhibition by free ammonia and free nitrous acid on ammonia oxidizing bacteria[J]. Bioresource Technology, 2010, 101(15): 6051-6058.
[47]Sun H. W. , Bai Y. , Peng Y. Z. ,etal. . Achieving Nitrogen removal via nitrite pathway from urban landfill leachate using the synergetic inhibition of free ammonia and free nitrous acid on nitrifying bacteria activity[J]. Water Science & Technology, 2013, 68(9): 2035-2041.
[48]Wang Q. , Liu Y. , Jian G. ,etal. . Side-stream sludge treatment using free nitrous acid selectively eliminates nitrite oxidizing bacteria and achieves the nitrite pathway[J]. Water Research, 2014, 55(10): 245-255.
[49]Vadivelu V. M. , Yuan Z. , Fux C. ,etal. . The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched nitrobacter culture[J]. Environmental Science & Technology, 2006, 40(14): 4442-4448.
[50]Law Y. , Liu Y. , Wang Q. ,etal. . Producing free nitrous acid—A green and renewable biocidal agent-From anaerobic digester liquor[J]. Chemical Engineering Journal, 2015, 259: 62-69.
[51]Yang Q. , Peng Y. , Liu X. ,etal. . Nitrogen removal via nitrite from municipal wastewater at low temperatures using Real-Time control to optimize nitrifying communities[J]. Environmental Science & Technology, 2007, 41(23): 8159-8164.
[52]Ling X. G. , Ming X. H. , Qing Y. ,etal. . Performance of heterotrophic partial denitrification under feast-famine condition of electron donor: a case study using acetate as external Carbon source[J]. Bioresource Technology, 2012, 133C(2): 263-269.
[53]Yang X. , Wang S. , Zhou L. . Effect of Carbon source, C/N ratio, nitrate and dissolved Oxygen concentration on nitrite and ammonium production from denitrification process by Pseudomonas stutzeri D6[J]. Bioresource Technology, 2012, 104(1): 65-72.
[54]Ge S. , Peng Y. , Wang S. ,etal. . Nitrite accumulation under constant temperature in anoxic denitrification process: The effects of Carbon sources and COD/NO3-N[J]. Bioresource Technology, 2012, 114(3): 137-143.
[55]Glass C. , Silverstein J. A. . Denitrification kinetics of high nitrate concentration water: PH effect on inhibition and nitrite accumulation[J]. Water Research, 1998, 32(3): 831-839.
[56]Saez F. , Pozo C. , Gomez M. A. ,etal. . Growth and nitrite and nitrous oxide accumulation of Paracoccus denitrificans ATCC 19367 in the presence of selected pesticides[J]. Emerging Infectious Diseases, 2003, 22(9): 1993-1997.
[57]Martienssen M. , Schops R. . Biological treatment of leachate from solid waste landfill sites—Alterations in the bacterial community during the denitrification process[J]. Optoelectronic & Microelectronic Materials & Devic, 1997, 31(5): 1164-1170.
[58]Vackova L. , Srb M. , Stloukal R. ,etal. . Comparison of denitrification at low temperature using encapsulated Paracoccus denitrificans , Pseudomonas fluorescens and mixed culture[J]. Bioresource Technology, 2011, 102(7): 4661-4666.
[59]Lee D. Y. , Ramos A. , Macomber L. ,etal. . Taxis response of various denitrifying bacteria to nitrate and nitrite[J]. Applied & Environmental Microbiology, 2002, 68(5): 2140-2147.
[60]Rui D. , Peng Y. , Cao S. ,etal. . Advanced Nitrogen removal from wastewater by combining anammox with partial denitrification[J]. Bioresource Technology, 2014, 179(179C): 497-504.
[61]Cao Y., Kwok B.H., Yan Z.,等. 新加坡最大回用水处理厂污水短程硝化厌氧氨氧化脱氮工艺[J].北京工业大学学报,2015(10):1441-1454.
(学科责编:吴芹)
Research progress of biological nitrogen removal from sewage via anammox
Wang Yonglei, Liu Baozhen, Zhang Kefeng
(School of Environmental and Municipal Engineering, Shandong Jianzhu University, Jinan 250101, China)
Biological nitrogen removal from sewage via anammox is very promising to reduce the energy consumption of sewage treatment and make sewage treatment energy-neutral or energy-positive. Good retention time of anammox bacteria and stable supply of nitrite are real bottleneck for applying anammox in sewage treatment. They are both affected by the active facts of anammox bacteria and the microflora participating nitrosation process. By using the advanced researches about facts affecting of anammox bacteria such as temperature, pH, organics were summarized. Meanwhile, in order to gain the good retention of ananmmox bacteria, the forming of anammox bacteria biofilm/granules were studied by microbiological point. What’s more, two promising methods of offering nitrite-nitration and partial-denitrification were introduced, and the strategies for achieving partial-denitrification were summarized by reviewing the factors affecting anammox bacteria and nitrite-oxidizing bacteria growth. Finally, two cases of applying anammox in the mainstream sewage treatment plants were documented, and the possibility and challenge of the application of anammox process in the mainstream domestic wastewater treatment system were discussed.
biological nitrogen removal; anammox bacteria; nitrosation; partial-denitrification; influencing factors
2016-03-07
济南市科技局高校院所自主创新计划项目(201303076);山东省重点研发项目(2015GSF117003);山东建筑大学博士基金项目(XNBS1511)
王永磊(1977-),男,副教授,博士,主要从事污水处理技术等方面的研究.E-mail: wyl1016@ sina.com
1673-7644(2016)03-0259-11
X703
A

