电针治疗对缺氧缺血性脑病模型大鼠mTOR表达的影响
徐涛,王翠霞,王一冰,刘伟,张辉
(1.青岛市妇女儿童医院,山东青岛 266034;2.青岛市第八人民医院,山东青岛 266041;3.青岛市中心医院,山东青岛 266031;4.青岛大学医学院中西医结合中心,山东青岛 266021)
电针治疗对缺氧缺血性脑病模型大鼠mTOR表达的影响
徐涛1,王翠霞2,王一冰1,刘伟3,张辉4
(1.青岛市妇女儿童医院,山东青岛266034;2.青岛市第八人民医院,山东青岛266041;3.青岛市中心医院,山东青岛266031;4.青岛大学医学院中西医结合中心,山东青岛266021)
【目的】观察电针对缺氧缺血性脑病模型大鼠雷帕霉素靶蛋白(mTOR)表达的干预作用。【方法】选择7日龄SD大鼠,随机分为3组:假手术组、模型组、电针组。每组又以1、3、7、21 d分为4个亚组,采用苏木精—伊红(HE)染色观察缺氧缺血侧脑组织的形态学变化,Western blot法检测mTOR的蛋白表达。【结果】HE染色显示:电针组在21 d时,神经细胞界限清楚,排列有序,细胞肿胀变轻,细胞轮廓及核仁清晰,可见胶质细胞增生。模型组mTOR蛋白的表达均在第1天开始增加,第3、7、21天持续增加,与假手术组比较,差异均有统计学意义(P<0.05)。电针组在1、3、7、21 d 4个时间点与模型组比较,差异均有统计学意义(P<0.05)。【结论】电针能够促进mTOR蛋白水平的表达,对缺氧缺血性脑损伤大鼠可起到脑保护作用。
缺氧缺血性脑病/针灸疗法;雷帕霉素靶蛋白;脑皮质/病理学;疾病模型,动物;大鼠
新生儿缺氧缺血性脑损伤(hypoxic-ischemic encephalopathy,HIE)是各种原因引起的缺氧和脑组织血流减少,脑组织表现为水肿、软化、坏死、出血等主要改变,是新生儿窒息引起的重要并发症之一,是儿童神经系统伤残的常见原因之一[1]。目前研究表明:新生儿缺氧缺血脑损伤发生后,短时间内神经元细胞自噬明显上调[2],而自噬过程与雷帕霉素靶蛋白(mTOR)信号通路关系密切。mTOR是许多细胞内重要的信号传导通路,它能够直接参与调节蛋白合成、基因转录、自噬等,并影响着神经干细胞的分裂、神经环路的形成、神经可塑性等[3]。mTOR活化后可抑制自噬的发生,起到脑保护的作用[4]。
近年来,电针在治疗缺氧缺血性脑损伤中的疗效越来越受到肯定,已有文献[5]报道,电针治疗可以促进缺血部位脑组织的修复与再生。因此,本研究通过观察mTOR的表达,探讨在分子水平上,电针对缺氧缺血性脑病模型幼鼠的脑保护作用,为缺氧缺血性脑病的针灸治疗提供科学依据,现报道如下。
1 材料与方法
1.1实验动物与分组
SPF级7日龄SD大鼠母带子共14窝,每窝9只或10只,共136只,雌雄不拘,母乳喂养,体质量10.5~15.0 g,购自青岛市药检所,合格证号:scxk鲁20130001。各组的喂养条件相同,动物房温度控制在20℃~25℃,光暗周期各12 h。按照随机区组法分为3组,分别于术后第1天、第3天、第7天和第21天4个时间点取脑并检测各项指标。
1.2主要试剂
1.3主要仪器
DW-40W100-20℃低温冰箱为海尔公司产品;705型 -80℃ Thermo超低温冰箱为美国Harris公司产品;AMA440 ASTELL高压灭菌锅为英国产品;SIM-F140AY65制冰机为日本SANYO产品;KA-1000低速离心机为上海安亭科学仪器厂产品;165-1801 Bio-Rad电泳仪为美国伯乐公司产品;Gel Doc XR+凝胶成像分析仪为美国伯乐公司产品;THZ-82A水浴恒温振荡器为浙江金坛华城开元实验仪器厂产品;FA电子天平为上海方瑞仪器有限公司产品;101A-2型干燥箱为上海试验仪器总厂产品;G6805-II电针仪为上海华谊厂产品。
1.4模型制作
假手术组25只,乙醚麻醉,切开颈部皮肤,分离双侧颈总动脉,但不结扎,缝合切口后不作低氧处理,4 h后行为学测定均无异常。将剩余111只幼鼠麻醉,仰卧固定,模型采用Rice等[6]的方法并加以改进,结扎双侧颈总动脉,置于自制密闭容器中,置于37℃恒温水浴箱中,以1 L/min的速度通入低氧混合气体(体积分数8%氧气,92%氮气),复制缺氧缺血性脑病的幼鼠模型。缺氧2.5 h后取出幼鼠,将存活者保温1 h后放回鼠笼。将成功的动物模型共76只纳入统计范围,按照随机区组法分为模型组、电针组2组。手术2 h后仍未苏醒或已死亡的大鼠剔除不用。
1.5电针干预
假手术组仅手术分离但不结扎双侧颈总动脉,切口缝合后亦无需做低氧处理;模型组分离并结扎双侧颈总动脉,缝合切口,不做其他处理;电针组缺血缺氧后第2天开始,以0.5寸毫针向后平刺百会穴5 mm:位置在颅顶正中;直刺大椎穴5 mm:位置在背部正中第7颈椎与第1胸椎间;直刺两侧曲池穴8 mm:位置在肘横纹的外端和肱骨外上髁之间连线中点;速刺涌泉穴3次:位置在足底前三分之一。百会穴、曲池穴采用G6805-II电针治疗仪进行电针刺激,疏密波,5~10 Hz,以穴周组织轻微抖动为度,电压约3~5 V,每日1次,每次时间10 min;其定位参照大鼠的常用针灸穴位[7]。
1.6病理检查
3组大鼠分别在术后第l、3、7、21天4个不同时间点进行取材。经过视交叉处冠状向后切,取缺氧缺血侧大鼠脑组织约2 mm,以40 g/L多聚甲醛缓冲液固定,石蜡包埋,制备成4 μm厚度的切片,显微镜下观察脑组织病理改变。
1.7Western blot印迹法检测
提取脑组织总蛋白,制备十二烷基硫酸钠—聚丙烯酰胺凝胶,电泳分离,采用全湿法转膜,取出聚偏二氟乙烯膜(PVDF膜),放入50 g/L脱脂牛奶中封闭过夜。孵育1 h后加入抗 mTOR单克隆抗体一抗,孵育3 h,漂洗,加入羊抗兔二抗,孵育1 h,再经磷酸盐缓冲液(PBST)洗涤后,浸洗5 min,共3次后显影。将膜置于A、B混合显影液中,采用凝胶成像系统扫描,Quantity One软件进行灰度分析。以GAPDH的灰度值作为内参,按公式计算:目的蛋白相对值(relative value of protein,RVP)=(样品灰度值/GAPDH灰度值),用以上步骤重复测定3次,取平均值作为该样本的最终值,进行统计分析。
1.8统计方法实验结果采用SPSS 17.0统计软件分析。计量资料以均数±标准差(±s)表示,多组比较经方差齐性检验后,采用多组间单因素方差分析,组间两两比较采用t检验法,以P<0.05为差异有统计学意义。
2 结果
2.1各组病理检查
图1结果显示:假手术组神经细胞排列整齐紧密,结构正常,胞浆呈淡红色,胞核呈蓝色,核仁清晰。模型组第1天时,即出现神经细胞改变,呈筛网状结构,有变性坏死,坏死细胞呈三角形和多角形固缩,细胞间隙增大,细胞质染色欠规则,神经细胞胞质浓缩、深染,胞浆有空泡形成,细胞核固缩深染,核仁消失;第3天时神经细胞变性坏死较前更明显,着色深,细胞间排列紊乱,常见细胞核细胞膜破裂,正常细胞结构消失,仍可见大量细胞核固缩、深染、裂解;第7天及21天,出现大量神经细胞丢失,伴有少量固缩核,周围有较多胶质细胞增生及空泡形成。电针组第1天即出现大量神经细胞坏死性改变,细胞核固缩,神经细胞胞质浓缩、深染;第3天可见神经细胞肿胀变性,但坏死的程度较模型组轻;第7天时神经细胞界限清楚,排列较前有序,只出现少量增生的胶质细胞;第21天时神经细胞界限清楚,细胞肿胀变轻,细胞间排列有序,可见胶质细胞增生,神经细胞轮廓及核仁仍清晰。
上述表现以缺血缺氧后第3天神经细胞变性坏死最为明显。而且,随着缺血时间的延长,上述各组的病理改变有减轻趋势,而电针组与模型组比较,神经细胞形态恢复较好,细胞轮廓和核仁清晰,表明电针刺激对缺血缺氧导致的神经元损伤具有一定的保护作用。
2.2各组不同时段脑组织中mTOR蛋白表达变化
表1结果显示:模型组mTOR蛋白的表达均在1 d时开始增加,3 d、7 d、21 d持续增加,与假手术组比较,差异均有统计学意义(P<0.05)。在1 d、3 d、7 d、21 d 4个时点,电针组均较模型组进一步升高,差异均有统计学意义(P<0.05)。
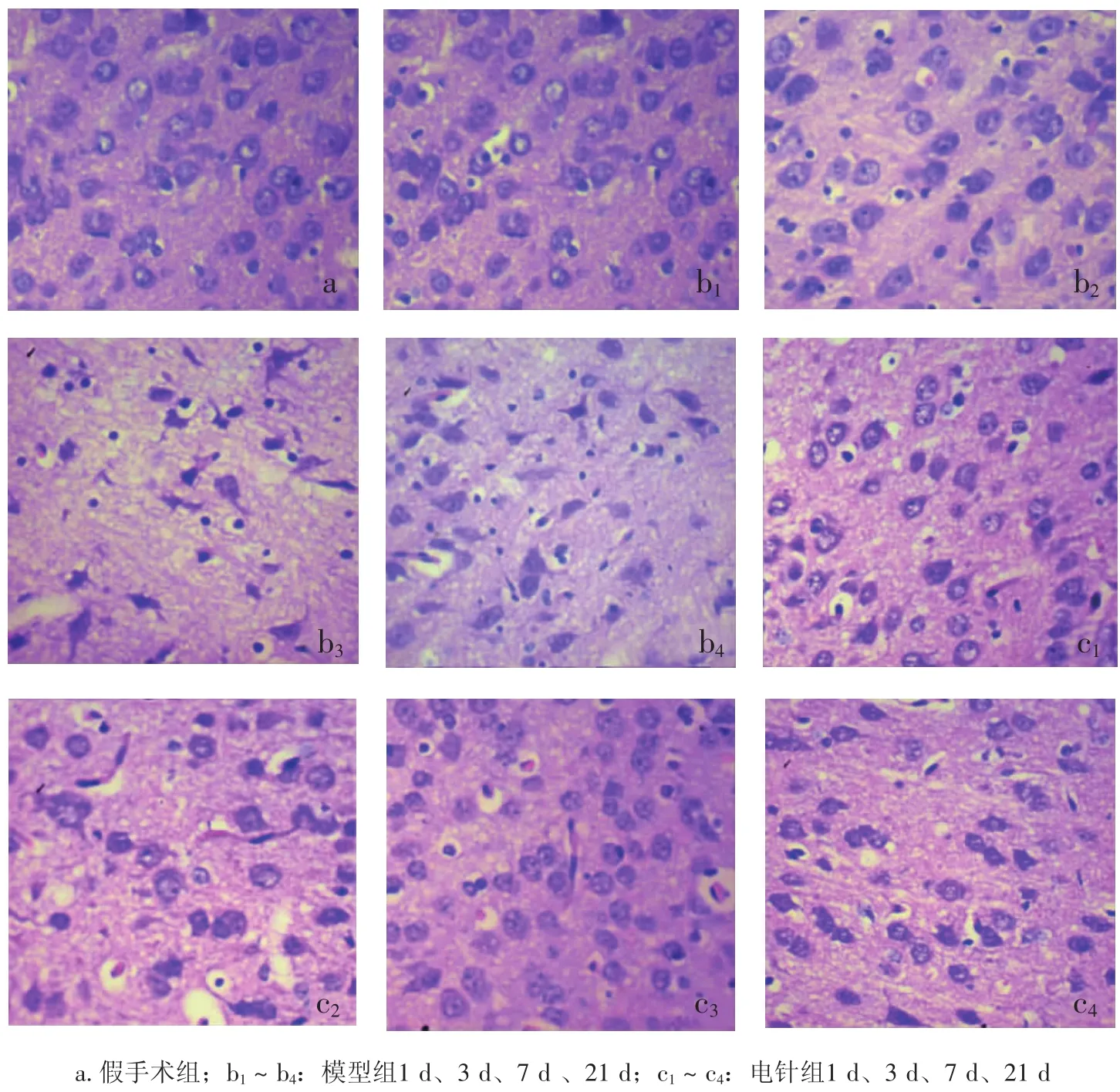
图1 各组大鼠皮质区病理形态比较(HE染色,×400)Figure 1 Histological features of rat cortex of different groups(by HE staining,×400)
表1 幼鼠缺氧缺血侧脑组织mTOR蛋白表达Table 1 Comparison of cerebral mTOR expression in rats of different groups (±s,pmTOR/GAPDH)

表1 幼鼠缺氧缺血侧脑组织mTOR蛋白表达Table 1 Comparison of cerebral mTOR expression in rats of different groups (±s,pmTOR/GAPDH)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
时间假手术组模型组电针组N 6 6 6 t=1 d 1.006 1±0.135 8 1.341 1±0.043 2①1.750 2±0.131 5②t=3 d 1.006 1±0.135 8 2.131 0±0.243 5①2.832 3±0.073 2②t=7 d 1.042 8±0.337 9 2.585 8±0.162 1①3.232 4±0.104 9②t=21 d 1.029 1±0.209 8 2.684 9±0.148 7①3.534 1±0.134 8②
3 讨论
mTOR是一个259 kDa的高度保守丝氨酸/苏氨酸激酶,是磷脂酰肌醇激酶相关蛋白激酶(phosphatidylinositol kinase-related kinase,PIKK)的家族成员,在各种真核细胞中广泛表达。mTOR在进化上相对保守,可整合营养、能量及生长因子等多种细胞外信号,参与基因转录、蛋白质翻译、核糖体合成等生物过程,在细胞生长和凋亡中发挥极为重要的作用[8-9]。近年来,mTOR的生物学功能研究日益深入,特别是其与细胞凋亡及自噬、蛋白质合成、免疫、细胞运动及代谢等的联系越来越受到重视[10]。mTOR与神经干细胞、神经回路和神经可塑性的关系密切[11-12]。
mTOR在多种神经系统疾病发生发展的过程中发挥着重要作用。最新研究发现,mTOR是一种有效的自噬调节剂,细胞自噬是真核生物中相对保守的一种亚细胞代谢途径,是细胞在多种不利因素作用下的一种适应性反应,能为细胞代谢提供循环可利用的原料及能量,维持细胞稳定,促进细胞生存[13]。在营养充足的条件下,自噬处于较低水平,仅在胞质中去除受损和多余的细胞器以维持细胞内环境稳定,称为基本自噬。当某些条件发生改变,如缺氧、能量发生变化、缺血、寒冷、营养物质缺乏等情况下,机体可通过多种信号途径激活自噬,这种称为诱导型自噬。在这种情况下,细胞自噬被过度激活,又会导致细胞程序性死亡,即II型程序性细胞凋亡,从而引起一系列疾病过程[14]。在自噬的活性调节中,其分子诱导机制非常复杂且高度保守,mTOR通路及其相关因子在诱导细胞自噬的发生方面发挥了最直接的调控作用,是调节自噬信号途径的关键分子。当某些病理状态造成机体自噬水平过高时,生物体便会通过一系列复杂的途径,上调mTOR蛋白的表达,mTOR的激活可通过调控自噬相关基因,直接抑制自噬的启动,从而阻断细胞凋亡,对生物体起到保护作用[15]。
本研究结果显示:模型组幼鼠脑组织中mTOR蛋白的表达均在缺氧缺血后第1天开始增加,至第7天时上升趋势较前明显,但在第7天至第21天时上升趋势不明显,提示在脑缺氧缺血产生后,幼鼠神经系统可通过磷脂酰肌醇-3-激酶/蛋白激酶(PI3-K/Akt)途径自发产生脑保护作用,但在无其他干预措施时,幼鼠自发产生的脑保护能力仅能维持一个较短的时段。电针组中,mTOR的变化自第1天起呈上升趋势,并能维持持续上升;第3天、7天、21天与模型组比较,差异均有统计学意义。综上所述,电针能促进损伤脑组织中mTOR蛋白的表达,对缺氧缺血性脑损伤大鼠具有较好的脑保护作用。本结果可为新生儿缺氧缺血性脑病的治疗提供思路。
mTOR信号通路普遍存在于生物体内,与细胞生命活动息息相关,并与临床各种疾病有广泛的联系。但mTOR的脑保护作用具体通过何种机制作用于生物体,mTOR与其他调控因子之间的作用关系如何,电针是否通过其他更多信号通路达到神经保护作用等问题,有待进一步深入研究。
[1]Mercuri E,Ricci D,Cowan F M,et al.Head growth in infants with hypoxic-ischemic encephalopathy:correlation with neonatal magnetic resonance imaging[J].Pediatrics,2000,106(2Pt1):235.
[2]Koike M,Shibata M,Tadakoshi M.Inhibition of autophagy prevents hippocampal pyramidal neuron death after hypoxic-ischemic injury [J].Am J Pathol,2008,172(2):454.
[3]Mazure N M,Pouysségur J.Hypoxia-induced autophagy:cell death or cell survival[J].Curr Opin Cell Biol,2010,22(2):177.
[4]Blagosklonny M V.Hypoxia,MTOR and autophagy:converging on senescence or quiescence[J].Autophagy,2013,9(2):260.
[5]Inoki K,Corradetti M N,Guan K L.Dysregulation of the TSC-mTOR pathway in human disease[J].Nat Genet,2005,37(1):19.
[6]Rice J E 3rd,Vannucci R C,Brierley J B,et al.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131.
[7]林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1994:286.
[8]Sasore T,Reynolds A L,KennEdy B N.Targeting the PI3K/ Akt/mTOR pathway in ocular neovascularization[J].Adv Exp Med Biol,2014,801:805.
[9]NeishabouriSH,HutsonSM,DavoodiJ.Chronic activation of mTOR complex 1 by branched chain amino acids and organ hypertrophy[J].Amino Acid,2015,47(6):1167.
[10]Daneshmanesh A H,Hojjat-Farsangi M,Moshfegh A,et al. The PI3K/AKT/mTOR pathway is involved in direct apoptosis of CLL cells induced by ROR1 monoclonal antibodies[J].Br J Haematol,2015,169(3):455.
[11]Tang Z,Ioja E,Bereczki E,et al.mTOR mediates tau localization and secretion:Implication for Alzheimer's disease [J].Biochim Biophys Acta,2015,1853(7):1646.
[12]Leventer R J,Scerri T,Marsh A P,et al.Hemispheric cortical dysplasia secondary to a mosaic somatic mutation in MTOR[J].Neurology,2015,84(20):2029.
[13]Martínez-Borra J,López-Larrea C.Autophagy and self-defense [J].Adv Exp Med Biol,2012,738:169.
[14]Denton D,Nicolson S,Kumar S.Cell death by autophagy:facts and apparent artefacts[J].Cell Death Differ,2012,19 (1):87.
[15]Abounit K,Scarabelli T M,McCauley R B.Autophagy in mammalian cells[J].World J Biol Chem,2012,3(1):1.
【责任编辑:黄玲】
Effect of Electro-acupuncture on Mammalian Target of Rapamycin Expression in Hypoxic-ischemic Encephalopathy Newborn Rats
XU Tao1,WANG Cuixia2,WANG Yibing1,LIU Wei3,ZHANG Hui4
(1.Qingdao Women and Children Hospital,Qingdao 266034 Shandong,China;2.The Eighth People's Hospital of Qingdao,Qingdao 266041 Shandong,China;3.Qingdao Central Hospital,Qingdao 266031 Shandong,China;4.Integrated Traditional Chinese and Western Medicine Center,Medical School of Qingdao University,Qingdao 266021 Shandong,China)
ObjectiveTo observe the intervention effect of electro-acupuncture(EA)on mammalian target of rapamycin(mTOR)expression in hypoxic-ischemic encephalopathy(HIE)newborn rats.Methods Seven-day-old SD rats were randomly assigned into 3 groups,namely sham-surgery group,HIE model group,and EA group. All of the groups were subdivided into 4 subgroups in terms of 4 time periods of 1,3,7 and 21 day(s). Hematoxylin-eosin staining was used for the observation of histological changes in the affected cerebral region. Expression levels of cerebral mTOR were detected with Western blotting method.Results The results of HE staining showed that EA group at experimental day 21 had clear organizational structure,ordered arrangement of neurons,relieved cellular swelling,well cell integrity with clear nucleolus and proliferative glial cells. Compared with the sham-surgery group,mTOR level of the model group was dramatically increased on the 1st,3rd,7th and 21st day(P<0.05),and the mTOR expression level of EA group was significantly higher than that in the model group at the above time points(P<0.05).Conclusion EA can promote mTOR expression in brain tissue and can protect the brain of newborn rats from HIE.
hypoxic-ischemic encephalopathy/acup-moxibustion therapy;mammalian target of rapamycin;cerebral cortex/pathology;disease models,animal;rats
R259;R746.2
A
1007-3213(2016)05-0669-05
10.13359/j.cnki.gzxbtcm.2016.05.013
2016-03-24
徐涛(1973-),女,副研究员,副主任医师,硕士研究生导师;E-mail:307040527@qq.com
王翠霞,女,主治医师;E-mail:qdcxw@163.com
国家自然科学基金资助项目(编号:81202761)

