转录因子TBX3在小鼠胚胎动脉囊及弓动脉发育过程中的表达*
许智慧杨艳萍王晶晶宋励师亮景雅
转录因子TBX3在小鼠胚胎动脉囊及弓动脉发育过程中的表达*
许智慧①杨艳萍①王晶晶①宋励①师亮①景雅①
目的:探讨在小鼠胚胎早期发育过程中转录因子TBX3(T-box transcription factor3)和动脉囊发育的关系。方法:对胚龄9~12 d(E9~E12)的小鼠胚胎心做连续石蜡切片,抗转录因子TBX3抗体、抗胰岛因子-1(ISL-1)抗体、抗α-平滑肌肌动蛋白(α-SMA)抗体对切片进行免疫组织化学染色。结果:胚龄9 d,TBX3阳性细胞在呼吸内胚层聚集。胚龄10 d,在动脉囊和第3对弓动脉连接处可见TBX3阳性细胞。胚龄11 d,在第4、6对弓动脉之间可以观察到TBX3细胞的阳性表达。胚龄12 d,TBX3阳性表达集中于咽前间充质。结论:传导系的阳性心肌前体细胞TBX3参与动脉囊及弓动脉的形态发生。
动脉囊; 转录因子TBX3; 胰岛素增强子结合蛋白; 免疫组化;小鼠
First-author's address:Shanxi Medical University,Taiyuan 030001,China
动脉囊先后共发出6对弓动脉,从动脉囊发出延伸至背主动脉[1]。6对弓动脉不同时出现,第1、2对弓动脉很早消失退化,第5对发育不全并退化,在小鼠胚胎时期笔者主要观察第3、4、6对弓动脉的形成。动脉囊位于流出道远端,流出道的形态发生与动脉囊的分隔紧密关联。T-box所含有的转录因子调控胚胎发育的多个方面,包括心脏的形态发生和模式,人类和小鼠缺失或者突变一定数量的T-box基因会导致先天性心脏缺陷,小鼠心脏TBX3的表达最先在心脏循环开始的流出道被发现[2-3]。其表达可以描述发育中的心脏传导系统、房室管心内膜垫和流出道间质,发育中的心脏转录因子TBX3主要表达在中枢传导系的心肌前体细胞[4-6]。TBX3表达缺失会导致心脏畸形,包括房室管细胞的过度增殖,心室不完全分隔,右心室双流出道和主动脉弓形成延迟[7]。TBX3基因敲除突变的小鼠除导致中枢传导系工作心肌异位表达、心室或心房形成异位节律点外,还会引起小鼠流出道出现严重畸形,包括主动脉弓和主肺动脉干的异常[8-9]。在以往的报道中多见第二生心区ISL-1阳性咽前间充质细胞和α-SMA阳性细胞对动脉囊的分隔[10-11]。对TBX3在第二生心区的时空表达虽有描述但与弓动脉的形成关系报道却较少。本实验用α-平滑肌肌动蛋白抗体(α-SMA)标记发育中心肌及平滑肌,用ISL-1抗体标记心肌前体细胞,TBX3抗体显示转录因子TBX3表达和动脉囊、弓动脉发育的关系。免疫组织化学方法观察3种蛋白质在E9~12小鼠胚胎第二生心区的时空表达特征,以探讨其在动脉囊发育过程中的可能作用,为先天性弓动脉发育畸形提供实验依据。
1 材料与方法
1.1材料 取足3月龄健康雌性昆明鼠30只,体重22~28 g,在明暗相间12 h条件下饲喂,动情期与同种雄鼠于19∶00 合笼,次早晨发现阴栓者为妊娠0.5 d。乙醚麻醉处理妊娠小鼠收集胚胎,胚龄9 d(E9)胚胎带子宫固定,其余胚胎子宫内剥离出后固定。标本固定脱水详见文献[12],石蜡包埋。各胚龄胚胎分别取7只,行7 μm厚连续切片,每4片取1片做HE染色以便观察胚胎形态学特征,其余心脏切片用于免疫组织化学染色,多聚赖氨酸处理载玻片。
1.2方法 免疫组织化学染色PAP法染色,标本脱蜡水化后,3%过氧化氢、TENG-T(Tris 10 mmol/L,EDTA 5 mmol/L,NaCl 150 mmol/L,0.25% gelatin,0.05% Tween-20,pH 8.0)依次各处理40 min,以减低内源性过氧化物酶活性和非特异性背景染色。处理后的切片分别用小鼠抗α-SMA单克隆抗体(1∶800,武汉博士德生物工程有限公司),兔抗ISL-l多克隆抗体(1∶120,Abcam公司),山羊抗TBX3多克隆抗体(1∶150,Santa Cruz公司)室温下过夜孵育。根据所孵育一抗的不同,滴加相对应的二抗和三抗,时间均为2 h,兔过氧化物酶-抗过氧化物酶复合物孵育1.5 h;DAB显色,出现呈棕黄色的阳性结果时滴加蒸馏水终止。常规脱水、透明、中性树胶封片,抗体用PBS(pH 7.4)稀释。
2 结果
(1)胚龄9 d,呼吸内胚层ISL-1和TBX3细胞阳性表达并在此聚集,流出道呈管状,在流出道的远段ISL-1阳性细胞向近段延伸并逐渐表达α-SMA,见图1A~C。(2)胚龄10 d,流出道进一步增长,阳性α-SMA细胞延伸至心包腔的背侧壁与脏壁中胚层返折处,见图2C。咽内胚层中ISL-1阳性细胞数量增多,鳃弓核心间充质ISL-1阳性细胞增殖添加到动脉囊和第3对弓动脉连接处,见图2A)。咽两侧TBX3细胞呈现强阳性表达,在动脉囊和第3对弓动脉相交接处出现TBX3和ISL-1阳性细胞,见图2A、2B~2E。(3)胚龄11d,α-SMA由流出道延伸至整个动脉囊壁,见图3C。ISL-1阳性咽前间充质细胞围绕呼吸内胚层形成对称的特征性锥体形结构,经动脉囊背侧壁伸入动脉囊腔,形成主肺动脉隔原基(图3A),在该椎体结构有TBX3阳性细胞表达(图3B)[13]。随着第二生心区间充质细胞数目的增加,TBX3阳性细胞在咽前间充质中明显增多(图3E),ISL-1阳性细胞不断的增殖添加到锥体结构,锥体结构纵向延长(图3D),动脉囊腹侧壁向腔内横向突起,两者共同将动脉囊分隔,形成第4、6对弓动脉;在第4、6对弓动脉之间未见ISL-1阳性细胞(图3D),但可见明显的TBX3阳性细胞(图3E、3G)。(4)胚龄12 d,流出道缩短,动脉囊分隔为升主动脉及肺动脉干,流出道远端α-SMA表达止于大动脉根部见图4A~4C(da:背主动脉;ph:咽;as:动脉囊;o:流出道;3:第3对弓动脉;fg:前肠;4:第4对弓动脉;6:第6对弓动脉;d:流出道远段;a:升主动脉;pt:肺动脉干;aps:主肺动脉隔)。

图1 胚龄9 d心横切面注:1A示ISL-1阳性表达,1B示TBX3阳性表达,1C示α-SMA阳性表达,↑流出道远段α-SMA阳性表达,标尺示200 μm。
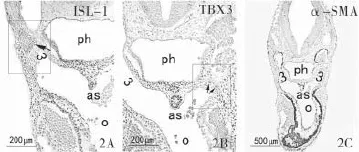

图2 胚龄10 d心横切面注:2A示ISL-1阳性表达,↑示动脉囊和第3对弓动脉连接处;2B示TBX3阳性表达,↑示动脉囊和第3对弓动脉连接处;2C示阳性α-SMA细胞延伸至心包腔的背侧壁与脏壁中胚层返折处;2D、2E分别是2A、2B的放大,2A、2B标尺示200μm,2C标尺示500μm,2D、2E标尺示100μm。
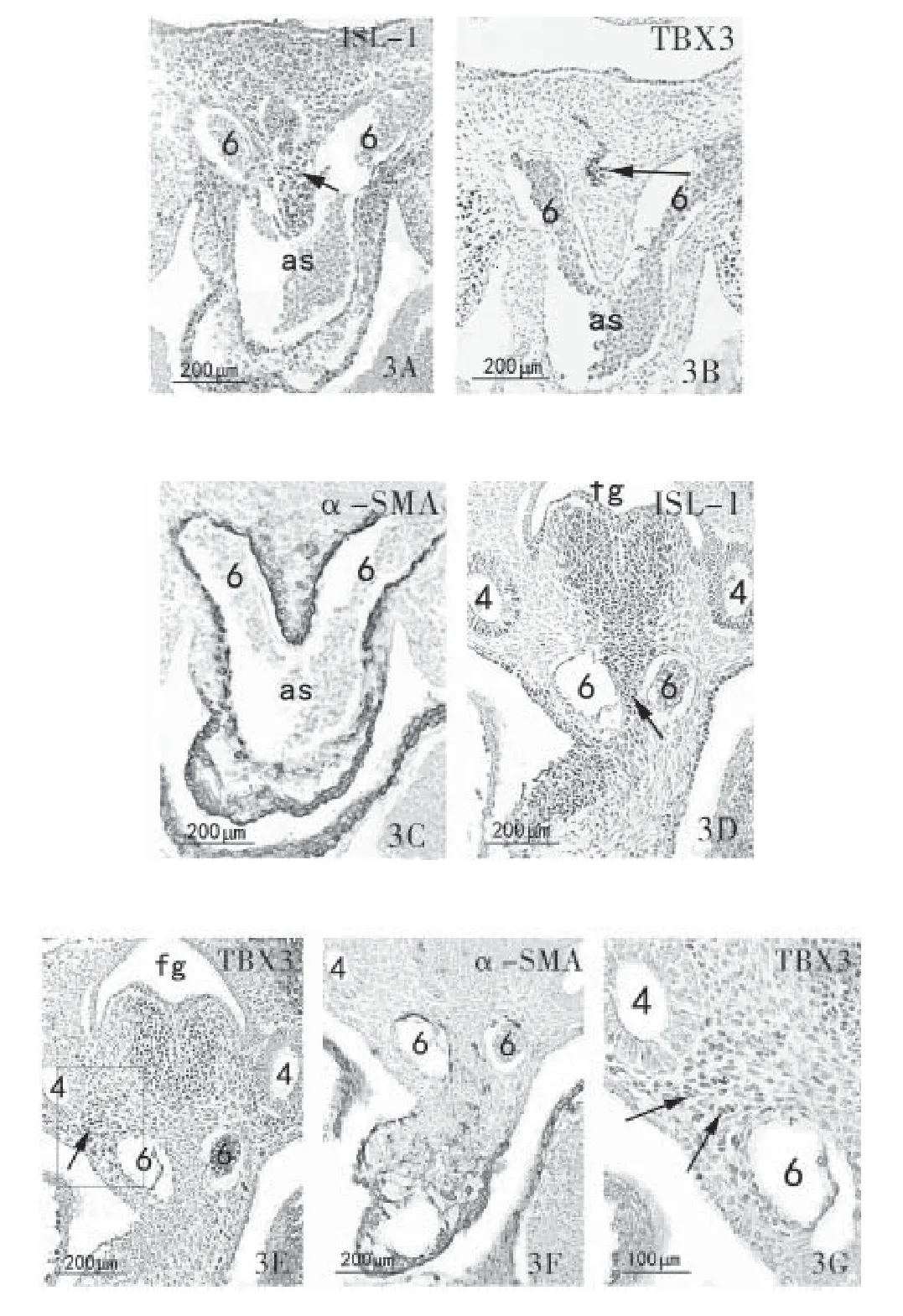
图3 胚龄11 d心横切面注:3A、3B分别示ISL-1、TBX3阳性表达,↑示ISL-1阳性咽前间充质细胞围绕呼吸内胚层形成对称的特征性锥体形结构;3C示α-SMA阳性表达;3D示ISL-1阳性表达,↑示主肺动脉隔;3E示TBX3阳性表达`,↑示第4、6弓动脉间;3G为E的放大,3A~F标尺示200μm;3G标尺示100μm

图4 胚龄12 d心横切面注:3A示ISL-1阳性表达,3B示TBX3阳性表达,3C示α-SMA阳性表达,标尺示500μm
3 讨论
22q11.2染色体缺失综合征(22q11.2DS),其特征为咽管和心脏发育异常;而在22q11.2DS经常观察到的是心血管畸形,其中最为常见的是流出道畸形,流出道的发育和分隔缺陷会造成圆锥动脉干和室间隔先天性心脏畸形[9]。编码基因的T-box转录因子与22q11.2DS密切相关,T-box家族成员TBX2 和TBX3是调节流出道发育和咽的发生所必须[14]。相关研究表明,TBX3基因突变在人类导致尺骨-乳腺综合征[15-16]。TBX3基因敲除的小鼠,会引起小鼠流出道出现严重畸形,包括主动脉弓和肺动脉干的异常[9]。流出道的远端与动脉囊相延续,在胚胎心脏早期流出道分隔开始于动脉囊。在咽前间质中表达的TBX3阳性细胞和心脏神经嵴细胞共同填充流出道并参与流出道的分隔[17]。呼吸内胚层向腹侧的延伸可对流出道正常分隔,以及诱导ISL-1阳性细胞正常迁移[18]。转录因子ISL-1是第二生心区心前体细胞良好的标记蛋白,ISL-1基因敲除小鼠胚胎心流出道、右心室及大部分心房组织缺失,胚胎死于10.5 d[19]。因此以ISL-1的迁移做参照,观察TBX3的表达可以进一步说明其对动脉囊的作用。
本实验观察到,胚龄9 d时TBX3的阳性表达主要集中在呼吸内胚层上,同时在该区域有ISL-1的阳性表达,笔者已知ISL-1和多种细胞信号及转录因子相互作用调控第二生心区的发育、增生和细胞特异性的保持[19-20]。并有数据表明,TBX3可能间接控制流出道发育,通过细胞间信号传导途径协调第二生心区的增殖和分布[9]。呼吸内胚层细胞的数目会随着胚胎心脏发育不断增殖并对流出道分隔,提示TBX3阳性细胞一定时间内在呼吸内胚层会与ISL-1阳性细胞同步表达。
胚龄10~11 d时,呼吸内胚层TBX3的阳性细胞数目增多,同时咽两侧鳃弓出现TBX3阳性细胞。鳃弓核心间充质细胞向动脉囊腔增殖,在动脉囊与第3对弓动脉的连接处可以观察到TBX3的阳性细胞。由于ISL-1阳性细胞在动脉囊腔构成的锥体结构向下延伸,动脉囊被进一步分隔;分隔后的动脉囊形成第4、6对弓动脉,两者之间可明显观察到有TBX3阳性细胞。研究报道用在动脉内皮细胞表达的等位基因Cx40-eGFP标记弓动脉连接处的TBX3-/-,在流出道与第3、4对弓动脉连接的地方可见其表达,胚胎中异常的弓动脉可以观察到TBX3的一个子集[9,21-22]。TBX3的缺失除会延迟弓动脉的形成,还会影响已知调节流出道伸长的其他信号传导途径,如:骨形态发生蛋白(BMP)信号促进第二生心区动脉极的发生和BMP4在流出道远端表达都被降低,从而进一步影响流出道的形态发生[9]。结果提示,除ISL-1间充质细胞对动脉囊的分隔外,TBX3也参与动脉囊及弓动脉的形态发生。
胚龄12 d时,升主动脉及肺动脉干壁内可见ISL-1阳性间充细胞,腔内可见α-SMA阳性表达,主肺动脉隔以及升主动脉和肺动脉干开始向平滑肌分化,由此笔者可知TBX3对动脉囊及弓动脉的影响主要在早期胚胎发育过程。结合上述的研究和本实验的结果,可为动脉囊及弓动脉的发生提供进一步的形态学依据。
[1] Gupta S K,Bamforth S D,Anderson R H.How frequent is the fifth arch artery[J].Cardiol Young,2015,25(4):628-646.
[2] Naiche L A,Harrelson Z,Kelly R G,et al.T-box genes in vertebrate development[J].Annu Rev Genet,2005,39(11):219-239.
[3] Hoogaars W M,Barnett P,Moorman A F,et al.T-box factors determine cardiac design[J].Cell Mol Life Sci,2007,64(6):646-660.
[4] Washkowitz A J, Gavrilov S,Begum S,et al.Diverse functional networks of Tbx3 in development and disease[J].Wiley Interdiscip Rev Syst Biol Med,2012,4(3):273-83.
[5] Hoogaars W M H,Tessari A,Moorman A F M,et al.The transcriptional repressor Tbx3 delineates the developing central conduction system of the heart[J].Cardiovasc Res,2004,62(3):489-499.
[6]石锐,景雅,师亮,等.核纤层蛋白、转录因子、缝隙连接蛋白表达与小鼠胚胎心发育[J].解剖学报,2015,16(2):238-243.
[7] Gavrilov S,Harvey R P,Papaioannou V E.Lack of genetic interaction between Tbx20 and Tbx3 in early mouse heart development[J].PLoS One,2013,8(7):e70 149.
[8] Bakker M L,Bouken B J,Mommersteeg M T.Transcription factor Tbx3 is required for the specification of the atrioventricular conduction systein[J].Circ Res,2008,102(11):1340-1349.
[9] Mesbah K,Harrelson Z,Thé veniau-Ruissy M,et al.Tbx3 is required for outflow tract development[J].Circ Res,2008,103 (7):743-750.
[10]李慧超,景雅,师亮,等.小鼠胚胎呼吸内胚层形态发生与咽前间充质发育及流出道分隔的关系[J].解剖学报,2013,44(6):804-812.
[11]杨艳萍,赵瑞庆,李海荣,等.小鼠胚胎心脏流出道嵴的发育[J].解剖学报,2010,41(1):80-86.
[12]冯先玲,景雅,李海荣,等.转录因子、表达与小鼠胚胎心的早期发育[J].解剖学杂志,2010,33(5):577-594
[13] Liang S,Ya J,Li H C,et al.Pulmonary endoderm,second heart field and the morphogenesis of distal outflow tract in mouse embryonic heart[J].Growth Differ,2014,56(4):276-292.
[14] Mesbah K,Rana M S,Francou A,et al.Identification of a Tbx1/Tbx2/Tbx3 genetic pathway governing pharyngeal and arterial pole morphogenesis[J].Human Molecular Genetics,2012,21(6):1217-1229.
[15] Bamshad M,Le T,Watkins W S.The spectrum of mutations in TBX3:genotypephenotype relationship in ulnar-mammary syndrome[J].Am J Hum Genet,1999,64(6):1550-1562.
[16] Meneghini V,Odent S,Platonova N,et al.Novel TBX3 mutation data in families with Ulnar-Mammary syndrome indicates a genotype-phenotype relationship: mutations that do not disrupt the T-domain are associated with less severe limb defects[J].Eur J Med Genet,2006,49(2):151-158.
[17] Bajolle F,Zaffran S,Kelly R G,et al.Rotation of the myocardial wall of the outflow tract is implicated in the normal positioning of the great arteries[J].Circ Res,2006,98(3):421-428.
[18] Ghatpande S,Ghatpande A,Zile M,et al.Anterior endodem is sumcient to rscue foregut apoptosis and heart tube morphogenesis in an embryo lacking retinoic acid[J].Dev Biol,2000,219(1):59-70.
[19] Cai C L,Liang X,Shi Y,et al.Isl1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart[J].Dev cell,2003,5 (6):877-889.
[20] Rochais F,Mesbah K,Kelly R G.Signaling pathways controlling second heart field development[J].Circ Res,2009,104(8):933-942.
[21] Miquerol L,Meysen S,Mangoni M,et al.Architectural and functional asymmetry of the His-Purkinje system of the murine heart[J].Cardiovasc Res,2004,63(1):77-86.
[22]石锐,景雅,师亮,等.核纤层蛋白A、转录因子TBX3、缝隙连接蛋白43表达与小鼠胚胎心发育[J].解剖学报,2015,46(2):238-243.
Expression of the Transcription Factor TBX3 during Development of Mouse Embryonic Aortic Sac and Arch Arteries
XU Zhi-hui,Y ANG Y an-ping,WANG J ing-jing,et al.
Medical Innovation of China,2016,13(19):014-017
Objective:To explore the relationship between transcription factor TBX3( T-box transcription factor3) and the development of aortic sac in the during early development mouse embryo.Method:Serial paraffin sections of mouse embryonic hearts form embryonic 9 days to 12 days(E9-E12) were stained with antibodies against T-box transcription factor3(TBX3),islet-1(ISL-1) and α-smooth muscle actin( α-SMA )by the immunohistochemical method.Result:At embryonic 9 days,TBX3 positive cells gathered in the pulmonary endoderm.At embryonic 10 days,we could observe that there TBX3 positive cells at the communication between aortic sac and third arch artery.At embryonic 11 days,communication between the fourth and sixth arch arteries observed TBX3 positive expression.At embryonic 12 days,TBX3 positive expression was mainly focused on pharyngeal mesenchymal.Conclusion:The cardiac conduction system of positive precursor cells TBX3 involved in aortic sac and arch arteries morphogenesis.
Aortic sac; Transcription factor TBX3; Islet-1; Immunohistochemistry; Mouse
10.3969/j.issn.1674-4985.2016.19.004
国家自然科学基金资助项目(3077114l,31200899)
①山西医科大学 山西 太原 030001
景雅
2016-04-29) (本文编辑:周亚杰)

