荧光光谱法测定3种黄酮类化合物与人血清白蛋白相互作用的机制研究Δ
兰 蕊,龚小保,黄利挂,陈 竹,曾 雪,张保顺#
(1.西南大学药学院,重庆 400715;2.重庆医药高等专科学校药学系,重庆 400030)
荧光光谱法测定3种黄酮类化合物与人血清白蛋白相互作用的机制研究Δ
兰蕊1*,龚小保1,黄利挂1,陈竹2,曾雪2,张保顺1#
(1.西南大学药学院,重庆400715;2.重庆医药高等专科学校药学系,重庆400030)
目的:研究黄酮类化合物与人血清白蛋白(HSA)相互作用的机制,比较化合物B环不同取代基(羟基、甲氧基)对大分子物质结合的影响。方法:采用荧光光谱法对槲皮素、橙皮素、甲基橙皮素3种B环取代基不同的黄酮类化合物与HSA相互作用的规律进行研究,测定并分析3种黄酮类化合物与HSA发生荧光猝灭的类型,计算相应的结合常数、结合位点及热力学参数等。结果:随着温度的升高,猝灭常数(Ksv)均呈规律性下降,结合常数(KA)相应降低,结合位点数(n)近似等于1,热力学参数ΔH<0、ΔS>0,B环的取代基不同对大分子物质结合有影响。结论:3种黄酮类化合物与HSA相互作用发生荧光猝灭的机制属于静态猝灭;结合位点数为1;3种化合物与HSA之间的作用力以静电力为主;羟基可能为黄酮类化合物与大分子物质相互作用的主要活性基团,甲氧基与HSA的结合力小于羟基。
黄酮;荧光猝灭;人血清白蛋白;机制
人血清白蛋白(HSA)是人体血液循环中最为丰富的蛋白质,约占血浆总蛋白含量的60%,是药物运输的重要载体[1-2]。近年来,生物大分子与药物之间的结合作用成为研究热点。人体血液中每个配体与血浆蛋白结合的过程,对药动学和药效学均可产生一定的影响,如减轻药物毒性、延长半衰期等。因此,研究血清白蛋白与药物间的作用关系,探讨不同基团对两者相互作用的影响[3],能更好地了解药物在体内的吸收和分布。
自然界存在的黄酮类化合物具有重要药理活性,其广泛分布于植物的根、茎、叶和果实中[4]。目前关于黄酮或类黄酮类化合物与HSA发生荧光猝灭的机制研究,以及金属离子对药物与蛋白质亲和力的影响有较多报道,如徐倩等[5]采用荧光法和分子对接的方法研究黄酮类相互作用机制;兰玲等[6]利用荧光光谱法,发现大豆素和葛根素与HSA相互作用均发生荧光猝灭,且为静态猝灭过程,葛根素与HSA结合力强于大黄素。而针对多羟基黄酮类化合物中B环上的不同基团与HSA作用后所引起荧光猝灭的差异却少有报道。本研究通过荧光光谱法,在模拟人体pH条件下(pH 7.4),定性地研究槲皮素、橙皮素和甲基橙皮素3种黄酮类化合物对HSA的荧光猝灭反应,根据3种化合物B环上3′、4′位取代基的不同,初步探究含羟基(-OH)的槲皮素、含1个甲氧基(-OCH3)的橙皮素、含2个-OCH3的甲基橙皮素与HSA相互作用的影响。通过计算判断其猝灭类型、结合常数以及结合位点,从而更好地了解药物与HSA分子间的相互作用机制。槲皮素、橙皮素、甲基橙皮素分子结构详见图1。
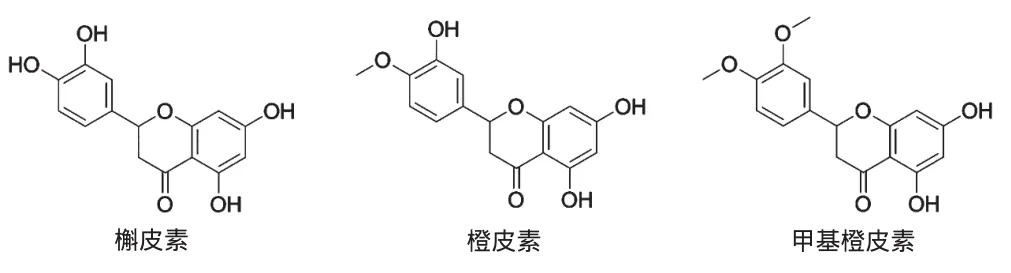
图1 槲皮素、橙皮素、甲基橙皮素分子结构Fig 1 Molecular structure of quercetin,hesperetin and methyl hesperetin
1 材料
1.1仪器
F-4500荧光分光光度计(日本日立公司);AL-104电子分析天平(美国梅特勒-托利多仪器有限公司);HH-1恒温水浴锅(金坛市万华实验仪器厂);FE28-Standard FiveEasy Plus型台式pH计(美国梅特勒-托利多仪器有限公司);UV-3150型紫外可见分光光度计(日本Jasco公司)。
1.2药品与试剂
HSA(同路生物制药有限公司,批号:20130946,纯度:>99%);槲皮素、橙皮素、甲基橙皮素(均为实验室自制,纯度:>99%);三羟甲基氨基甲烷(Tris,分析纯,北京鼎国昌盛生物技术有限责任公司,批号:BT350-500G);盐酸(HCl,分析纯,重庆川东化工有限公司);氯化钠(NaCl,分析纯,成都市科龙化工试剂);水为二次蒸馏水。
2 方法
2.1溶液的配制
2.1.1HSA溶液的配制量取适量HSA溶解于pH为7.4的Tris-HCl缓冲液(0.1 mol/L,含NaCl 0.1 mol/L以维持离子强度),混匀并定容,制成浓度为1.0×10-4mol/L的HSA溶液,低温保存,备用。
2.1.2黄酮类化合物溶液的配制称取槲皮素、橙皮素、甲基橙皮素适量,分别溶解于pH为7.4的Tris-HCl缓冲液(0.1 mol/ L,含NaCl 0.1 mol/L以维持离子强度),混匀并定容,制成浓度均为1.0×10-4mol/L的槲皮素、橙皮素、甲基橙皮素溶液,低温保存,备用。
2.2荧光发射光谱的测定
吸取“2.1.1”项下HSA溶液1 ml于10 ml量瓶中,分别加入0、1、2、4、6、8 ml槲皮素、橙皮素、甲基橙皮素溶液,用Tris-HCl缓冲液定容,分别于25、31、37℃下恒温水浴30 min,以280 nm波长为激发波长,340 nm波长为发射波长,激发狭缝和发射狭缝的宽度设为5 nm,在290~500 nm波长范围内测定样品的荧光发射光谱。分别记录25、31、37℃温度下的荧光强度(F),用于判断并比较3种黄酮类化合物与HSA发生荧光猝灭的类型,计算相应的结合常数、结合位点及热力学参数等。
3 结果与讨论
3.1槲皮素、橙皮素和甲基橙皮素对HSA荧光光谱的影响
按照“2.2”项下方法分别测定25、31、37℃下槲皮素、橙皮素和甲基橙皮素的荧光猝灭图谱,结果,3个温度下图谱相差不大,故选择便于操作的接近室温的25℃为恒温水浴温度,之后,测定不同浓度的槲皮素、橙皮素和甲基橙皮素在25℃温度条件下对HSA的荧光猝灭光谱,结果见图2。由图2可知,随着3种化合物浓度的增加,其相应的HSA荧光图谱中的特征峰均表现出降低趋势,说明HSA与3种化合物均发生相互作用导致规律性的荧光猝灭。其相应特征峰降低趋势存在一定差异:随着槲皮素浓度增大,荧光物质的荧光强度降低最显著;橙皮素次之;甲基橙皮素与HSA发生荧光猝灭后,其荧光物质的荧光强度降低趋势最小。由此推断,黄酮类化合物B环上3′、4′基团的不同可影响药物与蛋白质的结合(图中a→f代表黄酮类化合物的浓度依次为0、1×10-5、2×10-5、4×10-5、6×10-5、8×10-5mol/L)。

图23 种黄酮类化合物与HSA的荧光猝灭图谱A.槲皮素;B.橙皮素;C.甲基橙皮素Fig 2 The fluorescence quenching spectra of HSA by three kinds of flavonoidsA.quercetin;B.hesperetin;C.methyl hesperetin
3.2荧光猝灭类型
蛋白质等生物大分子荧光猝灭根据其机制不同可分为动态猝灭、静态猝灭和非辐射能量转移[7]。陈科力等[8]曾报道药物对大分子物质HSA的荧光猝灭机制主要分为激发态反应、能量转移、形成复合物以及碰撞导致的荧光猝灭。动态猝灭过程与扩散有关,在一定范围内,随着温度升高,扩散系数随之增大,从而使双分子猝灭常数Kq增大;静态猝灭则反之,温度升高将降低化合物-大分子物质形成的复合物稳定性,从而减小猝灭的程度。动态猝灭一般遵循Stern-Volmer方程[9]。

式(1)中,F0为无猝灭剂时荧光物质的荧光强度,F为加入猝灭剂时荧光物质的荧光强度,Ksv为动态猝灭常数(称为Stern-Volmer猝灭常数),[Q]为猝灭剂的浓度,Kq为由扩散过程控制的双分子动态猝灭速率常数,τ0为无猝灭剂时生物大分子的平均荧光寿命(约为10-8s[10])。
以[Q]为横坐标,以F0/F为纵坐标进行线性回归,可以得到Stern-Volmer曲线,斜率即为动态猝灭常数Ksv,详见图3。槲皮素、橙皮素和甲基橙皮素的Ksv和Kq见表1。理论上,猝灭剂对大分子物质的最大碰撞猝灭常数为2.00×1010L/(mol·s)。若化合物与HSA荧光猝灭属于动态猝灭类型,则应当符合Stern-Volmer方程,即Ksv随着温度升高而增大,而静态猝灭常数则减小,可由此判断荧光猝灭类型[11]。由图3可知,随着温度的升高,Ksv值均减小,且Kq远远超出扩散碰撞过程中的最大碰撞猝灭常数约3个数量级,说明上述3种化合物与HSA发生荧光猝灭均不符合动态猝灭规律,可能是化合物与HSA形成新复合物而发生的静态猝灭。
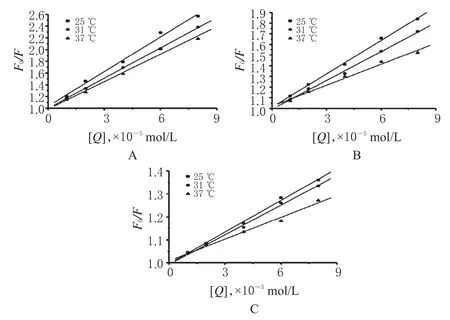
图3 不同温度下3种黄酮类化合物对HSA荧光猝灭的Stern-Volmer曲线A.槲皮素;B.橙皮素;C.甲基橙皮素Fig 3 Stern-Volmer curves of three kinds of flavonoids on HSAunder different temperaturesA.quercetin;B.hesperetin;C.methyl hesperetin
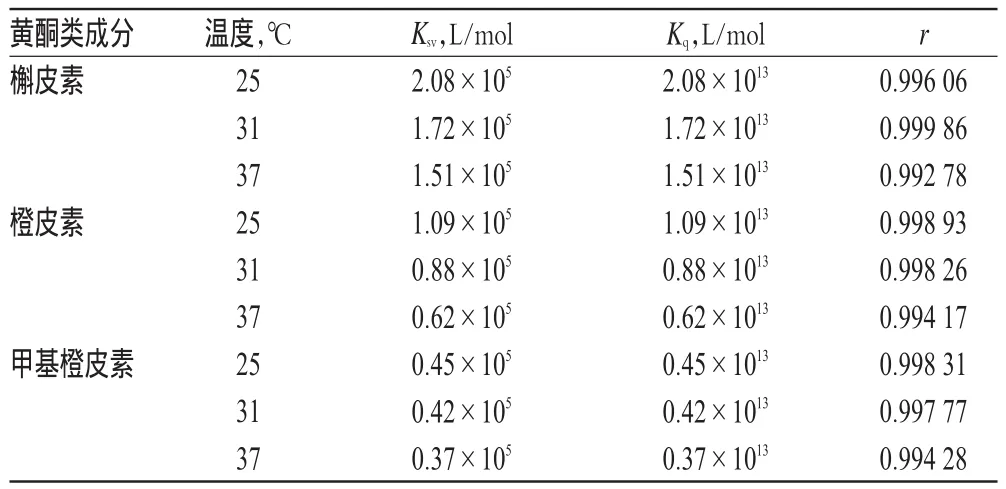
表1 不同温度下槲皮素、橙皮素、甲基橙皮素与HSA的猝灭常数Tab 1 Interaction constants of quercetin,hesperetin,methyl hesperetin to HSAunder different temperatures
3.3结合常数(KA)及结合位点数(n)的测定
静态猝灭中荧光体系的荧光强度(F)、KA、n及猝灭剂的浓度[Q]之间的关系可以用式(2)表示。
以lg(c[Q])为横坐标,以lg[(F0-F)/F]为纵坐标进行线性回归,结果见图4。不同温度下槲皮素、橙皮素和甲基橙皮素与HSA结合常数和结合位点数见表2。由表2可知,槲皮素、橙皮素和甲基橙皮素与HSA结合位点数均接近1,进一步证明了上述3种化合物对HSA的猝灭方式为静态猝灭;随着温度的升高,其结合常数KA相应地降低,说明温度对上述化合物与HSA形成的新复合物的稳定性有一定影响;同一温度下,3种化合物与HSA的结合常数KA存在一定差异,KA由大到小依次为:槲皮素>橙皮素>甲基橙皮素,说明B环上3′、4′位取代基对化合物与HSA结合有一定影响。随着B环3′、4′位羟基数目减少、甲氧基数目增加,结合力相应减弱,说明羟基可能是与大分子物质结合的活性基团,而甲氧基与蛋白质结合力小于羟
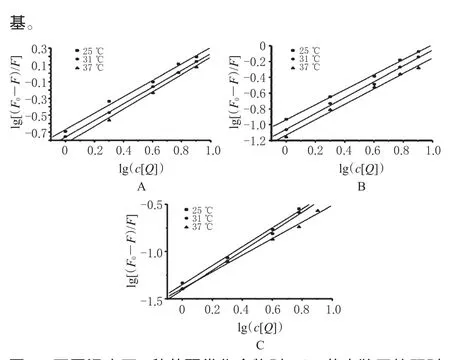
图4 不同温度下3种黄酮类化合物对HSA荧光猝灭的双对数曲线A.槲皮素;B.橙皮素;C.甲基橙皮素Fig 4 Double-log plots of three kinds of flavonoids quenching on HSAunder different temperaturesA.querceti;B.hesperetin;C.methyl hesperetin
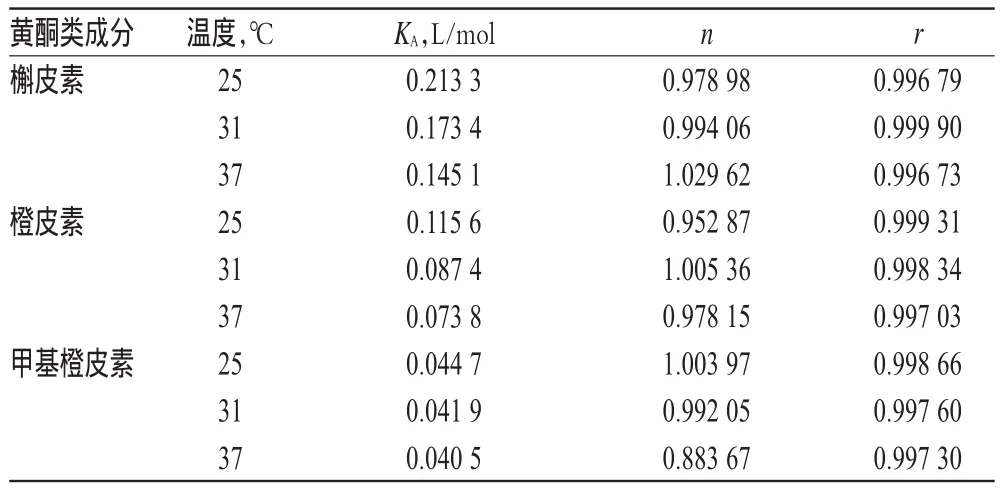
表2 不同温度下槲皮素、橙皮素、甲基橙皮素与HSA的结合常数及结合位点数Tab 2 The binding constant and binding sites of quercetin,hesperetin,methyl hesperetin with HSA under different temperatures
3.43种化合物与HSA结合的作用力及热力学参数
生物大分子与小分子之间的作用力包括范德华力、静电力、疏水相互作用力等。当温度变化不大时,反应焓变(ΔH)可认为是一个常数。根据反应前后的热力学参数焓变(ΔH)和熵变(ΔS)的相对大小,可以确定分子间的相互作用力类型[12]:当ΔH<0、ΔS<0时,分子间作用力为氢键和范德华力;当ΔH<0、ΔS>0时,分子间作用力为静电引力;ΔH>0、ΔS>0时,分子间作用力为疏水作用力[13]。热力学公式如式(3)、式(4)。

利用式(3)分别计算出不同温度(T)下3种化合物对HSA作用的焓变ΔH和熵变ΔS(式中K为KA,下同)。由式(4)计算吉布斯自由能ΔG,结果见表3。根据Ross PD等[14]总结出的判断生物大分子与小分子结合力性质和生物大分子自身结合力性质的热力学规律,推断出3种化合物与HSA之间的作用力均以静电力为主,但各自又存在一定差异,吉布斯自由能ΔG由大到小依次为甲基橙皮素>橙皮素>槲皮素;ΔH均小于0,说明反应是一个放热过程。
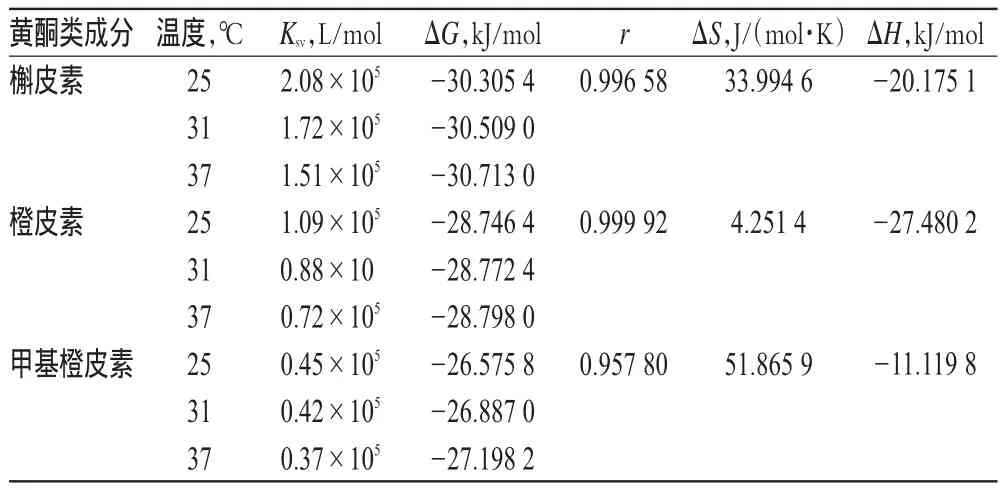
表3 槲皮素、橙皮素、甲基橙皮素与HSA作用的热力学参数Tab 3 Thermodynamic parameters of the interaction of quercetin,hesperetin,methyl hesperetin with HSA
4 结论
通过荧光光谱试验结果得知,槲皮素、橙皮素、甲基橙皮素与HSA的荧光猝灭类型属于静态猝灭,结合位点数均为1,即药物分子与生物大分子形成1∶1的复合物;通过对3种化合物的热力学参数计算可知,ΔG<0,反应可自发进行,其与HSA相互作用类型以静电力为主。3种化合物B环上3′、4′位取代基对化合物与HSA结合力有一定影响,即同一温度下,随浓度升高,3种化合物各自对应的荧光图谱的特征峰降低趋势有明显差异:槲皮素F值降低最显著,橙皮素次之,甲基橙皮素F值降低趋势较小。同一温度时对应的Ksv由大到小依次为槲皮素>橙皮素>甲基橙皮素,其结合常数KA大小由大到小依次为槲皮素>橙皮素>甲基橙皮素;温度一定时,吉布斯自由能ΔG由大到小依次为甲基橙皮素>橙皮素>槲皮素。以上均说明羟基可能是与大分子物质结合的主要基团,而甲氧基与生物大分子结合能力比羟基弱,羟基的数目影响黄酮类化学物与人血清白蛋白相互作用的结合常数和结合位点。马康等[15]报道,3种黄酮类化合物(高良姜素、山萘酚、槲皮素)随B环上羟基数目增加,与牛血清蛋白(BSA)结合能力增强。本试验针对黄酮类化合物B环3′、4′位的基团不同,比较其与HSA结合的差异,进一步验证了羟基可能是与大分子物质结合的活性基团,同时推测甲氧基与大分子物质结合的能力弱于羟基,但是关于结合力强弱的原因有待进一步探讨。因此,可利用羟基比甲氧基结合能力强这一特点,为后续药物与大分子物质结合以及药物分子活性基团的修饰改性提供理论依据。
[1]Zhang G,Wang L,Pan J.Probing the binding of the flavonoid diosmetin to human serum albumin by multispectroscopic techniques[J].J Agric Food Chem,2012,60 (10):2 721.
[2]Vorum H,Honoré B.Influence of fatty acids on the binding of warfarin and phenprocoumon to human serum albumin with relation to anticoagulant therapy[J].J Pharm Pharmacol,1996,48(8):870.
[3] Ding F,Diao JX,Sun Y,et al.Bioevaluation of human serum albumin-hesperidin bioconjugate:insight into protein vector function and conformation[J].J Agric Food Chem,2012,60(29):7 218.
[4]谢孟峡,徐晓云,王英典,等.4,5,7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究[J].化学学报,2005,63(22):2 055
[5]徐倩,邓丹丹,曹志娟,等.荧光法和分子对接研究4种黄酮与血清白蛋白的相互作用[J].分析化学研究报告,2010,38(4):483.
[6]兰玲,袁婧威,赵成新,等.异黄酮分子与人血清白蛋白的相互作用[J].河北联合大学学报:自然科学版,2015,37 (4):45.
[7]Zhang J,Wang XJ,Yan YJ,et al.Comparative studies on the interaction of genistein,8-chlorogenistein,and 3′,8-dichlorogenistein with bovine serum albumin[J].J Agric Food Chem,2011,59(13):7 506.
[8]陈科力,赵平.采用荧光猝灭法研究穗花杉双黄酮与牛血清白蛋白的相互[J].中南民族大学学报:自然科学版,2015,34(3):45.
[9] Soares S,Mateus N,Freitas VD,et al.Interaction of different polyphenols with bovine serum albumin and human salivary α-amylase by fluorescence quenching[J].J Agric Food Chem,2007,55(16):6 726.
[10] Lakowicz JR,Weber G.Quenchig of proterin fluorescence by oxygen detection of structural fluctuations in proteins on the nanosecond time scale[J].Biochemistry,1973,12(21):4 171.
[11]马贵斌,高飞,任斌知,等.荧光法研究药物分子与人血清白蛋白的结合作用[J].化学学报,1995,53(12):1 193.
[12]张爱平,郝娟,黄茜,等.三种查尔酮类化合物与人血清白蛋白相互作用及其构效关系研究[J].分析科学学报,2013,29(1):73.
[13] Xu HL,Yao NN,Xu HR,et al.Characterization of the interaction between eupatorin and bovine serum albumin by spectroscopic and molecular modeling methods[J].Int J Mol Sci,2013,14(7):14 185.
[14]Ross PD,Subramanian S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3 096.
[15]马康,陈晓青,陈景文.荧光光谱法研究3种黄酮类化合物与BSA的相互作用[J].光谱实验室,2008,25(4):662.
(编辑:刘明伟)
Study on Interaction Mechanism between 3 Kinds of Flavonoids Compounds and Human Serum Albumin by Fluorescence Spectrometry
LAN Rui1,GONG Xiaobao1,HUANG Ligua1,CHEN Zhu2,ZENG Xue2,ZHANG Baoshun1
(1.School of Pharmacy,Southwest University,Chongqing 400715,China;2.Dept.of Pharmacy,Chongqing Medical and Pharmaceutical College,Chongqing 400030,China)
OBJECTIVE:To study the interaction mechanism between flavonoids and human serum albumin(HSA),and to compare the effects of different B-ring substitutions(hydroxyl,methoxyl group)of flavonoids on macromolecular receptor.METHODS:The interaction regularity between three flavonoids with different B-ring substitutions(quercetin,hesperetin,methyl hesperetin)and HSA was studied with fluorescence spectroscopy,the fluorescence quenching types between 3 flavonoids and HSA were determined and analyzed,and the velated binding constant,binding site and thermodynamic parameters were calculated.RESULTS:The quenching constants(Ksv)and binding constants(KA)were decreased with the increase of temperatures.The number of binding site(n)was approximately equal to one,and the thermodynamic parameters ΔH<0,ΔS>0,the binding interaction of these compounds with macromolecules was influenced because of the difference of the B-ring substituents.CONCLUSIONS:The quenching mechanism between three flavonoids and HSA was static quenching;the number of binding site was one;the interaction force of the three compounds with HSA was mainly static electricity,and hydroxyl group in the B-ring was likely the major active group and exerted stronger binding force than methoxyl group to connect with macromolecules.
Flavonoids;Fluorescence quenching;Human serum albumin;Mechanism
O0657.32
A
1001-0408(2016)22-3054-04
10.6039/j.issn.1001-0408.2016.22.10
重庆市基础与前沿研究计划项目(No.cstc2013jcyjA10070,cstc2014jcyjA10125);西南大学基本科研业务费专项资金项目(No.XDJK2013B040);重庆市教委科学技术研究项目(No. KJ132501);重庆市卫生局医学科研项目(No.2011-1-114)
*本科生。研究方向:药学专业。E-mail:424070743@qq.com
副教授,硕士生导师,博士。研究方向:天然活性物质的提取分离、结构修饰及药理活性研究。电话:023-68251225。E-mail:zbs360@swu.edu.cn
2016-05-06
2016-06-27)

