丹参酮ⅡA磺酸钠注射液对万古霉素致肾损伤模型大鼠的保护作用及其机制研究
席加喜,张华君,陈晓宇
(广西壮族自治区人民医院药学部,南宁 530021)
丹参酮ⅡA磺酸钠注射液对万古霉素致肾损伤模型大鼠的保护作用及其机制研究
席加喜*,张华君,陈晓宇#
(广西壮族自治区人民医院药学部,南宁530021)
目的:研究丹参酮ⅡA(TSⅡA)磺酸钠注射液对万古霉素(VAN)致肾损伤模型大鼠的保护作用及其机制。方法:将72只大鼠随机分为空白组、模型组、阳性对照组(氨磷汀,1 mg/kg)和TSⅡA磺酸钠注射液低、中、高剂量组(15、30、60 μg/kg),每组12只。除空白组外,其余各组大鼠均于尾iv VAN(200 mg/kg)复制肾损伤模型,造模成功后给药组大鼠每天ip相应药物1次,空白组和模型组大鼠ig生理盐水,连续10 d。测定大鼠尿中24 h蛋白量及N-乙酰-β-D氨基葡萄糖苷酶(NAG)、人肾损伤因子1(KIM-1)水平,测定血清中胱抑素C(Cys C)、肌酐(Scr)、尿素氮(BUN)和肾组织匀浆中超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮(NO)水平,并观察肾组织的病理变化。结果:与空白组比较,模型组大鼠血清中Cys C、Scr、BUN水平,尿中24 h蛋白量和NAG、KIM-1水平以及肾组织中MDA、NO水平均明显升高,肾组织中SOD、GSH-Px水平明显降低(P<0.01);病理结果显示,模型组大鼠发生肾小管浊肿、刷状缘脱落,肾小管上皮细胞崩解、脱落等肾损伤病变。与模型组比较,各给药组大鼠血清中Cys C、Scr、BUN水平,尿中24 h蛋白量和NAG、KIM-1水平,以及肾组织中MDA、NO水平均明显降低,且肾组织中SOD、GSH-Px水平明显升高(P<0.05或P<0.01);肾脏的病理变化明显减轻。结论:TSⅡA磺酸钠注射液能有效改善VAN所致大鼠肾损伤,其机制可能与抑制大鼠体内的氧化反应有关。
万古霉素;肾损伤;丹参酮ⅡA磺酸钠注射液;氧化指标;保护作用;机制;大鼠
万古霉素(VAN)是一种糖肽类抗生素,对革兰阳性菌有强大的杀菌作用,是治疗耐甲氧西林金黄色葡萄球菌(MRSA)所致严重感染的重要药物[1-2],也是常用的抗菌药物之一[3]。VAN通过肾脏排泄,具有明显的肾毒性。国外研究表明,VAN肾毒性发生率约为5%~25%[4]。目前,关于VAN致肾损伤的机制尚不清楚,但有研究认为其机制可能与氧化应激有关,VAN可能通过间接生成与炎症相关的氧自由基,致使细胞膜脂质过氧化、蛋白质变性及DNA损伤,从而导致肾细胞损伤[5]。目前临床多采取调整给药剂量和监测血药浓度的方法来减少VAN肾毒性[6-7],但患者个体差异较大,即便严格根据患者肌酐(Scr)清除率控制药物剂量和连续药物浓度监测也不能确保使每一位患者获益[8-10]。
丹参酮ⅡA(TSⅡA)磺酸钠注射液是由中药丹参中的有效成分制成的,具有抗炎抑菌、清除自由基、抗氧化、保肝及改善肝功能、抗癌、改善血循环等广泛的药理作用[11-12],故笔者研究了其对VAN致肾损伤大鼠肾功能指标及其氧化指标的影响,探讨其对VAN致肾损伤模型大鼠的保护作用及其机制,为TsⅡA磺酸钠注射液的应用提供实验参考。
1 材料
1.1仪器
CX41-RFL型荧光显微镜(日本Olympus公司);30328型石蜡切片机(德国Leica公司);CF16RXⅡ型高速冷冻离心机(日本Hitachi公司);721型分光光度计(上海分析仪器总厂)。
1.2药品与试剂
TSⅡA磺酸钠注射液(上海第一生化药业有限公司,批号:1503022,规格:10 mg/5 ml);注射用氨磷汀(大连美罗大药厂,批号:53110301,规格:每支0.4 g);注射用VAN(礼来苏州制药有限公司,批号:C467438,规格:每支500 mg);丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、一氧化氮(NO)、Scr、尿素氮(BUN)、N-乙酰-β-D氨基葡萄糖苷酶(NAG)测定试剂盒以及总蛋白测定试剂盒[用于尿24 h蛋白量(Upro/24 h)测定](南京建成生物工程研究所,批号:20140117、20140109、20131202、20131231、2011231、20140118、20131225、20140208);大鼠半胱氨酸蛋白酶抑制剂胱抑素C (Cys C)酶联免疫吸附(ELISA)检测试剂盒(上海酶联生物科技有限公司,批号:ml003138);人肾损伤因子1(KIM-1)ELISA试剂盒(上海达为科生物科技有限公司,批号:201303)。
1.3动物
成年健康清洁级SD大鼠,72只,♂,体质量180~200 g,由广西医科大学实验动物中心提供[试验动物生产许可证号为SCXK(桂)2003-0030]。大鼠饲养于温度为(23±1)℃、湿度为60%、明暗各12 h的清洁级动物实验室内,自由饮水、进食,实验前适应性喂养1周。
2 方法
2.1动物分组、造模与给药
将72只大鼠随机分为6组,即空白组、模型组、阳性对照组(氨磷汀,1 mg/kg)和TSⅡA磺酸钠注射液低、中、高剂量组(记为TSⅡA-L、TSⅡA-M、TSⅡA-H组,给药剂量分别为15、30、60µg/kg),每组12只。除空白组大鼠ip 0.9%氯化钠注射液外,其余各组大鼠ip VAN(200 mg/kg)复制肾损伤模型。并于造模同时ip相应药物,每天1次,连续10 d。阳性对照组氨磷汀剂量由人临床常规剂量按照体表面积法换算后而得,为临床用量的6.45倍;TSⅡA低、中、高剂量设置则结合TSⅡA磺酸钠注射液临床成人用量的范围和预实验结果,分别为成人剂量的3、6、12倍。
2.2尿液中KIM-1、Upro/24h、NAG水平测定
实验期间动物自由摄食、饮水,予正常饮食喂养。于给药的最后一天收集大鼠24 h尿液,分别测定尿中KIM-1、Upro/24 h、NAG水平。其中,KIM-1采用ELISA法测定;Upro/24 h采用考马斯亮蓝法测定;NAG采用对硝基酚比色法测定。实验操作按照相关试剂盒说明书进行。
2.3血清中Cys C、BUN、Scr水平测定
给药结束后1 d,各组大鼠ip 20%乌拉坦(4 ml/kg)麻醉,腹主动脉取血4 ml,以1 300×g离心10 min,取上清,检测血清中Cys C、BUN、Scr水平。其中,Cys C水平采用ELISA法测定;BUN水平采用二乙酰一肟法测定;Scr水平采用苦味酸法测定。各指标检测实验操作按照相关试剂盒说明书进行。
2.4肾组织病理观察
取血完成后处死大鼠,取出肾脏,沿冠状面切成两半。取一半肾组织用10%甲醛固定,石蜡包埋、切片(厚度为5µm),37℃烘干12 h,然后进行苏木精-伊红(HE)染色,观察肾组织病理形态变化。
2.5肾组织匀浆中SOD、GSH-Px、MDA、NO水平测定
取“2.4”项下剩余肾组织,加细胞裂解液匀浆,取上清液,测定肾组织上清液中SOD、GSH-Px、MDA、NO水平。其中,SOD活性采用黄嘌呤氧化法测定;GSH-Px活性采用分光光度法测定(测定412 nm波长处的光密度值);MDA含量采用硫代巴比妥酸(TBA)法测定;NO水平采用硝酸还原酶法测定。各指标检测操作按照相应试剂盒说明书进行。
2.6统计学方法
采用SPSS 16.0统计学软件对实验数据进行处理和分析。计量资料以±s表示,多组比较采用方差分析,组间两两比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1TSⅡA磺酸钠注射液对大鼠尿液中KIM-1、Upro/24 h、NAG水平的影响
与空白组比较,模型组大鼠尿液中KIM-1、Upro/24 h、NAG水平显著升高(P<0.01)。与模型组比较,除TSⅡA-L组大鼠KIM-1水平降低不显著外,其余各给药组大鼠上述指标均显著降低(P<0.05或P<0.01),且呈一定的剂量依赖性;但随着TSⅡA磺酸钠注射液剂量的增大,上述指标均未降至正常水平。各组大鼠尿液中KIM-1、Upro/24 h、NAG水平测定结果见表1。
表1 各组大鼠尿液中KIM-1、Upro/24 h、NAG水平测定结果(±s,n=12)Tab 1 Levels of KIM-1,Upro/24 h and NAG in urine of rats in each group(±s,n=12)
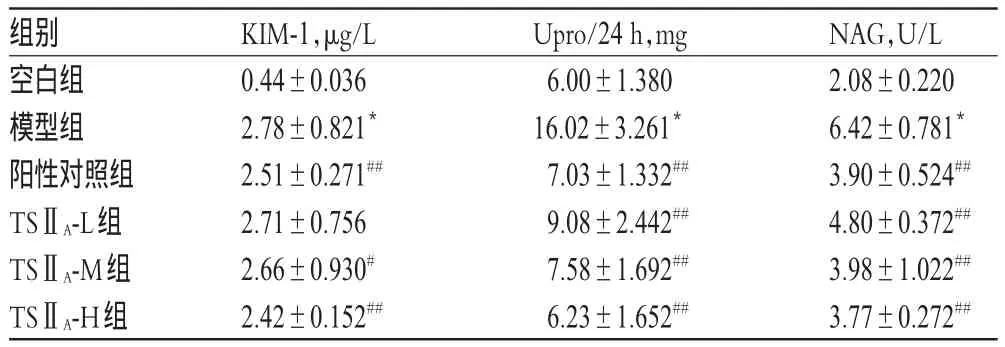
表1 各组大鼠尿液中KIM-1、Upro/24 h、NAG水平测定结果(±s,n=12)Tab 1 Levels of KIM-1,Upro/24 h and NAG in urine of rats in each group(±s,n=12)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank group,*P<0.01;vs.model group,#P<0.05,##P<0.01
NAG,U/L 2.08±0.220 6.42±0.781*3.90±0.524##4.80±0.372##3.98±1.022##3.77±0.272##组别空白组模型组阳性对照组TSⅡA-L组TSⅡA-M组TSⅡA-H组KIM-1,μg/L 0.44±0.036 2.78±0.821*2.51±0.271##2.71±0.756 2.66±0.930#2.42±0.152##Upro/24 h,mg 6.00±1.380 16.02±3.261*7.03±1.332##9.08±2.442##7.58±1.692##6.23±1.652##
3.2TSⅡA磺酸钠注射液对大鼠血清中Cys C、BUN、Scr水平的影响
与空白组比较,模型组大鼠血清中Cys C、BUN、Scr水平显著升高(P<0.01)。与模型组比较,除TSⅡA-L组大鼠血清中BUN水平降低不显著外,其余各组大鼠上述指标均显著降低(P<0.05或P<0.01),且呈一定的剂量依赖性;且随着TSⅡA磺酸钠注射液剂量的增大,上述指标可以降至正常水平。各组大鼠血清中Cys C、BUN、Scr水平测定结果见表2。
表2 各组大鼠血清中Cys C、BUN、Scr水平测定结果(±s,n=12)Tab 2 Levels of Cys C,BUN and Scr in serum of rats in each group(±s,n=12)
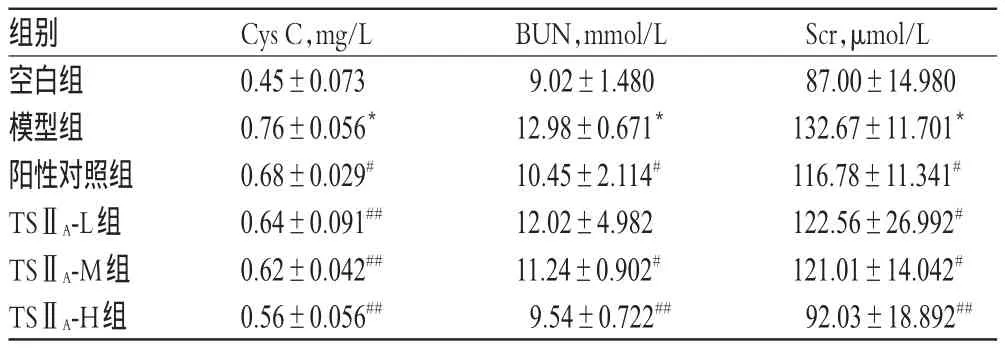
表2 各组大鼠血清中Cys C、BUN、Scr水平测定结果(±s,n=12)Tab 2 Levels of Cys C,BUN and Scr in serum of rats in each group(±s,n=12)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank group,*P<0.01;vs.model group,#P<0.05,##P<0.01
Scr,μmol/L 87.00±14.980 132.67±11.701*116.78±11.341#122.56±26.992#121.01±14.042#92.03±18.892##组别空白组模型组阳性对照组TSⅡA-L组TSⅡA-M组TSⅡA-H组Cys C,mg/L 0.45±0.073 0.76±0.056*0.68±0.029#0.64±0.091##0.62±0.042##0.56±0.056##BUN,mmol/L 9.02±1.480 12.98±0.671*10.45±2.114#12.02±4.982 11.24±0.902#9.54±0.722##
3.3TSⅡA磺酸钠注射液对大鼠肾组织匀浆中SOD、GSH-Px、MDA、NO水平的影响
与空白组比较,模型组大鼠肾组织匀浆中SOD、GSH-Px水平明显降低,MDA、NO水平明显升高(P<0.01)。与模型组比较,各给药组大鼠肾组织中SOD水平升高,MDA、NO水平降低;阳性对照组和TSⅡA-M、TSⅡA-H组大鼠肾组织中GSHPx水平升高(P<0.05或P<0.01),呈一定的剂量依赖性;且随着TSⅡA磺酸钠注射液剂量的增大,上述指标能降低或升高至正常水平。各组大鼠肾组织中SOD、GSH-Px、MDA、NO水平测定结果见表3。
表3 各组大鼠肾组织中SOD、GSH-Px、MDA、NO水平测定结果(±s,n=12)Tab 3 Levels of SOD,GSH-Px,MDA and NO in renal tissue of rats in each group(±s,n=12)
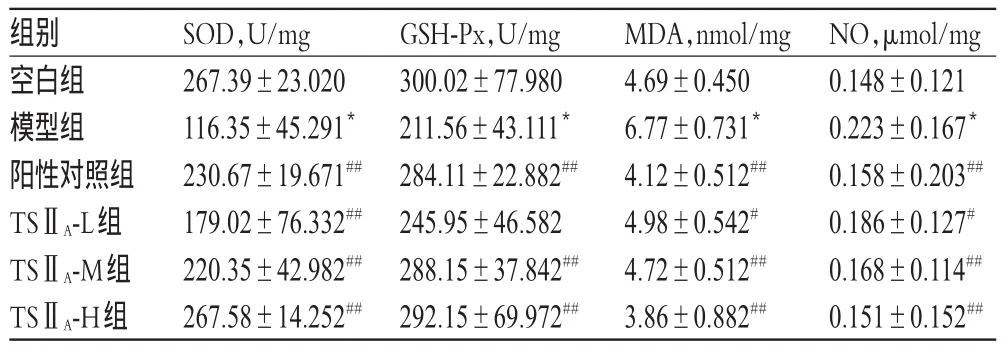
表3 各组大鼠肾组织中SOD、GSH-Px、MDA、NO水平测定结果(±s,n=12)Tab 3 Levels of SOD,GSH-Px,MDA and NO in renal tissue of rats in each group(±s,n=12)
注:与空白组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.blank group,*P<0.01;vs.model group,#P<0.05,##P<0.01
NO,μmol/mg 0.148±0.121 0.223±0.167*0.158±0.203##0.186±0.127#0.168±0.114##0.151±0.152##组别空白组模型组阳性对照组TSⅡA-L组TSⅡA-M组TSⅡA-H组SOD,U/mg 267.39±23.020 116.35±45.291*230.67±19.671##179.02±76.332##220.35±42.982##267.58±14.252##GSH-Px,U/mg 300.02±77.980 211.56±43.111*284.11±22.882##245.95±46.582 288.15±37.842##292.15±69.972##MDA,nmol/mg 4.69±0.450 6.77±0.731*4.12±0.512##4.98±0.542#4.72±0.512##3.86±0.882##
3.4TSⅡA磺酸钠注射液对大鼠肾组织形态的影响
HE染色结果显示,空白组大鼠肾小球和肾小管形态正常、结构清晰,无异常病理表现。模型组大鼠肾小管浊肿、刷状缘脱落,肾小管上皮细胞崩解、脱落及空泡变性,肾小管内偶见透明管型、基底膜裸露,肾小管基底膜增厚、萎缩或断裂,炎性细胞呈多灶性浸润,主要的炎性细胞浸润部位在血管、肾小管周围及部分肾小球周围。各给药组大鼠肾组织上述症状均呈不同程度减轻,并随着TSⅡA磺酸钠注射液剂量的增加,大鼠肾组织损伤程度减轻更明显。各组大鼠肾组织病理观察结果见图1。
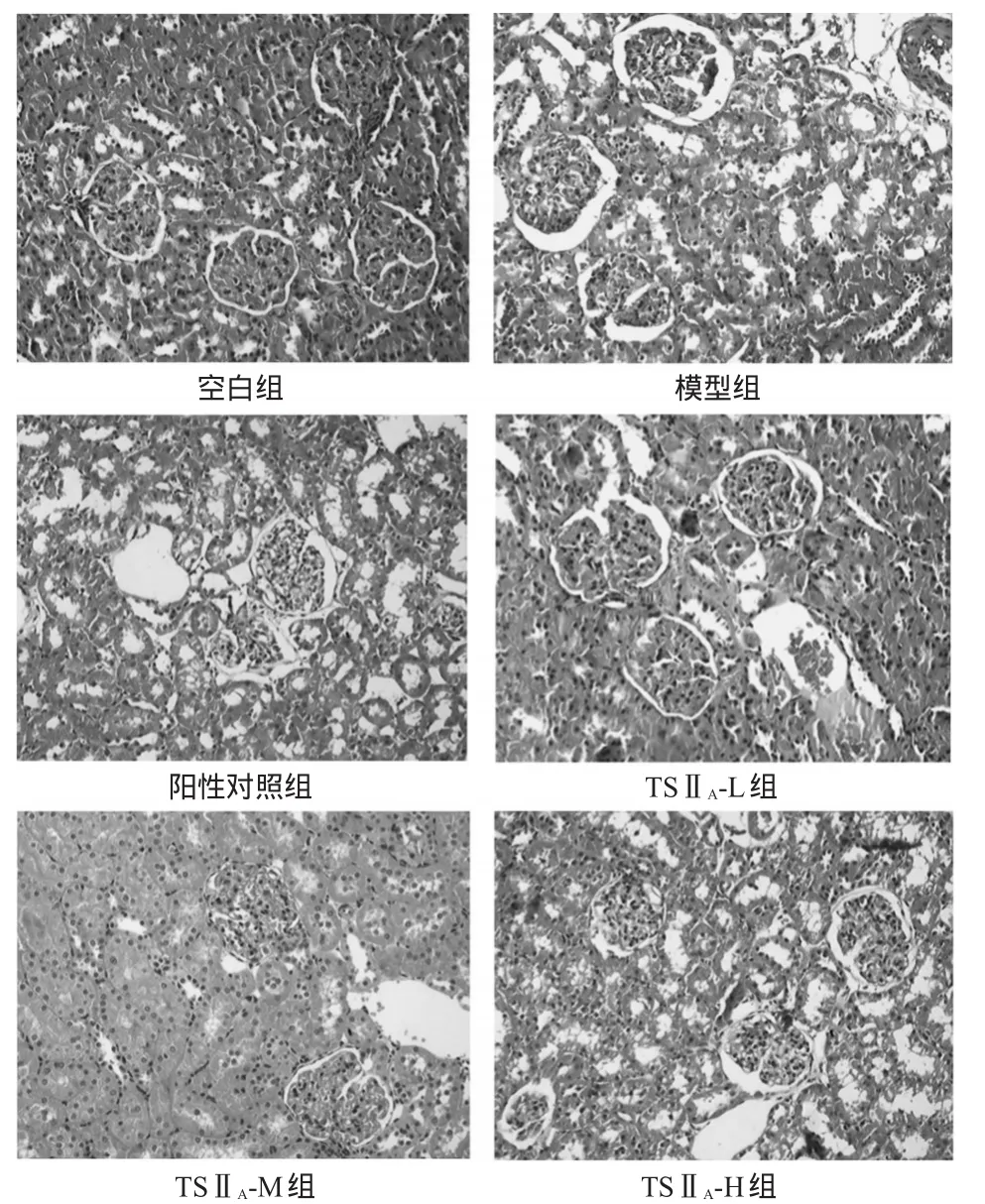
图1 各组大鼠肾组织病理观察结果(HE染色,×400)Fig 1 Pathological observation of renal tissue of rats(HE staining,×400)
4 讨论
研究发现,氧化性损伤可能是VAN引起肾功能损伤的主要原因,而氧化应激反应及在氧化过程中产生的多种代谢产物一方面直接损伤细胞核酸、蛋白质、黏多糖和脂类物质,另一方面通过多种途径激活细胞内凋亡信号转导通路,引起组织细胞凋亡,从而导致有功能的肾小管、肾小球和肾实质细胞损害和坏死,产生肾功能短时间内急剧衰退,表现为急性肾功能损害[13-14]。本研究以VAN致肾损伤的可能机制——氧化损伤为研究点,是目前前人对TSⅡA磺酸钠注射液研究中所欠缺的。同时目前临床上对VAN致肾损伤没有有效的防治药物。笔者在长期的临床观察实践中发现,当TSⅡA磺酸钠注射液与VAN联合使用时,发生肾功能损伤的病例明显减少。因此,本研究采用TSⅡA磺酸钠注射液为研究对象,一方面,观察了BUN、Scr、Cys C、Upro/24 h、NAG等反映肾功能的特异性、敏感性指标;另一方面,观察了SOD、GSH-Px、MAD、NO等氧化相关性指标。
氨磷汀为一种有机硫化磷酸化合物,其在组织中被与细胞膜结合的碱性磷酸酶水解脱磷酸后,成为具有活性的代谢产物WR-1065。氨磷汀化学结构式为H2N(-CH2)3-NH(-CH2)2-SH,因巯基具有清除组织中自由基的作用,这与TSⅡA磺酸钠注射液的抗氧化作用和VAN致肾损伤的机制均相关,故本实验选其作为阳性对照药。
本研究结果显示,与空白组比较,模型组大鼠肾组织中Scr、BUN、NAG和Cys C等反映肾功能的指标显著降低,这提示模型组大鼠产生了明显的药物性肾损伤;同时病理切片镜下可见明显的病理改变,以肾小管细胞结构改变和细胞凋亡等病变为主。给予TSⅡA磺酸钠注射液后,大鼠肾组织中Scr、BUN和Cys C等指标不同程度升高,这提示其对VAN所致肾损伤有一定的保护作用。模型组大鼠肾组织中氧化指标SOD、GSH-Px活性的升高和MAD、NO活性的降低提示VAN激活了模型组大鼠体内的氧化应激反应,从而导致氧化性指标异常;而TSⅡA磺酸钠注射液各剂量组大鼠氧化性指标均出现不同程度的改善,这提示TSⅡA磺酸钠注射液可能通过其抗氧化作用而保护VAN致肾损伤模型大鼠的肾功能。而氧化反应的抑制可减少大鼠体内活性氧的含量,从而减少活性氧对肾小管上皮细胞的损伤和凋亡。此外,文献研究显示,VAN在血药浓度达80~100 mg/L时易引发耳肾毒性[15]。本实验中VAN剂量设计为200 mg/L,考虑设计较高剂量以保证VAN肾毒性模型能成功建立。但是在实验过程中笔者观察到模型组大鼠与实验组大鼠的日常活动(包括摄食、饮水、精神状态、体质量、皮毛状况以及听力等)方面的差异并不明显,所以笔者认为还应进一步摸索最佳的VAN造模浓度,以获得更具有代表性的实验数据。
综上,TSⅡA磺酸钠注射液可显著改善VAN致肾损伤细胞的形态,保护肾小管上皮细胞的正常结构与形态,减少细胞凋亡;同时降低VAN肾损伤大鼠肾组织中BUN、Scr、Cys C水平,升高SOD、GSH-Px活性,降低MDA、NO含量。这提示TSⅡA磺酸钠注射液保护VAN肾损伤大鼠肾功能的作用机制可能与其抗氧化作用有关。
[1]王明强,张思森,刘小军,等.替考拉宁与万古霉素及利奈唑胺治疗MRSA感染患者的疗效评价[J].中华医院感染学杂志,2015,25(17):3 923.
[2]陈红,李小惠,李为民,等.万古霉素治疗耐甲氧西林金黄色葡萄球菌肺炎老年患者的疗效分析[J].中国感染与化疗杂志,2015,15(5):434.
[3]谢慧,姜顺军,陈文瑛,等.我院2013-2014年万古霉素临床应用分析[J].中国药房,2015,26(20):3 756.
[4]Iwamoto T,Kagawa Y,Kojima M.Clinical efficacy of therapeutic drug monitoring in patients receiving vancomycin[J].Biol Pharm Bull,2003,26(6):876.
[5]Nishino Y,Takemura S,Minamiyama Y,et al.Targeting superoxide dismutase to renal proximal tubule cells attenuates vancomycin-induced nephrotoxicity in rats[J].Free Radic Res,2003,37(4):373.
[6]门鹏,李慧博,翟所迪,等.万古霉素血药谷浓度与肾毒性相关性的验证:基于双变量模型的Meta分析[J].中国临床药理学杂志,2015,31(20):2 058.
[7]李刚,朱以翠,黎庆萍,等.万古霉素相关肾毒性的观察及血药浓度监测的意义[J].中国生化药物杂志,2015,35 (3):85.
[8]马莹,魏润新,钱南萍,等.我院万古霉素血药浓度监测与临床应用评价[J].中国药房,2015,26(5):622.
[9]梁晓宇,吴菊芳,杨敏婕,等.万古霉素治疗药物浓度监测队列研究[J].中国感染与化疗杂志,2015,15(5):472.
[10]罗万慰,朱春香,张海燕,等.某院85例万古霉素血药浓度监测结果分析及药学监护[J].中国医院药学杂志,2015,35(12):1 142.
[11]崔广智,金树梅,赵桂峰,等.丹参酮ⅡA对TNF诱导的ECV304细胞NF-B、IB-a表达及黏附分子ICAM-1、VCAM-1 mRNA表达的影响[J].中国药理学通报,2007,23(12):1 671.
[12]曹译心,张旭,张翠薇,等.丹参酮ⅡA对急性肾功能衰竭大鼠肾脏的保护作用[J].四川解剖学杂志,2011,19(2):10.
[13]刘杨,吴菊芳,萧正伦,等.1 031例患者应用去甲万古霉素不良反应观察[J].中华内科杂志,2004,43(11):815.
[14]张玉方,赵春景.丹参酮ⅡA及其钠盐的药理研究进展[J].中国药业,2008,17(1):1.
[15]黄义泽,毛名扬,袁孔贤.万古霉素血药浓度监测的临床应用[J].中国感染与化疗杂志,2011,11(4):295.
(编辑:林静)
Study on the Protective Effect of TanshinoneⅡASulfonate Injection on Vancomycin-induced Renal Injury Model Rats and Its Mechanism
XI Jiaxi,ZHANG Huajun,CHEN Xiaoyu
(Dept.of Pharmacy,Guangxi Zhuang Autonomous Region People's Hospital,Nanning 530021,China)
OBJECTIVE:To study the protective effect of tanshinoneⅡA(TSⅡA)sulfonate injection against vancomycin (VAN)-induced renal injury model rats and its mechanism.METHODS:72 rats were randomly divided into blank group,model group,positive control group(amifostine,1 mg/kg)and TSⅡAsulfonate injection low-dose,medium-dose and high-dose groups (15,30,60 μg/kg),with 12 rats in each group.Except for blank group,those groups were given VAN(200 mg/kg)intravenously via tail vein to induce renal injury rat model;after modeling,each drug group was given relevant medicine intraperitoneally once a day,and blank group and model group were given normal saline intragastrically for consecutive 10 days.The levels of 24 h protein,NAG and KIM-1 in urine were determined,and those of Cys C,Scr and BUN in serum and those of SOD,MDA,GSHPx and NO in renal homogenate were also determined;the pathological change of renal tissue was observed.RESULTS:Compared with blank group,the levels of Cys C,Scr and BUN in serum,those of 24 h protein,NAG and KIM-1 in urine and those of MDA and NO in renal tissue increased significantly in model group,while the levels of SOD and GSH-Px decreased significantly (P<0.01);the pathological slice indicated that model group suffered from renal injury such as kidney tubules albuminoid degeneration,brush border abscission,renal tubular epithelial cell disintegration and abscission.Compared with model group,the levels of Cys C,Scr and BUN in serum,those of 24 h protein,NAG and KIM-1 in urine and those of MDA and NO in renal tissue decreased significantly in treatment groups,while the levels of SOD and GSH-Px in renal tissue increased significantly(P<0.05 or P<0.01);pathological changes of renal tissue were relieved significantly.CONCLUSIONS:TSⅡAsulfonate injection can effectively relieve VAN-induced renal injury in rats,and its mechanism may be associated with inhibiting the oxidative reaction of rats in vivo.
Vancomycin;Renal injury;TanshinoneⅡAsulfonate injection;Oxidation index;Protective effect;Mechanism;Rat
R285
A
1001-0408(2016)22-3081-04
10.6039/j.issn.1001-0408.2016.22.17
*主管药师。研究方向:抗肿瘤药物的临床应用。电话:0771-2186165。E-mail:543908024@qq.com
副主任药师,博士。研究方向:抗感染药物的临床应用。电话:0771-2186165。E-mail:1534746296@qq.com
2015-11-26
2016-03-28)

