不同碳源对球等鞭金藻生长和细胞组成的影响
王星宇,黄旭雄,2,3
1.上海海洋大学农业部淡水水产种质资源重点实验室,上海2013062.上海市水产养殖工程技术研究中心,上海2013063.水产动物遗传育种中心上海市协同创新中心(ZF1206),上海201306
不同碳源对球等鞭金藻生长和细胞组成的影响
王星宇1,黄旭雄1,2,3
1.上海海洋大学农业部淡水水产种质资源重点实验室,上海201306
2.上海市水产养殖工程技术研究中心,上海201306
3.水产动物遗传育种中心上海市协同创新中心(ZF1206),上海201306
本文研究了批次培养模式下培养基中分别添加0.018mol/L不同碳源(NaHCO3,C6H12O6,CH3COONa和CH3CH2COONa)对球等鞭金藻(Isochrysisgalbana)生长、色素含量、蛋白质含量和脂肪酸组成的影响。结果表明:在盐度26,温度25℃,光照3000 lux条件下,f/2培养液中添加不同碳源对球等鞭金藻的生长和细胞组成有显著影响。不同碳源对球等鞭金藻促生长效果依次为:葡萄糖>碳酸氢钠>空白对照>丙酸钠>乙酸钠。培养液中添加各种碳源均不同程度上降低了球等鞭金藻细胞蛋白质含量。添加碳酸氢钠、乙酸钠和丙酸钠组藻叶绿素a和类胡萝卜素含量均显著降低,而添加葡萄糖组藻细胞中两种色素含量显著增加。添加碳源改变了球等鞭金藻细胞脂肪酸组成,单不饱和脂肪酸(MUFA)含量均显著增加,而多不饱和脂肪酸(PUFA)均显著降低。上述研究表明葡萄糖是促进球等鞭金藻生长的高效碳源,培养液中添加葡萄糖是球等鞭金藻高密度培养的有效策略。
球等鞭金藻;碳源;葡萄糖;细胞组成
球等鞭金藻(Isochrysisgalbana)由于个体小,无细胞壁,易消化,富含多糖,胡萝卜素及高能量的脂类物质,是世界各地水产养殖(特别是贝类养殖)中重要的饵料微藻[1]。金藻亦是生理活性物质的天然宝库,其中β-胡萝卜素和高不饱和脂肪酸具有抗衰老、抗胁迫及促进神经系统发育等功能。应用生物技术筛选、提取并生产藻类抗衰老等生物活性物质具有重要的潜在开发前景[2]。然而,与小球藻(Chlorella vulgaris)和螺旋藻(Spirulina platensis)相比,球等边金藻缺乏独特性的培养条件和强的抗污染能力,加之生长速度和培养密度也相对低,目前国内外对球等鞭金藻尚未有大规模工业化生产[3]。
微藻高密度培养是微藻产业化开发的前提,同时也是节约后续生产成本的重要手段[4]。微藻的营养方式一般主要以二氧化碳为碳源进行光合自养,充足的二氧化碳供应是保障微藻快速生长的必要条件[5]。王星宇[6]等发现在球等鞭金藻的培养液中添加1.5mg/m L的NaHCO3(碳浓度为0.018mol/L)也可以获得最佳的生长性能。前人对其他微藻的研究表明,念珠藻Nostoc flagelliforme[7]、杜氏盐藻Dunaliella salina[8]、莱茵衣藻Chlamydomonasreinhardii[9]、螺旋藻Spirulina platensis[10]等微藻同时具有利用有机碳源混合营养生长的能力,且在混合营养条件下具有更大的生长及细胞密度。然而,也有报道认为培养液中添加5mM和50mM有机碳(葡萄糖、果糖、乙酸钠和甘油)会抑制球等鞭金藻CCMM 5001的生长[11]。表明不同微藻对不同碳源的利用能力存在种类特异性。本研究探讨了f/2培养液中添加碳浓度为0.018mol/L的不同碳源对球等鞭金藻生长和细胞营养价值的影响,并探讨最佳碳源下藻细胞组成随培养时间的变化,以期为高效开发利用球等鞭金藻积累基础性数据。
1 材料与方法
1.1藻种来源
球等鞭金藻(Isochrysis galbana)来自于上海海洋大学微藻藻种室。藻种在温度25℃,光照强度3000 lux,盐度26的灭菌海水中采用采用f/2配方培养基[12]经行逐级扩大培养后用于试验。
1.2培养液中添加不同碳源对球等鞭金藻生长及细胞组成影响试验
以NaHCO3,C6H12O6,CH3COONa,CH3CH2COONa为碳源,碳浓度为0.018mol/L,设置个实验组,每组3个平行。
将扩大培养后的藻液接种于1000m L三角烧瓶中培养,初始密度3×105cell/m L,将三角烧瓶置于光照培养箱内培养(L:D=18:6),培养温度25℃,光照强度3000 lux,盐度26。培养周期10 d,定时摇瓶3次/d,培养期间每日定时取样计数藻细胞密度。藻细胞密度的测定采用XB-K-25血球计数板计数法,每个样品平行测定4次。
培养结束时,摇匀取30m L藻液经混合纤维素酯滤膜(孔径为0.45μm)过滤,置于烘箱中105℃烘干至恒重,得到细胞干重。另摇匀取1m L藻液加入1m L 2N NaOH,95℃水浴10m in,冷却至室温,加入1m L 1.6N HCl中和,离心后取上清,采用福林-酚试剂测定蛋白质含量[13]。取20m L藻液用于细胞叶绿素a和类胡萝卜素含量的测定。剩余藻液经离心后,冷冻干燥用于脂肪酸组成的测定。
叶绿素a的含量采用分光光度法测定[14]。取20m L藻液,10000 rpm离心5min去上清,再加等量蒸馏水重新悬浮后离心去上清;离心得到的藻泥在黑暗条件下,用超声波破碎仪在冰浴条件下破碎10min,加3m L纯甲醇45℃水浴黑暗静置35min,中间可振摇1次,依据浸提情况可适当延长浸提时间;再次离心取上清,用纯甲醇作参比,分别在750、665、652和480 nm处,使用1m光径的比色皿测定吸光值。其中,750 nm处的吸光值用以校正提取液的浑浊度,分别将665,652和480 nm处测定溶液的吸光度值减去750 nm下的吸光度值,得到校正后的A665、A652、A480。叶绿素a浓度的测定参考J.Ritchie[15]的计算公式;类胡萝卜素浓度的测定参考Strickland和Parsons[16]的计算公式:
[Chl-a]ug/m L=(-8.0962×A652+16.5169×A665)×提取液体积m L/藻液用量m L/比色皿光程cm
[Carotenoids]ug/m L=4×A480×提取液体积m L/藻液用量m L/比色皿光程cm
根据测定的浓度和单位体积内的藻细胞的生物量折算成色素含量(mg/g)。
1.3培养时间对球等鞭金藻生长及细胞组成影响试验
根据1.2试验结果,筛选出5组中球等鞭金藻生长密度最高组(C组-C6H12O6)为放大试验组,将扩大培养后的藻液接种于60 L柱状气升式光生物反应器(高1m,直径0.3m)中培养,初始接种密度3×106cell/m L。反应器中内置LED光源,光照强度2500 lux,连续光照,室温培养。培养周期10 d,培养期间每日定时取样计数藻细胞密度,隔天定期收获5 L藻液用于细胞蛋白和脂肪酸组成的测定。
1.4脂肪酸的测定
细胞脂肪酸组成的测定参照Griffiths[17]等的方法,移取一定量藻粉依次加入甲醇钠(NaOMe,0.5 mol/L)和BF3-甲醇溶液(14%)进行两步甲酯化,提取含有脂肪酸甲酯的正己烷-甲苯混合物,转移至进样瓶。然后采用气-质联用仪(Agilent 7890A/5975C)分析脂肪酸甲酯,毛细管柱为Supelco Omegawax320(30.0×0.32mm×0.25μm)。根据脂肪酸标准品(Sigma,美国)的分析图谱和保留时间对样品脂肪酸定性分析,利用峰面积归一化法计算各脂肪酸的相对百分含量[18],每组样品平行测量3次。
1.5数据统计与分析
实验结果以平均值±标准差(mean±SD)表示。数据采用SPSS11.0软件(SPSS Inc.,USA)进行单因子方差分析(One-Way ANOVA),并用Duncan氏检验进行多重比较,差异显著性水平为P<0.05。
2 结果与分析
2.1培养液中添加不同碳源对球等鞭金藻生长及细胞组成影响
培养液中添加不同碳源对球等鞭金藻生长的影响如图1所示。在培养前4 d,碳源的添加与否对球等鞭金藻细胞生长无显著影响(P>0.05)。培养到第5 d,不同碳源对藻细胞生长的影响开始显现,但组间差异不显著(P>0.05);之后,乙酸钠(D)组、丙酸钠(E)组和空白对照(A)组的细胞密度出现下降趋势,而葡萄糖(C)组和碳酸氢钠(B)组藻细胞则依然呈增长趋势。培养第9 d,C组藻细胞密度显著高于B、A、D和E组(P<0.05),且C和B组藻细胞密度分别达到最大值,其中C组最大密度为7.60×106cell/m L,B组最大密度为3.28×106cell/m L。培养第10 d,各组藻细胞密度均较前一日有所下降。

图1 培养液中添加不同碳源对球等鞭金藻生长的影响Fig.1Effectof different carbon resourceson grow th of them icroalgae Isochrysisgalbana
经过10 d培养,培养液中不同碳源对藻细胞色素含量有显著影响(P<0.05)(图2)。葡萄糖(C)组藻细胞叶绿素a含量显著高于对照(A)组(P<0.05),碳酸氢钠(B)组、乙酸钠(D)组和丙酸钠(E)组藻细胞叶绿素a含量显著低于对照(A)组(P<0.05),D组藻细胞叶绿素a含量显著低于其他组(P<0.05)。藻细胞中类胡萝卜素含量也呈现与叶绿素a类似的变化规律。

图2 培养液中添加不同碳源对球等鞭金藻细胞色素含量的影响Fig.2Effectsof different carbon resourceson pigment content in Isochrysisgalbana cells
经过10 d培养,培养液中添加不同碳源后藻细胞中蛋白质含量较对照组(A)显著降低(P<0.05)(图3)。在相同的碳源添加量下,藻细胞中蛋白质含量从高到低依次为葡萄糖(C)组>丙酸钠(E)组>碳酸氢钠(B)组>乙酸钠(D)组。乙酸钠(D)组藻细胞蛋白含量显著低于其他组(P<0.05),而葡萄糖(C)组和丙酸钠(E)组无显著差异(P>0.05)。

图3 培养液中添加不同碳源对球等鞭金藻蛋白质含量的影响Fig.3Effectsof different carbon resourceson protein content in Isochrysisgalbana
从各处理组球等鞭金藻细胞脂肪酸组成(表2)可知,球等鞭金藻细胞中主要的脂肪酸为18:1n9、16:0、18:4n3、14:0和22:6n3。培养液中添加不同碳源对藻细胞的脂肪酸有不同的影响。
与对照(A)组相比,添加碳酸氢钠(B)组藻细胞14:0、18:4n3和多不饱和脂肪酸(PUFA)含量显著降低(P<0.05);16:0、18:1n9、22:6n3和单不饱和脂肪酸(MUFA)含量显著增加(P<0.05);饱和脂肪酸(SFA)含量无显著变化(P>0.05)。
与对照(A)组相比,添加葡萄糖(C)组藻细胞14:0、18:4n3和PUFA含量显著降低(P<0.05);18:1n9、22:6n3和MUFA含量显著增加(P<0.05);SFA含量无显著变化(P>0.05)。
与对照(A)组相比,添加乙酸钠(D)组藻细胞14:0、18:4n3和PUFA含量显著降低(P<0.05);18:1n9、20:5n3和MUFA含量显著增加(P<0.05);22:6n3和SFA含量无显著变化(P>0.05)。
与对照(A)组相比,添加丙酸钠(E)组藻细胞14:0、18:4n3、SFA和PUFA含量显著降低(P<0.05);18:1n9、20:5n3和MUFA含量显著增加(P<0.05)。
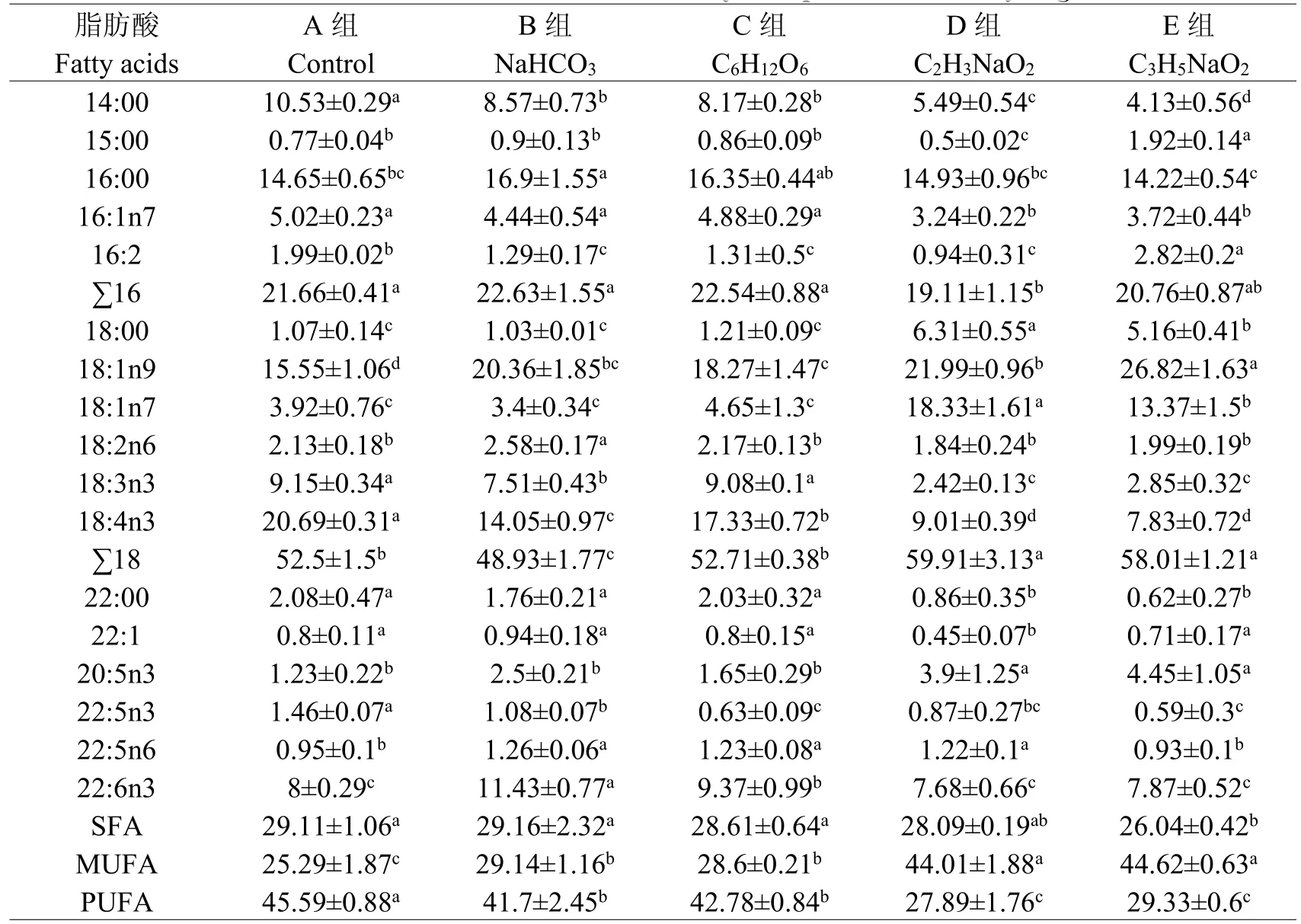
表2 培养液中添加不用碳源对球等鞭金藻细胞脂肪酸组成的影响Table2Effectsof different carbon resourceson fatty acid profiles in Isochrysisgalbana cells
2.2培养时间对添加碳浓度为0.018mol/L C6H12O6的球等鞭金藻生长和细胞组成的影响
图4所示为添加碳浓度为0.018mol/LC6H12O6条件下球等鞭金藻在60 L光生物反应器中的生长曲线。可知,1~9 d藻细胞密度随培养时间的增长而增加,在第9 d藻细胞密度达到最大值,为5.26×106cell/m L。之后细胞密度随培养时间的延长而逐渐降低。

图4 添加C6H12O6条件下球等鞭金藻在60 L光生物反应器中的生长曲线Fig.4 The grow th curve of Isochrysisgalbana supp lemented w ith C6H12O6in 60 L bioreactor
培养阶段对球等鞭金藻细胞蛋白质含量有显著影响(P<0.05)(图5)。藻细胞中蛋白质含量随着培养时间的延长呈现先升后降的变化。第7 d藻细胞蛋白质含量显著高于其他时间点(P<0.05)。

图5 培养时间对添加C6H12O6的球等鞭金藻细胞蛋白质含量的影响Fig.5Effectsof grow th phaseson protein content of Isochrysisgalbana supp lemented w ith C6H12O6
由不同培养阶段球等鞭金藻脂肪酸组成可知,在添加0.018mol/LC6H12O6条件下,随着培养天数的增加,18:1n9和18:2n6含量逐渐增加,14:0、16:0、18:3n-3、18:4n-3和22:6n3含量显著减少;20:5n3含量先增后减;SFA含量逐渐减少,MUFA含量逐渐增加,PUFA含量则显著减少(表3)。

表3 培养时间对添加C6H12O6的球等鞭金藻细胞脂肪酸组成的影响Table3Effectsof grow th phaseson fatty acid profiles in Isochrysisgalbana supp lemented w ith C6H12O6
3 讨论
混合营养(M ixotrophism)是指同时进行无机营养光合作用与有机营养的现象。通过混合营养培养可以大规模高密度生产微藻。已有学者研究了微藻的混合营养生长特点[19,20]。本研究中,培养液中添加碳浓度为0.018mol/L的不同碳源对球等鞭金藻的生长、色素含量、细胞蛋白质含量和脂肪酸组成有显著影响。研究发现球等鞭金藻3011的兼养生长对不同碳源具有选择性。
培养液中添加碳酸氢钠对球等鞭金藻的生长有显著影响,王星宇[6]等的研究中也得到了证实,类似的结果在White[21]等的研究中均有发现,添加1 g/L碳酸氢钠,可以提高四爿藻(Tetraselmis suecica)和微绿球藻(Nannochloropsissalina)培养的细胞密度。戴玉蓉[22]的研究发现,在绿色巴夫藻3012(Pavlova viridis)、等鞭金藻3011、等鞭金藻8701、亚心扁藻(Platymonassubcordiformis)和海水小球藻(Chlorella pacifica)中添加1 g/LNaHCO3对这5种单细胞藻类的生长均有明显的促进作用。研究表明,水体中的微藻只能吸收利用CO2和HCO3-[23]。二氧化碳可以自由扩散进入细胞,进而为微藻细胞的光合作用所利用;HCO3-既可以直接转运也可间接转运到细胞中为微藻细胞所利用[24]。然而,在正常海水中,因其pH呈碱性(约8.1左右),超过90%的可溶性无机碳是以HCO3-形式存在的。微藻对环境中的HCO3-利用存在两种机制[25,26]:一方面,微藻能够从外界环境中跨质膜运输HCO3-到胞液中,然后在胞液内通过胞内碳酸酐酶的作用将HCO3-分解成CO2供光合作用所需。另一方面,有些微藻分泌的细胞外的碳酸酐酶也可以将环境中的HCO3-催化成CO2,然后CO2跨膜被藻细胞利用。
对于具有混合营养功能的微藻而言,在培养基内添加有机碳,可促进微藻的生长和胞内物质的含量。本文中,培养液中添加葡萄糖对球等鞭金藻的生长有明显促进作用,使球等鞭金藻细胞密度增加了370%。培养液中添加葡萄糖对微藻生长的促进作用在其他微藻中也得到了证实。徐芳等[27]研究发现,当有机碳浓度为30mmol/L时,葡萄糖对微绿球藻(Nannochloropsis sp.)的生长有促进作用。王荣荣[9]等研究发现培养基中加入葡萄糖明显的促进了莱茵衣藻(Chlamydomona s reinhardtii)的生长,且葡萄糖作为能量物质和原料对细胞分裂的影响更大。马为民[28]等的研究表明绿色微囊藻(Microcystisviridis)在添加葡萄糖的混合营养条件下生长速率和生物量明显提高。田华[29]等在研究以葡萄糖为碳源对螺旋藻(Spirulina platensis)混合营养条件下培养时发现,葡萄糖浓度为3.0 g/L时,干重是对照的1.29倍。培养液中添加葡萄糖促进藻类生长的机理,有学者认为葡萄糖既作为细胞生长的能源,又作为细胞生长的碳源,甚至葡萄糖本身或葡萄糖的某一种间接代谢产物可能成为细胞生理的调节和刺激物质,因此外源葡萄糖对细胞的生理和代谢产生影响,使整个细胞处于比较活跃的生理状态[30]。混合营养条件下细胞葡萄糖激酶的活力明显高于光合自养条件下的葡萄糖激酶的活性,有机碳源被微藻细胞摄入后,将参与到细胞的代谢,有机碳源的利用会影响细胞初级代谢的流动状况,磷酸戊糖途径氧化性分支的反应过程明显加强,并随着培养的进行,有机碳源被细胞用作碳源的比例可能减小,而用作能源的比例有所增加,葡萄糖的氧化释放CO2弥补了气体碳源CO2供应的不足,并可能使细胞在碳源利用中所消耗的ATP和NADPH有所节省,最终导致光合反应速率增加、光饱和值升高、暗呼吸和光补偿点也显著提高,藻生物量浓度较光合自养有很大程度提高[29]。
本研究中,在培养液中添加碳浓度为0.018mol/L的乙酸钠或丙酸钠对球等鞭金藻的生长有抑制作用。徐芳等[27]研究微绿球藻(Nannochloropsis sp.)的兼养生长时发现,当有机碳浓度为30mmol/L,乙酸钠不能促进藻细胞的生长。有研究表明,乙酸钠对微藻生物量促进作用具有适宜的浓度范围,乙酸钠浓度过高会严重抑制藻细胞的生长[31,32]。鱼腥藻7120[33],微绿球藻Nannochloropsis sp.[34],莱茵衣藻Chlamydomonasreinhardtii[35]等微藻已证实不能利用乙酸钠。Chen等认为如果在养殖系统中加入具有强离子性的有机物(如乙酸钠),培养液中的离子浓度就会增加,这就会明显的抑制微藻的生长[36]。然而,龙元薷[37]等研究发现混合营养条件下0.5~1.5 g/L的乙酸钠对雨生红球藻(Haematococcus pluvialis)的生长有明显促进作用。刘晓娟等[38]研究发现乙酸钠浓度为100~400mmol/L时静置培养的三角褐指藻(Phaeodactylum tricornutum)的生物量较空白组显著提高。黄振华等[39]研究发现在培养液中添加0.5~10 g/L的乙酸钠对湛江等鞭金藻(Isochrysiszhanjiangensis)的生长均促进作用。刘茜[40]的研究发现丙酸钠对小球藻(Chlorella vulgaris)生长有促进作用。上述研究表明,培养液中添加乙酸钠或丙酸钠是否能促进微藻的生长,不但与其添加剂量有关,还与微藻种类特异性有关。
而在细胞色素方面,以NaHCO3,CH3COONa和CH3CH2COONa为碳源的实验组中,细胞色素含量均显著降低,但以C6H12O6为碳源,细胞色素含量却显著增加。可能原因是,在光反应阶段,培养液中加入NaHCO3不能增加球等鞭金藻捕获光的能力,但却加强了固定CO2形成葡萄糖的暗反应阶段,有机物的积累使得藻细胞密度增加。而在培养液中加入葡萄糖,藻细胞可以直接利用葡萄糖,同时既加强了光反应也加强了暗反应,体现在细胞密度的增长和叶绿素含量的增加。田华[41]等在研究葡萄糖对螺旋藻叶绿素含量的影响中发现,在混合营养培养中,由于添加葡萄糖,螺旋藻混合营养培养代谢活跃,葡萄糖的氧化利用为细胞提供部分电子流流向PSⅠ,叶绿素因PSⅠ加强,吸收较多光能,体现在色素积累量上即为混合营养分批培养中叶绿素较光合自养含量高。
以NaHCO3,C6H12O6,CH3COONa,CH3CH2COONa为碳源,藻细胞蛋白质含量都有不同程度的降低,单不饱和脂肪酸(MUFA)显著增加;而多不饱和脂肪酸(PUFA)显著降低。而孙俊楠[8]等在杜氏盐藻培养过程中发现蛋白质的累积量和培养液中葡萄糖的消耗量与培养液中藻体的浓度有一定关系,藻体浓度高,则蛋白质累积量也高.这也说明以葡萄糖为碳源的混合营养条件培养对微藻类的蛋白质积累具有种的特异性。藻细胞蛋白质含量降低的原因,推测与培养液中C/N比增大有关。培养液中高的C/N比在某种程度上意味着N的相对缺乏,而氮缺乏会抑制藻细胞合成蛋白质,转而将能量以脂类和碳水化合物的形式贮存在细胞中[42]。微藻对葡萄糖的分解利用是通过糖酵解和三羧酸循环途径进行的,三羧酸循环是在线粒体中完成的,是糖的彻底氧化脱羧过程。微藻对乙酸钠的利用途径主要是乙醛酸循环,与葡萄糖的三羧酸循环虽然存在着某些相同的酶类和热间产物,但乙醛酸循环是在乙醛酸体中进行的,是与脂肪转化为糖密切相关的生化过程[43]。
在柱状光生物反应器中加入0.018mol/LC6H12O6对球等鞭金藻的兼性培养试验中,藻细胞最大密度为5.26×106cell/m L,并未达到之前在锥形瓶内培养时的7.60×106cell/m L,故利用光反应器培养微藻存在一些限制因素:在微藻达到较高的细胞密度时,光强一定,由于藻细胞之间相互遮蔽,限制了光的穿透,单个藻细胞获得的光能减少,一定程度上降低了藻的生长速度和细胞密度的上限。随着培养天数的增加,细胞蛋白质含量增加,MUFA含量逐渐增加,SFA和PUFA含量显著减少。培养阶段影响藻细胞生化组成与培养液中营养盐的变化有关。由于藻类生长过程中不断吸收利用培养液中的营养盐,导致营养盐的缺乏有关。而营养盐缺乏,尤其是氮的缺乏,引起藻细胞生化组成变化的显著特点为细胞蛋白质含量降低,脂肪含量增加,饱和脂肪酸增加,多不饱和脂肪酸脂肪酸降低[42]。
综上所述,一次性培养模式下,培养液中添加碳浓度为0.018mol/L的NaHCO3和C6H12O6可以提升球等鞭金藻生长性能。添加NaHCO3可提高22:6n3含量和单不饱和脂肪酸(MUFA)含量,添加C6H12O6可提升细胞色素含量、22:6n3含量和单不饱和脂肪酸(MUFA)含量。
所以,培养液中添加C6H12O6有望对球等鞭金藻高密度培养,工业化生产及提取并生产藻类抗衰老生物活性物质(β-胡萝卜素)提供有效策略。
[1]吴电云,邹宁,常林,等.球等鞭金藻(Isochrysisgalbana Parke)的培养研究进展及应用前景[J].科技信息,2010(33):28-29
[2]康燕玉.基于培养条件优化提高海洋微藻β-胡萝卜素和不饱和脂肪酸含量的初步研究[D].厦门:厦门大学,2006
[3]孙颖颖.环境因子对球等鞭金藻生长的影响[D].大连:大连理工大学,2007
[4]Bumbak F,Cook S,Zachleder V,et al.Best practices in heterotrophic high-cell-density microalgal processes:achievements,potentialand possible limitations[J].ApplM icrobiol Biotechnol,2011,91(1):31-46
[5]梁英,麦康森,孙世春.NaHCO3浓度对等鞭藻3011,等鞭藻塔溪堤品系和绿色巴夫藻生长的影响[J].中国水产科学,2001,8(1):37-40
[6]王星宇,黄旭雄,杨碧莲.NaHCO3及培养时间对球等鞭金藻(Isochrysisgalbana)生长、蛋白质和脂肪酸组成的影响[J].山东农业大学学报:自然科学版,2016,47(3):345-352
[7]于海峰,贾士儒,董永胜,等.有机碳源对发状念珠藻单体细胞生长和光合作用的影响[J].高校化学工程学报,2008,22(2):277-281
[8]孙俊楠,张建安,杨明德,等.葡萄糖对杜氏藻生长特性影响的研究[J].可再生能源,2006,24(4):38-41
[9]王荣荣,阎光宇,王全喜,等.外源葡萄糖对莱茵衣藻生长和产氢的影响[J].植物研究,2010(3):355-359
[10]张义明,陈锋,郭祀远.光照度及葡萄糖浓度对螺旋藻生长的影响[J].华南理工大学学报:自然科学版,1996,24(2):141-145
[11]张帆.海洋富油微藻球等鞭金藻(Isochrysisgalbana)CCMM 5001的优化培养[D].青岛:中国海洋大学,2010
[12]成永旭.生物饵料培养学[M].北京:中国农业出版社,2005
[13]Low ry OH,Rosebrough NJ,FarrAL,etal.Proteinmeasurementw ith the Folin phenol reagent[J].Journalof Biological Chemistry,1951,193:265-275
[14]Pruvost J,Van Vooren G,Le Gouic B,etal.Systematic investigation of biomassand lipid productivity bym icroalgae in photobioreactors forbiodieselapplication[J].Bioresource Technology,2011,102(1):150-158
[15]Ritchie RJ.Consistent sets of spectrophotometric chlorophyll equations foracetone,methanol and ethanol solvents[J]. Photosynthesis Research,2006,89(1):27-41
[16]Strickland JDH,Parsons TR.A practical handbook of seawater analysis[M].Ottawa:Bulletin of Fisheries Research Board of Canada,1968:167
[17]GriffithsMJ,Van Hille RP,Harrison ST.Selection of direct transesterification as the preferredmethod for assay of fatty acid contentofmicroalgae[J].Lipids,2010,45(11):1053-1060
[18]Wei L,Huang X,Huang Z,et al.Orthogonal test design for optimization of lipid accumulation and lipid property in Nannochloropsis oculata for biodieselproduction[J].Bioresource technology,2013,147:534-538
[19]Laliberte G,De-la-Nouee.Auto-,hetero-,and m ixotrophic grow th of Chlamydomonas humicola(Chlorophceae)on acetate[J].Journalof Phycology,1993,29:612-620
[20]Lee YK,Ding SY,Hoe CH,et al.M ixotrophic grow th of chlorella sorokiniana in ourdoor enclosed photobioreactor[J]. Journalof Applied Phycology,1996,8:163-169
[21]White DA,Pagarette A,Rooks P,etal.The effectof sodium bicarbonate supplementation on grow th and biochemical composition ofmarinem icroalgae cultures[J].Journalof Applied Phycology,2013,25:153-165
[22]戴玉蓉,卢敬让.NaHCO3在单胞藻藻种培养中的作用[J].齐鲁渔业,1997,14(5):20-21
[23]Colman B,Huertas IE,Bhatti S,et al.The diversity of inorganic carbon acquisition mechanisms in eukaryotic microalgae[J].Functional PlantBiology,2002,29:261-270
[24]Axelsson L,Ryberg H,Beer S.Two modes of bicarbonate utilization in the marine green macrolga ulva lactuca[J]. Plant,Cell&Environment,1995,18:439-445
[25]Bozzo GG,Colman B,Matsuda Y.Active transport of CO2and bicarbonate is induced in response to external CO2concentration in the green alga Chlorella kessleri[J].Journalof Experimental Botany,2000,51:1341-1348
[26]Young E,Beardall J,Giordano M.Inorganic carbon acquisition by Dunaliella tertiolecta(Chlorophyta)involves external carbonic anhydrase and direct HCO3-utilization insensitive to the anion exchange inhibitor DIDS[J]. European Journalof Phycology,2001,36:81-88
[27]徐芳,胡晗华,丛威,等.有机碳源对产EPA微藻Nannochloropsis sp.生长及光合作用的影响[J].过程工程学报,2003,3(6):560-563
[28]马为民,钱志萍,孙莉,等.绿色微囊藻的混合营养生长[J].植物研究,2002,22(2):241-246
[29]田华,于斐,汪金萍.葡萄糖对螺旋藻生长的影响及机理分析[J].食品研究与开发,2012,33(7):161-163
[30]郭宝江,庞启深.螺旋藻多糖对植物细胞辐射遗传损伤的防护效应[J].植物学报,1992,34(10):809
[31]庄惠如,陈必链,王明兹,等.雨生红球藻混合营养与异养培养研究[J].微生物学通报,2000,27(3):198-201
[32]Jeon YC,Cho CW,Yun YS.Combined effects of light intensity and acetate concentration on the grow th of unicellular microalga Haematococcuspluvialis[J].EnzymeM icrob Technol,2006,39(3):490-495
[33]喻国策,丛威,蔡昭铃,等.有机碳化合物对鱼腥藻7120生长的影响[J].水生生物学报,2003,27(3):238-242
[34]Chen F,M ichael RJ.Heterotrophic grow th of Chlamydomonas reinhardtii on acetate in chemostat culture[J].Process Biochemistry,1996,31(6):601-604
[35]Xu F,Cong W,Cai ZL.Effects of organic carbon sources on cell grow th and eicosapentaenoic acid content of Nannochloropsis sp.[J].Journalof Applied Phycology,2004,16:499-503
[36]Chen F,JohnsMR.Substrate Inhibition of Chlamydomonas reinhardtii by Acetate in Heterotrophic Culture[J].Process Biochem,1994,29(4):245-252
[37]龙元薷,刘建国,张立涛.兼养对雨生红球藻细胞生长的促进作用及藻株差异性[J].海洋科学,2014,38(12):1-7
[38]刘晓娟,段舜山,李爱芬.有机碳源和氮源对三角褐指藻生长的影响[J].水生生物学报,2008,32(2):252-257
[39]黄振华,段舜山,张小兵,等.有机碳化合物对湛江等鞭金藻生长的影响[J].生态科学,2007,26(1):14-17
[40]刘茜.利用啤酒工业废水养殖小球藻的研究[D].南昌:南昌大学,2012
[41]田华,谢素霞,张义明.葡萄糖对螺旋藻叶绿素及藻胆蛋白含量的影响[J].中国酿造,2011(6):41-43
[42]Huang XX,Huang ZZ,Wen W,etal.Effects of nitrogen supplementation of the culturemedium on the grow th,total lipid content and fatty acid profiles of three m icroalgae(Tetraselmis subcordiformis,Nannochloropsis oculata and Pavlova viridis)[J].Journalof Applied Phycology,2013,25:129-137
[43]赫冬梅,王娜,孙凯峰,等.葡萄糖和乙酸钠对湛江等鞭金藻兼养生长的影响[J].生态科学,2012,31(2):126-129
Effect of Different Carbon Sources on Growth and Biochemical Composition of Isochrysis galbana
WANG Xing-yu1,HUANG Xu-xiong1,2,3
1.KeyLaboratoryofFreshwaterFisheryGermplasm ResourcesofMinistryofAgriculture/ShanghaiOceanUniversity,Shanghai201306,China
2.ShanghaiEngineeringResearchCenterofAquaculture,Shanghai201306,China
3.Collaborative InnovationCenterin Shanghai/AquaticAnimalGeneticBreedingCenter(ZF1206),Shanghai201306,China
This paper studied the effect of adding 0.018mol/L of NaHCO3,C6H12O6,CH3COONa and CH3CH2COONa into medium respectively on the grow th,cellular pigmentand protein contents and fatty acid profiles of them icroalgae Isochrysis galbana under a batch culturemodel.The results showed therewas a significant influence to add different carbon compounds into f/2 medium under temperature 25℃,light intensity 3000 lux,salinity 26.The grow th promoting effect of the carbon sourceswere as follows:glucose>NaHCO3>CH3CH2COONa>CH3COONa.The cellular protein contents inmicroalgae decreased when the carbon sources were supplemented in the medium.The treatments supplemented NaHCO3,CH3CH2COONa and CH3COONa displayed significant low Chlorophyll a and Carotenoids contents.The treatments supplemented glucose displayed significant low chlorophyll a and carotenoids contents.The fatty acid profiles of the microalgae also changed when different carbon sourceswere added into themedium.Themonounsaturated fatty acids content increased while polyunsaturated fatty acids content decreased significantly.It was therefore suggested that glucose was an effective carbon source for improving the grow th of themicroalgae and could beapplied in the production ofmicroalgae.
Isochrysisgalbana;carbon source;glucose;cellular profiles
Q949.2
A
1000-2324(2016)04-0506-08
2015-02-11
2015-03-23
上海市科技兴农项目(沪农科推字(2013)第2-1号);上海市科技兴农项目(沪农科攻字(2015)第1-2号);上海高校水产学一流学科建设项目资助
王星宇(1994-),男,本科生,研究方向为水产动物营养与生物饵料.E-mail:Robsten8@126.com
*通迅作者:Author for correspondence.E-mail:xxhuang@shou.edu.cn

