低温下冬小麦SOD及APX酶相关基因的表达分析
陈 露,李卓夫,王晓楠,付连双,孙莹璐
(东北农业大学农学院,黑龙江哈尔滨 150030)
低温下冬小麦SOD及APX酶相关基因的表达分析
陈 露,李卓夫,王晓楠,付连双,孙莹璐
(东北农业大学农学院,黑龙江哈尔滨 150030)
为进一步揭示寒地冬小麦抗寒的生理机制,以抗寒性差异较大的“东农冬麦1号”和“中国春”为材料,测定不同低温冷冻条件下小麦超氧化物歧化酶(SOD)相关基因 TSOD-1、 TSOD-2、 TSOD-3以及抗坏血酸过氧化物酶(APX)相关基因 HAPX-1、 HAPX-2、 HAPX-3的表达差异。结果表明, TSOD-1、 TSOD-2、 TSOD-3、 HAPX-2和 HAPX-3基因在特定低温条件下于东农冬麦1号中的表达量明显高于中国春,而 HAPX-1基因在东农冬麦1号中的表达量几乎均低于中国春。其中, TSOD-3基因在冻处理初期(低温驯化30 d及 -10 ℃ 2 h)于东农冬麦1号中的表达量相对于中国春达到最大,分别是中国春中的8.63和11.78倍; HAPX-2和 HAPX-3基因均在冷冻期(-12 ℃ 2 h)于东农冬麦1号中的表达量相对于中国春达到最大,分别是中国春中的3.12和21.22倍。因此,初步推断 TSOD-3、 HAPX-2和 HAPX-3基因是参与低温响应的重要基因。其中, TSOD-3基因在冷胁迫初期起主要作用, HAPX-2和 HAPX-3基因在持续冷冻下起主要作用。
小麦;低温;qRT-PCR;超氧化物歧化酶(SOD);抗坏血酸过氧化物酶(APX)
植物在遭受低温胁迫时会发生自由基的积累,细胞内活性氧产生和清除的平衡系统遭到破坏,造成植物细胞脂质过氧化,破坏了细胞结构,从而引起细胞膜的非正常代谢。为了应对一系列的变化,植物细胞存在复杂的抗过氧化酶保护系统,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)、单脱氢坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)等。当植物受到低温胁迫时,这些物质可以相互协同除去植物体内的自由基,保护自身正常代谢。在这些抗氧化酶系统中,SOD作为第一个参与反应的酶,处于活性氧清除反应的核心地位,可催化比其他活性氧毒性都大的超氧阴离子发生歧化反应,是植物体内活性氧的关键抗氧化酶[1]。SOD普遍存在于植物界并且具有多种类型,是一种含金属的抗氧化酶类。目前已知高等植物中有3类SOD酶,包括线粒体Mn-SOD、叶绿体Fe和Cu/Zn-SOD以及细胞质Cu/Zn-SOD。不同来源的Cu/Zn-SOD在氨基酸序列上具有较高的同源性,结构上有高度的同一性[2]。Gupta等[3]将豌豆Cu/Zn-SOD的cDNA转化到烟草植株中,当目的基因大量表达后提高了烟草植株对光抑制的抗性,而且光合速率比对照提高了20%;Samis等[4]将Mn-SOD导入紫花苜蓿中,基因大量表达后,提高了转基因植物的膜稳定性,增加了越冬成活率,同时提高了植物的生物量。APX是植物体内尤其是叶绿体中清除H2O2的关键酶[5]。Davletova等[6]的研究发现,在拟南芥中,如果缺乏细胞质APX时,会导致叶绿体和过氧化物酶体的H2O2清除系统瓦解,从而不能清除光合作用和光呼吸中产生的H2O2,导致H2O2含量升高,蛋白发生氧化,其中AtAPx1同工酶是拟南芥消除活性氧的重要成员。目前,APX序列已在菠菜、豌豆、拟南芥、西红柿、水稻和马铃薯等植物中分离获得[7-9]。转基因植物中APX的过量表达,已被证明可以提高转基因植物的抗性。Wang等[10]研究表明,将一个细胞质APX(cAPX)转入番茄中过量表达,转基因番茄的抗寒和抗盐能力得到了显著提高。此外,本课题组前期的研究表明,植物在遭遇低温及其他逆境胁迫时会造成体内代谢异常,这些异常代谢会引起体内抗氧化酶的活性变化及相关基因的活跃表达。冯玉磊[11]的研究表明,低温会影响冬小麦体内SOD、POD、CAT及APX含量及膜质过氧化程度。抗寒性好的品种SOD活性及APX含量均增加较快。同时,前期有关SOD及APX相关的生理试验结果表明,两种酶在抗寒性不同的品种中活性变化差异显著。但目前有关这两种酶相关基因表达分析方面的研究却甚少。鉴于此,本研究以抗寒性差异较大的“东农冬麦1号”和“中国春”为材料,测定不同低温冷冻条件下SOD相关基因 TSOD-1、 TSOD-2、 TSOD-3以及APX相关基因 HAPX-1、 HAPX-2、 HAPX-3的表达差异,旨在明确低温下起关键作用的抗氧化酶基因,为揭示寒地冬小麦的抗寒机理奠定基础。
1 材料与方法
1.1供试材料及其处理
供试材料为抗寒性差异显著的两个小麦品种“东农冬麦1号”(强抗寒性)和“中国春”,均由东北农业大学小麦遗传育种研究室保存。
选取两个参试品种饱满的种子,种植于长30 cm、宽25 cm、高10 cm的盆栽盒子中,每盆种植100粒,均匀分布,每个品种种10盆。置于自然条件下生长,待幼苗生长至三叶一心期时,将盆栽转移到光照培养箱中进行冷驯化处理(最大光照强度为2 000 lx,光周期10 ℃、12 h,暗周期4 ℃、12 h),冷驯化30 d后将盆栽转移至低温冰箱进行冷冻处理。具体处理见表1。CK为对照,A~G为7个不同处理。每个处理对应1个取样时期,每次取样量1~2盆(视材料长势),将泥土清洗干净后吸干水分,去除根部及叶片,留取分蘖节至茎部约2 cm处组织,于-80 ℃保存备用。
1.2RNA的提取与反转录
参照关 涛等[12]所用试剂及方法对不同处理样品进行总RNA提取及其RNA反转录。
1.3实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)分析
根据本课题组从抗寒性不同的两个冬小麦品种转录组测序的基因表达谱里选取的差异基因 TSOD-1(GeneBank:AF092524.1)、 TSOD-2(GeneBank:U69536.1)、 TSOD-3(GeneBank:JX398977.1)、 HAPX-1(GeneBank:AJ006358.1)、 HAPX-2(GeneBank:AF411228.1)和 HAPX-3(GeneBank:AF527606.1)序列,利用Primer 5软件设计qRT-PCR引物(表2),并交由华大基因NCBI北京公司合成。以1.2中得到的cDNA为模板,以GAPDH基因为内参,进行qRT-PCR分析。反应体系(20 μL):Real Master Mix 10 μL,RNase-free H2O 6.8 μL,引物(10 μmol·L-1)0.8 μL,DyeⅡ 0.4 μL,模板(0.5 μg·μL-1) 2 μL。反应条件:94 ℃预变性30 s;94 ℃变性5 s,50~60 ℃退火15 s(各对引物具体退火温度见表2),72 ℃延伸10 s,40个循环;65 ℃ 15 s生成溶解曲线;40 ℃冷却30 s。每个样品设3次重复。结果计算采用2-ΔΔCt法[12]。计算所得全部数据将处理CK矫正为1作为相对表达量,其他数据是它的相对倍数。
1.4数据分析
数据整理及图表的制作采用Excel 2007。
2 结果与分析
2.1不同处理下SOD相关基因的表达
2.1.1不同处理下 TSOD-1基因的表达
qRT-PCR分析结果(图1)表明,东农冬麦1号中 TSOD-1基因在处理F下上调表达最明显,为对照的6.69倍,其次是在处理C下,为对照的6.36倍,在处理 A、B下与对照差异不显著。中国春中 TSOD-1基因在F处理下也表现为明显上调,为对照的6.39倍,在处理B下呈现出下调表达,仅为对照的0.44倍。比较两小麦品种相对表达量,发现二者的表达量差异在B处理时较为明显。

表1 样品编号及处理

表2 本研究中qRT-PCR分析所用引物
2.1.2不同处理下 TSOD-2基因的表达
qRT-PCR分析结果(图2)表明,东农冬麦1号中 TSOD-2基因在处理A、C、D和F下上调表达明显,分别为对照的5.98、3.90、7.76和2.84倍。中国春中 TSOD-2基因均为上调表达,但在处理A、C、D、E和F下表达量上调较为明显,分别为对照的2.81、2.95、3.32、2.85和4.10倍。比较两小麦品种相对表达量,发现二者的表达量差异在处理A、D和E下较为明显,其中,在处理A和D下,东农冬麦1号表达量为中国春的2.13和2.34倍,在处理E下,东农冬麦1号表达量为中国春的0.46倍。
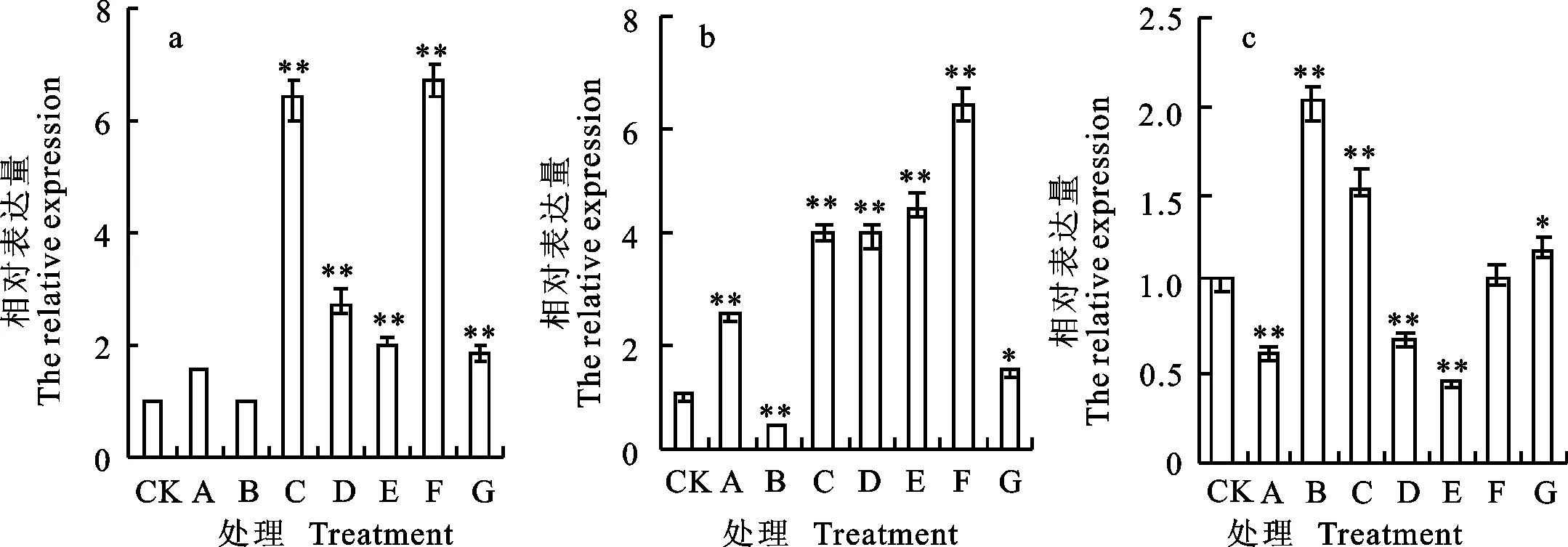
a:东农冬麦1号的相对表达量;b:中国春的相对表达量;c:东农冬麦1号相对于中国春的表达量;*和**分别表示在5%和1%水平下与CK差异显著。下同。
a:The relative expression of Dongnongdongmai 1;b:The relative expression of Chinese Spring;c:The relative expression of Dongnongdongmai 1 compared to Chinese Spring;* and ** indicated significant difference with CK at 5% and 1% significance level,respectively.The same as in following figures.
图1 TSOD-1基因在不同处理下的相对表达量
Fig.1Relative expression of TSOD-1 gene under various treatments detected by qRT-PCR
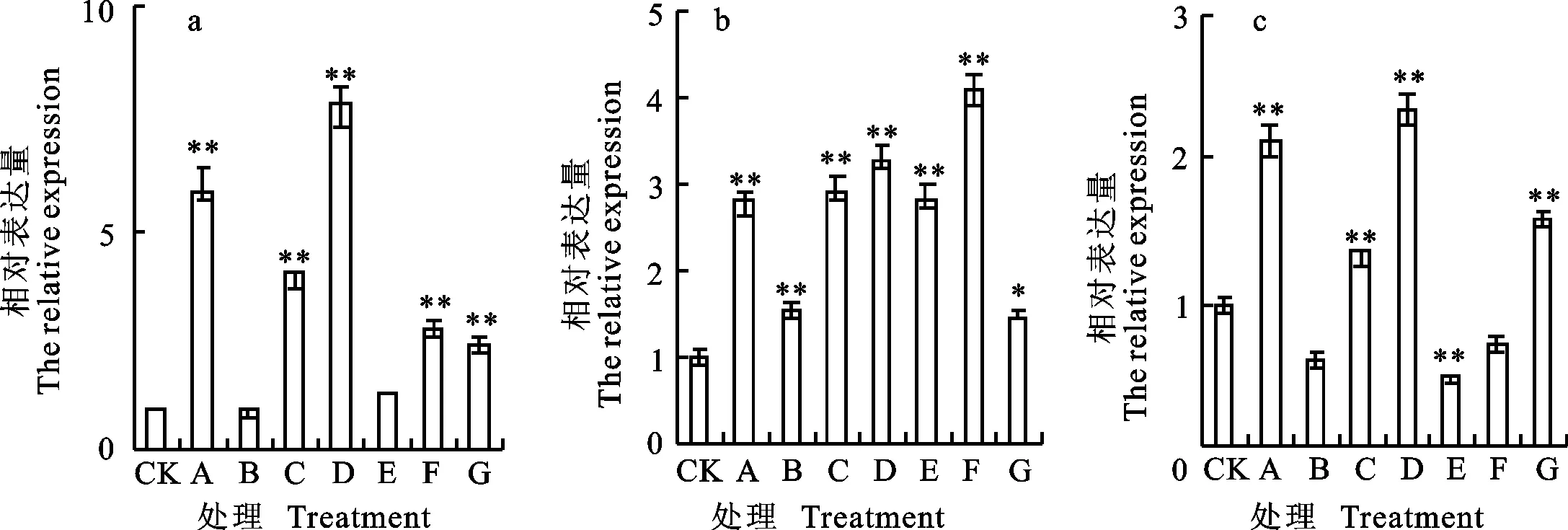
图2 TSOD-2基因在不同处理下的相对表达量
2.1.3不同处理下 TSOD-3基因的表达
qRT-PCR分析结果(图3)表明,东农冬麦1号中 TSOD-3基因在处理B、C下迅速大量上调表达,分别为对照的12.65和14.17倍。中国春中 TSOD-3基因在处理A、D和E下表达量分别为对照的6.48、6.14和4.18倍。比较两小麦品种相对表达量,发现二者的表达量差异在C处理下最大,东农冬麦1号表达量为中国春的11.78倍,在处理B下次之,为8.63倍。
2.2不同处理下APX相关基因的表达
2.2.1不同处理下 HAPX-1基因的表达
qRT-PCR分析结果(图4)表明,东农冬麦1号中 HAPX-1基因在处理B下下调表达最明显,为对照的0.41倍。中国春中 HAPX-1基因在处理B下是对照的2.98倍。比较两小麦品种相对表达量,发现东农冬麦1号在任何处理下均未明显高于中国春,除处理B和C外,其他处理条件下二者并没有明显差异。
2.2.2不同处理下 HAPX-2基因的表达
qRT-PCR分析结果(图5)表明,东农冬麦1号中 HAPX-2基因在不同处理下的相对表达量变化范围为0.44~6.88,在处理F下达到最大值,为对照的6.88倍。中国春中 HAPX-2基因在不同处理下呈现出不同程度的上调表达,变化范围为2.68~7.41,在处理C下达到最大值,为对照的7.41倍。比较两小麦品种相对表达量,发现东农冬麦1号在处理B、D和F下明显高于中国春,前者分别为后者的2.72、3.12和2.56倍。
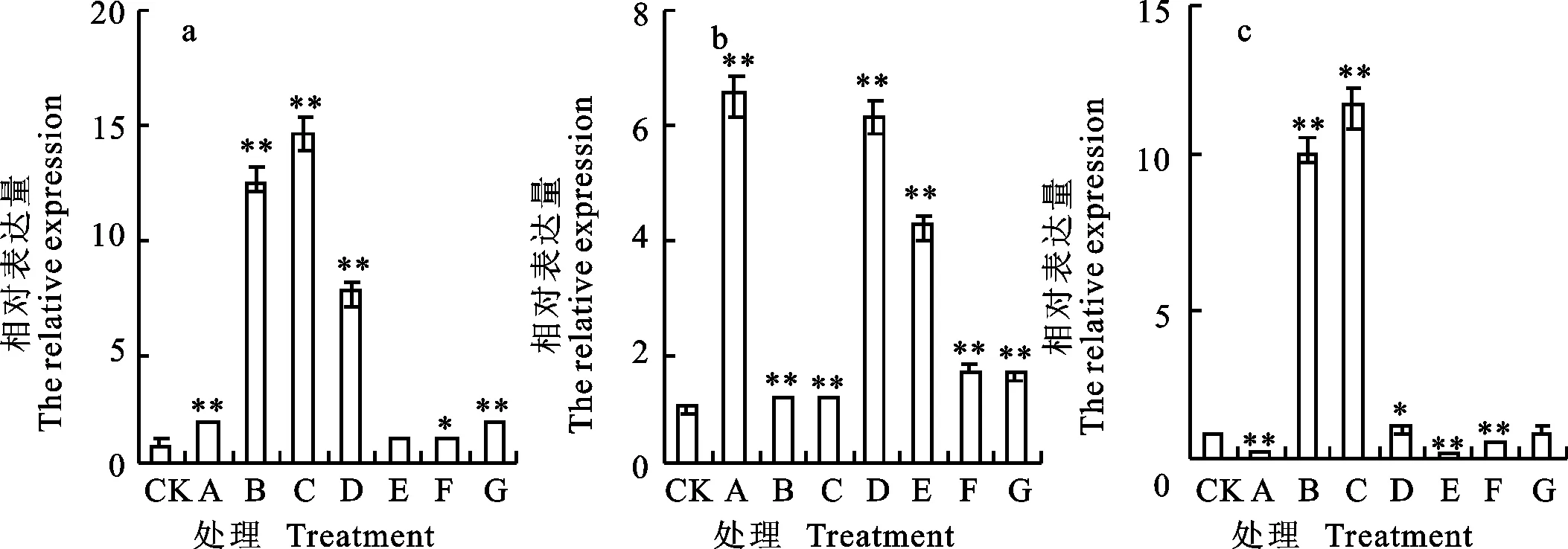
图3 TSOD-3基因在不同处理下的相对表达量
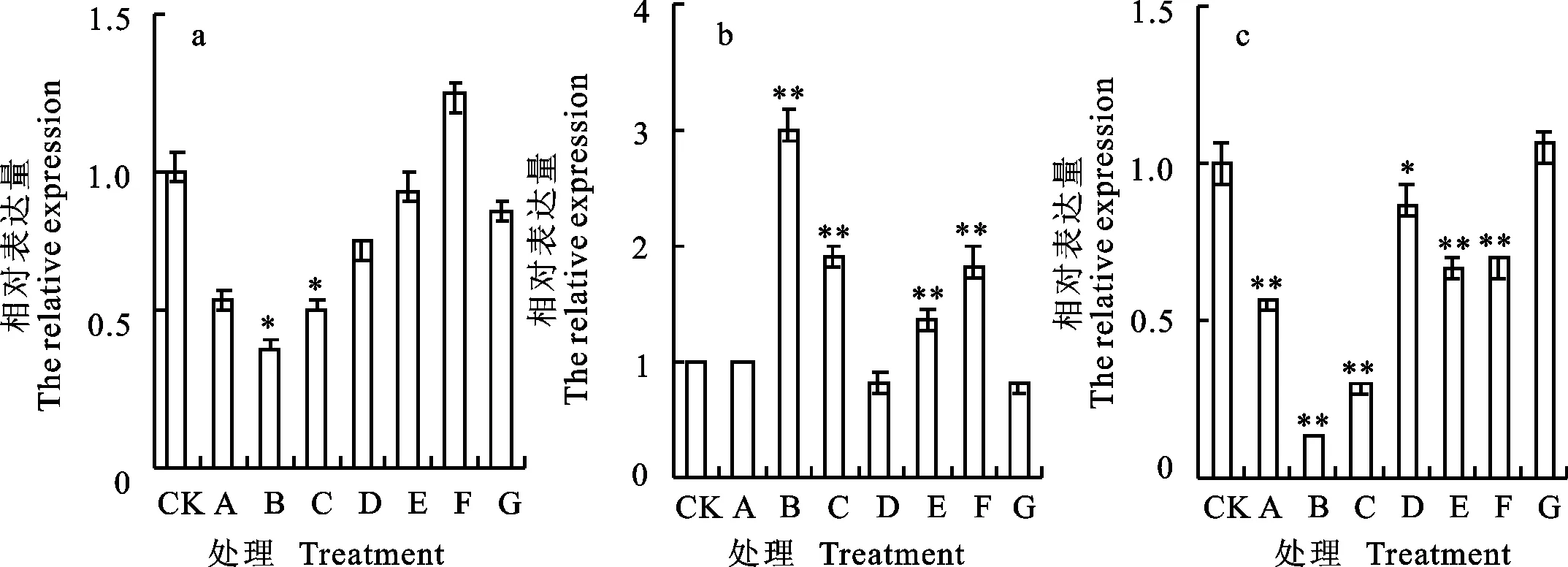
图4 HAPX-1基因在不同处理下的相对表达量
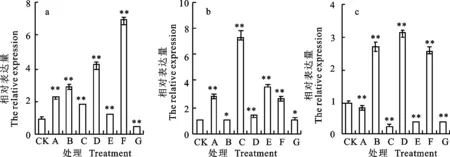
图5 HAPX-2基因在不同处理下的相对表达量
2.2.3不同处理下 HAPX-3基因的表达
qRT-PCR分析结果(图6)表明,东农冬麦1号中 HAPX-3基因在不同处理下呈现出不同程度的上调表达,在处理A、B和D下上调表达最明显,分别是对照的4.39、5.68和8.80倍。中国春中 HAPX-3基因在低温驯化期和冷冻处理初期上调表达,在B处理下上调表达明显,为对照的7.41倍,但在D处理下显著下调,仅为对照的0.41倍,当持续到E处理时,仅为对照的0.24倍。比较两小麦品种相对表达量,发现二者的表达量差异在D处理下最大,东农冬麦1号的表达量为中国春的21.22倍。
3 讨 论
在冬季寒地冬小麦地上部叶片全部死亡,只有分蘖节能够安全越冬和返青[14],因此选用小麦分蘖节作为研究材料。在低温胁迫下,植物体内自由基会大量积累,导致细胞内活性氧的积累和清除平衡遭到破坏,大量的活性氧积累,从而引起细胞的非正常代谢甚至导致植物死亡。因此,为了应对这些变化,植物细胞存在复杂的抗氧化保护系统。其中,超氧化物歧化酶(SOD)和抗坏血酸过氧化物酶(APX)是其中非常重要的两种活性氧清除酶,生物和非生物胁迫因子可大量诱导SOD和APX基因表达。因此,对SOD和APX相关基因的研究可以为今后探明小麦抗逆的分子机制奠定基础。

图6 HAPX-3基因在不同处理下的相对表达量
逆境下植物产生的H2O2主要分布在叶绿体和胞质中,APX主要清除植物体内产生的H2O2。前人已有报道,提高APX活性可以通过过表达的APX基因实现[14-15]。张丽君等[16]报道,导入APX基因能提高菊苣的抗渗透胁迫能力,而野生型植株在NaCl和甘露醇的渗透胁迫下不能存活。伍小兵和成雨洁[17]将APX基因转化至甘薯中,甘薯幼苗在5 ℃下冷胁迫12 h后植株的长势、膜透性、APX和CAT活性以及光合活性均显著地高于未转化的甘薯植株。曾秀存等[18]对比分析抗寒性不同的冬油菜的APX基因的表达,发现低温下抗寒品种的APX基因的表达量要显著高于不抗寒品种,其最大表达量在-4 ℃时出现。本研究中,在低温下东农冬麦1号中 HAPX-2 和 HAPX-3 基因的表达量显著高于中国春,而 HAPX-1 基因的表达量低于中国春,推测低温下 HAPX-2 和 HAPX-3 基因的表达量与APX活性显著正相关, HAPX-1 基因的表达量与APX活性显著负相关。 HAPX-2 和 HAPX-3 基因在东农冬麦1号相对于中国春中的表达量在4 ℃低温驯化初期为CK的2倍左右,说明适度的低温会刺激这两个基因的表达,但是在低温驯化结束后,再进行C处理(-10 ℃ 2 h)时, HAPX-2 和 HAPX-3 基因表达量均降低,而再次给予D处理(-12 ℃ 2 h)时东农冬麦1号中 HAPX-2 和 HAPX-3 基因的表达量上升,而中国春中的表达量则降低,同时东农冬麦1号相对于中国春中这2个基因表达量达到最大值,分别为中国春的3.12倍和21.22倍,说明冷冻条件下,这两个基因不属于应激性表达基因,在适应一段冷冻低温后,抗寒品种中 HAPX2 和 HAPX3 基因高表达,而不抗寒品种不具备这个特性,这可能是区分两者抗寒性的指标之一,尤其是 HAPX-3 基因值得进一步功能研究。
SOD是一种氧自由基清除剂,它降低自由基的毒害是通过催化超氧阴离子的歧化反应,从而维持植物细胞膜的结构和功能的稳定性[19]。曾秀存等[20]在冬油菜中研究表明,叶片中Cu/Zn-SOD基因在4 ℃下上调表达,在-4 ℃下调表达,而根中该基因在-4 ℃仍上调表达且达到最高。曾秀存等[21]在冬油菜中还发现,4 ℃低温胁迫Fe-SOD基因上调表达,而在-4 ℃和-8 ℃下,Fe-SOD基因表达受到抑制。本研究中, TSOD-1 、 TSOD-2 、 TSOD-3 基因在-10 ℃条件下同样上调表达,这与曾秀存的研究有所差异,说明本研究中的SOD基因均对冷冻有积极响应。 TSOD-1基因在东农冬麦1号相对于中国春中的表达量于低温驯化30 h及-10 ℃ 2 h的条件时显著高于CK,而在持续冷冻条件下出现显著低于CK,说明 SOD-1 基因仅在在冷冻初期起作用。 TSOD-2 基因在低温驯化初期(4 ℃ 6 h)和封冻初期(-10 ℃ 2 h,-12 ℃ 2 h)于两个品种中均高表达,且在低温驯化初期和封冻初期于抗寒品种中的表达量均高于不抗寒品种,说明该基因为低温应激响应基因,且在抗寒品种中对温度响应更敏感。 TSOD-3 基因在低温驯化30 d和-10 ℃ 2 h下于抗寒品种中高表达,而在不抗寒品种中于低温驯化初期高表达,且在低温驯化30 d和-10 ℃ 2 h于抗寒品种中的表达量为不抗寒品种的8.63和11.78倍,说明 TSOD-3 基因在抗寒品种中在抗寒过程中的关键基因,其功能值得进一步研究。
[1]李 璨,杨天杰.植物抗寒基因工程研究进展[J].吉林农业科学,2011,36(2):15-20.
LI C,YANG T J.Cold advances in genetic engineering of plants [J].JilinAgriculturalSciences,2011,36(2):15-20.
[2]李高科,林创水,胡建广.抗寒及其他植物基因工程的研究进展[J].广东农业科学,2007,103(2):15-20.
LI G K,LIN C S,HU J G.Cold and other plant genetic engineering research progress[J].GuangdongAgriculturalScience,2007,103(2):15-20.
[3]GUPTA A S,WEBB R P,HOLADAY A S,etal.Overexpression of superoxide dismutase protects plants from oxidature stress [J].PlantPhysiology,1993,103:1067-1073.
[4]SAMIS K,BOWLEY S,MCKERSIE B.Pyramiding Mn-superoxide dismutase transgenes to improve persistence and biomass production in alfalfa [J].JournalofExperimentalBotany,2002,53(372):1343-1350.
[5]ISHIKAWA T,SAKAI K,YOSHIMURA K,etal.cDNAs encoding spinach stromal and thylakoid-bound ascorbate peroxidase differing in thepresence or absence of their 3′-coding regions [J].FEBSLetters,1996,384(3):289-293.
[6]DAVLETOVA S,RIZHSKY L,LIANG H J,etal.Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network ofArabidopsis[J].PlantCell,2005,17(1):268-281.
[7]SHARMA P,DUBEY R S.Ascorbate peroxidase from rice seedlings effects of stresses and protective roles of osmolytes[J].PlantScience,2004,167(3):541-550.
[8]D′ARCY-LAMETA A,FERRARI-ILIOU R,CONTOUR-ANSEL D,etal.Isoation and characterization of four ascorbate peroxidase cDNAs responsive to water deficit in cowpea leaves [J].AnnalsofBotany,2006,97(1):133-140.
[9]PEREIRA C S,DA COSTA D S,TEIXEIRA J,etal.Organ-specific distribution and subcellular localisation of ascorbate peroxidase isoenzymes in potato(SolanumtuberosumL.) plants [J].Protoplasma,2005,226(3-4):223-230.
[10]WANG Y J,WISNIEWSKI M,MEILAN R,etal.Overexpression of cytosolic ascorbate peroxidase in tomatoconfers tolerance to chilling and salt stress [J].JournaloftheAmericanSocietyforHorticulturalScience,2005,130(2):167-173.
[11]冯玉磊.寒地冬小麦返青期抗氧化特性[J].麦类作物学报,2012,32(3):547-550.
FENG Y L.Reviving anti-oxidant properties in cold winter wheat [J].JournalofTriticeaeCrops,2012,32(3):547-550.[12]关 涛,王晓楠,李卓夫.冷驯化和冷冻条件下不同抗寒性冬小麦品种三个COR基因表达差异的分析[J].麦类作物学报,2013,33(2):230-235.
GUAN T,WANG X N,LI Z F,etal.qRT-PCR expression analysis of threeCORgenes in two winter wheat varieties with different cold resistance under cold acclimation and freezing conditions [J].JournalofTriticeaeCrops,2013,33(2):230-235.
[13]DONG J X,CHEN C,CHEN Z X.Expression profiles of theArabidopsisWRKY gene super family during plant defense response [J].PlantMolecularBiology,2003,51:21-37.
[14]陈 莉,辛海波,孙向荣.百合APX基因的克隆及转LlAPX提高拟南芥耐盐性[J].园艺学报,2010,37(12):1983-1990.
CHEN L,XIN H B,SUN X R.LilyAPXgene cloning and turnLlAPXimprove salt resistance inArabidopsisthaliana[J].JournalofGardening,2010,37(12):1983-1990.
[15]孙 云,林玉玲,赖钟雄.茶树品种及萎凋过程中叶片APX基因表达的qPCR 分析[J].福建农林大学学报(自然科学版),2012,41(4):476-480.
SUN Y,LIN Y L,LAI Z X.Tea plant varieties and blade in the process of the witheringAPXqPCR analysis of gene expression [J].FujianAgricultureandForestryJournalofUniversity(NaturalScienceEdition),2012,41(4):476-480.
[16]张丽君,程林梅,杜建中.导入APX基因提高了普那菊苣植株的抗逆性[J].草地学报,2012,20(1):153-160.
ZHANG L J,CHENG L M,DU J Z.ImportAPXgene improves the resistance of pune chicory plant [J].JournalofGrass,2012,20(1):153-160.
[17]伍小兵,成雨洁,邓西平.叶片喷施 H2O2以及转入Cu/Zn-SOD和APX基因对甘薯幼苗冷后恢复的作用[J].中国农业科学,2010,43(7):1379-1388.
WU X B,CHENG Y J,DENG X P.Spraying on the leaf H2O2and transferred toCu/Zn-SODandAPXgene of sweet potato seedling cold recovery [J].ChinaAgriculturalScience,2010,43(7):1379-1388.
[18]曾秀存,孙万仓,方 彦.白菜型冬油菜抗坏血酸过氧化物酶(APX)基因的克隆、表达及其活性分析[J].作物学报,2013,39(8):1400-1408.
ZENG X C,SUN W C,FANG Y.Cabbage type of winter rapeseed ascorbic acid peroxidase (APX) gene cloning,expression and activity analysis [J].JournalofCrops,2013,39(8):1400-1408.
[19]LAWRENCE V G,NICOLE T B,WU G H.Superoxide dismutase: an all-purpose gene for agri-biotechnology [J].MolecularBreeding,2009,24:103-115.
[20]曾秀存,刘自刚,史鹏辉.白菜型冬油菜铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆及其在低温条件下的表达[J].作物学报,2014,40(4):636-643.
ZENG X C,LIU Z G,SHI P H.Cabbage type of winter rapeseed copper zinc superoxide dismutase (Cu/Zn-SOD) gene cloning and expression under the condition of low temperature [J].JournalofCrops,2014,40(4):636-643.
[21]曾秀存,孙万仓,孙 佳.白菜型冬油菜铁超氧化物歧化酶(Fe-SOD)基因的克隆及表达分析[J].中国农业科学,2013,46(21):4603-4611.
ZENG X C,SUN W C,SUN J.Cabbage type of winter rapeseed iron superoxide dismutase (Fe-SOD) gene cloning and expression analysis [J].China’sAgriculturalScience,2013,46(21):4603-4611.
Expression of Genes Related to SOD and APX Enzymes in Winter Wheat at Low Temperature
CHEN Lu,LI Zhuofu,WANG Xiaonan,FU Lianshuang,SUN Yinglu
(College of Agriculture,Northeast Agricultural University,Harbin,Heilongjiang 150030,China)
In order to clarify the expression of genes related to antioxidant enzymes under cryogenic conditions,and reveal the physiological mechanism of cold resistance in winter wheat,Dongnongdongmai 1 and Chinese Spring,with distinguishing cold resistance were used as materials to identify the expression differences of TSOD-1, TSOD-2, TSOD-3 related to superoxide dismutase(SOD) and HAPX-1, HAPX-2, HAPX-3 related to ascorbate peroxidase(APX) under different low temperature.Results showed that,under specific low temperature treatment,the expression level of TSOD-1, TSOD-2, TSOD-3, HAPX-2 and HAPX-3 genes in Dongnongdongmai 1 were significantly higher than that in Chinese Spring,while the expression level of HAPX-1 gene in Dongnongdongmai 1 was almost lower than that in Chinese Spring.Among them,the relative expression level of TSOD-3 gene in Dongnongdongmai 1 with respect to that in Chinese Spring reached the maximum at the beginning of the cold processing (cold acclimation 30 d,-10 ℃ for 2 h),with a ratio of 8.63 and 11.78,respectively.However,the relative expression level of HAPX-2 and HAPX-2 gene in Dongnongdongmai 1 relative to that in Chinese Spring reached the maximum at the frozen period (-12 ℃ for 2 h),with a ratio of 3.12 and 21.22,respectively.It is conclued that TSOD-3, HAPX-2,and HAPX-3 genes are important genes involved in cold response.Of them, TSOD-3 gene plays a major role in the early stage of cold stress,and HAPX-2 and HAPX-3 continue to play a major role in refrigeration.
Wheat; Chilling; qRT-PCR; Superoxide dismutase(SOD); Ascorbate peroxidase(APX)
2016-01-25
2016-04-18
黑龙江省博士后科研启动基金项目(LBH-Q14026);东北农业大学学科团队项目
E-mail:282339738@qq.com
李卓夫(E-mai:zflicn@163.com)
S512.1;S330
A
1009-1041(2016)08-0982-07
网络出版时间:2016-08-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160801.1120.004.html

