吲哚-2-羧酸酯类化合物合成研究进展
黄俊松,李坚军
(浙江工业大学,绿色制药技术与装备教育部重点实验室,杭州310014)
吲哚-2-羧酸酯类化合物合成研究进展
黄俊松,李坚军*
(浙江工业大学,绿色制药技术与装备教育部重点实验室,杭州310014)
介绍了吲哚-2-羧酸酯类化合物的生物活性及应用。按化学键形成方法的不同对吲哚-2-羧酸酯类化合物的主要合成方法分类叙述,包括Hemetsberger吲哚合成、Ullmann偶联、分子内Heck偶联、Sundberg吲哚合成,并对这些方法的特点及适用范围进行分析。认为通过铜催化的偶联反应合成吲哚-2-羧酸酯的方法具有操作简单、反应条件温和、产率高、产物容易提纯分离等特点,符合绿色化学发展方向,是具有较大工业化应用前景的方法。
吲哚-2-羧酸酯;合成;研究进展
吲哚及其衍生物是一类重要包含六元苯环和五元含氮杂环的有机化合物,发现至今的100余年中,人们发现其具有广泛的生物活性并出现在许多天然产物和生物活性分子的关键组分上,是重要的精细化工原料及食品、饲料添加剂、香料原料等。因此,该类化合物成为众多领域,如医药、农药、香料、染料以及材料科学的研究热点[1]。
由吲哚结构单元构成的吲哚-2-羧酸酯类具有独特的结构,广泛存在于多种具有显著生物活性的天然产物和药物分子之中。这类化合物吸引了很多的关注,是因为他们的各种潜在的生物活性,如抗菌抑菌、细胞毒性和神经调节等[2-4]。由于吲哚-2-羧酸酯类在人们的日常生活中具有很重要的应用价值,因此越来越多的化学工作者开始对这类物质的合成进行了深入的研究。本文叙述了近些年来关于吲哚-2-羧酸酯类的合成方法,并按照化学键的形成类型进行了分类。
1 Hemetsberger吲哚合成
Hemetsberger吲哚合成法也称Kenoevenagel-Hemetsberger吲哚合成法、Hemetsberger-Knittel吲哚合成[5]。包含2个步骤,一是叠氮基丙烯酸酯与芳醛的Kenoevenagel缩合反应,得到2-叠氮基-3-取代苯基丙烯酸酯,二是加热或光照条件下得到氮丙啶中间体并最终关环得到吲哚-2羧酸酯类化合物。但该类反应存在着一些不足,如制备叠氮化反应底物比较困难,而且比较危险,同时叠氮化合物也不稳定。
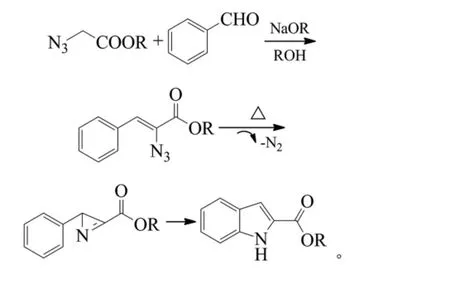
2007年,Driver等报道了一种反应条件较为温和的方法,是以2价的铑盐作为催化剂与叠氮物形成配合物在甲苯中加热分子内亲电环合生成吲哚类化合物[6]。作者发现当与铑连接的是吸电子能力较强的酯基时,反应产率高;当不加催化剂时,反应需在150℃下进行。铑盐催化下反应温度只需30~60℃,产率高(收率71%~98%),但反应时间长达16 h,使用的催化剂较为昂贵。反应式如下(R1=H、Cl、Me、OMe,R2=H、Cl、Br、OMe,R3=H、Cl、Br、Me、OMe、CF3、t-Bu。Me为甲基,Ph为苯基,t-Bu为叔丁基):

2011年,Bolm课题组在催化剂上作了改进,选用廉价的催化剂三氟甲磺酸亚铁(Fe(OTf)2)并得到了较好的效果,作者发现反应在二甲基甲酰胺,乙腈,水,乙醇等极性较强的溶剂中进行时,没有产物生成;在正己烷,甲苯,二甲苯等极性较弱的溶剂中反应,产物会有适中的产率;醚类溶剂如二甲醚、甲基叔丁基醚、四氢呋喃等也有很好的适应性,最后,选择了四氢呋喃(THF)作为反应溶剂,虽然其反应时间长达24 h,但是反应温度温和、使用范围广、产率高(75%~99%),使用的催化剂无毒、廉价、环境友好[7]。反应式如下(R=H、4-OMe、4-Me、4-CF3、4-F、4-Cl、4-Ph、2-OMe,R1=Me、OMe、Ph):

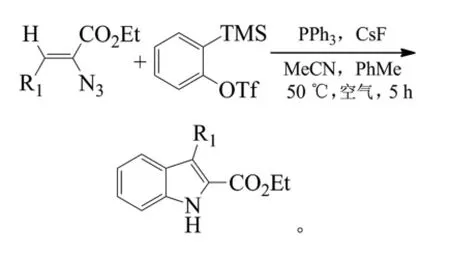
2010年,Wang等以2-(三甲基硅烷基)三氟甲磺酸苯和2-叠氮基-3-丙烯酸苯酯为原料合成吲哚类化合物[8]。其机理是2-(三甲基硅烷基)三氟甲磺酸苯通过氟化物的催化形成苯炔,再在三苯基膦(PPh3)催化作用下与2-叠氮基-3-丙烯酸苯酯环合。研究发现,反应溶剂以乙腈、甲苯摩尔比为1:1时产率最高(70%~89%),该方法不需金属催化剂,且反应条件温和、收率高。反应式如下(R1=芳基、烷基):
2015年,Su等报道了以金属铑盐与二羧酸类形成的有机笼络合物兼顾配体与催化剂的作用促进叠氮类化合物分子内环合得到吲哚-2-羧酸酯,产率93%~99%[9]。该反应符合绿色化学发展方向,但操作过程较为繁杂。
2 Ullmann偶联
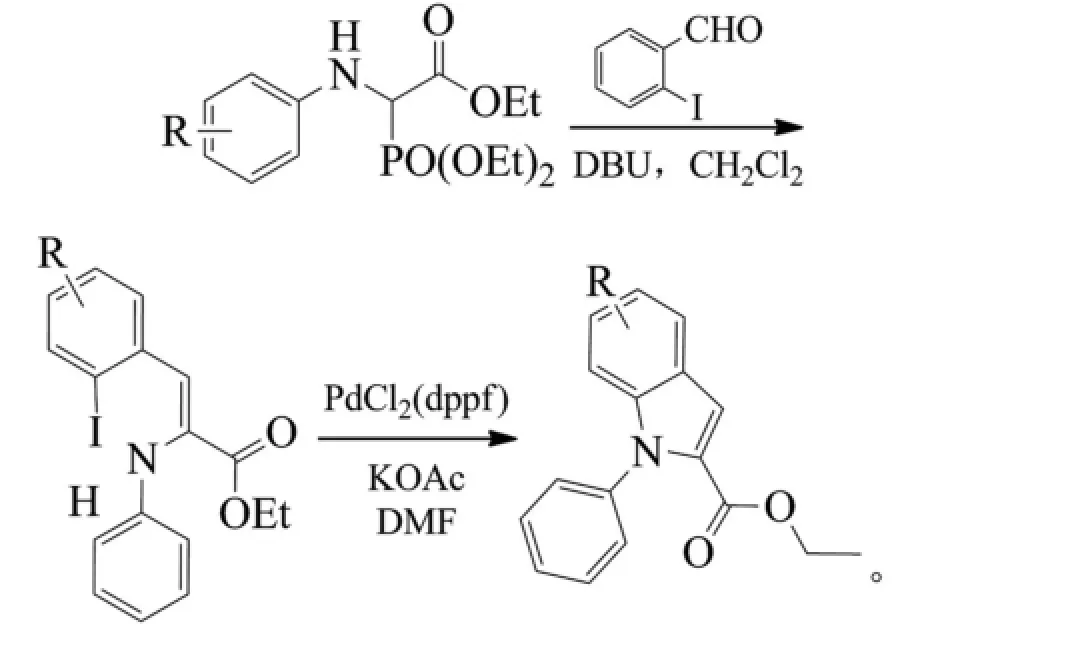
Brown课题组采用醋酸钾(KOAc)为碱,1,1'-双二苯基膦二茂铁二氯化钯为催化剂,在N,N'-二甲基甲酰胺(DMF)中催化烯胺酯类进行分子类环合得到吲哚-2-羧酸酯化合物,烯胺酯类由邻碘苯甲醛类与膦酰基甘氨酸酯类通过Horner-Wadsworth-Emmons反应制备得到。反应取得了较高的收率(83%~94%)[10]。但当用邻氯苯甲醛类或邻溴苯甲醛类代替邻碘苯甲醛类时,反应很难进行。该反应还使用了较昂贵的钯催化剂。反应式如下(R=H、6-NO2、5-OMe,Et为乙基,DBU为1,8-二氮杂二环十一碳-7-烯):
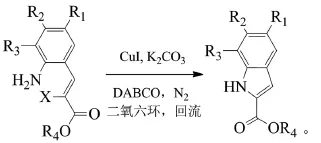
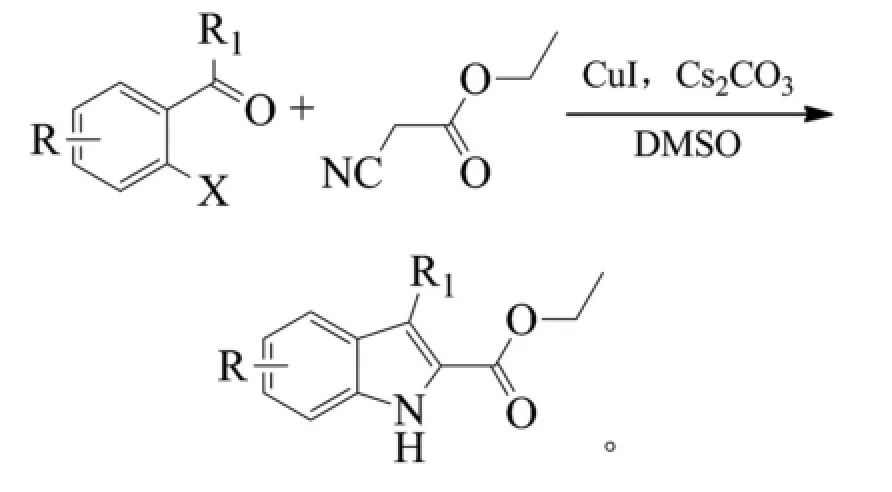
Zeng等用三亚乙基二胺(DABCO)作为配体,碘化亚铜催化邻氨基苯乙烯酯进行分子内环合得到吲哚-2-羧酸酯[11]。研究发现,当苯环上连有给电子基或较弱的吸电子基时,反应的效果较好;当苯环上连有强吸电子基时,反应的效果较差;酯基部分甲基被异丙基、乙基或氨基替代时,反应效果会好一些。该反应条件温和、产率高,但原料的制备过程较麻烦。反应式如下(R1=H、Br、I、OMe,R2=H、Cl、Br、OAc、OMe、CN、COOMe,R3=H、OMe、COOMe,R4=Me、Et,X=Br、I,。收率52%~96%):
Peng等报道了无配体条件下,碳酸铯为碱,氧化亚铜催化串联邻溴苯甲醛类和甘氨酸酯盐酸盐类得到吲哚-2-羧酸酯化合物,考察了反应在DMF溶剂中的一系列铜盐,CuI、CuBr、CuCl、CuCl2、Cu(OAc)2,、Cu(OTf)2及Cu2O,其中Cu2O的效果最好,收率达52%。研究还发现,反应对烷基、醚基、卤素等取代基团有较好的适应性,吸电子基团的效果比给电子基团的效果好[12]。该反应原料廉价易得,但是该反应类型不适用于邻氯苯甲醛类,因此限制了其工业化应用。反应式如下(R1=H、F、Cl、OMe,R2=F、Me、OMe,收率35%~88%):
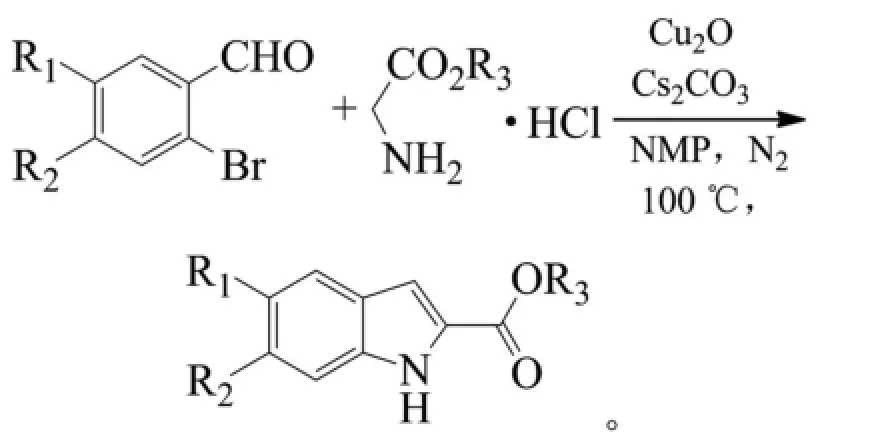
2009年,Cai等报道了无配体条件下,碳酸铯为碱、碘化亚铜为催化剂催化2-卤代芳基醛(酮)和异氰基乙酸乙酯反应得到吲哚-2-羧酸酯化合物。反应以邻碘芳醛(酮)为底物时,室温反应16 h,产率就可以达到77%。以邻溴芳醛(酮)和邻氯芳醛(酮)为底物时,需要在80℃下反应24 h,可以获得20%~91%的收率[13]。这种合成转化得益于反应活性较好的异氰基乙酸乙酯,但该物质具有恶臭难闻气味、有毒,而且价格较昂贵。反应式如下(X=Cl、Br、I,DMSO为二甲基亚砜):
3 分子内Heck偶联
2003年,Kondo课题组以三(邻甲基苯基)磷(P(o-Tol)为配体,三(二亚苄基丙酮)二钯(Pd(dba)3)为催化剂,催化烯胺酯类分子内Heck偶联反应得到吲哚-2-羧酸酯类化合物,用三乙胺作碱,在100℃下DMF中反应2 h,由烯胺酯类通过Horner-Wadsworth-Emmons反应制备[14]。该反应对合成吲哚-2-羧酸酯是一个很好的开头,但反应也存在一些缺点,如需要摩尔分数15%的昂贵的钯催化剂,底物的制备过程繁杂,最终的产物产率较低(30%~62%)。反应式如下(X=Br、I,R1=H、4-Me、6-OMe、5-CF3、 6-NO2,R2=H、Ph、4-MeOC6H4、2-Pyridyl):

4 Sundberg吲哚合成
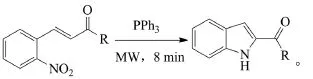
2009年,Creencia等以三苯基膦为催化剂,微波(MW)条件下促进2-硝基查尔酮类分子内还原环合生成吲哚-2-羧酸酯类,反应只需8~11 min就能取得很好的收率(61%~83%)[15]。反应式如下(R=Ph、OEt、OMe):
5 结语
吲哚-2-羧酸酯类化合物是合成很多具有显著生物活性的天然产物和药物分子的关键中间体,关于这类化合物的合成方法,近年来,人们已经开发出用廉价的铜催化剂代替昂贵的钯催化剂的方法,该方法具有操作简单、反应条件温和、产率高和产物容易提纯分离等特点,符合绿色化学发展方向,是具有较大工业化应用前景的方法。但其合成路线还存在使用的底物比较昂贵,需要使用较为复杂的配体等问题。因此,相信随着对该类化合物合成的不断深入研究,更绿色经济且适合工业化生产的合成路线会被报道。
[1]Kochanowska-Karamyan A J,Mark T Hamann.Marine indole alkaloids:potential new drug leads for the control of depression and anxiety[J].Chem Rev,2010,110(8):4489-4497.
[2]Tiwari R K,Singh D,Singh J,et al.Synthesis and antibacterial activity of substituted 1,2,3,4-tetrahydropyrazino[1,2-a]indoles[J].Bioorg Med Chem Lett,2006,16:413-416.
[3]Boger D L,Fink B E,Hedrick M P.A new class of highly cytotoxic diketopiperazines[J].Bioorg Med Chem Lett,2000,10:1019-1020.
[4]Lehr M.3-(Octadecanoylaminomethyl)indole-2-carboxylic acid derivatives and l-methyl-3-octadecanoylindole-2-carboxylic acid as inhibitors of cytosolic phospholipase A2[J].Arch Pharm Pharm Med Chem,1996,329:386-392.
[5]Hemetsberger H,Knittel D.Synthese und thermolyse von α-azidoacrylestern[J].Monatsh Chem,1972,103:194-204.
[6]Stokes B J,Dong H Leslie,B E Pumphrey,et al.Intramolecular C-H amination reactions:exploitation of the Rh2(II)-catalyzed decomposition of azidoacrylates[J].J Am Chem Soc,2007,129(24):7500-7501.
[7]Bonnamour J,Bolm C.Iron(II)triflate as a catalyst for the synthesis of indoles by intramolecular C—H amination[J]. Org Lett,2011,13(8):2012-2014.
[8]Hong D,Chen Z,Lin X,et al.Synthesis of substituted indoles from 2-azidoacrylates andortho-silyl aryltriflates[J]. Org Lett,2010,12(20):4608-4611.
[9]Chen L,Yang T,Cui H,et al.A porous metal-organic cage constructed from dirhodium paddle-wheels:synthesis,struc ture and catalysis[J].J Mater Chem A,2015,3:20201-20209.
[10]Brown,J.A.Synthesis of N-aryl indole-2-carboxylates via anintramolecularpalladium-catalysedannulationof didehydrophenylalanine derivatives[J].Tetrahedron Lett, 2000,41:1623-1626.
[11]Xiao X,Chen T,Ren J,et al.CuI-catalyzed intramolecular cyclization of 3-(2-aminophenyl)-2-bromoacrylate:synthesis of2-carboxyindoles[J].Tetrahedron Lett,2014,55:2056-2060.
[12]Zhu Z,Yuan J,Zhou Y,et al.Ligand-free copper-catalyzed one-pot synthesis of indole-2-carboxylic esters[J].Eur J Org Chem,2014(4):511-514.
[13]Cai Q,Li Z,Wei J,et al.Assembly of indole-2-carboxylic acid esters through a ligand-free copper-catalysed cascade process[J].Chem Commun,2009,48:7581-7583.
[14]Yamazaki K,Nakamura Y,Kondo Y.Solid-Phase Synthesis ofindolecarboxylates using palladium-catalyzed reactions[J]. J Org Chem,2003,68(15):6011-6019.
[15]Creencia E C,Kosaka M,Muramatsu T,et al.Microwave-assisted cadogan reaction for the synthesis of 2-aryl-2H-indazoles,2-aryl-1H-benzimidazoles,2-carbonylindoles,carbazole,and phenazine[J].J Heterocycl Chem,2009,46:1309-1317.
环保大势所趋,HFCs制冷剂优势渐失
在谁是最终替代品还没有定论之前,寻找最优制冷剂的步伐不会停止。目前,HFCs制冷剂中R410A已经取得市场认可,而R32备受争议,虽已上市,但是只限于出口。已经在汽车领域开疆拓土的HFOs制冷剂,虽有进入家用空调领域之心,但目前由于各种原因仍然没有取得任何实质性进展。
从2013年家用空调行业开始淘汰R22,R410A就被提议作为过渡替代品。到目前为止,R410A已经成为比较成熟的替代产品,而R410A空调市场份额也已经占到50%左右。对于R410A今后的发展,环保部对外合作中心项目三处副处长钟志峰表示,2016年,国际相关组织不会再资助R410A生产线的改造,因为R410A技术已经相当成熟,基金资助的意义不大,R410A如何发展将由市场需求来决定。
替代R22的HFCs制冷剂,除了R410A,还有R32。对于R32的应用现状,在1~3 HP制冷量范围的壁挂式空调,环保部倡导使用R290。对于制冷量在3 HP以上的壁挂式或柜式空调,目前还没有确定的环保替代方案,R32只是选项之一。据了解,目前大金、松下、富士通等外资企业均配备了R32空调生产线,但产品主要用于出口。格力也排产了R32单元机、柜机,用于内销渠道,但并未着重布局。事实上,R32因为自身的问题备受争议。虽然R32单位容积制冷量更大,可以实现压缩机小型化,进一步降低整机制造成本,但R32属于HFCs制冷剂,最近国际环保组织会议一再表明:HFCs将在全球范围内受到广泛限制。对此,东岳化工认为,不管是系统性能,还是生产线改造成本,R32优于R410A,可以替代R410A。钟志峰则认为,在商业制冷领域,一些灌注量比较大的单元机上,考虑到安全性和技术可行性,R32是目前比较理想的替代产品。在国内氟化工产业布局相对完善的中化蓝天认为,在空调制冷剂最终替代方案没有确定之前,很多方案会并存相当长的时间,每个产品都会有一定的市场份额。
然而,纵观国内外环境,由于HFCs属于温室气体,出于环保要求,HFCs受到越来越多的抵制。比如,欧盟出台的新F-gas法规,从2016年开始削减HFCs应用。2015年7月,美国环境保护署明确提出自2017年1月1日起禁止在某些终端产品中使用HFCs,包括R134a和R404A制冷剂在某些食品冷冻、冷藏系统的应用。2015年12月13日,为了不断提升减排力度,《巴黎协定》明确了从2023年开始,以5年为周期的全球盘点机制,包含对减缓行动和资金承诺等比较全面的盘点。2016年,蒙特利尔议定书多边基金支持的《中国家用空调器行业HCFC-22淘汰管理计划》第2阶段的申请工作即将开始,包括R410A、R32和R134a等在内的HFCs制冷剂很有可能纳入淘汰名单,未来或采取配额生产制。在这样的压力下,对于HFCs制冷剂的未来走向,值得深思。2015年,国家已经非常明确地把HFCs物质纳入蒙特利尔议定书加以管控,即先冻结再削减。然而,这个想法上升到政策层面或者执行层面还需要很长的时间。因为,环保部需要实际去考虑中国企业乃至中国产业的情况,很多HFCs装置都是近年来才投入运行,虽然没有满负荷运行,一旦从国家层面叫停,将对HFCs产业产生巨大的打击。因此,HFCs制冷剂短期内不会受到影响。
(本刊编辑部)
经验交流
TQ251.3+4
A
10.3969/j.issn.1006-6829.2016.02.009
*通信联系人。电子邮件:lijianjun@zjut.edu.cn
2015-01-28

