小熊猫犬细小病毒福州株的分离鉴定
徐素慧
(海峡(福州)大熊猫研究交流中心,福建福州 350001)
小熊猫犬细小病毒福州株的分离鉴定
徐素慧
(海峡(福州)大熊猫研究交流中心,福建福州 350001)
为获得自然感染小熊猫的犬细小病毒(CPV)野毒株,以快速检测试纸确诊的且具有犬细小病毒病临床症状的发病死亡小熊猫肛门棉拭子、口腔棉拭子和抗凝血为病料进行CPV的PCR检测后,将病料预处理并接种于F81细胞盲传至培养细胞出现病变,收集细胞毒并进行PCR鉴定,接种细胞毒给2月龄健康幼犬进行回归试验。结果显示,小熊猫肛门棉拭子、口腔棉拭子和抗凝血的CPV PCR检测均为阳性。病料接种F81细胞盲传第5代时,细胞病变明显,细胞接毒72 h后出现拉网、皱缩、崩解、脱落。细胞毒的PCR扩增产物测序结果与已经发表的CPV-js23和2010-BJ-A64毒株相应序列的同源性均为100%。接种细胞毒的幼犬出现了犬细小病毒病特征性症状。结果表明,获得了对小熊猫毒力较强的CPV野毒株。
犬细小病毒;小熊猫;病原分离
犬细小病毒病属于一种高度接触性急性传染病,在临床主要表现为以呕吐、腹泻为特征的肠炎和心肌炎,发病动物无论种类都会引起较高的病死率[1]。本病在各年龄阶段的犬均可发生,尤其以断奶1个月的幼犬最为易感,其发病率和病死率介于50%~70%[2-3]。犬细小病毒病于1978年在加拿大和澳大利亚被同时发现,后证实为全球性传染病,在世界各地都有发生。感染发病动物除了犬之外,犬科其他动物也有发生,猫科、鼬科和浣熊科等多种动物[4-5],如虎、豹、狮子和浣熊等也会因感染而发病死亡[6-8],目前未见有小熊猫发生犬细小病毒病的报道。犬细小病毒病病原为犬细小病毒,该病毒首先由Eugster和Nairn从患出血性肠炎犬的腹泻粪便中分离得到[9]。1983年,我国的犬细小病毒病首先在犬发现并报道,除了在犬分离到犬细小病毒外,也有从人工饲养动物,如狐狸、水貂等患病动物中分离出本病原的报道[10-11],但有关小熊猫的相关研究鲜有报道。
1 材料与方法
1.1材料
1.1.1试验用动物福州熊猫世界圈养的1只雄性小熊猫尾巴受伤,伤口化脓,有黑色淤血伴腥臭味。对伤口清创处理,10 d后尾巴伤口未愈合,小熊猫出现精神沉郁,呼吸急促,食欲差等症状。肺部听诊有啰音,排出的粪便有难闻的腥臭味、暗红色并覆以大量黏液。取粪便分别用胶体金快速诊断试纸条做犬瘟热病毒、犬细小病毒、犬冠状病毒的快速诊断,结果呈犬细小病毒弱阳性,其余均为阴性。该发病小熊猫2 d后死亡。
1.1.2细胞株F81细胞株,由西北农林科技大学免疫学实验室惠赠。
1.1.3主要试剂和仪器MEM培养基(Gibco)、犊牛血清、胰酶、DMSO,Amresco公司产品;青霉素、链霉素、乙醇、氯化钠、氯化钾、磷酸氢二钾、磷酸二氢钠、碳酸氢钠等,国产或进口分析纯;PCR相关试剂,Takara公司产品;细胞培养箱,Thermo公司产品;PCR仪,Bio-Rad公司产品;恒压电泳仪EPS300,Tanon公司产品。
1.2方法
1.2.1样品采集与处理采集死亡小熊猫的肛门棉拭子、口腔棉拭子和抗凝血。用PBS(含1%双抗)浸泡肛门棉拭子、口腔棉拭子过夜,反复冻融3次。12 000 r/min离心10 min,取上清,转移至新的EP管,标记。用0.22 μm过滤,取滤液。标记并冻存于-20℃备用。
1.2.2病料样品的PCR检测
1.2.2.1病毒DNA提取取上述滤液各100 μL,各加入200 μL的lysis buffer,室温放置10 min。加入500 μL异丙醇(置-20℃预冷),沉淀DNA 5 min。14 000 r/min离心10 min。弃异丙醇,加入500 μL的700 mL/L乙醇洗涤。14 000 r/min离心10 min。弃乙醇,晾干,加入10 μL的无菌ddH2O溶解DNA。所得DNA储存于4℃备用。
1.2.2.2PCR扩增及电泳检测按下列反应体系以提取的DNA为模板进行PCR扩增:PCR反应体系(25 μL):模板2 μL,10×buffer 2.5 μL,2.5 mmol/L dNTP 2 μL,10 μmol/L引物1为1 μL,10μmol/L引物2为1 μL,LATaqDNA Polymerase 0.25 μL,ddH2O 16.25 μL。PCR循环条件:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,34个循环;最后72℃延伸10 min。琼脂糖凝胶电泳检测PCR产物。
1.2.3细胞培养复苏实验室冻存的F81细胞,培养液为含100 mL/L犊牛血清和1%双抗(青、链霉素)的MEM。待细胞铺满90%时,用2.5 g/L胰酶进行消化传代,然后将细胞瓶放入37℃体积分数为5% CO2培养箱中培养。连续传代2次,以调整细胞到最佳状态备用。
1.2.4病毒分离与鉴定
1.2.4.1病毒分离将状态良好的F81细胞消化,加入细胞维持液(含20 mL/L犊牛血清和1%双抗的MEM)。将PCR检测阳性的样品滤液,按照1∶10同步接入消化好的F81细胞中,同时设正常细胞对照,细胞瓶放入37℃体积分数为5%的CO2培养箱中连续培养4 d~5 d,连续观察细胞接毒后的状态。盲传至第5代。
1.2.4.2CPV鉴定(1)病毒DNA提取取盲传第5代细胞裂解液100 μL,加入200 μL的lysis buffer,室温放置10 min。加入500 μL的-20℃的异丙醇,沉淀DNA 5 min。14 000 r/min离心10 min。弃异丙醇,加入500 μL 700 mL/L乙醇洗涤。14 000 r/min离心10 min。弃乙醇,晾干,加入10 μL的无菌ddH2O溶解DNA。
(2)PCR扩增及基因测序引物参照文献[12],引物1:GTACATTTAAATATGCCAGA( 3029 nt ~3 408 nt )
引物2:ATTAATGTTCTATCCCATTG(3 461 nt~3 480 nt )。按下列反应体系以提取的DNA为模板进行PCR扩增:PCR反应体系(25 μL):模板2 μL,10×buffer 2.5 μL,2.5 mmol/L dNTP 2 μL,10μmol/L 引物1为1 μL,10μmol/L引物2为1 μL,LATaqDNA Polymerase 0.25 μL,ddH2O 16.25 μL。PCR循环条件为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,34个循环;最后72℃延伸10 min。琼脂糖凝胶电泳检测PCR产物,回收PCR产物,寄送上海生工生物工程技术服务有限公司测序,用DNA Star软件MegAlign/ClustalMethod对CPV分离株与GenBank登录的其他CPV毒株进行比较分析。
1.2.5动物回归试验2月龄幼犬8只,分成2组,试验组皮下注射104TCID50分离毒,对照组注射生理盐水,分开饲养。每天观察犬的精神状况、食欲、温度、粪便等临床表现。
2 结果
2.1样品的CPV PCR检测结果
样品PCR检测发现,肛门拭子、口腔拭子、抗凝血样品均出450 bp目的条带,与预期相符(图1)。

M.DNA标准DL 2 000;1.外周血;2.口腔拭子;3.肛门拭子;4.阳性对照;5.阴性对照
M.DNA Marker DL 2 000;1.Peripheral blood;2.Saliva swab;3.Rectal swab;4.Positive control;5.Negative control
图1病料样品PCR检测结果
Fig.1PCR results of clinical samples
2.2细胞CPE观察结果
病料滤液在F81细胞上盲传,前3代细胞病变不明显。盲传到第5代时,细胞病变明显,细胞接毒72 h出现拉网、皱缩、崩解、脱落(图2)。
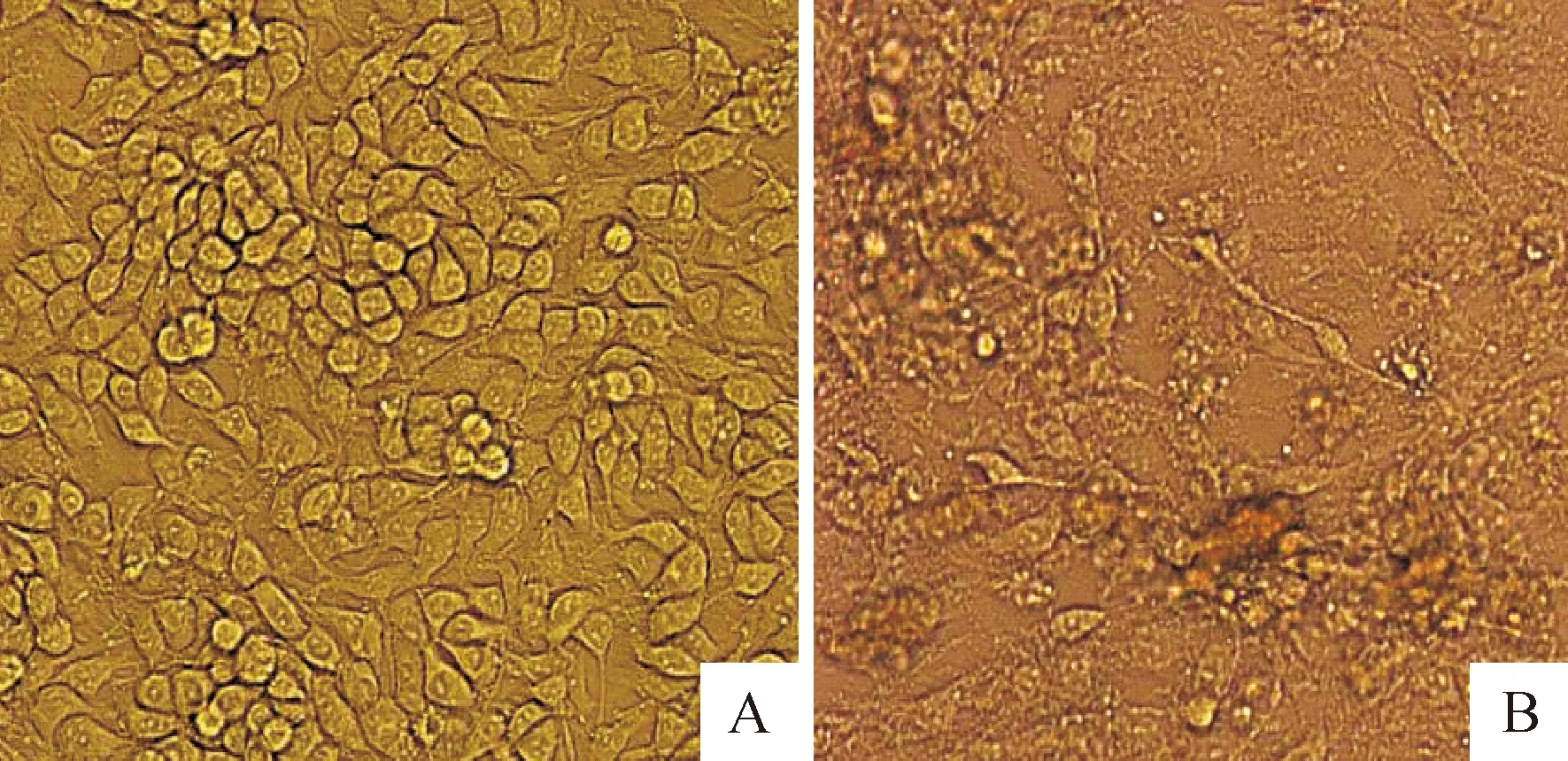
A.正常F81细胞对照;B.病料样品盲传第5代引起的细胞病变
A.F81 cell control;B.CPE in F81 cells induced by CPV after five passages
图2分离毒株引起F81细胞的细胞病变
Fig.2F81 cell CPE induced by isolate
2.3盲传样品PCR检测结果
盲传第5代毒PCR扩增到450 bp的CPV的VP2基因片段(图3)。回收PCR产物,送上海生工生物工程技术服务有限公司测序得到基因序列,登陆GenBank BLAST分析得出,分离毒株与已经发表的CPV江苏株(CPV-js23),登录号为KJ75535.1和北京株(2010-BJ-A64),登录号为KF803599.1的同源性都为100%(图4)。证明分离得到的病毒确实为CPV。
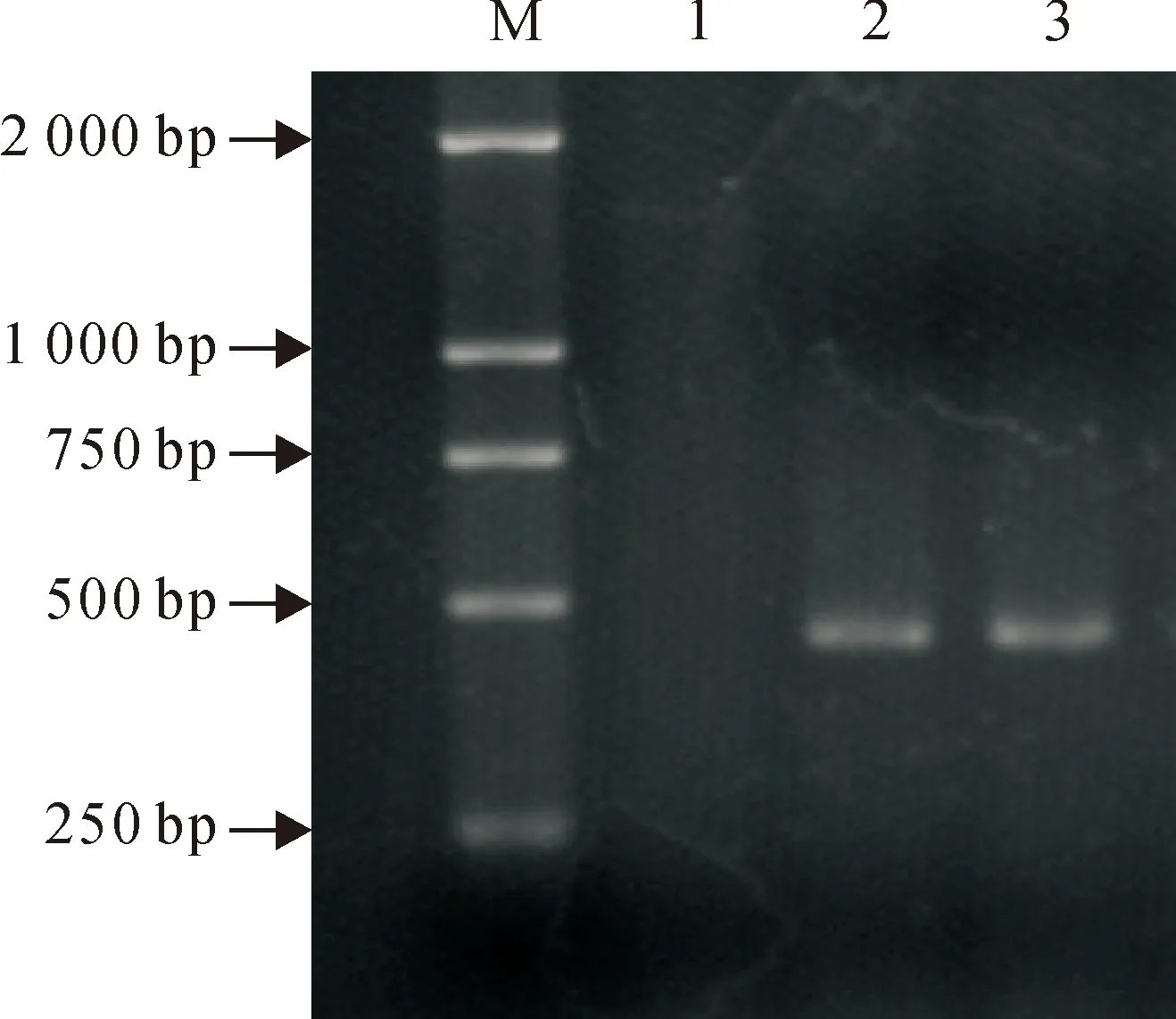
M.DNA标准DL 2 000;1.阴性对照;2.阳性对照;3.VP2基因PCR产物
M.DNA Marker DL 2 000 1.Negative control;2.Positive control;3.PCR products of VP2 gene
图3CPV的VP2基因PCR圹增结果
Fig.3PCR amplication of CPV VP2 gene
2.4动物回归试验结果
感染7 d后,试验组的犬出现精神沉郁、食欲下降,进而呕吐、腹泻、粪便带有犬细小病毒特有的腥臭味。对照组犬正常。
3 讨论
疫病防治一直是小熊猫人工饲养过程中的主要内容之一,尤其是一些重大传染病,如犬瘟热等,对小熊猫健康生存威胁巨大。犬细小病毒病对犬等动物的危害已经非常明确,但该病对小熊猫的危害至今仍不是很明确。2006年,对从国内10个动物园中无临床症状的圈养小熊猫采集的71份肛拭子和61份唾液拭子进行CPV检测,检出3个CPV阳性样品(其中北京动物园2个,云南野生动物园1个),并从云南野生动物园小熊猫样品中分离到1株CPV。作者单位现饲养的20多只小熊猫,也在前年例行的健康检查中,通过PCR检测发现2份肛门拭子样品CPV阳性,这些结果表明CPV对小熊猫也具有感染性[12]。本研究通过细胞培养技术从福州发病小熊猫体内分离到1株CPV野毒株,VP2基因PCR扩增产物测序结果显示这一毒株为CPV。这是到目前为止我国第2株从小熊猫体内分离到的CPV野毒株。
本次分离到CPV的小熊猫临床有较为典型的犬细小病毒病症状,排出的粪便有难闻的腥臭味、稀、土黄色、暗红色并覆以大量黏液,取粪便分别做犬瘟热病毒、犬细小病毒、犬冠状病毒的快速诊断,结果呈犬细小病毒阳性,其余均为阴性。对小熊猫静脉注射补液,抗生素对症治疗,2 d后死亡。死亡后取粪便做快速诊断,结果CPV阴性。取肠黏膜做犬细小病毒快速诊断,结果強阳性。结合以分离毒株进行的犬攻毒试验结果,显示该毒株属于野生强毒株,而非疫苗株。这一结果表明,CPV感染小熊猫后,也会引起其发病死亡。考虑到近年来我国绝大多数城市及周边环境中流浪猫、犬数量越来越多,圈养小熊猫感染CPV的风险越来越大,提示小熊猫疫病防控中应当将犬细小病毒病列为重点对象之一。
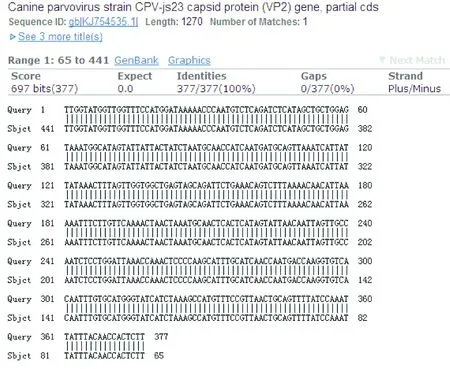
Query:分离毒株;Sbjct:参考序列(KJ754535.1)
本研究从小熊猫分离获得的CPV毒株,对于研发适合本单位小熊猫预防CPV疫苗、开发相应的免疫血清用于自家小熊猫犬细小病毒病紧急预防和治疗等,提供了极有价值的材料。
[1]Parrish Have P,Foreyt W J.The global spread and replacement of canine parvovirus strains[J].J Gen Viorl,1998,69:1111- 1116.
[2]刘静,赵学刚,陆江,等.犬细小病毒病流行病学调查[J].中国畜牧兽医,2013,40(3):199-201.
[3]徐汉坤.犬细小病毒性肠炎[J].畜牧与兽医,1983(1):29-31.
[4]Ikeday Nakamura K,Miyazawa T.Feline host range of canine parvovirus:recent emergence new antigenic types in cats [J].Perspectives,2002,8(4):1-11.
[5]Steinel A,Munson L,van Vuuren M,et al.Genetic characterization of feine parvovirus sequence from various carnivores[J].Gen Virol,2000,81(2):345-350.
[6]Thomas N J,Foreyt W J,Evermann J F,et al.Seroprevalence of canine parvovirus in wild coyotes from Texas,Utah,and Idaho (1972-1983) [J].J AM Vet Med Assoc,1984,185:1283-1287.
[7]韩磊,靳兴军,郭峰,等.狼体内犬细小病毒的分离[J].中国兽医科技,34(1):75-76.
[8]Mech L D,Kuaz H J,Goyal S. Death of a wild wolf from canine parvoviral enteritis[J].J Wildl Dis,1997,33(2):321 -322.
[9]Eugster A K,Nairn C.Diarrhea in puppies:parvovirus-like particles demonstrated in their faces[ J].Southwest Vet,1977,30:59-60.
[10]赵忠鹏,谢之景,夏咸柱,等. 果子狸细小病毒的分离与鉴定[J].特产研究,2003(4):5-11.
[11]张德礼.水貂肠炎病毒疫苗免疫效力指标及动物模型研究[J].实验动物科学与管理,1995,12(1):1-5.
[12]秦琴,张陕宁,李明,等.圈养小熊猫几种病毒的PCR检测[J].兽类学报,2006,26(4):387-391.
Isolation and Identification of CPV Fuzhou Strain from Red Panda
XU Su-hui
(Centre of Straits(Fuzhou) Giant Panda Research and Exchangement,Fuzhou,Fujian,350001,China)
To isolate and identify a CPV strain from a captive red panda,blood samples and rectal and saliva swabs were collected from the red panda with typic symptoms of canine parvovirus disease.After pretreatment,samples were detected by PCR,and inoculated in F81 cells.The F81 cell cultures with CPE were collected and identified by PCR,and used to challenage yang dogs.The results showed that,blood samples,rectal and saliva swabs were CPV positive,and CPE appeared in third F81 cell blind passage,and the PCR products were sequenced and identified as CPV.The challenaged dogs showed typic symptoms of canine parvovirus disease.The results indicated that a CPV strain,which may cause canine parvovirus disease in red pandas,was isolated successufly.
Canine parvovirus;red panda;pathogen isolation
2016-03-16
徐素慧(1975-),女,福建邵武人,硕士研究生,主要从事野生动物疫病防治研究。
S852.655
B
1007-5038(2016)08-0124-04

