氧化钛光催化材料及其在陶瓷中的应用
苏华枝,彭诚,吴建青
(1.华南理工大学材料科学与工程学院,广州 510640;2.佛山市大千色釉料有限公司,佛山 528137)
综述与评述
氧化钛光催化材料及其在陶瓷中的应用
苏华枝1,2,彭诚1,吴建青1
(1.华南理工大学材料科学与工程学院,广州510640;2.佛山市大千色釉料有限公司,佛山528137)
氧化钛具有活性高、稳定性好、无毒和成本低等优点,是目前研究最为广泛的光催化剂之一,也是最有可能制备成光催化陶瓷的材料。本文就TiO2光催化机理、光催化活性的影响因素、纳米TiO2的制备、纳米TiO2的相变、TiO2光催化材料的应用及光催化陶瓷的研究进展进行了综述。
氧化钛;光催化;陶瓷;应用
1 引言
自从1972年日本学者Fujishima和Honda发现在半导体TiO2电极上能光催化分解水制备氢气以来[1],TiO2光催化技术引起了科技工作者极大的关注[2-9]。随后1976年,加拿大科学家等研究发现在紫外光照射下,纳米TiO2可使难降解的有机物联苯及氯化联苯分解[10]。随着能源和环境问题的日益突出,半导体光催化技术受到广泛的重视,并取得迅速的发展[11-14]。目前,广泛研究的半导体光催化剂多为n型半导体化合物[12,15-21],如:TiO2、ZnO、CdS、ZnS、MoO3、WO3等。其中,TiO2以催化活性高、稳定性好、无毒以及成本低等优点而倍受青睐[22-26]。TiO2具有降解有机污染物、净化空气、抗菌和自清洁等方面的应用潜能[11-13]。但由于TiO2的禁带较宽和难以牢固负载在载体上等关键技术难题,其发展和应用受到严重制约[13,27-29]。
TiO2光催化材料是利用禁带较宽具有的较强的氧化还原能力,将有害的物质分解。它在玻璃、陶瓷、纺织材料等方面的应用近年来倍受人们的关注,已成为国际上的一个研究热点[30-36]。其中,光催化陶瓷具有安全、无毒、抗菌、除臭、自清洁等功能,在污水处理、废气净化、防雾、自清洁、抗菌等方面具有广阔的应用前景。
目前,TiO2光催化陶瓷的制备方法一般是将TiO2光催化剂或以TiO2为主的光催化剂以喷、涂、镀等方式覆膜于陶瓷表面上,再通过二次热处理制备而成的[30-34]。其中,最常用的是TiO2溶胶涂膜的方法[31]。这些喷、涂、镀覆膜的热处理温度一般低于800℃,目的是使得TiO2以具有较强光催化能力的锐钛矿相存在于覆膜中。但正是由于热处理温度较低,且没有高温液相出现,使得玻璃或陶瓷表面上的光催化涂层的附着性能较差,在使用过程中容易磨损、脱落,使得光催化能力降低[37-40]。提高热处理温度,增加光催化涂层和基材之间的附着力是提高其耐磨性和使用寿命的有效方法[28,41]。但具有较高光催化性能的锐钛矿相TiO2是亚稳定相,在高温热处理下极易不可逆地转换为光催化能力较弱的金红石相,解决这一矛盾是制备TiO2光催化陶瓷的关键[32,33]。
2 TiO2光催化机理
TiO2具有半导体材料的结构和特性是其能作为光催化剂的主要原因。一般半导体的能带结构由一个充满电子的最高价带VB及没有充满电子的最低导带CB构成,中间隔以禁带。当光子的能量hν大于或者等于半导体的禁带宽度Eg时,半导体吸收光子能量,在导带上形成光生电子e-,相应在价带上形成光生空穴h+。由于半导体的能带间缺少连续区域,电子-空穴对一般有皮秒级的寿命,足以使光生电子和光生空穴向吸附在半导体表面的物质转移。处于激发态的光生电子和空穴有两种可能的路径,一种是参与光催化反应:空穴夺取表面被吸附物质的电子,使原来不吸收光的物质被活化并被氧化,而电子受体可以捕获催化剂表面的电子而被还原;另一种是光生空穴和电子发生复合,产生的能量以热或光的形式散发,其具体激发过程如图1所示[42]。

图1 半导体催化剂激发过程示意图
当TiO2吸收能量足够高的光时 (波长通常小于385 nm),将产生电子-空穴对,电子-空穴对可通过体相复合、表面复合或把能量转移给吸附在表面的有机分子而失活。一般而言,TiO2的光催化离不开空气和水溶液,这是因为氧气或水分子与光生电子或空穴结合可产生化学性质极为活跃的超氧离子自由基 (·O2-)和羟基自由基(· OH)。光催化反应过程较为复杂,一般认为有两种可能:一种是认为电子-空穴对直接与反应物发生作用,即直接反应机理;另一种认为电子-空穴对通过生成自由基将各种有机物氧化为CO2和H2O等无机小分子,即自由基间接反应机理。
其中,自由基间接反应机理可用以下的反应式表示[43]:
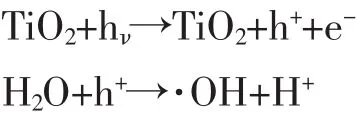
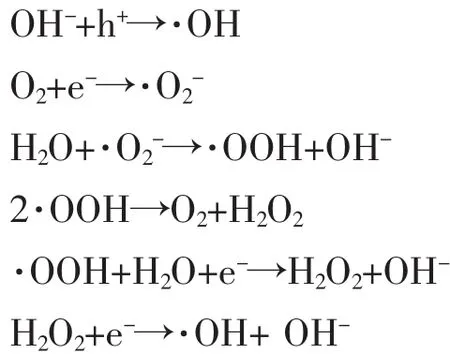
3 TiO2光催化活性的影响因素
从光催化机理可以看出,要提高光催化活性,必须提高光催化的量子效率,即抑制光生电子-空穴对的复合,提高电子-空穴对参与反应的效率。
3.1晶体结构
TiO2有三种晶型结构:锐钛矿型、金红石型和板钛矿型。其中锐钛矿型和板钛矿型属于亚稳定相,金红石型属于稳定相。板钛矿型属于正交晶系,一般难以制备,目前很少研究。锐钛矿型和金红石型属于四方晶系,均可以用TiO6八面体表示,但TiO6八面体的连接方式和畸变程度不同。如图2所示,锐钛矿中每个八面体与周围的8个八面体以4个共边4个共顶角相连;而金红石中每个八面体与周围10个八面体以2个共边8个共顶角相连。这些结构上的差异导致了两种晶型有不同的质量密度和电子能带结构,锐钛矿的质量密度(3.894 g·cm-3)略小于金红石(4.250 g·cm-3),锐钛矿的能带(3.2 eV)略大于金红石(3.0 eV)。一般金红石型TiO2对氧气吸附能力较差,缺陷较少,晶粒尺寸较大同时比表面积较小,因此其光催化活性要低于锐钛矿型[43]。但当两种晶型结构的TiO2混合时,其光催化活性可能会更高,该现象称为混晶效应,如:商业P25 TiO2催化剂为例,它由25%的金红石和75%的锐钛矿组成,其活性高于由25%金红石和75%锐钛矿直接机械混合组成的催化剂。
3.2晶粒尺寸

图2 TiO2锐钛矿型和金红石型结构示意图
当TiO2晶粒尺寸减小到纳米级时,其具有与块体不同的独特性能,除了高比表面积和高吸附性能外,还有量子尺寸效应和小尺寸效应等特殊光响应性质。一般来说,比表面积与吸附性能有关,高的吸附性能有利于光生电子-空穴对与被吸附物质之间的反应。量子尺寸效应是指当半导体的尺寸与电荷载体的德布罗意波波长相当时,会引起激发态能级变大,禁带宽度变宽,吸收阀值蓝移。能隙的变宽会抑制光生载流子的移动性,从而减少其复合率。小尺寸效应是指由于纳米粒子的粒径小于空间电荷层厚度,因而光生载流子可以通过简单的扩散就能从粒子的内部迁移到表面,进而与吸附在其表面的物质发生反应。有计算表明:10 nm和100 nm的TiO2粒子中电子从体相扩散至表面的时间分别为1 ps和10 ns,而电子和空穴的复合时间约为10 ns[44]。可见对于纳米粒子来说,光生电子-空穴对在未复合前就可能到达表面,有效地减小了电子-空穴的复合率,从而提高其光催化活性。
3.3光催化剂改性
TiO2改性的常见方法有:贵金属沉积、半导体复合、金属离子掺杂、非金属元素掺杂和表面光敏化等[45-50]。其中,半导体表面贵金属沉积被认为是一种有效的捕获光生电子的方法;复合半导体可获得比单一TiO2体系更广阔的光响应范围;金属离子和非金属元素的掺杂可拓展TiO2的激发光波长范围至可见光区和提高光催化的反应效率;半导体的光敏化是通过物理或化学吸附的形式将光敏剂固定在半导体表面,进而利用光敏剂对可见光的有效吸收将半导体材料的光吸收范围延伸到可见光区。
4 纳米TiO2的制备方法
目前,纳米TiO2的制备方法主要分为液相法、气相法和固相法。液相法包括:溶胶-凝胶法、水热法、水解法和微乳液法等;气相法包括:物理气相沉积法和化学气相沉积法;固相法包括:氧化还原法和热分解法[43]。其中,液相法由于合成温度低、设备简单、易操作和成本低等优点被广泛采用。
4.1溶胶-凝胶法
溶胶-凝胶法以钛醇盐Ti(OR)4为原料在溶剂中形成均相溶液,加水使钛醇盐水解,发生缩聚反应形成溶胶,经陈化后形成凝胶,最后经过干燥研磨煅烧得到纳米TiO2粉体。
4.2水热法
水热法是在一个特制的密闭反应容器(高压釜)内,采用水溶液为反应介质,通过高温高压的反应环境,使得通常难溶或不溶的物质溶解并重结晶。该方法制备的粉体结晶良好,不需要后期再高温处理,避免了粉体的硬团聚,而且可以实现粉体粒径、晶型等特征的控制。水热法制备纳米TiO2粉体常采用TiO2粉末或TiO2溶胶为前躯体。
4.3水解法
水解法是通过醇盐水解、均相成核和生长,在液相中生成沉淀产物,再经过液固分离、干燥和煅烧得到纳米TiO2粉体。
4.4微乳液法
微乳液法是由表面活性剂、助表面活性剂、油和水组成。它可分为O/W型微乳液和W/O微乳液。其反应机理是:当两者微乳液混合后,由于胶团颗粒的碰撞,发生了水核内物质间的相互交换和传递,当水核内粒子化学反应长大到一定尺寸,表面活性剂分子将附在粒子表面,使粒子稳定并防止其进一步长大。最后,通过离心或加入水和丙酮混合液,使超细颗粒与微乳液分离,再用有机溶剂清洗去除附在粒子表面的油和表面活性剂,最后在一定温度下干燥煅烧后得到超细粉体。
5 纳米TiO2的负载
催化剂负载是解决纳米粉体利用和回收的有效途径,常见的负载方法有两种[51-56]:一是通过浸渍、共沉淀等方法将纳米TiO2粉末直接负载在载体上,常见的载体有二氧化硅、三氧化二铝、玻璃纤维、微孔玻璃和沸石等。二是先将TiO2的前驱体负载在载体上,经过热处理后使前驱体转变成TiO2。但往往由于附着力较弱,负载的催化剂在反应过程中容易出现活性组成流失,导致催化效率下降,这一问题可以通过高温热处理解决。另一方面,如果负载后大部分催化剂活性组分被包裹或填埋在载体内部,将不利于光催化反应的进行。因此,如何实现光催化剂的表面负载化和固定化是纳米TiO2应用的重要方向。
6 纳米TiO2的相变及影响因素
从热力学角度来看,锐钛矿相TiO2是亚稳定相,金红石相是稳定相,锐钛矿相经过一定温度的热处理后会不可逆转变成金红石相。由于使用的原料和合成条件的不同,相变温度范围一般在400~1200℃[57]。影响TiO2晶型转变的因素有以下几个方面。
6.1温度
TiO2由锐钛矿结构转变成金红石结构是一种不可逆相变,这种转变是温度和时间的函数。要实现TiO2彻底的相变,通常需要较高的热处理温度和较长的保温时间[58]。
6.2颗粒尺寸
根据临界尺寸理论,当晶粒尺寸减小到一定值时,锐钛矿相比金红石相更稳定。根据热力学分析,该尺寸一般在10~15 nm之间[59-64]。当颗粒尺寸高于临界尺寸时,粒度越小,相变温度越低;粒度越大,相变温度越高。研究表明,减小颗粒尺寸能有效地降低相变活化能,从而导致相变起始温度的降低[65-68]。因此,通常情况下纳米TiO2的相变温度低于600℃。
6.3杂质
大量研究表明杂质可以抑制或促进锐钛矿相转变成金红石相[49,57],当杂质以取代的形式进入锐钛矿的晶格形成固溶体,将影响到氧缺陷的数量,从而促进或抑制相变的进行。当杂质以置换的形式进入锐钛矿的晶格形成固溶体,将会导致晶格的失稳或稳定,这取决于杂质尺寸的大小,价态和含量的影响,从而促进或抑制相变的进行。当杂质超出可溶的限制,多余的杂质将会析出,通过异相成核促进相变的进行。
(1)阳离子掺杂
尺寸小和低价态的阳离子取代Ti4+后,会增加氧缺陷数量,从而加速相变的进行;反之,尺寸大和高价态的阳离子取代Ti4+后,会减少氧缺陷数量,从而抑制相变的进行,如图3所示。
(2)阴离子掺杂
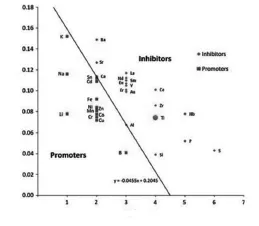
图3 阳离子尺寸/价态对TiO2相变的影响
阴离子对相变的抑制或促进作用可能取决于尺寸和电荷的影响,它们的影响依次是:Cl->N3->O2->F-。
6.4气氛
金红石常出现晶格缺氧,其表达式可写作为TiO2-x。因此,为了保持化学计量比平衡,常会在晶格外出现钛离子,杂质或低于4价的掺杂物。锐钛矿中的氧缺陷常被认为可以促进相变的发生是由于氧缺陷有利于离子的重排。
与掺杂相比,烧成的气氛也可能影响到相变的进行[69-71]。中性气氛(如惰性气体)或还原气氛(如氢气)可增加锐钛矿晶格的氧缺陷数量(相比在空气下),因此会促进相变的进行。相反,在空气或氧气下能减少氧缺陷的数量,从而抑制相变的进行。
6.5颗粒边界的影响
当掺入难溶的氧化物时,在颗粒边界形成阻碍物,制约了晶粒的生长和减少颗粒间的接触,有效地阻碍了相变的进行[72-76]。常见的有:SiO2和Al2O3等。
7 TiO2光催化材料的应用
能源短缺和环境污染是全世界都在关注的焦点问题,纳米TiO2作为最主要光催化材料,在解决能源和环境问题上倍受重视,期待其可应用在制备新能源和解决环境污染上。
7.1制备氢气
纳米TiO2光照产生的光生电子-空穴对,具有分解水生成氢气和氧气的能力[77-82]。其中,光生电子e-能还原H2O产生H2,而光生空穴h+能氧化H2O产生O2。但在实际反应过程中,由于半导体能带弯曲及表面过电位等因素的影响,往往需要加入牺牲剂来提高水分解反应的光催化反应活性。当缺少还原性牺牲剂时,光生电子-空穴迅速复合,使得能参与氧化还原的电子-空穴对大大减少。时间分辨光谱法研究也表明,超过90%的光生电子-空穴在激发后快速复合,这正是影响光催化活性的重要因素[83]。
7.2污水处理
利用光催化反应,可对水中的含氯有机物、染料、表面活性剂和苯酚等进行有效的分解[15,84]。此方法特别适用于处理生物或一般化学方法难以处理的芳烃和芳香化合物等难降解物,其具有氧化能力强,没有选择性等特征。
此外,纳米TiO2光催化还能有效解决汞、铅、铬等重金属离子的污染问题。当金属离子接触到处于激发态的TiO2表面时,通过捕获其表面的光生电子从而发生还原反应,使得高价的金属离子得以降解。
7.3净化空气
利用光催化氧化技术,可在室温下利用空气中的氧气和水蒸气去除空气中的有害污染物,如甲醛、硫化物和氮化物等[85-87]。例如,将TiO2制作成涂料,对NOx进行有效的降解,达到消除大气中氮氧化物的目的。当NO及NO2吸附到涂料上,与TiO2表面产生的超氧离子自由基和羟基自由基发生氧化还原反应,生成硝酸。另外,在隧道内照明灯灯罩上涂上TiO2涂层,可以有效除去汽车排出的尾气中带有的NOx等废气。作为净化涂料,同时还能降解大气中如硫化物、醛类、卤代烃、多环芳烃等污染物,具有广阔的应用前景。
7.4抗菌除臭
微生物多由蛋白质构成,常用的杀菌剂如银能使细胞失去活性,但细菌被杀死后,仍然会释放出内毒素等有害的成份。但TiO2光催化材料不仅能杀死细菌,还能降解细菌释放出的有害物质,从而彻底消除细菌的危害[88-91]。研究表明,TiO2光催化材料对大肠杆菌、沙门氏菌、金色葡萄球菌、芽枝菌、曲霉和绿脓杆菌等均有很强的杀菌能力。实验显示,当细菌吸附在TiO2表面时,超氧离子自由基和羟基自由基能破坏细胞膜,进入细菌体内,阻止成膜物质的传输,切断其呼吸系统,从而杀灭细菌。因此,TiO2在抗菌除臭等方面倍受重视。
7.5防雾与自清洁
TiO2在紫外光照射下,除了具有强氧化还原能力外,还具有超亲水超疏水的特性。利用这一性质,制备TiO2薄膜,使得空气中的水分子或水蒸气无法在上面形成单个水滴,而是形成水膜均匀铺展在表面上,避免发生光散射现象。若将两种特性结合起来,就能形成长期防污和自清洁的作用[92-98]。
此外,TiO2的研究主要集中在扩展其光响应范围和提高量子效率上,但进展缓慢[99,100]。在负载方面依然以薄膜形式为主,离实际应用还有一定的距离[101]。
8 二氧化钛光催化陶瓷
TiO2由于具有光催化活性高、化学性能稳定、无毒和成本低等优点,将TiO2附着在陶瓷表面,可使传统的陶瓷具备抗菌除臭、净化空气和自清洁等功能,成为具有实际应用意义的新材料。最早,研究人员通过sol-gel法在陶瓷表面涂覆上一层TiO2前躯体,经400~500℃煅烧后得到一层TiO2薄膜[31,37]。虽然所得薄膜的光催化性能好,但其附着性能差,不耐磨易脱落,难以满足实际应用的要求[37-40]。此外,sol-gel法制备的薄膜需要涂覆数次才能达到一定的厚度(例如10次以上才能达到1 μm)。L.Zan等[54]提出将通过沉淀法制备而得的TiO2浆体一次涂覆在含釉陶瓷表面,在800℃下保温一定时间得到嵌入型陶瓷基纳米TiO2薄膜。为了避免TiO2薄膜脱离,以TOTO公司为代表,通过使用粘结剂层的方法使得光催化剂层固定在基材上。例如,先在陶瓷基材表面喷涂一层SiO2-Al2O3-Na/K2O玻璃料组成的粘结剂层,再涂布由TiCl4经水热法制备的TiO2溶胶水溶液,在一定温度下焙烧。当粘结剂层软化温度为680℃时,焙烧温度越高,抗菌性能越差,耐磨性能越好,抗菌性能差一是由于TiO2颗粒相转变为金红石;二是焙烧温度与粘结剂层的软化温度相差太大时,粘结剂层熔化,黏度变低,使得TiO2颗粒埋在粘结剂层中无法发挥光催化作用。但这有利于TiO2颗粒和粘结剂层的结合,有利于耐磨性能的提高。
对于陶瓷材料有人尝试过将具有热稳定性的改性TiO2粉体均匀涂覆在陶瓷釉面上,再在一定温度下热处理制备而得。例如曾志超等[32]将Si/Al/P改性的TiO2与釉混合后涂在陶瓷表面,在800℃热处理后,改性的TiO2与釉料复合在一起附着在陶瓷表面。由于热处理温度较低,釉料中液相较少,TiO2颗粒未被釉料完全覆盖,部分能暴露在空气中使其呈现出一定的光催化活性。但由于液相较少,未达到烧结程度,涂层与基体的附着力有限。D. Penner等[33]将Si/Al改性的TiO2涂覆在陶瓷表面并在1080℃下热处理。虽然煅烧温度提高了,但是选用的釉料是建筑陶瓷中不用的Ca-Ba-B釉,其熔融温度高,所得涂层未达到烧结程度,表面粗糙。该改性粉体在常用的以钾、钠为熔剂的釉料中不具备高温热稳定性能。因此 ,虽然通过降低烧成温度或选用高熔融温度的釉料可达到高温烧成,但都是未到达烧结程度,其附着性能以及产品表面光洁程度均未达到最佳,这必将影响其美观和耐磨性能,而且不能与陶瓷的使用寿命相匹配。在烧结温度下同时实现光催化性能和附着性能,是制备负载型TiO2光催化陶瓷的关键。提高煅烧温度对提高涂层和基材的结合性能有利,即对涂层的耐磨性能有利。但TiO2经高温煅烧后会发生不可逆的相变,光催化活性高的锐钛矿相会转变成活性低的金红石相。因此,不管是Si/Al/P改性TiO2粉体还是的Si/Al改性TiO2粉体,在建筑陶瓷中常用的以钾、钠为主要熔剂的釉料中都难以保持高的稳定性能。此外,烧结温度下TiO2颗粒“埋没”在釉层中的问题也是需要克服的。
因此,在以钾、钠为主要熔剂的釉料中制备具有高温稳定的锐钛矿TiO2,以及克服TiO2颗粒在烧结过程中“埋没”在釉层中的问题都是亟待解决的难题,是制备具有一定的抗菌除臭、净化空气和自清洁的能力,并且具有与陶瓷使用寿命相匹配的TiO2光催化陶瓷的关键。
[1]Fujishima A.,Honda K.Photolysis-decomposition of water at the surface of an irradiated semiconductor[J].Nature,1972,238 (5385):37~8.
[2]O'regan B.,Grtzeli M.A low-cost,high-efficiency solar cell based on dye-sensitized colloidal TiO2films[J].Nature,1991,353 737~40.
[3]Bach U.,Lupo D.,Comte P.,et al.Solid-state dye-sensitized mesoporous TiO2solar cells with high photon-to-electron conversion efficiencies[J].Nature,1998,395(6702):583~5.
[4]Yu J.C.,Yu J.,Ho W.,et al.Effects of F-doping on the photocatalytic activity and microstructures of nanocrystalline TiO2powders[J].Chem Mater,2002,14(9):3808~16.
[5]Ohno T.,Mitsui T.,Matsumura M.Photocatalytic activity of S-doped TiO2photocatalyst under visible light[J].Chem Lett,2003,32(4):364~5.
[6]Ito S.,Zakeeruddin S.M.,Humphry-Baker R.,et al.High Efficiency Organic Dye Sensitized Solar Cells Controlled by Nanocrystalline TiO2Electrode Thickness[J].Adv Mater,2006,18 (9):1202~5.
[7]Matsumoto T.,Iyi N.,Kaneko Y.,et al.High visible-light photocatalytic activity of nitrogen-doped titania prepared from layered titania/isostearate nanocomposite[J].Catal Today,2007,120(2):226~32.
[8]Shen H.,Mi L.,Xu P.,et al.Visible-light photocatalysis of nitrogen-doped TiO2nanoparticulate films prepared by lowenergy ion implantation[J].Appl Surf Sci,2007,253(17):7024~8.
[9]Irie H.,Miura S.,Kamiya K.,et al.Efficient visible lightsensitive photocatalysts:Grafting Cu(II)ions onto TiO2and WO3photocatalysts[J].Chem Phys Lett,2008,457(1):202~5.
[10]Carey J.H.,Oliver B.G.Intensity effects in the electrochemical photolysis of water at the TiO2electrode[J].1976.
[11]Paz Y.Application of TiO2photocatalysis for air treatment:Patents'overview[J].Appl Catal,B,2010,99(3):448~60.
[12]Hoffmann M.R.,Martin S.T.,Choi W.,et al.Environmental applications of semiconductor photocatalysis[J].Chem Rev,1995,95(1):69~96.
[13]Hashimoto K.,Irie H.,Fujishima A.TiO2Photocatalysis:A Historical Overview and Future Prospects[J].Japanese Journal of Applied Physics Part 1 Regular Papers Short Notes and Review Papers,2005,44(12):8269.
[14]Ochiai T.,Fujishima A.Photoelectrochemical properties of TiO2photocatalyst and its applications for environmental purification [J].J Photochem Photobiol,C,2012.
[15]Mills A.,Davies R.H.,Worsley D.Water purification by semiconductor photocatalysis[J].Chem Soc Rev,1993,22(6):417~25.
[16]Chen D.,K Ray A.Removal of toxic metal ions from wastewater by semiconductor photocatalysis[J].Chem Eng Sci,2001,56(4):1561~70.
[17] RobertsonP.K.Semiconductorphotocatalysis: an environmentally acceptable alternative production technique and effluent treatment process[J].J Cleaner Prod,1996,4(3):203~12.
[18]Zou Z.,Ye J.,Sayama K.,et al.Direct splitting of water under visiblelightirradiationwithanoxidesemiconductor photocatalyst[J].Nature,2001,414(6864):625~7.
[19]Fox M.A.,Dulay M.T.Heterogeneous photocatalysis[J].Chem Rev,1993,93(1):341~57.
[20]Zhang P.-y.,Yu G.,Jiang Z.-p.Review of semiconductor photocatalyst and its modification[J].Advances in Environmental Science,1997,5(3):1~10.
[21]Sayama K.,Mukasa K.,Abe R.,et al.A new photocatalytic water splitting system under visible light irradiation mimicking a Z-scheme mechanism in photosynthesis[J].J Photochem Photobiol,A,2002,148(1):71~7.
[22]Choi Y.,Umebayashi T.,Yoshikawa M.Fabrication and characterization of C-doped anatase TiO2photocatalysts[J].J Mater Sci,2004,39(5):1837~9.
[23]Wang Y.,Cheng H.,Hao Y.,et al.Preparation,characterization and photoelectrochemical behaviors of Fe(III)-doped TiO2nanoparticles[J].J Mater Sci,1999,34(15):3721~9.
[24]Porter J.F.,Li Y.-G.,Chan C.K.The effect of calcination on themicrostructural characteristics andphotoreactivityof Degussa P-25 TiO2[J].J Mater Sci,1999,34(7):1523~31.
[25]Li X.,Xiong R.,Wei G.S-N Co-doped TiO2photocatalysts with visible-light activity prepared by sol-gel method[J].Catal Lett,2008,125(1~2):104~9.
[26]Mathews N.,Jacome M.,Morales E.R.,et al.Structural and spectroscopic study of the Fe doped TiO2thin films for applications in photocatalysis[J].physica status solidi(c),2009,6(S1):S219~S23.
[27]Kumar S.G.,Devi L.G.Review on modified TiO2photocatalysis under UV/visible light:selected results and related mechanisms on interfacial charge carrier transfer dynamics[J].J Phys ChemA,2011,115(46):13211~41.
[28]Chen Y.,Dionysiou D.D.Effect of calcination temperature on the photocatalytic activity and adhesion of TiO2films prepared by the P-25 powder-modified sol-gel method[J].J Mol Catal A:Chem,2006,244(1):73~82.
[29]Li H.,BianZ.,ZhuJ.,et al.Mesoporous Au/TiO2nanocomposites with enhanced photocatalytic activity[J].J Am Chem Soc,2007,129(15):4538~9.
[30]Marcos P.S.,Marto J.,Trindade T.,et al.Screen-printing of TiO2photocatalyticlayers onglazedceramictiles[J].J Photochem Photobiol,A,2008,197(2~3):125~31.
[31]Bondioli F.,Taurino R.,Ferrari A.M.Functionalization of ceramic tile surface by sol-gel technique[J].J Colloid Interf Sci,2009,334(2):195~201.
[32]Zeng Z.,Peng C.,Hong Y.,et al.Fabrication of a Photocatalytic Ceramic by Doping Si-,P-,and Zr-Modified TiO2Nanopowders in Glaze[J].J Am Ceram Soc,2010,93(10):2948~51.
[33]Hofer M.,Penner D.Thermally stable and photocatalytically active titania for ceramic surfaces[J].J Eur Ceram Soc,2011,31(15):2887~96.
[34]Carneiro J.,Teixeira V.,Azevedo S.,et al.Development of photocatalytic ceramic materials through the deposition of TiO2nanoparticles layers[J].J Nano Res,2012,18 165~76.
[35]Lee C.-S.,Kim J.,Son J.,et al.Photocatalytic functional coatings of TiO2thin films on polymer substrate by plasma enhanced atomic layer deposition[J].Appl Catal,B,2009,91 (3):628~33.
[36]Lee J.A.,Krogman K.C.,Ma M.,et al.Highly Reactive Multilayer-Assembled TiO2Coating on Electrospun Polymer Nanofibers[J].Adv Mater,2009,21(12):1252~6.
[37]Kajitvichyanukul P.,Amornchat P.Effects of diethylene glycol on TiO2thin film properties prepared by sol-gel process[J].Sci Technol Adv Mat,2005,6(3):344~7.
[38]Park S.,DiMasi E.,Kim Y.-I.,et al.The preparation and characterization of photocatalytically active TiO2thin films and nanoparticles using Successive-Ionic-Layer-Adsorption-and-Reaction[J].Thin Solid Films,2006,515(4):1250~4.
[39]Habibi M.H.,Nasr-Esfahani M.,Egerton T.A.Preparation,characterizationandphotocatalyticactivityofTiO2/ Methylcellulose nanocomposite films derived from nanopowder TiO2and modified sol-gel titania[J].J Mater Sci,2007,42(15):6027~35.
[40]Liang S.,Chen M.,Xue Q.Deposition behaviors and patterning of TiO2thin films on different SAMs surfaces from titanium sulfate aqueous solution[J].Colloids Surf,A,2008,324(1):137~42.
[41]Tsuge Y.,Kim J.,Sone Y.,et al.Fabrication of transparent TiO2film with high adhesion by using self-assembly methods:Application to super-hydrophilic film[J].Thin Solid Films,2008,516(9):2463~8.
[42]Linsebigler A.L.,Lu G.,Yates Jr J.T.Photocatalysis on TiO2surfaces:principles,mechanisms,and selected results[J].Chem Rev,1995,95(3):735~58.
[43]高濂,郑珊,张青红.纳米氧化钛光催化材料及应用[M].北京:化学工业出版社,2002.
[44]李新勇,李树本.纳米半导体研究进展[J].化学进展,1996,8 (3):231~9.
[45]XuA.-W.,GaoY.,LiuH.-Q.ThePreparation,Characterization,and their Photocatalytic Activities of Rare-Earth-Doped TiO2Nanoparticles[J].J Catal,2002,207(2):151~7.
[46]Venkatachalam N.,Palanichamy M.,Arabindoo B.,et al. Alkaline earth metal doped nanoporous TiO2for enhanced photocatalytic mineralisation of bisphenol-A[J].Catal Commun,2007,8(7):1088~93.
[47]Chen X.,Burda C.The electronic origin of the visible-light absorption properties of C-,N-and S-doped TiO2nanomaterials [J].J Am Chem Soc,2008,130(15):5018~9.
[48]Panagiotopoulou P.,Kondarides D.I.Effects of alkali additives on the physicochemical characteristics and chemisorptive properties of Pt/TiO2catalysts[J].J Catal,2008,260(1):141~9.
[49]Zaleska A.Doped-TiO2:a review[J].Recent Patents on Engineering,2008,2(3):157~64.
[50]Panagiotopoulou P.,Kondarides D.I.Effects of alkali promotion of TiO2on the chemisorptive properties and water-gas shift activity of supported noble metal catalysts[J].J Catal,2009,267 (1):57~66.
[51]Choi Y.S.,Kim B.W.Photocatalytic disinfection of E coli in a UV/TiO2-immobilised optical-fibre reactor[J].J Chem Technol Biot,2000,75(12):1145~50.
[52]Lee J.-C.,Kim M.-S.,Kim B.-W.Removal of paraquat dissolved in a photoreactor with TiO2immobilized on the glasstubes of UV lamps[J].Water Res,2002,36(7):1776~82.
[53]Ao C.,Lee S.Enhancement effect of TiO2immobilized on activated carbon filter for the photodegradation of pollutants at typical indoor air level[J].Appl Catal,B,2003,44(3):191~205.
[54]Zan L.,Peng Z.-H.,Xia Y.-L.,et al.Novel route to prepare TiO2-coated ceramic and its photocatalytic function[J].J Mater Sci,2004,39(2):761~3.
[55]Lizama C.,Bravo C.,Caneo C.,et al.Photocatalytic degradation of surfactants with immobilized TiO2:comparing two reaction systems[J].Environ Technol,2005,26(8):909~14.
[56]Takeuchi M.,Deguchi J.,Hidaka M.,et al.Enhancement of the photocatalytic reactivity of TiO2nano-particles by a simple mechanical blending with hydrophobic mordenite(MOR)zeolite [J].Appl Catal,B,2009,89(3):406~10.
[57]Hanaor D.A.,Sorrell C.C.Review of the anatase to rutile phase transformation[J].J Mater Sci,2011,46(4):855~74.
[58]Gnaser H.,Lsch J.,Orendorz A.,et al.Temperature-depen dent grain growth and phase transformation in mixed anataserutile nanocrystalline TiO2films[J].physica status solidi(a),2011,208(7):1635~40.
[59]Banfield J.Thermodynamic analysis of phase stability of nanocrystalline titania[J].J Mater Chem,1998,8(9):2073~6.
[60]Wang C.-C.,Ying J.Y.Sol-gel synthesis and hydrothermal processing of anatase and rutile titania nanocrystals[J].Chem Mater,1999,11(11):3113~20.
[61]Chen P.-L.,Kuo C.-T.,Pan F.-M.,et al.Preparation and phase transformation of highly ordered TiO2nanodot arrays on sapphire substrates[J].Appl Phys Lett,2004,84 3888.
[62]Reidy D.J.,Holmes J.D.,Nagle C.,et al.A highly thermally stable anatase phase prepared by doping with zirconia and silica coupled to a mesoporous type synthesis technique[J].J Mater Chem,2005,15(34):3494~500.
[63]Reidy D.,Holmes J.,Morris M.The critical size mechanism for the anatase to rutile transformation in TiO2and doped-TiO2[J].J Eur Ceram Soc,2006,26(9):1527~34.
[64]Baiju K.,Shukla S.,Sandhya K.,et al.Photocatalytic activity of sol-gel-derived nanocrystalline titania[J].The Journal of Physical Chemistry C,2007,111(21):7612~22.
[65]Li W.,Ni C.,Lin H.,et al.Size dependence of thermal stability of TiO2nanoparticles[J].J Appl Phys,2004,96(11):6663~8.
[66]Ghosh T.,Dhabal S.,Datta A.On crystallite size dependence of phase stability of nanocrystalline TiO2[J].J Appl Phys,2003,94 (7):4577~82.
[67]Lee G.H.,Zuo J.M.Growth and Phase Transformation of Nanometer-Sized Titanium Oxide Powders Produced by the Precipitation Method[J].J Am Ceram Soc,2004,87(3):473~9.
[68]Huber B.,Brodyanski A.,Scheib M.,et al.Nanocrystalline anatase TiO2thin films:preparation and crystallite sizedependent properties[J].Thin Solid Films,2005,472(1):114~24.
[69]Pan X.,Ma X.Phase transformations in nanocrystalline TiO2milled in different milling atmospheres[J].J Solid State Chem,2004,177(11):4098~103.
[70]Riyas S.,Yasir V.A.,Das P.M.Crystal structure transformation of TiO2in presence of Fe2O3and NiO in air atmosphere[J].B Mater Sci,2002,25(4):267~73.
[71]Robben L.,Ismail A.A.,Lohmeier S.J.,et al.Facile synthesis of highly ordered mesoporous and well crystalline TiO2:Impact of different gas atmosphere and calcination temperatures on structural properties[J].Chem Mater,2012,24(7):1268~75.
[72]Lee D.-W.,Ihm S.-K.,Lee K.-H.Mesostructure control using a titania-coated silica nanosphere framework with extremely high thermal stability[J].Chem Mater,2005,17(17):4461~7.
[73]Okada K.,Yamamoto N.,Kameshima Y.,et al.Effect of Silica Additive on the Anatase-to-Rutile Phase Transition[J].J Am Ceram Soc,2001,84(7):1591~6.
[74]Schiller R.,Weiss C.K.,Landfester K.Phase stability and photocatalytic activity of Zr-doped anatase synthesized in miniemulsion[J].Nanotechnology,2010,21(40):405~603.
[75]Lee J.E.,Oh S.-M.,Park D.-W.Synthesis of nano-sized Al doped TiO2powders using thermal plasma[J].Thin Solid Films,2004,457(1):230~4.
[76]Yang J.,Huang Y.,Ferreira J.M.F.Inhibitory effect of alumina additive on the titania phase transformation of a sol--gelderived powder[J].J Mater Sci Lett,1997,16(23):1933~5.
[77]Chen X.,Shen S.,Guo L.,et al.Semiconductor-based photocatalytic hydrogen generation[J].Chem Rev,2010,110 (11):6503~70.
[78]Kato H.,Asakura K.,Kudo A.Highly efficient water splitting into H2and O2over lanthanum-doped NaTaO3photocatalysts with high crystallinity and surface nanostructure[J].J Am Chem Soc,2003,125(10):3082~9.
[79]Kho Y.K.,Iwase A.,Teoh W.Y.,et al.Photocatalytic H2evolution over TiO2nanoparticles.The synergistic effect of anatase and rutile[J].The Journal of Physical Chemistry C,2010,114(6):2821~9.
[80]Kitano M.,Tsujimaru K.,Anpo M.Decomposition of water in the separate evolution of hydrogen and oxygen using visible light-responsive TiO2thin film photocatalysts:Effect of the work function of the substrates on the yield of the reaction[J].Appl Catal,A,2006,314(2):179~83.
[81]Shaban Y.A.,Khan S.U.Visible light active carbon modified n-TiO2forefficienthydrogenproductionby photoelectrochemical splitting of water[J].Int J Hydrogen Energ,2008,33(4):1118~26.
[82]Tanaka S.-i.,Iwatani T.,Hirose N.,et al.Effect of hydrogen on the formation of porous TiO2in alkaline solution[J].J Electrochem Soc,2002,149(12):F186~F90.
[83]Navarro Yerga R.M.,?lvarez Galván M.C.,Del Valle F.,et al. Water Splitting on Semiconductor Catalysts under Visible-Light Irradiation[J].ChemSusChem,2009,2(6):471~85.
[84]Han C.,Pelaez M.,Likodimos V.,et al.Innovative visiblelight-activated sulfur doped TiO2films for water treatment[J]. Appl Catal,B,2011,107(1):77~87.
[85]Obee T.N.,Brown R.T.TiO2photocatalysis for indoor air applications:effects of humidity and trace contaminant levels on the oxidation rates of formaldehyde,toluene,and 1,3-butadiene [J].Environ Sci Technol,1995,29(5):1223~31.
[86]Ao C.,Lee S.Indoor air purification by photocatalyst TiO2immobilized on an activated carbon filter installed in an air cleaner[J].Chem Eng Sci,2005,60(1):103~9.
[87]Ao C.,Lee S.,Yu J.C.Photocatalyst TiO2supported on glass fiber for indoor air purification:effect of NOonthe photodegradation of CO and NO2[J].J Photochem Photobiol,A,2003,156(1):171~7.
[88]Tsai T.M.,Chang H.H.,Chang K.C.,et al.A comparative study of the bactericidal effect of photocatalytic oxidation by TiO2on antibiotic-resistant and antibiotic-sensitive bacteria [J].J Chem Technol Biot,2010,85(12):1642~53.
[89]Fu G.,Vary P.S.,Lin C.-T.Anatase TiO2nanocomposites for antimicrobial coatings[J].J Phys ChemB,2005,109(18):8889~98.
[90]Keleher J.,Bashant J.,Heldt N.,et al.Photo-catalytic preparation of silver-coated TiO2particles for antibacterial applications[J].World J Microbiol Biotechnol,2002,18 (2):133~9.
[91]Armelao L.,Barreca D.,Bottaro G.,et al.Photocatalytic and antibacterial activity of TiO2and Au/TiO2nanosystems[J]. Nanotechnology,2007,18(37):375709.
[92]Gan W.Y.,Lam S.W.,Chiang K.,et al.Novel TiO2thin film with non-UV activated superwetting and antifogging behaviours [J].J Mater Chem,2007,17(10):952~4.
[93]Zeman P.,Takabayashi S.Self-cleaning and antifogging effects of TiO2films prepared by radio frequency magnetron sputtering [J].Journal of Vacuum Science&Technology A:Vacuum,Surfaces,and Films,2002,20(2):388~93.
[94]Lai Y.,Tang Y.,Gong J.,et al.Transparent superhydrophobic/ superhydrophilic TiO2-based coatings for self-cleaning and anti-fogging[J].J Mater Chem,2012,22(15):7420~6.
[95]GuanK.Relationshipbetweenphotocatalyticactivity,hydrophilicity and self-cleaning effect of TiO2/SiO2films[J].Surf Coat Technol,2005,191(2):155~60.
[96]Bozzi A.,Yuranova T.,Guasaquillo I.,et al.Self-cleaning of modified cotton textiles by TiO2at low temperatures under daylight irradiation[J].J Photochem Photobiol,A,2005,174(2):156~64.
[97]Montazer M.,Seifollahzadeh S.Enhanced Self-cleaning,Antibacterial and UV Protection Properties of Nano TiO2Treated Textile through Enzymatic Pretreatment[J].Photochem Photobiol,2011,87(4):877~83.
[98]Yaghoubi H.,Taghavinia N.,Alamdari E.K.Self cleaning TiO2coating on polycarbonate:Surface treatment,photocatalytic and nanomechanical properties[J].Surf Coat Technol,2010,204(9):1562~8.
[99]Asahi R.,Morikawa T.,Ohwaki T.,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5528):269~71.
[100]KhanS.U.,Al-Shahry M.,Ingler W.B.Efficient photochemical water splitting by a chemically modified n-TiO2[J].Science,2002,297(5590):2243~5.
[101]Nakata K.,Fujishima A.TiO2photocatalysis:Design and appli -cations[J].J Photochem Photobiol,C,2012,13(3):169~89.
A Review of Titanium Dioxide Photocatalytic Material and its Application in Ceramics
SU1,2Hua-zhi,PENG1Cheng,WU1Jian-qing
(1.School of Materials Science and Engineering,South China University of Technology,Guangzhou510640;2.Foshan Daqian Pigment and Glaze Ltd.,Foshan528137)
Titanium dioxide(TiO2)has been widely investigated as a heterogeneous photocatalyst due to its excellent functionality,long-term stability,low cost,and nontoxicity.It is also the most promising candidate to prepare photocatalytic ceramics.This review mainly introduces the photocatalytic mechanism,factors to influence photocatalytic activity and phase transition,preparation methods of nano TiO2as well as the progresses of photocatalytic titanium dioxide applications and photocatalytic ceramic preparation.
Titania;Photocatalysis;Ceramic;Application
吴建青,博士,教授。
国家自然科学基金(51472092)。
——潘桂棠光生的地质情怀
——以金红石为例

