毛蚶抗癌活性蛋白对K562细胞增殖和凋亡的影响
赵 晨,付 莹,林华英,孙震晓(.北京中医药大学中药学院,北京 000;.中国海洋大学海洋生命科学学院,山东青岛 66003)
毛蚶抗癌活性蛋白对K562细胞增殖和凋亡的影响
赵 晨1,付 莹1,林华英2,孙震晓1
(1.北京中医药大学中药学院,北京 100102;2.中国海洋大学海洋生命科学学院,山东青岛 266003)
目的考察毛蚶抗癌蛋白(ASAP)活性组分体外对人慢性粒细胞性白血病K562细胞的细胞毒作用,初步探讨其作用机制。方法 ASAP由毛蚶软体经常规低温水提和硫酸铵沉淀法制备;Bradford法测定ASAP样品的蛋白质浓度,计算蛋白质含量;倒置相差显微镜下观察ASAP作用后K562细胞形态变化,姬姆萨染色观察细胞和细胞核的变化;MTT法检测ASAP对K562细胞存活的影响;流式细胞术检测细胞凋亡和周期的变化;Western蛋白质印迹法检测细胞凋亡和细胞周期相关蛋白胱天蛋白酶原3(35 ku),胱天蛋白酶3(17 ku),程序性细胞死亡因子4(PDCD4)和P53的表达。结果 MTT实验结果表明,ASAP 50,100和200 mg·L-1作用24~72 h对K562细胞增殖具有明显的抑制作用,呈时间和浓度依赖性,24,48和72 h的浓度-效应相关系数分别为0.851,0.8977和0.8997(P<0.01)。镜下观察发现,ASAP 200 mg·L-1作用48 h,K562细胞出现变形或核碎裂等形态变化。流式细胞术结合姬姆萨染色显示,ASAP可浓度依赖性地引起K562细胞凋亡和G2/M期阻滞,其中ASAP 200 mg·L-1处理48 h,K562细胞早期凋亡率为(32.8±0.1)%〔对照组(3.7±1.1)%〕(P<0.01),晚期凋亡率为(31.2±2.2)%〔对照组(9.9±0.8)%〕(P<0.01);G2/M期细胞为(55.2±1.7)%〔对照组(15.3±0.8)%〕(P<0.01)。Western蛋白质印迹法实验结果显示,ASAP作用0~40 h,K562细胞中胱天蛋白酶原3(32 h时)明显下调(P<0.01),胱天蛋白酶3表达明显增加(P<0.01),而随着ASAP作用时间的延长,PDCD4和P53蛋白表达均下调(P<0.01)。结论 诱导K562细胞凋亡和G2/M期阻滞可能是ASAP细胞毒作用的主要机制;ASAP诱导的细胞凋亡是胱天蛋白酶3通路依赖的,诱导K562细胞凋亡和G2/M期阻滞可能与PDCD4和P53蛋白表达下调相关。
毛蚶抗癌活性蛋白组分;K562细胞;细胞凋亡;细胞周期;胱天蛋白酶3
DOl:10.3867/j.issn.1000-3002.2016.03.007
毛蚶(Arca subcrenata Lischke)为软体动物门瓣鳃纲列齿目蚶科毛蚶属生物,在中国、日本和朝鲜沿岸产量丰富。毛蚶壳为中药瓦楞子的来源之一[1],《本草纲目》记载瓦楞子能“消血块,散痰积”,《医林纂要·药性》记载其能“攻坚破瘀”。笔者前期研究发现,毛蚶水提物对人结肠癌细胞HT-29、HCT-116、人肝癌细胞HepG-2、Bel-7402和人肺癌细胞A549生长具有明显的抑制作用,均随浓度增加和作用时间延长而抑制作用增强[2]。进一步对毛蚶水提物进行活性追踪发现,毛蚶抗癌蛋白(Arca subcrenata Lischke anticancer protein,ASAP)活性组分为其主要活性部位。体外实验表明,ASAP兼具细胞毒性和免疫激活双重作用,对多种肿瘤细胞生长具有抑制作用[3]。
慢性粒细胞白血病(chronic granulocytic leukemia,CGL)又称慢性髓细胞白血病(chronic myelogenous leukemia,CML),因产生大量不成熟的白细胞,在骨髓内聚集,抑制骨髓的正常造血,并且通过血液在全身扩散。由于来源不同,白血病细胞对抗肿瘤药物的敏感性与上皮来源的肿瘤细胞有所不同。本研究选择人CGL细胞K562细胞,探讨ASAP的细胞毒作用及其可能的机制。
1 材料与方法
1.1细胞和其培养基
K562细胞为北京中医药大学中药学院生物制药实验室冻存。RPMI 1640培养基购自美国Gibco BRL公司;胎牛血清购自杭州四季青公司。青霉素/链霉素双抗购自北京拜尔迪生物技术有限公司。
1.2主要试剂
去甲斑蝥素(norcantharidin,母液浓度10 g·L-1)、二甲亚砜(dimethyl sulfoxide,DMSO)、MTT和姬姆萨(Giemsa)染料购自美国Sigma公司;Annexin Ⅴ-FITC细胞凋亡检测试剂盒购自中国凯基生物公司;BCA(bicinchoninic acid)蛋白测定试剂盒为美国Thermo scientific公司产品;碘化丙啶(propidium iodide,PI)购自美国Amresco公司;其他试剂均为市售分析纯。胱天蛋白酶3一抗和P53一抗(鼠抗)购自美国Cell Signaling Technology公司,稀释比例分别为1∶1000和1∶2000;二抗(山羊抗兔IgG/辣根过氧化物酶标记购自北京中杉金桥生物技术有限公司,稀释比例1∶2500;程序性细胞死亡因子4 (programmed cell death 4,PDCD4)一抗(兔抗)为美国肯塔基大学杨新盛博士惠赠,稀释比例1∶1000;β肌动蛋白一抗(小鼠抗β肌动蛋白单抗)(稀释比例1∶1000)和二抗(山羊抗小鼠IgG/辣根过氧化物酶标记)(稀释比例1:2500)均购自北京中杉金桥生物技术有限公司。
1.3主要仪器
倒置显微镜(TE 2000-S,日本Nikon公司),超低温冰箱(MOF-U3386S,日本SANYO公司),恒温培养箱〔MCO-18AIC(UV),日本SANYO公司〕,酶标仪(130315A,美国Molecular Devices公司),流式细胞仪(BD FACSCantoⅡ,美国Beckman Coulter公司),细胞涂片离心机(TXD3,长沙湘仪离心机仪器有限公司),高速冷冻离心机(TGL-20M,上海卢湘仪离心机仪器有限公司),纯水仪(Milli-Q Biocel,Millipore公司),渗透压仪(STY-1,天津天大天发科技有限公司),电子天平(PB303-S,北京Sartorius仪器有限公司)。
1.4细胞培养
K562细胞用含10%胎牛血清、青霉素100 kU·L-1和链霉素100 mg·L-1的RPMI 1640完全培养基于37℃,5%CO2和饱和湿度条件下进行常规培养,平均2 d传代1次,取对数生长期细胞进行实验。
1.5毛蚶及其抗癌活性蛋白组分的制备
毛蚶购自北京望京海鲜市场,产地为山东青岛,经北京中医药大学生物制药系孙震晓教授鉴定证实。依据参考文献[3]中描述的方法,取同批次新鲜毛蚶(以200 g为例),在0.3%盐水中吐砂,去壳,清洗后取毛蚶软体加入适量超纯水,制成匀浆。离心(4℃,12 000×g,20 min)取上清,缓慢加入硫酸铵至饱和度达到35%;磁力搅拌40 min,离心(4℃,12 000×g,20 min)收集上清,继续加入硫酸铵使饱和度至70%;磁力搅拌40 min,离心(4℃,12 000×g,20 min),收集上清;继续加入硫酸铵使饱和度达到100%时收集上清,溶于5 mL预冷的高纯水中,透析24 h后,离心(4℃,12 000×g,20 min),0.22 μm孔径滤膜过滤除菌,获ASAP,分装保存于-80℃。取冻干粉测定ASAP的蛋白含量。细胞实验时取适量溶于RPMI 1640培养基,配成所需蛋白浓度。
1.6ASAP相对分子质量范围和蛋白含量测定
根据文献[4]方法,采用SDS-PAGE电泳分析ASAP主要蛋白质条带及其相对分子质量分布。ASAP冻干粉称重,加适量超纯水溶解配成ASAP溶液。Bradford法制标准蛋白浓度曲线并计算ASAP浓度。根据ASAP浓度及冻干粉干重计算ASAP含量:ASAP含量(%)=ASAP浓度(g·L-1)× ASAP样品体积(mL)/ASAP冻干粉净重(mg)× 100%
1.7细胞形态观察
对数生长期的K562细胞于6孔板培养24 h后离心弃旧培养液。将ASAP溶液(终浓度0,50,100 和200 mg·L-1)加入K562细胞中培养0~48 h,倒置显微镜下观察细胞形态。另依据参考文献[5]的方法,把处于对数生长期的K562细胞按每孔2×104个接种于12孔板中,培养24 h后分别加ASAP(终浓度为50,100和200 mg·L-1)。继续培养48 h,离心收集全细胞,用无菌PBS缓冲液按等体积重悬,涂片离心(1000×g,10 min),甲醇固定5 min,姬姆萨染色20 min,拍照记录。
1.8MTT法测定细胞存活
根据文献[6]方法,取对数生长期K562细胞接种于96孔板中,每孔2000细胞;培养24 h后加入ASAP溶液(终浓度为50,100和200 mg·L-1),以RPMI 1640完全培养基为细胞对照,去甲斑蝥素(终浓度10 mg·L-1)为阳性对照组;于37℃,5%CO2和饱和湿度条件下培养24~72 h,离心弃培养基,加入100 μL MTT工作液(终浓度500 mg·L-1),孵育4 h;弃上清,加入150 μL DMSO,振荡10 min,酶标仪上550 nm波长处测吸光度(A550 nm)值。细胞存活抑制率(%)=(1-ASAP组A550 nm/细胞对照组A550 nm)× 100%。
1.9AnnexinⅤ/Pl双染法检测细胞凋亡
取对数生长期的K562细胞接种于12孔板,每孔8×105细胞。培养24 h后加入ASAP(终浓度200 mg·L-1),处理48 h,分别收集细胞对照组和ASAP处理组全细胞,离心(4℃,2000×g,5 min)弃上清。加入预冷的PBS 1 mL,离心(4℃,2000×g,5 min)弃上清,重复2次。其余步骤按细胞凋亡检测试剂盒说明书操作。上机前进行常规光路校准,然后进行检测,用BD FACSDiva software v6.1.3软件分析细胞凋亡。
1.10流式细胞术检测细胞周期
细胞接种和药物处理同上,ASAP作用48 h后收集全细胞,PBS洗1遍,70%冷乙醇重悬,4℃固定过夜;测定前离心(1000×g,10 min),除去固定液,PBS洗涤2次,适量预冷的50 mg·L-1RNA酶A。PBS重悬,孵育30 min,加入PI染液,4℃避光染色30 min,流式细胞仪检测。上机前进行常规校准光路,ModFit LT软件分析细胞周期。
1.11Western蛋白质印迹法检测胱天蛋白酶原3,胱天蛋白酶3,P53及PDCD4蛋白表达
依据参考文献[7]方法进行样品处理。处于对数生长期的K562细胞经200 mg·L-1ASAP处理8,16,24,32和40 h,分别收集细胞对照组和处理组细胞,PBS清洗2次后加入细胞裂解液(Tris-HCl 50 μmol·L-1,pH 8.0;1%NP-40,NaCl 150 μmol·L-1;0.1%SDS,1%蛋白酶抑制剂Cocktail Set)破碎细胞,收集蛋白质;BCA法测定蛋白质样品的浓度。蛋白上样量为50 μg,进行SDS-PAGE(10%SDS),硝酸纤维素滤膜电转1.5 h,5%脱脂奶粉封闭2 h,加胱天蛋白酶3,PDCD4及P53一抗稀释液(抗体稀释比例分别为1∶1000,1∶1000和1∶2000),4℃过夜,辣根过氧化物酶标记的二抗(稀释比例1∶2500)室温孵育2 h;β肌动蛋白抗体稀释比例1∶1000;参照ECL试剂盒说明书进行ECL反应,于暗室压片曝光,扫描蛋白质条带,用Quantity One (Bio-Rad Laboratories,USA)软件分析积分吸光度(integrated absorbance,IA),待测蛋白相对表达水平用IA待测蛋白/IAβ肌动蛋白比值表示。
1.12统计学分析
2 结果
2.1ASAP蛋白含量及相对分子质量范围
本研究制备的ASAP冻干粉蛋白含量为(79.95± 7.11)%。由SDS-PAGE电泳分析结果(图1)可见,ASAP组成以<30 ku的小分子蛋白质为主。

Fig.1 Protein molecular mass range of A.subcrenata Lischke anticancer protein(ASAP).

Fig.2 Effect of ASAP on K562 cell proliferation(A)and inhibition curve(B).Cell inhibitory rate(%)=(1-A550nmof ASAP treated group/A550nmof control group)×100%.,n=3.**P<0.01,compared with corresponding control group.
2.2ASAP对K562细胞的细胞毒作用
如图2(A)所示,在24~72 h内细胞对照组K562细胞存活呈指数增长趋势,而ASAP组细胞存活曲线升高趋势减弱,表明ASAP明显抑制K562细胞存活。以ASAP浓度为横坐标,对K562细胞存活抑制率为纵坐标绘制抑制率曲线(图2B),可见作用24~72 h,ASAP对K562细胞存活的抑制作用呈浓度和时间依赖性,24,48和72 h的浓度-效应相关系数分别为0.851(P<0.01),0.8977(P<0.01)和0.8997(P<0.01);ASAP 50,100,200,400和800 mg·L-1的时间-效应相关系数分别为0.0195(P<0.05),0.7043(P<0.01),0.9359(P<0.01),0.9735(P<0.01)和0.9698(P<0.01)。

Fig.3 Effect of ASAP on morphological changes of K562 cells observed under inverted phase-contrast microscope.
2.3ASAP对K562细胞形态的影响
倒置相差显微镜下观察(图3),细胞对照组细胞数随时间呈正常增加的趋势,而各ASAP处理组随着浓度和作用时间的增加,细胞数量明显减少,且出现形态变化如变形和碎裂等。
姬姆萨染色发现,ASAP作用K562细胞48 h,细胞出现明显的核碎裂和凋亡小体(图4),推测ASAP可引起K562细胞发生G2/M期阻滞或细胞凋亡。

Fig.4 Effect of ASAP for 48 h on cell and nuclear morphological changes of K562 cells(Giemsa staining).↑:nuclear fragmentation;▽:apoptosis.
2.4ASAP对K562细胞凋亡的诱导作用
ASAP 50,100和200 mg·L-1作用48 h后,K562细胞早期凋亡和晚期凋亡率明显增加(图5,表1)(P<0.01),表明ASAP能诱导K562细胞凋亡。
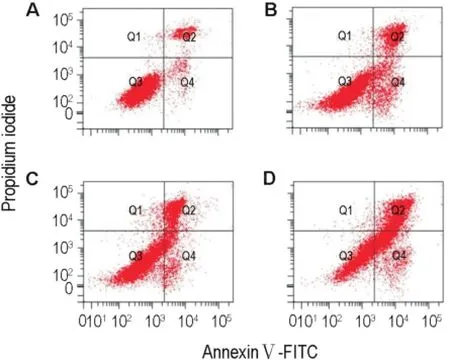
Fig.5 Effect of ASAP for 48 h on K562 cell apoptosis determinted by flow cytometry.A:control group;B-D:ASAP 50,100 and 200 mg·L-1group,respectively.

Tab.1 Apoptosis rate of K562 cells induced by ASAP for 48 h
2.5ASAP对K562细胞周期的影响
由图6和表2所示,ASAP 50,100和200 mg·L-1作用48 h,K562细胞G1和S期细胞比例减少,G2/M期细胞比例显著增加(P<0.01),发生明显的G2/M期阻滞。
2.6ASAP对K562细胞胱天蛋白酶原3,胱天蛋白酶3,P53及PDCD蛋白表达的影响
如图7所示,ASAP 200 mg·L-1作用于K562细胞0~40 h,随着作用时间的延长,细胞中凋亡蛋白胱天蛋白酶原3(35 ku)(32 h时)呈明显下调趋势(P<0.01),同时可检测到凋亡蛋白胱天蛋白酶3(17 ku)的表达明显增加(P<0.01),说明ASAP诱导K562细胞凋亡与效应蛋白胱天蛋白酶3的激活密切相关。

Fig.6 Effect of ASAP for 48 h on K562 cell cycle deter⁃minted by flow cytometry.A:control group;B-D:ASAP 50,100 and 200 mg·L-1groups,respectively.

Tab.2 Cell cycle changes of K562 cells induced by ASAP for 48 h
如图8所示,ASAP 200 mg·L-1作用于K562细胞0~40 h,P53蛋白(53 ku)表达与对照组比较明显下调(P<0.01)。

Fig.7 Effect of ASAP 200 mg·L-1on expression of procaspase 3 and caspase 3 proteins in K562 cells detected by Western blotting.B was the semi-quantitative result of A.,n=3.**P<0.01,compared with control(0 h)group.

Fig.8 Effect of ASAP 200 mg·L-1on expression of P53 protein in K562 cells detected by Western blotting. B was the semi-quantitative result of A.,n=3.**P<0.01,compared with control group.
如图9所示,ASAP 200 mg·L-1作用于K562细胞0~40 h,随着药物作用时间的延长,PDCD4蛋白(52 ku)表达较对照组明显下调(P<0.01)。

Fig.9 Effect of ASAP 200 mg·L-1on expression of programmed cell death 4(PDCD4)protein in K562 cells detected by Western blotting.B was the semi-quan⁃titative result of A.,n=3.**P<0.01,compared with control group.
3 讨论
本研究发现,ASAP 50~800 mg·L-1作用24~72 h,对K562细胞存活有明显的抑制作用,部分细胞形态发生较明显变化。流式细胞术实验结果显示,ASAP 50~200 mg·L-1作用于K562细胞48 h,随着浓度增加,G1和S期细胞百分率明显减少,G2/M期细胞和凋亡细胞比例明显增加。
已知胱天蛋白酶是细胞凋亡通路上的关键酶之一,依赖胱天蛋白酶的细胞凋亡往往与35 ku的胱天蛋白酶原3断裂产生有活性的17 ku左右的效应分子胱天蛋白酶3有关[8]。本研究发现,ASAP 200 mg·L-1作用于K562细胞32 h,细胞胱天蛋白酶原3蛋白明显下调,而其活性形式胱天蛋白酶3蛋白明显上调,说明ASAP诱导K562细胞凋亡与胱天蛋白酶3依赖通路的激活有关。
抑癌基因蛋白PDCD4和P53的表达与细胞凋亡和细胞周期阻滞关系密切。本研究发现,ASAP可以下调PDCD4和P53蛋白的表达。有研究表明,PDCD4蛋白具有抑制蛋白翻译的作用,可以抑制胱天蛋白酶原蛋白的表达,其表达下降可促进胱天蛋白酶依赖的细胞凋亡[8]。笔者前期研究也发现,抗肿瘤药物去甲斑蝥素在诱导肿瘤细胞凋亡时PDCD4的表达明显下调[9],推测ASAP下调PDCD4表达与ASAP诱导K562细胞凋亡有关。已知抑癌基因p53突变与多种细胞恶性转化及肿瘤发展有关[10-13],突变型p53不仅丧失了抑癌功能,还可以促进肿瘤细胞的增殖及阻断细胞凋亡[14],提示ASAP下调P53蛋白的表达对其诱导K562细胞凋亡和G2/M期阻滞有重要作用。
Hu等[15]比较了毛蚶提取物P2对7种癌细胞(HepG2,HeLa,HT-29,K562,B16-F10,DU145和SPC-A-1)的抗癌活性。结果表明,P2对HeLa和HT-29细胞作用明显;体内实验对小鼠H22和S180的最高抑瘤率分别为46.4%和60.1%。本研究在前期ASAP体外抗肿瘤活性筛选的基础上,证明其对人K562细胞具有明显的周期阻滞作用和诱导凋亡作用。其体内给药对肿瘤的的抑制作用还有待进一步研究。
从毛蚶中分离活性蛋白单体已有报道。Song等[16]利用DEAE阴离子交换和Sephadex G50凝胶柱层析分离纯化出了G-6和G-4-2两个活性多肽,分子质量分别为8.2和16.0 ku。其中G-6是糖肽,已通过氨基酸自动分析仪获得了其氨基酸组成。体外实验证实了G-4-2能抑制HeLa,HL-60和KB细胞的增殖。Chen等[17]利用阴离子柱层析和疏水柱层析分离得到抗肿瘤、抗氧化单体肽H3,相对分子质量为20.5 ku,等电点为6.65,获知了部分氨基酸序列,并证实其能在体外抑制多种肿瘤细胞增殖。上述研究为进一步获取活性更好、纯度更高的毛蚶抗癌蛋白奠定了基础。有关ASAP中活性蛋白的进一步分离纯化也在进行中。
[1]Chinese Pharmacopoeia Commission.Pharmaco⁃poeia of the People′s Republic of China,Vol.1(中华人民共和国药典2010年版一部)[S].Beijing:China Medical Science Press,2010,65.
[2]Feng T,Tian JX,Li ZM,Lin HY,Sun ZX.Studies on the antitumor activities of the water extract of Arca subcrenata Lischke[J].Chin J Mar Drugs(中国海洋药物),2013,32(3):40-48.
[3]Fu Y,Feng T,Zhao Chen,Tian JX,Sun ZX.The antitumor activity of Arca subcrenata Lischke protein [J].Carcinog Teratog Mutag(癌变·畸变·突变),2014,6:412-418.
[4]Liu SC.Extraction and purification of polypeptides from Arca subcrenata and preliminary study of their anti-oxidative capacity and antitumor activity in vitro(毛蚶天然多肽提取纯化及其体外抗氧化能力和抑制肿瘤活性的初步研究)[D].Qingdao:Ocean University of China(中国海洋大学),2013.
[5]Li RJ,Hong XF,Ji YY,Sun ZX.Norcantharidin induced mitotic arrest and apoptosis in human ovarian cancer SK-OV-3 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(2):180-186.
[6]Li ZM,Wang M,Xu ZL,Geng D,Sun ZX.Different cytotoxic effects of hydroxycamptothecin on human lung cancer cells and human embryo lung fibroblast cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(3):315-320.
[7] Li ZM,Sun ZX.The effect and the synergistic mechanism of irinotecan combined with norcan⁃tharidin in human gastric cancer cell line BGC-823 [J].Prog Biochem Biophys(生物化学与生物物理进展),2015,42(2):169-181.
[8]Eto K,Goto S,Nakashima W,Ura Y,Abe SI. Loss of programmed cell death 4 induces apoptosis by promoting the translation of procaspase 3 mRNA[J].Cell Death Differ,2012,19(4):573-581.
[9]Wu Y,Cao CM,Wang HQ,Li ZM,Sun ZX.Nor⁃cantharidin downregulates programmed cell death 4 expression in human gastric cancer cells[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(4):622-628.
[10]Sun LM,Wang LJ,Song M,Song JY.Expressions of mutated p53 and tumor suppressor gene PTEN in breast cancer[J].Chin J Cancer Prev Treat(中华肿瘤防治杂志),2008,15(6):430-433.
[11]Bian C,Li Z,Xu Y,Wang J,Xu L,Shen H.Clinical significance of mutant p53 protein expression in lung adenocarcinoma[J].Chin J Lung Cancer(中国肺癌杂志),2015,18(1):23-28.
[12]Duan W,Gao L,Jin D,Otterson GA,Villalona-Calero MA.Lung specific expression of a human mutant p53 affects cell proliferation in transgenic mice[J]. Transgenic Res,2008,17(3):355-366.
[13]Liu YY.Resuscitating wild-type p53 expression by disrupting ceramide glycosylation:a novel approach to target mutant p53 tumors[J].Cancer Res,2011,71(20):6295-6299.
[14]Hong B,Van Den Heuvel AP,Prabhu VV,Zhang S,El-Deiry WS.Targeting tumor suppressor p53 for cancer therapy:strategies,challenges and oppor⁃tunities[J].Curr Drug Targets,2014,15(1):80-89.
[15]Hu X,Song L,Huang L,Zheng Q,Yu R.Antitumor effect of a polypeptide fraction from Arca subcrenata in vitro and in vivo[J].Mar Drugs,2012,10(12):2782-2794.
[16]Song L,Ren S,Yu R,Yan C,Li T,Zhao Y. Purification,characterization and in vitro anti-tumoractivity of proteins from Arca subcrenata Lischke [J].Mar Drugs,2008,6(3):418-430.
[17]Chen L,Song L,Li T,Zhu J,Xu J,Zheng Q,et al. A new antiproliferative and antioxidant peptide isolated from Arca subcrenata[J].Mar Drugs,2013,11(6):1800-1814.
Effect of Arca subcrenata Lischke anticancer protein on cell proliferation and apoptosis of human myeloid leukemia K562 cells
ZHAO Chen1,FU Ying1,LIN Hua-ying2,SUN Zhen-xiao1
(1.College of Chinese Pharmacy,Beijing University of Chinese Medicine,Beijing 100102,China;2.College of Life Sciences,Ocean University of China,Qingdao 266003,China)
OBJECTlVE To investigate the cytotoxic activity of Arca subcrenata Lischke anticancer protein(ASAP)constituents on human myeloid leukemia K562 cells in vitro and analyze its anticancer mechanisms.METHODSASAP was extracted by low temperature water and ammonium sulfate precipitation.Protein concentration of ASAP was detected by Bradford method.Morphological changes of cultured K562 cells treated with ASAP were observed under the inverted phase-contrast micro⁃scope.The cell and nucleus changes were analyzed by Giemsa staining.The cytotoxicity of ASAP on K562 cells was detected by MTT assay.Flow cytometry was used to detect apoptosis and cell cycle of K562 cells treated with ASAP.The expression of apoptosis and cell cycle related proteins procaspase 3,caspase 3,P53 and programmed cell death 4(PDCD4)were analyzed by Western blotting.RESULTS ASAP exhibited significant cytotoxic effect on K562 cells in a time-and concentration-dependent manner. The concentration-effect correlation coefficient of ASAP 50,100 and 200 mg·L-1on K562 cells for 24,48 and 72 h was 0.851,0.8977 and 0.8997,respectively.Under an optical microscope,K562 cells showed cytomorphosis,or nuclear fragmentation after treatment with ASAP 200 mg·L-1for 48 h.Flow cytometry analysis and Giemsa staining assay indicated that apoptotic cells increased and G2/M phase cells accumulated significantly with the increase of ASAP concentration.After treatment with ASAP 200 mg·L-1for 48 h,the early and late apoptosis cell rate increased to(32.8±0.1)%and(31.2±2.2)% vs control group(3.7±1.1)%and(9.9±0.8)%(P<0.01),respectively,and the G2/M phase cells increased to(55.2±1.7)%vs(15.3±0.8)%in control group(P<0.01).After treatment with ASAP 200 mg·L-1for 0-40 h,the expression of apoptotic protein procaspase 3 was down-regulated and its active form caspase 3 was significantly up-regulated at 32 h,while PDCD4 and P53 protein expression was down-regulated significantly in 0-40 h.CONCLUSlON Apoptosis and cell cycle arrest induced in G2/M phase may account for ASAP cytotoxic activity to K562 cells.K562 cell apoptosis induced by ASAP depends on caspase 3 signal pathway.Down-regulated expression of PDCD4 and P53 proteins may be related to K562 cell apoptosis and cell cycle arrest in G2/M phase by ASAP.
Arca subcrenata anticancer protein;K562 cells;apoptosis;cell cycle;caspase 3
SUN Zhen-xiao,E-mail:sunzx@bucm.edu.cn,Tel:(010)84738646
R285.5,R979.1
A
1000-3002-(2016)03-0221-08
2015-10-27接受日期:2016-01-28)
(本文编辑:齐春会)
赵 晨,女,硕士研究生,主要从事天然药物抗癌活性成分筛选和药理学研究,E-mail:reko33@sina.com,Tel:13661122026
孙震晓,E-mail:sunzx@bucm.edu.cn,Tel:(010)84738646

