曲尼司特对高糖培养心肌成纤维细胞增殖及表型转化的影响
王建霞,符丽娟(辽宁医学院药理学教研室,辽宁锦州 121000)
WANG Jian-xia,FU Li-juan(Department of Pharmacology,Liaoning Medical College,Jinzhou 121001,China)
曲尼司特对高糖培养心肌成纤维细胞增殖及表型转化的影响
王建霞,符丽娟
(辽宁医学院药理学教研室,辽宁锦州 121000)
目的 探讨曲尼司特对高糖培养大鼠心肌成纤维细胞增殖及表型转化的作用及可能机制。方法体外培养大鼠心肌成纤维细胞(CF)分为正常对照组(5.5 mmol·L-1葡萄糖)、高渗对照组(葡萄糖5.5 mmol·L-1+甘露醇25 mmol·L-1)、高糖组(25 mmol·L-1葡萄糖)、曲尼司特干预组(葡萄糖25 mmol·L-1+曲尼司特50,100和200 μmol·L-1)及活化素受体样激酶7(ALK7)阻断剂组(葡萄糖25 mmol·L-1+SB431542 10 μmol·L-1)。各组细胞分别与不同药物孵育48 h后,采用MTT法检测CF存活,免疫荧光法检测CF表型转化,Western蛋白印迹法检测CF特异性蛋白1(FSP-1)、α平滑肌动蛋白(α-SMA)、转化生长因子β1(TGF-β1)和ALK7的蛋白表达。结果 与正常对照组比较,高糖组CF A492 nm明显升高(P<0.01),FSP-1表达明显减少(P<0.01),α-SMA表达明显增多(P<0.01),TGF-β1和ALK7表达增多(P<0.01),而高渗对照组以上指标均无显著性差异。与高糖组比较,应用ALK7阻断剂SB431542及不同浓度曲尼司特同步干预后,均可使CF A492 nm显著降低(P<0.05),FSP-1表达明显增多(P<0.05),α-SMA表达明显减少(P<0.01),TGF-β1表达明显减少(P<0.05),ALK7表达减少(P<0.05)。结论 曲尼司特可抑制高糖诱导的CF增殖及表型转化,其机制可能与下调ALK7的表达有关。
曲尼司特;高糖;心肌成纤维细胞;活化素受体样激酶7
DOl:10.3867/j.issn.1000-3002.2016.03.004
糖尿病性心肌病是糖尿病患者主要的并发症之一,心肌纤维化是其主要病变,其中心肌成纤维细胞(cardiac fibroblast,CF)过度增殖、表型转化以及细胞外基质(extracellular matrix,ECM)的分泌失衡是其主要病理基础。研究表明,高糖刺激后CF出现细胞增殖,可转化为表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的肌成纤维细胞[1]。其中转化生长因子β(transforming growth factor-β,TGF-β)是CF表型转化、迁移、增殖及合成ECM的关键因子。TGF-β对有丝分裂的影响是间接的,其诱导成纤维细胞增殖可能与TGF-β诱导下游一些基因的转录有关。活化素受体样激酶7 (activin receptor-like kinase 7,ALK7)是TGF-β超家族中丝/苏氨酸激酶Ⅰ型受体的一种,通过与配体结合介导TGF-β/Smad信号通路[2]。研究表明,高糖可能促进ALK7表达,然而其是否通过诱导ALK7表达从而促进CF增殖及表型转化报道较少[3]。曲尼司特是一种肥大细胞膜稳定剂,最初作为抗过敏药用于临床,研究发现其对心肌和肾有抗纤维化的作用[4-5]。本研究体外培养CF,观察曲尼司特对高糖培养CF增殖、表型转化以及ALK7蛋白表达的影响,以探讨其抗纤维化作用及可能机制。
1 材料与方法
1.1动物、药品和试剂
1~3日龄的新生SD乳鼠,由辽宁医学院实验动物中心提供,动物使用许可证号:SCXK(辽)2009-004。曲尼司特,国药准字H10930175,中国药科大学制药厂提供;ALK7阻断剂SB431542,上海前尘生物科技公司。DMEM培养基,美国Medi⁃atech公司;特级胎牛血清、青链霉素和胰蛋白酶,天津森润生物公司;MTT试剂,中国Beyotime试剂公司;兔抗大鼠成纤维细胞特异性蛋白1(fibroblast specific protein-1,FSP-1)抗体和小鼠抗大鼠ALK7单克隆抗体,北京博奥森生物技术公司;小鼠抗大鼠α-SMA抗体,博士德公司;TRITC标记羊抗兔IgG、异硫氰酸荧光素(FITC)标记山羊抗鼠荧光二抗和山羊血清工作液购于中杉金桥生物有限公司;其他相关试剂均由辽宁医学院实验室提供。
1.2CF制备、培养和鉴定
1~3日龄的新生SD乳鼠,在无菌条件下开胸取出心脏,用冷PBS溶液冲洗3次后剪成约1 mm3大小的组织块,加入0.25%的胰酶,置于37℃水浴中摇动离心管,至消化液稍混浊。弃去首次消化的上清液,将消化的上清液加至含10%胎牛血清的培养基中终止消化,剩余组织继续加入胰酶消化,将收集的细胞1000×g离心10 min,弃上清。将沉淀加入含10%胎牛血清的培养基吹打均匀后接种于底面积25 cm2培养瓶,送入通以体积分数为5%CO2及95%空气的二氧化碳孵箱中。根据心肌细胞和成纤维细胞贴壁时间不同,差速贴壁90 min后,PBS冲洗细胞,更换新的培养基[6]。细胞2 d换液1次,常规培养,细胞生长近汇合状态时用0.25%胰蛋白酶消化传代,实验用2~3代细胞。
1.3CF形态观察和免疫学鉴定
将差速贴壁的CF接种到培养皿中进行HE染色,在倒置显微镜下观察细胞形态并照相。
应用FSP-1抗体和α-SMA抗体免疫荧光染色进行CF纯度鉴定。取指数生长期的细胞传代至6孔板培养,观察细胞覆盖80%视野时,用PBS漂洗3次;用新鲜配置的4%多聚甲醛室温固定30 min,PBS漂洗3次;0.3%Triton X-100作用30 min,PBS漂洗3次;室温下3%山羊血清封闭30 min;滴加FSP-1一抗或α-SMA一抗溶液,置于湿盒内4°C孵育过夜;PBS漂洗后,加入罗丹明或FITC标记的二抗孵育1 h,PBS漂洗,封片,立即用激光共聚焦显微镜观察并拍照。经免疫荧光染色后只显示红色荧光、无绿色荧光的细胞表示FSP-1染色阳性、α-SMA染色阴性,即判断为CF,并计算CF纯度。
1.4细胞分组和药物处理
细胞传代培养24 h后,换用无血清低糖DMEM培养液饥饿培养24 h后进行药物处理。鉴定后的CF分为以下7组:正常对照组,给予低糖DMEM培养液(含葡萄糖5.5 mmol·L-1);高渗对照组,给予含甘露醇25 mmol·L-1的低糖DMEM培养液;高糖组,给予高糖DMEM培养液(含葡萄糖25 mmol·L-1);3组曲尼司特干预组,分别给予含曲尼司特50,100 和200 μmol·L-1的高糖DMEM培养液;ALK7阻断剂干预组,给予含SB431542 10 μmol·L-1的高糖DMEM培养液。各组细胞分别与含有不同药物的培养基共培养48 h后用于实验。
1.5MTT法检测细胞活力
将对数生长期的细胞进行胰酶消化后,用培养液制成单个细胞悬液计数,以每孔300个细胞接种至96孔板,每孔200 μL,贴壁培养24 h后吸去上清,加入不同条件培养基药物处理48 h,每组设6复孔。每孔加入10 μL MTT(10 g·L-1)溶液,继续培养4 h,终止培养,小心吸弃孔内上清,每孔加DMSO 150 μL,摇床上避光振荡10 min,使形成的甲瓒结晶物充分溶解,测定各孔吸光度A492 nm值。
1.6免疫荧光染色检测FSP-1和α -SMA的表达
取指数生长期的细胞传代至6孔板培养,细胞覆盖80%视野时血清饥饿24 h。加入不同条件培养基药物处理48 h,用PBS洗3次。FSP-1和α-SMA免疫荧光染色方法同1.3。每组随机选3个视野用Image pro plus图像分析软件分析,以积分吸光度(integrated absorbance,IA)与每孔总面积的比值表示FSP-1和α-SMA表达水平。
1.7Western蛋白印迹法检测FSP-1,α -SMA,TGF-β1和ALK7蛋白表达水平
各组CF经药物处理48 h后,用冷PBS冲洗,立即放入预冷的裂解液中4℃超声破碎匀浆,4℃12 000×g离心,取上清,用BCA法进行蛋白质定量,将各组蛋白浓度调成一致。用10%~12%的SDS-PAGE凝胶电泳,每个泳道蛋白上样量为20 μg,转膜,封闭,洗膜,分别加入兔抗大鼠FSP-1一抗、小鼠抗大鼠α-SMA一抗、羊抗大鼠TGF-β1一抗和羊抗大鼠ALK7一抗,4℃孵育过夜,再与二抗室温孵育1 h,ECL化学发光显影后,用CAMIAS008图像分析系统处理,蛋白表达水平用待测蛋白条带与内参蛋白β肌动蛋白条带IA的比值表示。
1.8统计学分析
2 结果
2.1CF形态和免疫学鉴定
本研究制备的细胞经正常培养后,在倒置显微镜下观察,细胞扁平铺开,呈梭形,细胞核比较大,一个细胞内常常有1~3个细胞核,细胞浆透明,折光弱,无自发搏动。将差速贴壁细胞接种到培养皿中后进行HE染色,在倒置显微镜下观察细胞形态,可见成纤维细胞清晰的形态。制备的细胞经免疫荧光染色后只显示红色荧光,无绿色荧光,提示FSP-1染色阳性,α-SMA染色阴性。以上细胞形态和免疫学特点表明,本研究制备的细胞为CF,CF纯度≥95%。

Fig.1 Morphological observation and identification of cardiac fibroblasts(CFs)(×100).CFs were identified with immunofluorescence staining,fibroblast specific protein-1 (FSP-1)immune response was positive and α-smooth muscle actin(α-SMA)was negative.
2.2曲尼司特对高糖环境下CF活力的影响
MTT法检测结果显示,与正常对照组相比,高糖组CF A492 nm明显升高(P<0.01),而高渗对照组无明显变化,提示高糖培养可促进CF的存活。与高糖组相比,加入曲尼司特50,100和200 μmol·L-1干预后,对CF的存活具有显著抑制作用;与高糖组相比,ALK7阻断剂干预组CF A492 nm明显降低(P<0.05),提示ALK7可促进CF的存活(图2)。

Fig.2 Effect of tranilast on CFs proliferation incubated with high concentration of glucose by MTT assay.The CFs were incubated for 48 h.1:normal control group(glucose 5.5 mmol·L-1);2:hypertonic group(glucose 5.5 mmol·L-1+mannitol 25 mmol·L-1);3:high glucose group(glucose 25 mmol·L-1);4,5 and 6:tranilast group(glucose 25 mmol·L-1+tranilast 50,100 and 200 μmol·L-1,respectively);7:activin receptor-like kinase 7,(ALK7)inhibitor group(glucose 25 mmol·L-1+SB431542 10 μmol·L-1).,n=6.**P<0.01,compared with normal control group;#P<0.05,compared with high glucose group.
2.3曲尼司特对高糖培养心肌成纤维细胞FSP-1和α-SMA表达的影响
免疫荧光分析结果(图3,表1)显示,与正常对照组比较,高糖组细胞内FSP-1蛋白表达明显减少(P<0.01),α-SMA蛋白表达明显增多(P<0.01),而高渗对照组无明显变化,提示高糖培养环境可促进CF表型发生转化,高渗组并无CF表型转化。与高糖组比较,不同浓度曲尼司特干预组细胞内FSP-1蛋白表达明显增多(P<0.05),α-SMA蛋白表达明显减少(P<0.05),提示曲尼司特可以抑制CF表型转化。与高糖组比较,ALK7阻断剂干预组FSP-1蛋白表达明显增多(P<0.05),α-SMA蛋白表达明显减少(P<0.05),提示表型转化与ALK7的表达有关。

Fig.3 Effect of tranilast on fibroblast specific protein-1 (FSP-1)and α -smooth muscle actin(α -SMA)expression of CFs incubated with high concentration of glucose (×100).See Fig.2 for CF treatment.FSP-1 and α-SMA expression were detected by confocal laser scanning microscopy.

Tab.1 Effect of tranilast on FSP-1 and α -SMA expression of CFs incubated with high concentration of glucose
图4结果表明,与正常对照组比较,高糖培养CF细胞FSP-1蛋白表达明显减少(P<0.01),α-SMA蛋白表达明显增多(P<0.01),高渗对照组无显著性差异。与高糖组比较,曲尼司特50,100和200 μmol·L-1同步干预后,FSP-1蛋白表达明显增多(P<0.05),α-SMA蛋白表达明显减少(P<0.01),提示曲尼司特可抑制高糖诱导CF细胞向肌成纤维细胞转化。与高糖组比较,ALK7阻断剂干预组FSP-1蛋白表达明显增多(P<0.05),α-SMA蛋白表达明显减少(P<0.01),提示CF的表型转化可能与ALK7表达上调有关。

Fig.4 Effect of tranilast on FSP-1 and α -SMA expression of CFs incubated with high concentration of glucose.See Fig.2 for CF treatment.FSP-1 and α-SMA expression was detected by Western blotting.B was the semiquantitative result of A.1:normal control group;2:hypertonic group;3:high glucose group;4-6:high glucose+tranilast 50,100 and 200 μmol·L-1group,respectively;7:high glucose+ALK7 inhibitor group.,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with high glucose group.
2.4曲尼司特对高糖培养大鼠心肌成纤维细胞TGF-β1表达水平的影响
图5结果表明,与正常对照组比较,高糖培养CF细胞TGF-β1表达显著增多(P<0.01);与高糖组比较,曲尼司特50,100和200 μmol·L-1同步干预后,TGF-β1表达明显减少(P<0.05)。
2.5曲尼司特对高糖培养大鼠心肌成纤维细胞ALK7表达水平的影响
图6结果表明,与正常对照组比较,高糖组ALK7表达增多(P<0.01);与高糖组比较,曲尼司特50,100和200 μmol·L-1同步干预后ALK7表达显著减少(P<0.05)。
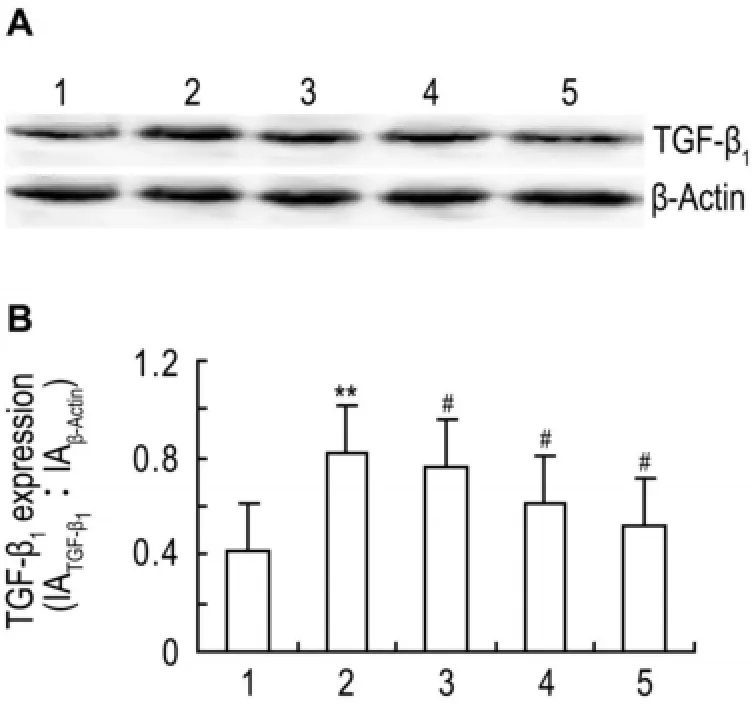
Fig.5 Effect of tranilast on transforming growth factor-β1(TGF-β1)expression of CFs incubated with high concen⁃tration of glucose.See Fig.2 for CF treatments.TGF-β1expression was detected by Western blotting.B was the semiquan⁃titative result of A.1:normal control group;2:high glucose group;3-5:high glucose+tranilast 50,100 and 200 μmol·L-1,respec⁃tively.,n=4.**P<0.01,compared with normal control group;#P<0.05,compared with high glucose group.
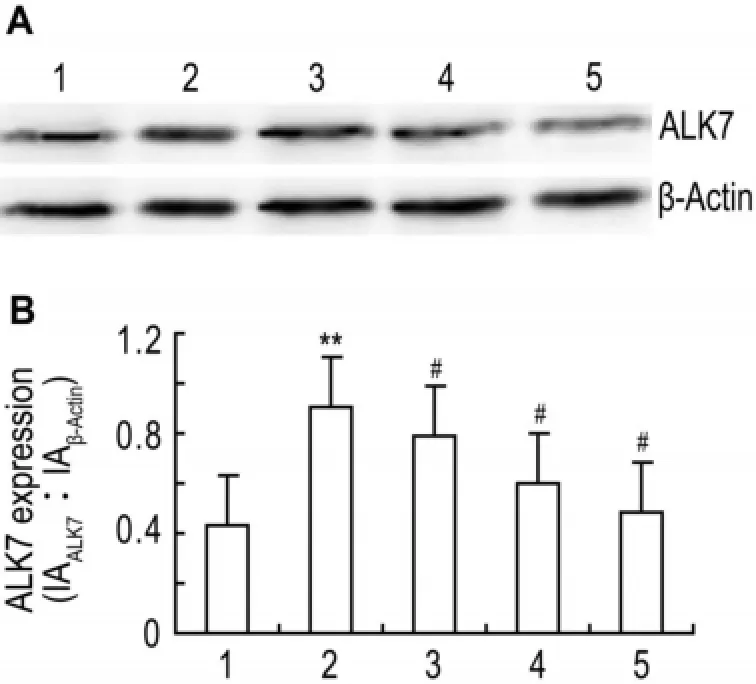
Fig.6 Effect of tranilast on activin receptor-like kinase 7 (ALK7)expression of CFs incubated with high concen⁃tration of glucose.See Fig.2 for CF treatments.ALK7 expression was detected by Western blotting.B was the semi⁃quantitative result of A.1:normal control group;2:high glucose group;3-5:high glucose+tranilast 50,100 and 200 μmol·L-1,respectively.,n=4.**P<0.01,compared with normal control group;#P<0.05,compared with high glucose group.
3 讨论
CF是心肌间充质细胞的主要成员,其在心脏胚胎发育、结构构成及细胞间信号传递过程中起关键作用。生理情况下,可以通过分泌多种细胞因子、生长因子及基质金属蛋白酶,维持细胞外基质蛋白的稳态平衡。在病理状态下,ECM合成增加和CF过度增殖可能将导致心肌纤维化。大量动物实验表明,高糖是导致糖尿病心肌纤维化的主要因素[7]。高糖通过诱导氧自由基的生成及促进ECM沉积,在糖尿病心肌纤维化的发生发展中发挥重要作用。有研究报道,高糖可以诱导CF增殖和活化转型,分化为肌成纤维细胞导致ECM沉积从而引起纤维化[8]。本研究结果表明,与正常对照组比较,高糖组CF明显增殖。CF在高糖25 mmol·L-1条件下培养48 h后,FSP-1表达下降,α-SMA表达升高,表明高糖培养CF出现增殖及表型转化。
TGF-β1是致纤维化的关键因子,与多脏器间充质纤维化有关。正常生理状态下CF分泌TGF-β1含量很低,当受到高糖、炎症和氧化应激等病理刺激时,TGF-β1表达上调,直接诱导CF转化为肌成纤维细胞[9]。本研究结果表明,与正常对照组比较,高糖诱导TGF-β1表达增加;与高糖组比较,应用不同浓度曲尼司特干预后TGF-β1表达降低,表明TGF-β1诱导CF表型转化。
研究表明,TGF-β及其下游Smad蛋白参与了心肌纤维化的病理过程[10]。ALK7是TGF-β超家族Ⅰ型受体的一种。研究报道[11],高糖可能促进ALK7表达从而促进细胞表型转化,机制可能是CF在受到高糖刺激后,TGF-β1分泌增多,激活ALK7与配体结合从而激活下游的Smad信号,促进CF核基因的表达,使CF转型为肌成纤维细胞,表达肌成纤维细胞标志物α-SMA,细胞增殖能力增加,其合成ECM的能力增加,心肌纤维化增加。本研究结果表明,与高糖组比较,ALK7阻断剂SB431542组细胞增殖降低,表型转化逆转,提示CF增殖及表型转化与ALK7表达上调有关。
曲尼司特是一种肥大细胞膜稳定剂,近年发现其有抗纤维化作用[12]。研究表明,曲尼司特可以明显抑制TGF-β1诱导的肾小管上皮细胞的转分化作用,可以通过TGF-β/Smad信号通路改善大鼠肾纤维化[13-14]。我们大量前期实验表明,曲尼司特可以通过降低TGF-β1和结缔组织生长因子的表达改善糖尿病大鼠心肌纤维化[15]。本研究结果显示,与正常对照组比较,高糖培养CF增殖及表型转化,TGF-β1分泌增加并能上调ALK7的表达;与高糖组比较,应用ALK7阻断剂SB431542和不同浓度曲尼司特同步干预后,FSP-1表达升高,α-SMA表达下降,TGF-β1分泌减少,ALK7表达减少,表明曲尼司特能抑制高糖培养CF增殖及表型转化,其机制可能与下调ALK7的表达有关。
综上所述,高糖能诱导CF增殖及表型转化;曲尼司特可以抑制CF表型转化的作用,其机制可能与下调ALK7的表达有关。
[1]Hayat SA,Patel B,Khattar RS,Malik RA.Diabetic cardiomyopathy: mechanisms, diagnosisand treatment[J].Clin Sci(Lond),2004,107(6):539-557.
[2]Hinz B,Gabbiani G.Fibrosis:recent advances inmyofibroblastbiologyandnewtherapeutic perspectives[J].F1000 Biol Rep,2010,2(2):78.
[3]Kogame M,Matsuo S,Nakatani M,Kurisaki A,Nishitani H,Tsuchida K,et al.ALK7 is a novel marker for adiposity differentiation[J].J Med Invest,2016,53(3):238-245.
[4]Oshima T, Kurosaka D,Kato K,Kurosaka H,Mashima Y,Tanaka Y,et al.Tranilast inhibits cell proliferation and collagen synthesis by rabbit corneal and Tenon′s capsule fibroblasts[J].Curr Eye Res,2000,20(4):283-286.
[5]Kaneyama T,Kobayashi S,Aoyagi D,Ehara T. Tranilast modulates fibrosis,epithelial-mesenchymal transition and peritubular capillary injury in unilateral ureteral obstruction rats[J].Pathology,2010,42 (6):564-573.
[6]Golden HB,Gollapudi D,Gerilechaogetu F,Li J,Cristales RJ,Peng X,et al.Isolation of cardiac myocytes and fibroblasts from neonatal rat pups [J].Methods Mol Biol,2012,843(3):205-214.
[7]Swaney JS,Roth DM,Olson ER,Naugle JE,Meszaros JG,Insel PA.Inhibition of cardiac myofi⁃broblastformationandcollagensynthesisby activation and overexpression of adenylyl cyclase [J].Proc Natl Acad Sci USA,2005,102(2):437-442.
[8]Thandavarayan RA,Giridharan VV,Watanabe K,Konishi T.Diabetic cardiomyopathy and oxidative stress:role of antioxidants[J].Cardiovasc Hematol Agents Med Chem,2011,9(4):225-230.
[9]Neumann S,Huse K,Semrau R,Diegeler A,Gebhardt R,Buniatian GH,et al.Aldosterone and D-glucose stimulate the proliferation of human cardiac myofibroblasts in vitro[J].Hypertension,2002,39 (3):756-760.
[10]Attisano L,Warne JL.Signal transduction by the TGF-beta superfamily[J].Science,2002,296(5573):1646-1647.
[11]Biernacka A,Dobaczewski M,Frangogiannis NG. TGF-β signaling in fibrosis[J].Growth Factors,2011,29(5):196-202.
[12]Mifsud S,Kelly DJ,Qi W,Zhang Y,Pollock CA,Wilkinson-Berka JL,et al.Intervention with tranilastattenuatesrenalpathologyandalbuminuriain advanced experimental diabetic nephropathy[J]. Nephron Physiol,2003,95(4):83-91.
[13]Li SS,Liu QF,He AL,Wu FR.Tranilast attenuates TGF-β1-induced epithelial-mesenchymal transition in the NRK-52E cells[J].Pak J Pharm Sci,2014,27(1):51-55.
[14]Tao Y,Hu L,Li S,Liu Q,Wu X,Li D,et al. Tranilast prevents the progression of chronic cyclo⁃sporine nephrotoxicity through regulation of trans⁃forming growth factor β/Smad pathways[J].Trans⁃plant Proc,2011,43(5):1985-1988.
[15]Wang J,Fu LJ,Yan R.Effects of tranilast on myocardialfibrosisofdiabeticrats[J].Chin Pharmacol Bull(中国药理学通报),2013,29(6):837-841.
Effect of tranilast on cardiac fibroblasts proliferation and phenotype transformation incubated with high concentration of glucose
OBJECTlVE To investigate the effect of tranilast on cardiac fibroblasts proliferation and phenotype transformation incubated with a high concentration of glucose and the possible mechanism. METHODS The cardiac fibroblasts were divided into seven groups in accordance with different nutrient solutions:normal control group(5.5 mmol·L-1glucose),hypertonic group(5.5 mmol·L-1glucose+ mannitol 25 mmol·L-1),high glucose group(25 mmol·L-1glucose),tranilast intervention groups (25 mmol·L-1glucose+tranilast 50,100 and 200 μmol·L-1),and activin receptor-like kinase 7(ALK7)inhibitor group(25 mmol·L-1glucose+10 μmol·L-1SB431542).The cell proliferation was detected by MTT method.The transformation of cardiac fibroblasts was determined by immunfluorescence staining.The expression of fibroblast specific protein 1(FSP-1),α-smooth muscle actin(α-SMA),transforming growth factor-β1(TGF-β1)and ALK7 was assessed by Western blotting.RESULTS Compared with nor⁃mal control group,A492 nmof cells in high glucose group was significantly increased(P<0.01),while the expression of α-SMA,TGF-β1and ALK7 protein in high glucose group was significantly increased(P<0.01),but FSP-1 protein was significantly decreased(P<0.01).There was no difference between normal control group and hypertonic group.Compared with high glucose group,A492 nmof cells in tranilast or SB431542 intervention groups were decreased(P<0.05),and the expression of α-SMA,TGF-β1and ALK7 protein was significantly decreased(P<0.05),but the expression of FSP-1 protein was increased (P<0.05)in tranilast or SB431542 intervention groups.CONCLUSlON Tranilast can inhibit the proliferation and phenotype transformation of cardiac fibroblasts induced by high glucose,which may be related to down-regulation of the expression of ALK7.
tranilast;high glucose;cardiac fibroblasts;activin receptor-like kinase 7
FU Li-juan,E-mail:lyflj2010@126.com
WANG Jian-xia,FU Li-juan
(Department of Pharmacology,Liaoning Medical College,Jinzhou 121001,China)
R966
A
1000-3002-(2016)03-0203-06
2015-07-13接受日期:2016-02-04)
(本文编辑:齐春会)
王建霞,女,硕士研究生,主要从事糖尿病并发症药理学研究;符丽娟,女,教授,主要从事糖尿病并发症药理学研究。
符丽娟,E-mail:lyflj2010@126.com

