壳聚糖固定化乙醇脱氢酶的酶学性质研究
李 雪, 张彩艳, 童凯琛, 马中良
(上海大学 生命科学学院,上海 200444)
壳聚糖固定化乙醇脱氢酶的酶学性质研究
李雪, 张彩艳, 童凯琛, 马中良
(上海大学 生命科学学院,上海 200444)
以壳聚糖作载体,戊二醛作交联剂,并以游离的乙醇脱氢酶作为对照,对壳聚糖固定化乙醇脱氢酶的酶学性质进行研究.结果表明,当戊二醛浓度为0.6%(v/v),交联时间为6h时,壳聚糖固定化乙醇脱氢酶对温度、碱性环境以及金属离子Cu2+溶液的耐受性均明显增强,且操作稳定性明显提高.
壳聚糖; 乙醇脱氢酶; 固定化酶
几丁质(chitin)是自然界中仅次于纤维素的第二大类天然高分子化合物,是地球上存量极为丰富的一种自然资源[1].壳聚糖(chitosan,CTS),几丁质的脱乙酰基产物,由β-(1,4)-2-乙酰胺基-D葡萄糖单元和β-(1,4)-2-氨基-D-葡萄糖单元组成,属多糖类物质,是天然多糖中少见的带正电荷的高分子物质,其在材料工业、农业、医药、食品、化妆品以及环保等诸多方面具有广泛的用途[2-4].
乙醇脱氢酶(alcoholdehydrogenase,ADH)大量存在于人类和动物肝脏、微生物细胞及植物组织内,是广泛专一性的含锌金属酶,以烟酰胺腺嘌呤二核苷酸(nicotinamideadeninedinucleotide,NAD)为辅酶,催化生物体内伯醇的氧化和醛的还原.乙醇脱氢酶与乙醛脱氢酶(acetaldehydedehydrogenase,ALDH)共同构成乙醇脱氢酶系,参与体内乙醇代谢,是人和动物体内重要的代谢酶[5-6].
固定化酶(immobilizedenzyme)是20世纪60年代发展起来的一种新技术,将水溶性酶用物理或化学方法处理,使之成为不溶于水的,但仍具有酶活性的状态,并在一定的空间范围内起催化作用,能反复和连续使用的酶[7-9].本文作者以壳聚糖作为载体,戊二醛作为交联剂,将乙醇脱氢酶固定化,与游离的乙醇脱氢酶作比较,进而研究壳聚糖固定化乙醇脱氢酶的酶学性质,为工业生产提供更多的理论依据.
1 材料与方法
1.1材料
壳聚糖(自制,脱乙酰度大于80%);乙醇脱氢酶为BBI公司(Canada)产品;戊二醛由上海试剂厂分装,浓度为25%(v/v);其他试剂均为分析纯或者生化试剂.
1.2方法
1.2.1甲壳素及壳聚糖的提取[10]
称取200g干虾壳置于4% 的HCl溶液中浸泡,期间不断搅拌使虾壳中钙质充分分解,用自来水充分洗净,直至pH呈中性后用10%(g/v) 的NaOH溶液浸没,并放置于温度设定为90 ℃的烤箱内7h以上,取出过滤.重复脱钙、去蛋白便可得到甲壳素.将得到的甲壳素用40% 的NaOH浸没,放置于温度设定为100 ℃的烤箱内7h以上,进行脱乙酰化反应后得到壳聚糖.
1.2.2壳聚糖固定化酶的制备[11-14]
称取3g壳聚糖溶于1%的醋酸溶液中,缓慢搅拌过夜使其充分溶解并抽滤,滤液用2mol/LNaOH调节pH至12,产生大量白色絮状沉淀后,抽滤,用蒸馏水洗至中性后悬浮于pH7.8Tris-HCl缓冲液中,再加入0.5mL乙醇脱氢酶原酶液,搅拌吸附1h,加入25%戊二醛,使其终浓度为0.6%(v/v),搅拌吸附6h,抽滤水洗,制备获得壳聚糖固定化酶,于4 ℃冰箱中保存备用.
1.2.3蛋白酶浓度的测定[15-16]
采用Lowry法对乙醇脱氢酶溶液蛋白浓度进行测定,并在650nm波长下测定吸光度变化值.
1.2.4酶活力的测定
称取0.5g的固定化醇脱氢酶,加入6mL、pH7.5NaHPO4/NaH2PO4缓冲溶液,37 ℃下水浴10min,然后加入2mol/L乙醇和4.5mmol/LNAD+,37 ℃下水浴5min,回收固定化酶,反应液立刻置于沸水中灭活1min,并在320nm波长下测定吸光度变化值.
2 结 果
2.1戊二醛浓度对固定化酶蛋白浓度以及酶活力的影响
戊二醛既是交联剂又是酶的变性剂,戊二醛的浓度对固定化酶的活性具有重大的影响,分别使用浓度为0.4%、0.6%、0.8%、1.0%、1.2%和2.0%的戊二醛与壳聚糖载体交联,测定不同条件下固定化酶蛋白量和酶活力.
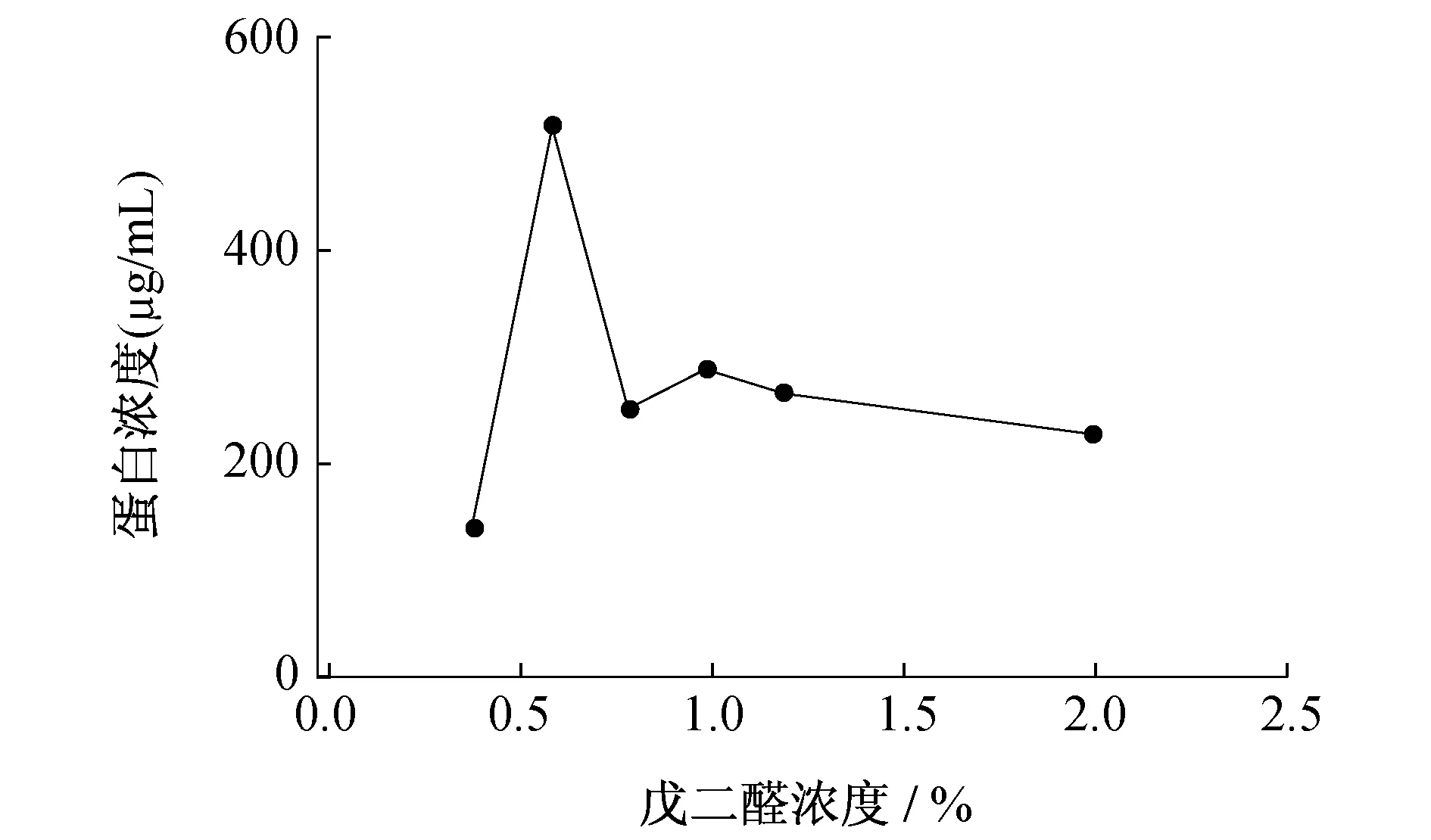
图1 戊二醛浓度对固定化酶蛋白质量浓度的影响
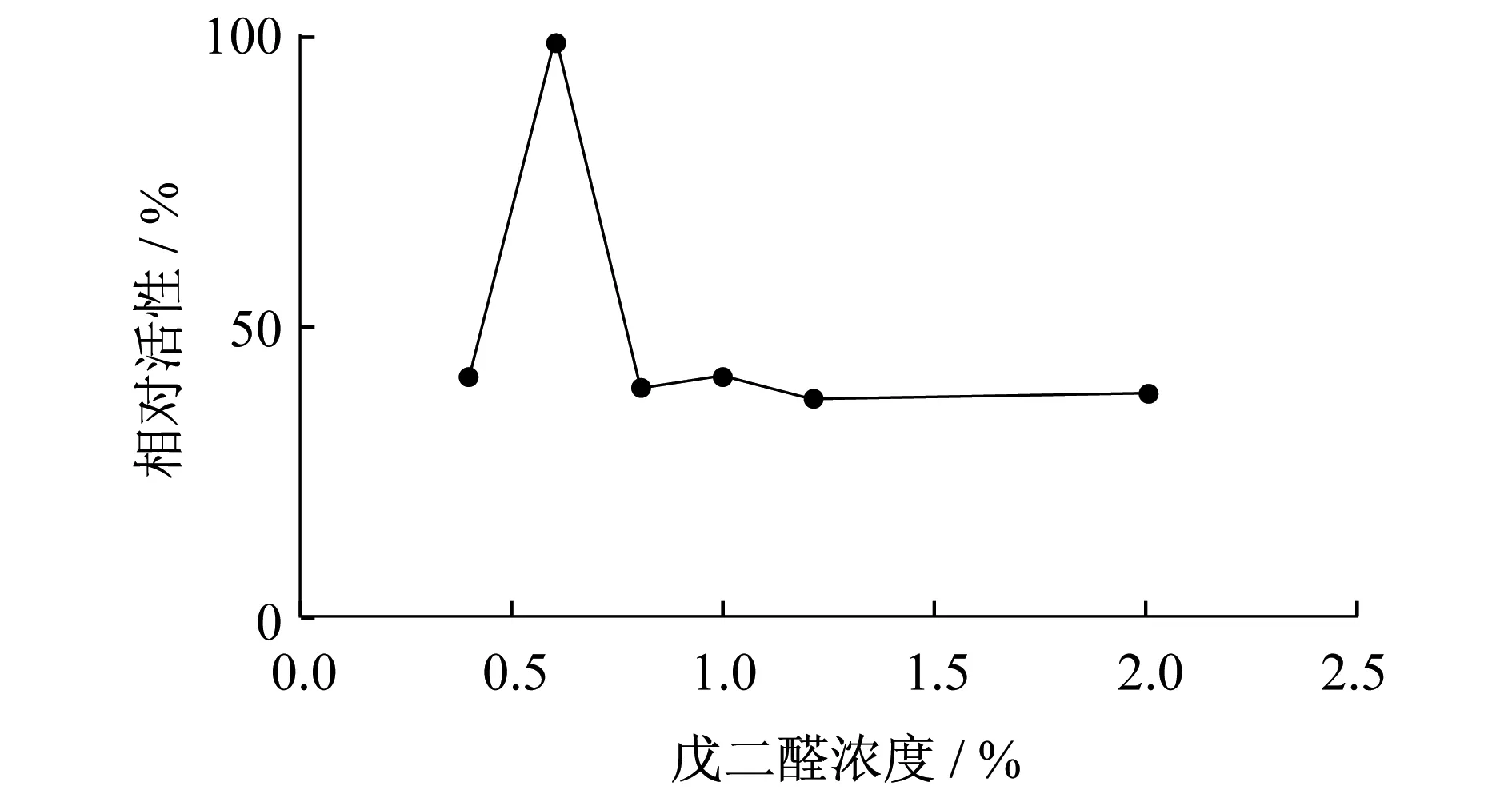
图2 戊二醛浓度对固定化酶酶活力的影响
从图1、2可以看出在交联体系中,戊二醛终浓度为0.6%时,固定化酶的酶活性是最高的.浓度低于或者高于0.6%,酶活性都会下降.
2.2pH值对固定化乙醇脱氢酶稳定性的影响
在pH值 6.0~11.0 范围内,测定不同pH值条件下游离酶和固定化酶的酶活力变化(图3).游离的乙醇脱氢酶在碱性条件下酶活力较高,但当pH值高于9.0后,酶活力急速下降;而固定化醇脱氢酶在较高pH值的环境下反而有更高的酶活性.由于壳聚糖为阳离子型载体,其表面具有游离氨基,固定化酶周围的微环境呈弱碱性,因而固定化酶的最适作用pH值明显高于游离酶.并且固定化酶的空间结构受载体的影响,也降低了其对pH值变化的敏感性.
2.3固定化乙醇脱氢酶的热稳定性
分别在不同的温度条件下将游离酶和固定化酶处理后测其酶活力(图4).游离的乙醇脱氢酶最适温度在40 ℃左右,超过50 ℃后酶活力急剧下降,温度超过60 ℃后游离酶活力接近于0.而壳聚糖固定化乙醇脱氢酶与游离酶相比其耐热性明显增强,固定化酶在较高的温度范围内保持有较高的活性,在80 ℃左右时,固定化酶仍具有较高的酶活力,这表明固定化酶的热稳定性明显提高.
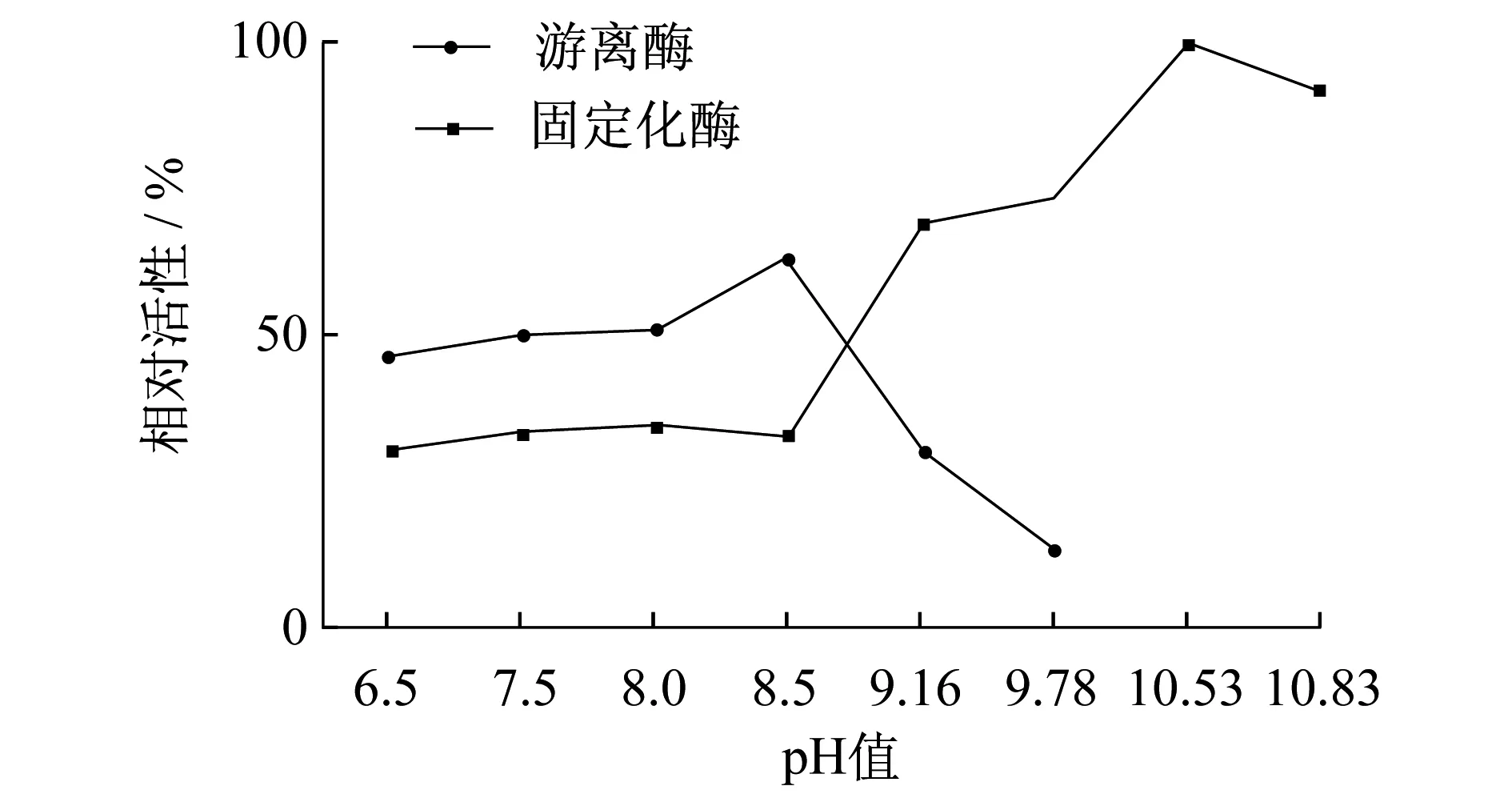
图3 游离酶和固定化酶的酶活性随pH值变化关系
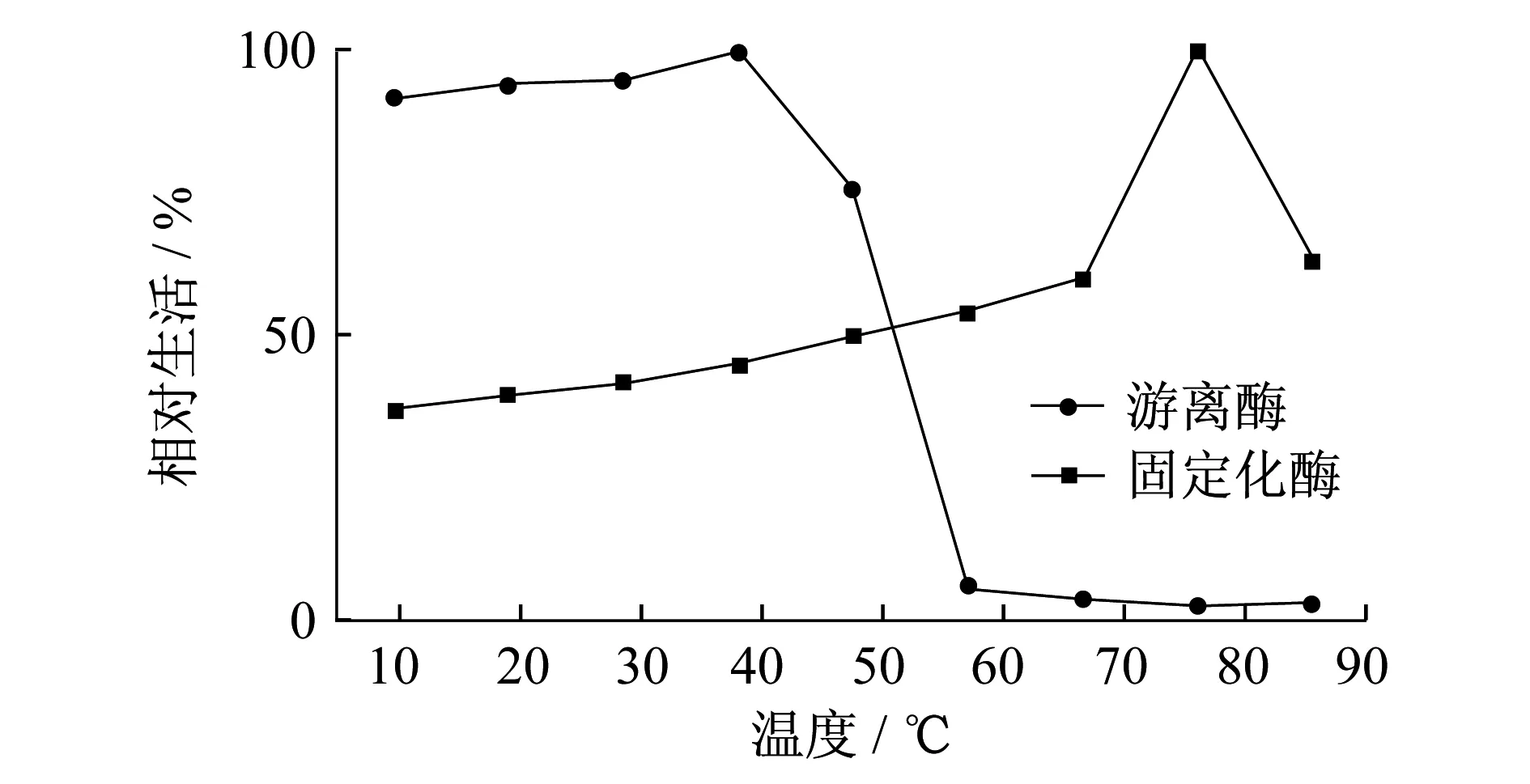
图4 游离酶和固定化酶的酶活力随温度变化关系
2.4金属离子对固定化乙醇脱氢酶酶活力的影响
研究金属离子对固定化酶酶活力的影响,分别配置物质的量浓度为10-2mol/L和10-3mol/L两种不同K+、Mn2+、Cu2+、Co2+、Zn2+以及Ca2+溶液,称量适量的游离酶溶液以及固定化酶加入其中,分别测其酶活力.由图5可知,两种不同物质的量浓度的Cu2+金属离子溶液对游离酶都有强烈的抑制作用,而对固定化乙醇脱氢酶的抑制作用则较为微弱.由此可见,固定化酶对Cu2+的稳定性较之游离酶有明显的提高,固定化降低了酶对外界环境的敏感性,能更大程度地发挥酶的活性.

图5 金属离子对游离酶和固定化酶酶活力的影响
2.5固定化乙醇脱氢酶的半衰期
将固定化酶分别悬浮在pH=9.0和pH=10.0的缓冲液中,并进行连续12次使用的操作,测定每次使用后的酶活力(图6).壳聚糖固定化乙醇脱氢酶具有较长的半衰期,在pH=9.0条件下,重复使用8次后,固定化酶酶活力虽随着次数的增加有所降低,但仍保持55%的酶活,且表现出较高的稳定性.在pH=10.0条件下,固定化酶稳定性相对较低,在第1次使用后酶活力下降较快,高酶活力的优势不再明显.相对于游离酶而言,固定化酶在使用中具有较好的稳定性,半衰期较长,更加经济耐用.

图6 不同pH值条件下固定化酶的半衰期
3 结 论
固定化酶的研究一直是酶学上研究的重要方面[17],乙醇脱氢酶在工业上的应用很广泛.本研究表明,壳聚糖固定化乙醇脱氢酶与游离的乙醇脱氢酶相比,在较广泛的温度范围和pH值范围内都有较高的酶活和稳定性,Cu2+对固定化酶酶活力抑制作用微弱,且固定化酶在操作过程中具有较好的重复使用性,在经过多次重复使用后仍然保有较高的催化活力.因此,壳聚糖固定化乙醇脱氢酶有望在实际生产中得到广泛应用.
[1]YounesI,RinaudoM.Chitinandchitosanpreparationfrommarinesources.Structure,propertiesandapplications[J].MarineDrugs,2015,13(3):1133-1174.
[2]SahariahP,GawareVS,LiederR,etal.Theeffectofsubstituent,degreeofacetylationandpositioningofthecationicchargeontheantibacterialactivityofquaternarychitosanderivatives[J].MarineDrugs,2014,12(8):4635-4658.
[3]EijsinkV,HoellI,Vaaje-KolstadaG.Structureandfunctionofenzymesactingonchitinandchitosan[J].Biotechnology&GeneticEngineeringReviews,2010,27(1):331-366.
[4]PrasadM,PalaniveluP.Immobilizationofathermostable,fungalrecombinantchitinaseonbiocompatiblechitosanbeadsandthepropertiesoftheimmobilizedenzyme[J].Biotechnology&AppliedBiochemistry,2015,62(4):523-529.
[5]LerchnerA,JaraschA,MeiningW,etal.Crystallographicanalysisandstructure-guidedengineeringofNADPH-dependentRalstoniasp.alcoholdehydrogenasetowardNADHcosubstratespecificity[J].Biotechnology&Bioengineering,2013,110(11):2803-2814.
[6]HongSH,NgoHP,KangLW,etal.CharacterizationofalcoholdehydrogenasefromKangiellakoreensisanditsapplicationtoproductionofall-trans-retinol[J].BiotechnologyLetters,2015,61(2):165-174.
[7]HomaeiAA,SaririR,VianelloF,etal.Enzymeimmobilization:anupdate[J].JournalofChemicalBiology,2013,6(4):185-205.
[8]QiaoL,LvB,FengX,etal.Anewapplicationofaptamer:One-steppurificationandimmobilizationofenzymefromcelllysatesforbiocatalysis[J].JournalofBiotechnology,2015,203:68-76.
[9]VidalJC,EstebanS,GilJ,etal.Acomparativestudyofimmobilizationmethodsofatyrosinaseenzymeonelectrodesandtheirapplicationtothedetectionofdichlorvosorganophosphorusinsecticide[J].Talanta,2006,68(3):791-799.
[10]郭敏亮,姜涌明,马中良.壳聚糖固定化AS1.398中性蛋白酶稳定性的研究 [J].微生物学通报,1996(1):19-21.
GuoML,JiangYM,MaZL.Studyonthestabilityofchitosan-imbolizedas1.398neutralproteinase[J].Microbiolgy,1996(1):19-21.
[11]马中良,李艳利,焦吉祥,等.壳聚糖固定化酵母蔗糖酶的研究 [J].药物生物技术,2005(6):379-382.
MaZL,LiYL,JiaoJX,etal.Studyonthepropertiesofchitsan-immoblizedyeastsurase.PharmacetticalBiotechnology[J].PharmaceuticalBiotechnology,2005,(6):379-382.
[12]李艳利,史永昶,姜涌明,等.壳聚糖多孔珠的制备及其作为亲和吸附剂载体的研究 [J].药物生物技术,1998(4):241-244.
LiYL,ShiYC,JiangYM,etal.Preparationofchitosanporousbeads(CPB)andstudiesonCPBasaffinityadsorbentssupport[J].PharmacetticalBiotechnology,1998(4):241-244.
[13]李艳利,史永昶,姜涌明,等.壳聚糖多孔珠作为亲和吸附剂载体纯化人尿胰蛋白酶抑制剂 [J].药物生物技术,2000(4):218-220.
LiYL,ShiYC,JiangYM,etal.Purificationofhumanurinetrypsininhibitorbyaffinitychromatographyusingchitosanporousbeadsassupport[J].PharmacetticalBiotechnology,2000(4):218-220.
[14]TaqieddinE,AmijiM.Enzymeimmobilizationinnovelalginate-chitosancore-shellmicrocapsules[J].Biomaterials,2004,25(10):1937-1945.
[15]Redmile-GordonMA,ArmeniseE,WhiteRP,etal.Acomparisonoftwocolorimetricassays,baseduponLowryandBradfordtechniques,toestimatetotalproteininsoilextracts[J].SoilBiology&Biochemistry,2013,67(100):166-173.
[16]LuTS,YiaoSY,LimK,etal.InterpretationofbiologicalandmechanicalvariationsbetweentheLowryversusBradfordmethodforproteinquantification[J].NorthAmericanJournalofMedicalSciences,2010,2(7):325-328.
[17]SilvaDF,RosaH,CarvalhoAF,etal.Immobilizationofpapainonchitinandchitosanandrecyclingofsolubleenzymefordeflocculationofsaccharomycescerevisiaefrombioethanoldistilleries[J].EnzymeResearch,2015:573721.
(责任编辑:顾浩然)
Study of enzymatic properties of Chitsan-immobilizedAlcohol Dehydrogenase
LI Xue, ZHANG Caiyan, TONG Kaichen, MA Zhongliang
(CollegeofLifeSciences,ShanghaiUniversity,Shanghai200444,China)
Takingfreeenzymeascontrol,weinvestigatedtheenzymaticpropertiesofimmobilizedalcoholdehydrogenaseusingchitosanascarrierandglutaraldehydeascrosslinkingagent.Theresultsshowedthattheresistanceofimmobilizedalcoholdehydrogenasetotemperature,alkalineenvironmentandCu2+wassignificantlyimprovedwhenthechitosanwascrosslinkedwith0.6%glutaraldehydefor6hours,andtheoperationstabilitywasalsoobviouslyimproved.
chitosan;alcoholdehydrogenases;immobilizedenzyme
10.3969/J.ISSN.1000-5137.2016.04.015
2015-05-26
上海市能源与育种重点实验室项目;上海大学生命科学学院大学生创新项目
马中良,中国上海市宝山区上大路99号,上海大学生命科学学院,邮编:200444,E-mail:zlma@shu.edu.cn
Q55
A
1000-5137(2016)04-0482-05

