假高粱、黑高梁和高粱细胞学指标比较及其生态学意义
邹满钰, 李 娜, 郭水良, 印丽萍
(1.上海师范大学 生命与环境科学学院,上海 200234;2.上海出入境检验检疫局 动植物与食品检验检疫技术中心,上海 200234)
假高粱、黑高梁和高粱细胞学指标比较及其生态学意义
邹满钰1, 李娜1, 郭水良1, 印丽萍2
(1.上海师范大学 生命与环境科学学院,上海 200234;2.上海出入境检验检疫局 动植物与食品检验检疫技术中心,上海 200234)
假高粱(Sorghum halepense (L.)Pers.)是世界十大恶性杂草之一.黑高粱(S.almumParodi)和高粱(S.bicolor(L.)Moench)是假高粱的两种近缘种,其中黑高粱有入侵性,高粱则为栽培植物,不表现出入侵性.为了解影响植物入侵能力的生物学因素,比较了高粱属3种植物根尖分生组织细胞的染色体、细胞核、细胞大小和细胞有丝分裂指数.结果表明,高粱染色体平均投影面积最大,其次是黑高粱,假高粱的最小;就细胞和细胞核大小而言,都是高粱最大、其次是黑高粱和假高粱;在25~35 ℃的温度范围内,高粱根尖分生区细胞的有丝分裂速率最低,假高粱的最高.3种植物的种子(颖果)以高粱最大,黑高粱和假高粱的显著小,幼苗相对生长速率以高粱最小,假高粱的最高.3种植物的细胞分裂速率与其染色体、细胞核、细胞和种子大小存在显著相关,表明入侵性植物往往具有较小的分生组织细胞、细胞核和种子,但是有相对高的细胞分裂速率和幼苗相对干重.因此,根尖分生组织细胞学指标在高粱属植物入侵能力评估上有潜在应用价值.
假高粱; 黑高粱; 高粱; 细胞学指标; 生态学意义
0 前 言
随着我国对外交流的增加,外来植物引种和传入的机会加大,导致了外来植物入侵问题的日益严重[1-2].目前首要的工作是要迅速建立我国的外来入侵植物体系,提高对外来植物的预警能力[3].解决外来植物入侵的一个核心问题是如何判定植物的入侵性.
许多研究表明,基因组大小与植物的入侵性密切相关[4-8].Chen等[7]统计了世界范围内3 676种被子植物的核DNA含量与入侵性的关系,发现在大多数类群中,基因组小的植物,其入侵性就高.因此,基因组大小是评估植物入侵能力的一个重要指标.
DNA在决定表型变异中有重要作用,可能与植物的生态适应间存在某种关系[9].例如,Bennett等[10]通过比较14种植物根尖细胞有丝分裂中期染色体总体积与DNA含量间的关系,发现其呈正相关;Baetcke等[11]通过比较30种草本被子植物平均顶端分生组织细胞核体积跟DNA含量间的关系,发现DNA含量高的物种的细胞普遍较大;Van′tHof等[12]通过比较温度为23 ℃时生长的6种被子植物根尖细胞最短有丝分裂周期时间与DNA含量间的关系,发现核DNA含量跟细胞有丝分裂周期持续时间呈正相关;Bennett等[13]通过比较温度为20 ℃时生长的18种二倍体被子植物减数分裂持续时间与DNA含量间的关系,其存在密切的正相关性;在葱属(Allium)、野碗豆属(Vicia)、还阳参属(Crepis)中[14-15],24种英国豆科植物,以及32种英国产的草本植物[16],其DNA含量跟种子重量之间也有极大的正相关关系.
由于测定基因组大小需要昂贵的仪器设备和试剂费用.高粱属的假高粱和黑高粱均属于外来入侵性杂草,而与其同一属的高粱则属于典型的农作物(非杂草).以此3种植物所谓实验材料,通过测定入侵种与非入侵种的染色体大小、细胞核大小、细胞大小、细胞有丝分裂指数和幼苗生长速率,可以进行有关入侵性的比较研究实验来研究细胞繁殖生物学性状和植物入侵性的内在关联性,从而为植物入侵性评估提供新的指标.
1 材料与方法
1.1实验材料
实验材料假高粱、黑高梁和高粱种子由上海出入境检验检疫局动植物与食品检验检疫技术中心实验室提供.实验开始前,种子于室内干燥通风处晾干,并保存于纸袋内,室内保存.每种种子随机挑取100粒称重,重复5次,以测定各个物种种子的千粒重.
1.2实验方法
1.2.1细胞、细胞核、染色体大小以及有丝分裂指数的测定
首先将种子置入垫有2层滤纸的培养皿中,加入适量的蒸馏水,然后放入不同温度设定的光照培养箱中培养(光照时间和黑暗时间各12h).待幼苗根长至1~2cm时取出幼苗,挑取粗壮根尖洗净后用普通压片法制作根尖临时装片.预实验结果显示,对于高粱属3个物种而言,上午10:00取材较为理想,并且低温预处理效果较好.因此3种材料的取材时间均为上午10:00,然后放入温度为4 ℃的冰箱中进行预处理,处理时间为24h,再用卡诺氏溶液固定2~24h,取出材料,用蒸馏水洗净后放入解离液(95%乙醇(V):浓盐酸(V)=1∶1)解离15min,再用蒸馏水漂洗干净.之后用改良石炭酸品红溶液染色30~40min,制作根尖临时装片[17],在Motic数字显微镜DMB1.223(MoticLtd.Crop.中国)下镜检.每个物种选取15个能观察到处于细胞分裂中期,染色体清晰、分散的细胞,放在100倍镜下拍照.同时对于每个物种在100倍镜下各取500个分生区细胞和细胞核拍照.其中细胞和细胞核大小的比较实验总共设置低温、8-羟基喹啉和饱和对二氯苯3个预处理条件.
对每个物种而言,分别制作于25、30和35 ℃下培养的根尖染色体的临时装片用于统计有丝分裂指数.处理时每种挑选10个细胞分散、分生区清晰的根尖在40倍镜下连续拍摄10张照片,统计有丝分裂指数(前期、中期和后期细胞数/分生区细胞总数).
分别挑取高粱属3个物种的10个处于有丝分裂中期、染色体较为分散而清晰的细胞,统计计算染色体总投影面积和平均投影面积(MCH).
1.2.2幼苗生长的测定
挑选颗粒饱满的种子,进行萌发实验.种子先用蒸馏水洗涤3次,然后每个处理选取50颗,采用纸碟法[18],于POX多段可编程光照培养箱恒温(20、25、30 ℃)培养(光照12h,黑暗12h).培养皿直径9cm,每个处理设立3个重复.从培养皿中的种子萌发率到达30%后开始,统一挑出30颗已经萌发出来的种子,放在对应的温度中培养形成幼苗,培养2周后烘干称重.
1.2.3数据处理
采用SPSS10.0统计软件中的one-wayANOVA模块进行单因素方差分析,采用LSD方法进行多重比较.方差不整齐时,首先对数据进行对数转换或者开平方根-反正弦转换[19].
2 结 果
2.1染色体和种子大小
高粱属3种植物无论是染色体平均投影面积和种子千粒重都有显著差异.就染色体大小而言,黑高粱最大,假高粱次之,最后是高粱(表1).其中,假高粱和黑高粱是四倍体,高粱是二倍体.然而,就染色体平均投影面积而言,高粱的最大,然后是黑高粱,假高粱的最小;种子千粒重而言,高粱最大,然后是黑高粱,假高粱.总体上,高粱的染色体平均投影面积和种子千粒重要比假高粱和黑高粱的大.
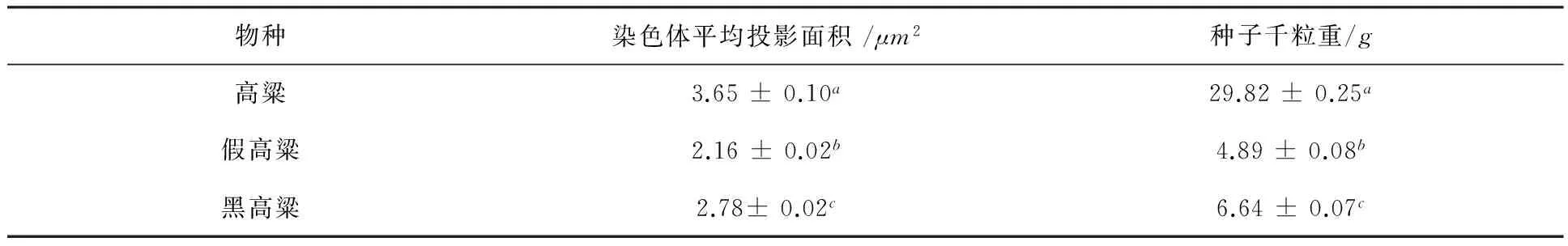
表1 高粱属3种植物染色体和种子大小
注:同一列中相同的字母表示相互间在0.05水平上无显著差异.
2.2不同预处理条件下的细胞和细胞核大小
高粱属3种植物在低温、8-羟基喹啉和饱和对二氯苯3个预处理条件下,就细胞和细胞核大小而言,都是高粱最大、然后是黑高粱和假高粱(表2~3).
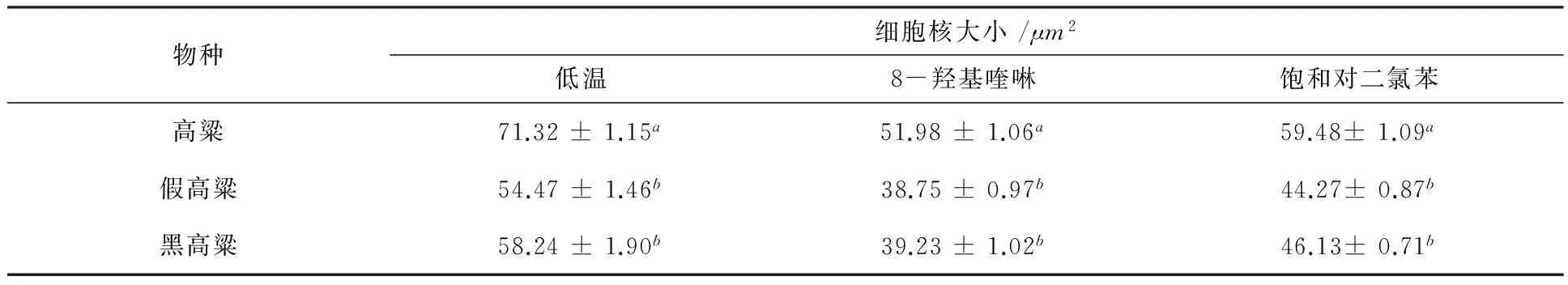
表2 高粱属3种植物不同预处理条件下细胞核大小
注:同一列中相同的字母表示相互间在0.05水平上无显著差异.

表3 高粱属3种植物不同预处理条件下细胞大小
注:同一列中相同的字母表示相互间在0.05水平上无显著差异.
2.3不同温度下的有丝分裂指数
在25~35 ℃的温度范围内,高粱的根尖分生区细胞的有丝分裂指数都是最小的;假高粱的有丝分裂速率在各个温度条件下都是最高的(表4).表4显示总体上随着细胞核的增大,根尖分生区细胞的有丝分裂速率下降.

表4 高粱属3种植物不同温度下有丝分裂指数
注:同一列中相同的字母表示相互间在0.05水平上无显著差异.
2.4幼苗生长速度的比较研究
随着温度从20~30 ℃,假高粱和黑高梁幼苗生长14d之后的幼苗相对干重(幼苗相对干重=幼苗干重/种子千粒重)也相应上升,之后随着温度的升高而下降,幼苗生长14d之后的相对干重在30 ℃时达到最高;高梁幼苗相对干重在25 ℃时达到最高,高于或低于该温度其相对干重都有所下降(表5).
从表5可以发现,高梁的幼苗生长14d之后的相对干重在25 ℃时达到最高,假高粱和黑高粱则的相对干重在30 ℃时达到最高.这反映出高粱属的这两种杂草与作物的幼苗生长对温度的反应是不同的.
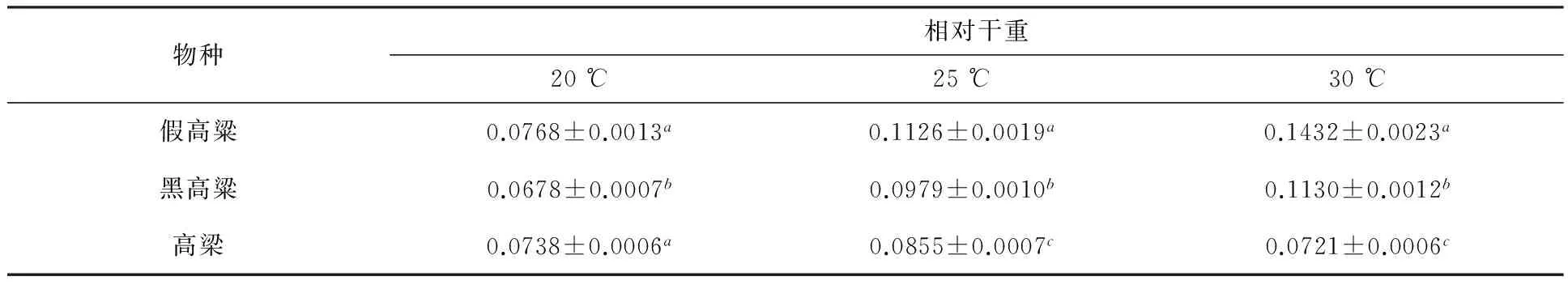
表5 假高粱、黑高粱、高梁于不同温度下生长14 d后的幼苗相对干重
注:同一列中相同的字母表示相互间在0.05水平上无显著差异.
3 结 论
入侵性强的植物往往具有较小的基因组[7].本研究中黑高粱、假高粱和高粱的基因组大小分别为 0.8188、0.8363和0.9050pg[20].通过对假高粱和高粱细胞学指标的比较,发现基因组大小和染色体平均投影面积、细胞核大小、细胞大小,以及种子重量之间呈正相关,与幼苗的相对重量呈负相关关系.
入侵性强的植物往往具有相对高的幼苗生长速率,即单位时间内幼苗的相对生物量较大,使它们在生活史的“起步”阶段处于竞争上的优势.在25和30 ℃条件下,假高粱的相对幼苗生物量极显著地高于高粱.生活史短、产生量大、适应远距离传播的[6,21-23]性状可以增强植物的入侵性.高粱的种子千粒重极显著地大于入侵性强的假高粱和黑高粱.
基因组大小上的变异主要是由非基因DNA部分所造成的.这说明核DNA可以通过两种途径影响生物的表型:第一种是通过核DNA遗传物质的表达;第二种是通过核DNA本身的重量及体积的物理作用影响.有人将核DNA不依赖其编码信息来影响表型的状况定义“核型”,显然,细胞大小、体积、重量及发育速率跟核DNA含量变化间的关系部分可能是由“核型”引起的[9].
本研究丰富了植物基因组大小影响植物入侵能力的生物学机理研究内容.同时也验证了植物根尖分生组织的细胞学指标在植物入侵能力评估上具有潜在的应用价值,至少在部分类群中适用,例如高粱属.Chen等[7]指出应用基因组大小评估植物的入侵能力,在不少类群中有潜在应用价值,但是并不适合于所有的类群.应用植物根尖细胞学指标进行入侵能力的评估,也可能局限于某些类群.因此,需要开展更多的工作来了解根尖分生组织细胞学指标对植物入侵评估的普适性.
[1]强胜,曹学章.中国异域杂草的考察与分析 [J].植物资源与环境学报,2000,9(4):34-38.
QiangS,CaoXZ.SurveyandanalysisofexoticweedsinChina[J].JournalofPlantResources&Environment,2000,9(4):34-38.
[2]LiZY,XIEY.InvasivealienspeciesinChina,Beijing[M].Beijing:ChinaForestPublishingHouse,2002.
[3]桑卫国.我国外来杂草入侵特点的初步分析 [J].中国农业科技导报,2002,4(5):59-61.
SangWG.PrimaryanalysisofinvasivecharacteristicsofalienweedsinChina[J].ReviewofChinaAgriculturalScienceandTechnology,2002,4(5):59-61.
[4]郭水良,陈国奇,毛俐慧.DNAC-值与被子植物入侵性关系的数据统计分析 [J].生态学报,2008,28:3698-3705.
GuoSL,ChenGQ,MaoLH.RelationshipbetweenDNAC-valueandinvasivenessin539angiospermspeciesinChina[J].ActaEcologicaSinica,2008,28:3698-3705.
[5]RejmánekM.Atheoryofseedplantinvasiveness:Thefirstsketch[J].BiologicalConservation,1996,78(1-2):171-181.
[6]BennettMD,LeitchIJ,HansonL.DNAamountsintwosamplesofangiospermweeds[J].AnnalsofBotany,1998,82(12):121-134.
[7]ChenGQ,GuoSL,YinLP.ApplyingDNAC-valuestoevaluateinvasivenessofangiosperms:validityandlimitation[J].BiologicalInvasions,2010,12(5):1335-1348.
[8]Leicht-YoungSA,JrSilanderJA,LatimerAM.ComparativeperformanceofinvasiveandnativeCelastrusspeciesacrossenvironmentalgradients[J].Oecologia,2007,154(2):273-282.
[9]BenettMD.Variationingenomicforminplantsanditsecologicalimplications[J].NewPhytologist,1987,106(s1):177-200.
[10]BennettMD,Heslop-HarrisonJS,SmithJB,eta1.DNAdensityinmitoticandmeioticmetaphasechromosomesofplantsandanimals[J].JournalofCellScience,1983,63(9):173-179.
[11]BaetckeKP,SparrowAH,NaumannCH,eta1.TherelationshipofDNAcontenttonuclearandchromosomevolumesandradiosensitivity(LD50) [J].ProceedingstheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1967,58(2):533-540.
[12]Van′THofJ,SparrowAH.ArelationshipbetweenDNAcontent,nuclearvolume,andminimumcellcycletime[J].ProceedingoftheNationalAcademyofSciences,1963,49(6):897-902.
[13]BennettMD,HarberdDJ.Thetimeanddurationofmeiosis[J].PhilosophicalTransactionsoftheRoyalSocietyofLondonB,1977,277(955):201-226.
[14]BennettMD.Thedurationofmeiosisinpollenmothercellsofwheat,ryeandtriticale[J].ProceedingstheRoyalSocietyofLondonB,1972,178(1052):259~275.
[15]JonesRN,BrownLM.ChromosomeevolutionandDNAvariationinCrepis[J].Heredity,1976,36(1):91-104.
[16]MowforthMAG.VariationinnuclearDNAamountsinfloweringplants:anecologicalanalysis[D].Sheffield,UK:UniversityofSheffield,1985.
[17]NaranjoCA,FerrariMR,PalermoAM,etal.Karyotype,DNAcontentandmeioticbehaviourinfiveSouthAmericanspeciesofVicia(Fabaceae) [J].AnnalsofBotany,1998,82(6):757-764.
[18]倪丽萍,郭水良.论DNAC-值与植物入侵性的关系 [J].生态学报,2005,25(9):2372-2381.
NiLP,GuoSL.ReviewonrelationshipbetweeninvasivenessofplantsandtheirDNAC-value[J].ActaEcologicaSinica,2005,25(9):2372-2381.
[19]SteinmausSJ,PratherTS,HoltJS.Estimationofbasetemperaturesfornineweedspecies[J].JournalofExperimentalBotany,2000,51(343):275-286.
[20]郭水良,于晶,李丹丹,周平,方其,印丽萍.长三角及邻近地区138种草本植物DNAC-值测定及其生物学意义 [J].生态学报,2015,35(19):6516-6529.
GuoSL,YuJ,LiDD,ZhouP,FangQ,YinLP.DNAC-valuesof138herbaceousspeciesandtheirbiologicalsignificance[J].ActaEcologicaSinica,2015,35(19):6516-6529.
[21]BakerHG.Theevolutionofweeds[M].Glasgow:J.MacLehoseandSons,2003.
[22]PheloungPC,WilliamsPA,HalloySR.Aweedriskassessmentmodelforuseasabiosecuritytoolevaluatingplantintroductions[J].JournalofEnvironmentalManagement,1999,57(4):239-251.
[23]WeberE,GutD.AssessingtheriskofpotentiallyinvasiveplantspeciesincentralEurope[J].JournalforNatureConservation,2004,12(3):171-179.
(责任编辑:顾浩然)
Comparison of cytological indexes of Sorghum halepense,S.almum and S. bicolor and its ecological significance
ZOU Manyu1, LI Na1, GUO Shuiliang1, YIN Liping2
(1.CollegeofLifeandEnvironmentalSciences,ShanghaiNormalUniversity,Shanghai200234,China;2.TechnicalCenterforAnimals,PlantsandFoodInspectionandQuarantine,ShanghaiEntry-ExitInspectionandQuarantineBureau,Shanghai200135,China)
Sorghum halepenseisoneoftheworld′stoptenviciousweeds.S.almumandS.bicoloraretwocogenericspeciesofS.halepense.S.almumisaweedyspeciestoo,whileS.bicolorisacultivatedplant,withoutweediness.Wecomparedsomecytologicalindexes,suchasthekaryotype,thesizeofkaryonsandcells,themitosisratesofapicalmeristematiccellsofthethreeSorghumspecies,inordertoclarifythebiologicalfactorsthattakearoleintheinvasivenessofplants.TheresultsshowthatS.bicolorhasthelargestaveragechromosomeprojectionarea,followedbyS.almum,andS.halepensehasthesmallestone.Asforthesizeofcellsandkaryons,S.colorhasthelargestcellsandkaryons,followedbyS.almum,andS.halepensehasthesmallestones.Within25~35 ℃,themitosisrateoftheapicalmeristematiccellsofS.bicolorwasthelowest,whilethatofS.halepensewasthehighest.Theinvasivenessofthethreefocalspeciesaredistinctivelyrelatedwiththeirchromosomes,karyons,cells,seedsizesandmitosisrates,supportingtheviewpointthattheplantswithsmallermeristematiccellsandkaryonshavehigherinvasiveness.Therefore,themeristematiccytologicalindexesmayhaveapotentialvalueinpredictionoftheinvasivenesstheSorghum.
Sorghum halepense; Sorghum Almum; Sorghum Bicolor;cytologicalindexes;ecologicalsignificance
10.3969/J.ISSN.1000-5137.2016.04.013
2015-05-14
国家自然科学基金(31070479);上海市科委基础研究重点项目(10JC1412100)
邹满钰,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:zou18772306330@sina.com;郭水良,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:gsg@shnu.edu.cn
Q94-331
A
1000-5137(2016)04-0471-06

