河南省商丘市艾滋病抗病毒治疗病毒未抑制患者HIV-1耐药毒株的变异*
袁 源,刘宏伟#,刘春华,王 哲,阮玉华,邢 辉
1)河南省疾病预防控制中心性病艾滋病研究所 郑州 450016 2)中国疾病预防控制中心性病艾滋病预防控制中心 北京 100050
河南省商丘市艾滋病抗病毒治疗病毒未抑制患者HIV-1耐药毒株的变异*
袁源1),刘宏伟1)#,刘春华1),王哲1),阮玉华2),邢辉2)
1)河南省疾病预防控制中心性病艾滋病研究所 郑州 4500162)中国疾病预防控制中心性病艾滋病预防控制中心 北京 100050
人类免疫缺陷病毒;耐药;抗病毒治疗;基因突变;河南省
目的:了解河南省商丘市艾滋病一线抗病毒治疗病毒未抑制患者HIV-1耐药毒株的变异。方法:采集河南省商丘市一线抗病毒治疗大于6个月、病毒未抑制的艾滋病患者血样231份,提取RNA,通过逆转录及巢式PCR扩增HIV-1 pol区基因,所得扩增片段进行测序后提交斯坦福大学HIV耐药数据库进行基因型耐药性分析。结果:在231份样本中,229份扩增并测序成功,共获得229例患者蛋白酶区和逆转录酶区的基因扩增片段。针对非核苷类逆转录酶抑制剂(NNRTIs)、核苷类逆转录酶抑制剂(NRTIs)和蛋白酶抑制剂(PIs),分别有185例(80.79%)、150例(65.50%)和3例(1.31%)发生耐药性突变,针对上述各抑制剂发生最多的耐药性突变分别为K103N/S 45.42%(104/229)、M184I/V 43.67%(100/229)和M46I 0.87%(2/229),其中与病毒载量5~ lg拷贝/mL相比,M184I/V耐药性突变在患者体内病毒载量3~拷贝/mL时更易出现(OR=0.283,95%CI为0.136~0.592,P<0.001),与治疗时间6~个月相比,K103N/S耐药性突变在患者治疗时间48~个月时更易出现(OR=7.422,95%CI为1.637~33.651,P<0.001),K65R突变位点在使用含D4T一线抗病毒治疗方案患者中发生率较高(P=0.044)。结论:河南省商丘市抗病毒治疗病毒未抑制人群中耐药性突变位点多、类型复杂,应根据耐药突变情况选用更适合的抗病毒起始治疗方案,以减少耐药毒株的产生。
高效抗逆转录病毒治疗(HAART)方法可有效地抑制HIV感染者体内病毒复制,明显降低患者的病死率,延长患者的生存期。但如果产生了耐药,病毒复制不能有效地控制,就会导致临床上抗病毒治疗的失败[1]。河南省是我国最早实施HAART的省份之一,初始抗病毒治疗方案为2种核苷类逆转录酶抑制剂(NRTI)+1种非核苷类逆转录酶抑制剂(NNRTI)的一线抗病毒治疗方案。随着抗病毒治疗时间的持续,HIV-1耐药毒株变异不可避免会发生。为了解河南省HIV-1耐药毒株变异的情况,作者选取商丘市一线抗病毒治疗病毒未抑制的患者进行了HIV-1基因型耐药性的检测与研究,为指导后续二线抗病毒治疗、制定有效抗病毒治疗方案提供依据。
1 对象与方法
1.1对象河南省商丘市重点县一线抗病毒治疗大于6个月,病毒未抑制(病毒载量≥3 lg拷贝/mL)的艾滋病患者231例,年龄18~68(45.3±9.1)岁,男124例,女107例,接受治疗时间8.3~73.3(53.6±14.1)个月,调查时病毒载量为3.31~6.55(4.45±0.75)lg拷贝/mL。采集患者的静脉血,经乙二胺四乙酸三钾(EDTA-3K)抗凝后,于6 h内经3 000×g离心10 min分离血浆,分装后冻存于-80 ℃用于基因型耐药的检测。
1.2病毒载量检测使用Abbott m2000 RealTime HIV-1全自动实时荧光定量病毒载量检测系统(美国Abbott公司)检测血浆HIV病毒载量,最小检测值1.602 lg拷贝/mL。
1.3基因型耐药性检测
1.3.1巢式PCR扩增采用RNA提取试剂盒(德国Qiagen公司),从待检血浆中抽提病毒RNA。以提取的RNA为模板,进行逆转录和巢式PCR扩增。先用一步RT-PCR方法完成逆转录和第一轮PCR(TaKaRa One Step RNA PCR Kit试剂盒,大连宝生物公司),再以第一轮PCR产物为模板进行第二轮PCR[2]。PCR扩增产物大小为1 300 bp,10 g/L琼脂糖凝胶电泳,切下目的片段,用QIAamp胶回收试剂盒(德国Qiagen公司)进行回收,回收产物用上海Invitrogen生物技术有限公司ABI 377全自动DNA测序仪双脱氧终止法测序。
1.3.2序列拼接与分析用ContigExpress软件将核苷酸序列拼接、校对后,得到包括蛋白酶区1~99氨基酸和逆转录酶区1~300氨基酸的pol基因区序列,提交美国斯坦福大学HIV耐药数据库(http://hivdb.stanford.edu/pages/algs/sierra_sequence.html)进行比对,确定耐药性突变位点和对各种抗病毒药物的耐受程度。针对每种药物给出评分,分为低度(15~分)、中度(30~分)和高度(60~分),低度及以上耐药即为基因型耐药。
1.4统计学处理应用SAS 9.2进行分析,对所得到的HIV-1耐药基因突变频率和位点与艾滋病患者的病毒载量、治疗时间的关系进行单因素logistic回归分析,抗病毒治疗方案与HIV-1耐药突变发生的关系分析Fisher精确概率法。检验水准α=0.05。
2 结果
2.1抗病毒治疗病毒未抑制患者情况分析共收集抗病毒治疗病毒未抑制HIV患者231例, 229例患者的样本扩增成功,获得229例患者蛋白酶区和逆转录酶区的基因扩增片段。229例患者中53.71%(123/229)为男性,99.56%(228/229)为汉族,年龄18~68(45.3±9.3)岁,感染途径主要以血液传播为主,占92.58%(212/229)。患者接受治疗时间为8.26~73.29(53.70±14.02)个月,调查时病毒载量为3.31~6.55(4.45±0.75)lg拷贝/mL。初始抗病毒治疗方案全部为2种NRTI+1种NNRTI的一线抗病毒治疗方案,其中71.62%(164/229)为齐多夫定(AZT)/司他夫定(D4T)+去羟肌苷(DDI)+奈韦拉平(NVP)/依非韦伦(EFV),22.71%(52/229)为AZT/D4T+拉米夫定(3TC)+ NVP/EFV,5.67%(13/229)为其他抑制剂组成的抗病毒治疗方案。
2.2HIV-1耐药基因突变发生情况分析成功完成HIV-1耐药基因检测的229例患者中,有187例患者检测出耐药性突变位点,其中针对NNRTI发生耐药性突变的有80.79%(185/229),发生突变的位点有13个,主要的耐药性突变为K103N/S 45.42%(104/229)、Y181C 31.00%(71/229)、G190A/S 20.52%(47/229);对NRTI发生耐药性突变的有65.50%(150/229),发生突变的位点有16个,主要的耐药性突变为M184I/V 43.67%(100/229)、≥1个胸苷类似物相关突变(TAMs) 42.79%(98/229)、T215F/Y 31.88%(73/229);针对蛋白酶抑制剂(PIs)发生耐药性突变的有1.31%(3/229),发生突变的位点较少只有4个,分别为M46I 2例、I54I/V 1例、G73S 1例、N88S 1例。
2.3病毒载量与HIV-1耐药性突变发生的关系 在检测出的耐药性突变位点中发现,M184I/V突变位点在病毒载量3~、4~、5~ lg拷贝/mL的患者中的发生率分别为56.76%(24/74)、43.75%(42/96)、27.12%(16/59),单因素logistic回归分析结果显示当患者病毒载量5~ lg拷贝/mL时,发生M184I/V突变的比例比病毒载量3~ lg拷贝/mL时发生的比例下降(表1)。
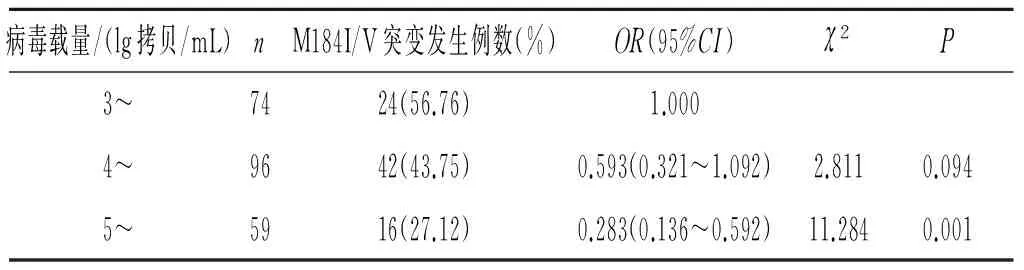
表1 抗HIV病毒治疗病毒未抑制患者体内病毒载量与M184I/V突变发生的关系
2.4抗病毒治疗时间与HIV-1耐药性突变发生的关系 在检测出的耐药性突变位点中发现,K103N/S突变位点在患者治疗时间6~个月、24~个月及48~个月时的发生率分别为27.27%(15/55)、34.04%(16/47)、57.48%(73/127),单因素logistic回归分析结果显示当患者治疗时间48~个月时比治疗时间6~个月的患者发生K103N/S突变的危险性增加(表2)。
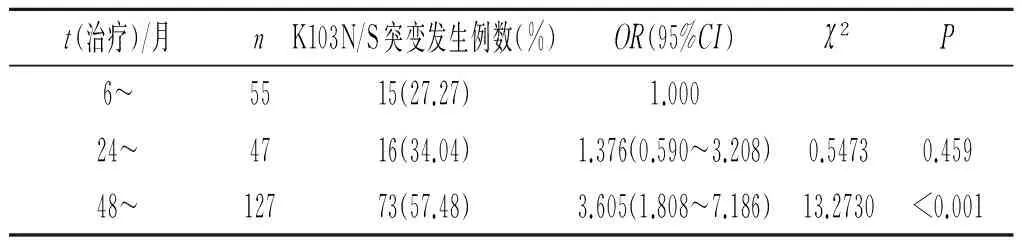
表2 抗HIV病毒治疗病毒未抑制患者治疗时间与K103N/S突变发生的关系
2.5抗病毒治疗方案与HIV-1耐药突变发生的关系K65R突变位点在使用含D4T一线抗病毒治疗方案患者中的发生率为7.14%(3/42),比使用非D4T 一线抗病毒治疗方案1.07%(2/187)发生率高(P=0.044)。
3 讨论
该次调查的231例一线抗病毒治疗病毒未抑制患者中,除2例未扩增成功外,其余229例均扩增并测序成功,总耐药率为81.66%(187/229),虽然接近南非83.5%的病毒抑制失败患者中的耐药率[3],但高于福建省61.3%的耐药率[4],这可能与患者抗病毒治疗时间长(超过一半患者治疗时间大于4 a),且使用易发生耐药的含DDI的一线抗病毒治疗方案有关[5]。
该调查结果显示,针对NNRTI发生的耐药性突变占主导地位,有185例(80.97%)患者出现了对NNRTI的耐药性突变,高于对NRTI(65.50%)和PI (1.31%)的耐药性突变,这与以往河南省抗病毒治疗(DDI+AZT+NVP)人群耐药性调查[6]相符。在出现针对NNRTI的耐药性突变较多的位点中,发生频率超过20%的突变为K103N/S、Y181C、G190A/S,其中K103N/S出现频率最高,这可能与河南省的流行B亚型和含NVP或EFV的治疗方案有关。研究[7]显示K103N的突变在整个B亚型的发生率是40%,是临床上最重要的NNRTI耐药突变,它可造成大多数可用NNRTI药物20~50倍的耐药[8]。同时在分析抗病毒治疗时间与耐药突变位点的关系中,发现K103N/S突变出现的频率与治疗时间有关,在治疗时间48~个月时K103N突变发生的危险性超过治疗时间6~个月患者的3.603倍,这可能与此耐药突变随治疗时间延长而累积有关。
229例患者中,针对NRTI的M184I/V耐药突变出现的频率在所有耐药突变中排在第2位,有104例(43.67%);同时它也是针对NRTI发生耐药突变最多的位点,其次是≥1个TAMs(42.79%)和T215F/Y(31.88%)。且在多项耐药调查[9-10]中出现,M184I/V出现频率排在前列。M184I/V突变出现后可在几周内就取代野生株产生对3TC和FTC的高度耐药,导致含3TC抗病毒治疗方案的失败[11],进而对所有NRTI产生耐药。但在分析抗病毒治疗患者体内病毒载量与耐药突变位点的关系中发现,M184I/V耐药突变发生高的患者体内病毒载量较低,这可能与M184I/V突变降低了耐药毒株的复制能力有关[12],提示此位点耐药突变的出现可降低患者体内HIV病毒载量的水平。该研究中未发现高频出现的耐药突变位点在含3TC和DDI的一线抗病毒治疗方案中差异有统计学意义,这可能与使用这些初始治疗方案的患者有约一半患者曾经更换一线治疗方案有关,但在低频率出现的耐药位点中发现使用含D4T的一线抗病毒治疗方案的患者更易出现K65R耐药突变,这与国外文献[13]报道一致。
由于河南省是国内最早开始一线抗病毒治疗的省份,病毒未抑制患者产生的耐药突变位点较多,耐药模式复杂,虽然针对NNRTI和NRTI的耐药性突变率较高,但针对PI的耐药突变率还很低(1.31%),建议应根据耐药监测情况调整治疗方案,减少或避免使用耐药突变发生率高的NNRTI类药物的使用,选择合适的二线抗病毒治疗方案,以减少耐药毒株的产生。
[1]STEEGEN K,LUCHTERS S,DAUWE K,et al.Effectiveness of antiretroviral therapy and development of drug resistance in HIV-1 infected patients in Mombasa, Kenya[J].AIDS Res Ther,2009,6(12):12
[2]SHAFER RW,RHEE SY,PILLAY D,et al.HIV-1 protease and reverse transcriptase mutations for drug resistance surveillance[J].AIDS,2007,21(2):215
[3]MARCONI VC,SUNPATH H,LU Z,et al.Prevalence of HIV-1 drug resistance after failure of a first highly active antiretroviral therapy regimen in KwaZulu Natal, South Africa[J].Clin Infect Dis,2008,46(10):1589
[4]王征桦,吴守丽,张春阳,等.2008-2013年福建省HIV-1毒株耐药基因变异研究[J].中国人兽共患病学报,2015,31(4):330
[5]LAURENT C,TCHATCHUENG MBOUGUA JB,NGOM GUÉYE NF,et al.Long-term effectiveness and safety of didanosine combined with lamivudine and efavirenz or nevirapine in antiretroviral-naive patients: a 9-year cohort study in Senegal[J].Trop Med Int Health,2011,16(2):217
[6]李韩平,李宏,杨坤,等.河南省部分艾滋病患者抗病毒治疗的临床效果以及基因型耐药分析[J].中华微生物学和免疫学杂志,2005,25(3):194
[7]WAINBERG MA,ZAHARATOS GJ,BRENNER BG.Development of antiretroviral drug resistance[J].N Engl J Med,2011,365(7):637
[8]ZHANG Z,XU W,KOH YH,et al.A novel nonnucleoside analogue that inhibits human immunodeficiency virus type 1 isolates resistant to current nonnucleoside reverse transcriptase inhibitors[J].Antimicrob Agents Chemother,2007,51(2):429
[9]HOSSEINIPOUR MC,GUPTA RK,VAN ZYL G,et al.Emergence of HIV drug resistance during first- and second-line antiretroviral therapy in resource-limited settings[J].J Infect Dis,2013,207(Suppl 2):S49
[10]BARTH RE,VAN DER LOEFF MF,SCHUURMAN R,et al.Virological follow-up of adult patients in antiretroviral treatment programmes in sub-Saharan Africa: a systematic review[J].Lancet Infect Dis,2010,10(3):155
[11]DIALLO K,GÖTTE M,WAINBERG MA.Molecular impact of the M184V mutation in human immunodeficiency virus type 1 reverse transcriptase[J].Antimicrob Agents Chemother,2003,47(11):3377
[12]KULKARNI R,BABAOGLU K,LANSDON EB,et al.The HIV-1 reverse transcriptase M184I mutation enhances the E138K-associated resistance to rilpivirine and decreases viral fitness[J].J Acquir Immune Defic Syndr,2012,59(1):47
[13]TANG MW,RHEE SY,BERTAGNOLIO S,et al.Nucleoside reverse transcriptase inhibitor resistance mutations associated with first-line stavudine-containing antiretroviral therapy: programmatic implications for countries phasing out stavudine[J].J Infect Dis,2013,207(Suppl 2):S70
(2015-11-19收稿责任编辑李沛寰)
Genotype resistant mutations among patients failed to high antiretroviral therapy in Henan Province
YUANYuan1),LIUHongwei1),LIUChunhua1),WANGZhe1),RUANYuhua2),XINGHui2)
1)InstituteforAIDS/STDControlandPrevention,HenanCenterforDiseaseControlandPrevention,Zhengzhou4500162)NationalCenterforAIDS/STDControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206
human immunodeficiency virus;drug resistance;antiretroviral treatment;gene mutation;Henan Province
Aim: To analyze the prevalence and diversity of genotype resistant mutations among patients failed to high antiretroviral therapy(HAART) in Henan Province. Methods: A total of 231 serum specimens of AIDS individuals with virus load ≥1 000 copies/mL were collected and had received more than six months treatment with HAART.The HIV-1 pol gene was amplified by RT-PCR,the sequences were then submitted to the Stanford University HIV drug resistance database to analyze the prevalence of resistant mutations. Results: A total of 229 plasma samples were amplified successfully for protease and reverse transcriptase fragments.Out of 229 sequences,185(80.79%),150(65.50%) and 3(1.31%) sequences occurred resistance mutations for non-nucleotide reverse transcriptase inhibitors(NNRTIs),nucleotide reverse transcriptase inhibitors(NRTIs) and protease inhibitors(PIs), respectively.The most common mutations to NNRTIs, NRTIs, and PIs were K103N/S 45.42%(104/229), M184I/V 43.67%(100/229) and M46I 0.87%(2/229), respectively. Univariate logistic regression analysis showed that among AIDS individuals, virus load 5- lg copies/mL decreased the risk of M184I/V mutation(OR=0.283,95%CI=0.136-0.592,P<0.001) compared with virus load 3- lg copies/mL. More than 48 months treatment with HAART had high rate of K103N/S mutation(OR=7.422,95%CI=1.637-33.651,P<0.001), compared with 6- months treatment. HAART with D4T was associated with high K65R mutation rate(P=0.044). Conclusion: The prevalence of HIV-1 drug resistance with complex patterns is higher among patients failed to HAART in Henan. Selecting more suitable antiretroviral treatment regimen is necessary to reduce the emergence of the drug resistant strains.
10.13705/j.issn.1671-6825.2016.05.022
*河南省重点科技攻关计划项目102102310003,112102310005;河南省卫生科技创新型人才工程专项经费资助项目2010年
,男,1972年2月生,博士,副主任医师,研究方向:艾滋病防治,E-mail:Hongweiliu36@163.com
R183.9