消癌平辅助丝裂霉素对肺癌细胞化疗增效的研究
谢泽新 杨杨 王金烁
·论著·
消癌平辅助丝裂霉素对肺癌细胞化疗增效的研究
谢泽新杨杨王金烁
目的通过消癌平联合丝裂霉素对肺癌A549细胞增殖,细胞周期、凋亡及相关基因表达的影响,探讨化疗增效机制。方法MTT检测消癌平(2、8、21 μl/ml)联合丝裂霉素(2 μg/nl)对肺癌A549细胞生长抑制(联合用药A、B、C组),并设立对照组、丝裂霉素组和消癌平组;流式细胞术检测细胞周期及凋亡;RT-PCR检测P53、CyclinD1基因表达。结果MTT检测显示在24、48、72 h联合用药A、B、C组OD(光密度)均比丝裂霉素低(P<0.05);流式细胞术检测表明消癌平、丝裂霉素与对照组相比,肺癌细胞均阻滞于G0/G1期,差异有统计学意义(P<0.05)。联合用药组G0/G1期细胞比率、细胞凋亡率与丝裂霉素组比较,差异有统计学意义(P<0.05)。消癌平组、丝裂霉素组与对照组比较,均能提高P53 mRNA 表达(P<0.05),联合治疗组P53 mRNA 表达高于丝裂霉素组(P<0.05)。消癌平组、丝裂霉素组与对照组比较均能降低Cyclin D1基因的表达(P<0.05)。与丝裂霉素组比较,联合用药可显著减低CyclinD1基因的表达(P<0.05)。结论消癌平辅助丝裂霉素对肺癌细胞化疗增效可能与上调P53 mRNA表达,增强细胞凋亡作用,以及下调CyclinD1 mRNA表达,阻滞细胞周期于G0/G1期有关。
消癌平;丝裂霉素;细胞周期;凋亡;Cyclin D1;P5
研究显示,60%~80%肺癌患者首诊时已到中晚期,已失去手术机会[1]。化学治疗成为中晚期肺癌主要治疗措施[2]。目前临床上常常通过联合用药以增强化疗效果,但经常受限于化疗药物的副作用,化疗治疗失败很高,肺癌多药耐药(multidrug resistance,MDR)是被认为是导致化疗治疗失败的最主要原因之一[3]。而中药作为中国国粹药物,其“成本廉价、应用历史悠久、不良反应少、杀癌谱广、作用靶点较多、逆转多重耐药性”等优势。研究表明,消癌平可抑制癌细胞生长,并使细胞阻滞于G0/G1期,调控细胞周期相关蛋白,从而促进凋亡[4]。鉴于此,此次研究采用消癌平联合丝裂霉素(阻滞于细胞周期G0/G1),监测其对肺癌A549细胞增殖,细胞周期、凋亡的影响,并以P53mRNA,CyclinD1 mRNA的为指标,探讨化疗增效机制。
1 材料与方法
1.1细胞株人肺腺癌细胞株 A549购中国科学院上海细胞库
1.2主要材料与试剂见表1。

表1 本研究所用之要材料与试剂
1.3方法
1.3.1采用MTT法检测消癌平联合丝裂霉素对肺癌A549细胞增殖的影响:取生长状态良好、处于对数期的肺癌A549细胞,常规消化,配成单细胞悬液,显微镜下计数,以每孔8 000~10 000个细胞接种于96孔培养板中,每孔100 μl。于37℃、5%CO2培养箱中培养。24 h细胞完全贴壁后,分别消癌平浓度分别为128、64、32、16、8、4、2、1、0.5 μl/ml。丝裂霉素浓度: 64、32、16、8、4、2、1、0.5 μg/ml,同时设阴性对照组,各孔最终体积为100 μl。每组均复5孔。培养24、48、72 h 后,每孔加入MTT溶液(5 mg/ml),37℃,4 h后终止培养,在酶联免疫检测仪上测定各孔光吸收值,并记录结果。采用Bliss法,借助SPSS 19.0计算出4组24、48、72 h IC50值,并绘制相应的浓度-抑制率曲线。细胞增殖抑制率(%)=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。联合用药方案:消癌平浓度分别为32、8、2 μl/ml,并与丝裂霉素2 μg/ml两两联合用药,并设立阴性对照组及丝裂霉素单药组。观察24、48、72 h,采用MTT法测量各组OD值,并计算出抑制率。
1.3.2流式细胞术检测各组细胞周期变化及凋亡的影响:取对数生长期的肺癌A549细胞,常规消化制成单细胞悬液(细胞终浓度为1×105/ml)后接种于培养瓶中,24 h细胞贴壁良好后,加入消癌平、丝裂霉素、消癌平与丝裂霉素组,药物浓度均为4组72 h IC50,使终体积为4 ml,阴性对照组加等量的普通培养液,37℃、5%CO2条件下孵育48 h后,常规消化,用预冷PBS溶液清洗1~2次, 70%的冷乙醇2 ml固定,4℃保存过夜。离心去乙醇,PBS清洗1次,将细胞重悬浮于250 μl结合缓冲液中,调整待测细胞的密度为1×106个/ml。加入PI(65 μg/ml)染液1 ml,4℃避光染色30 min,上机检测,记录激发波长488 nm处红色荧光,并用cell modifit软件分析细胞周期。
1.3.3RT-PCR检查各组细胞CyclinD1、P53等mRNA表达。
1.3.3.1取对数生长期的肺癌A549细胞,常规消化制成单细胞悬液(细胞终浓度为1×105/ml)后接种于培养瓶中,24 h细胞贴壁良好后,加入消癌平、丝裂霉素、消癌平与丝裂霉素组,药物浓度均为4组72 h IC 50,使终体积为4 ml,阴性对照组加等量的普通培养液,37℃、5%CO2条件下孵育48 h。
1.3.3.2逆转录:按cDNA反转录试剂盒步骤提取。
1.3.3.3聚合酶链反应(RT-PCR):按RT-PCR试剂盒操作步骤。见表2。

表2 RT-PCR引物及序列
1.3.3.4PCR产物琼脂糖凝胶电泳
1.3.3.5图像结果分析:EB染色后在紫外灯下拍照,用凝胶成像系统扫描条带灰度值,并以GAPDH灰度值作为参考定量标准,求得待测基因/GAPDH的比值作为待测基因mRNA的相对表达量。

2 结果
2.14组药物抑瘤率随时间变化趋势在不同时间段,消癌平(2、8、32 μl/ml)联合丝裂霉素的OD值均比单药消癌组及丝裂霉素组低,其OD值随浓度的增高而减小。见图1。
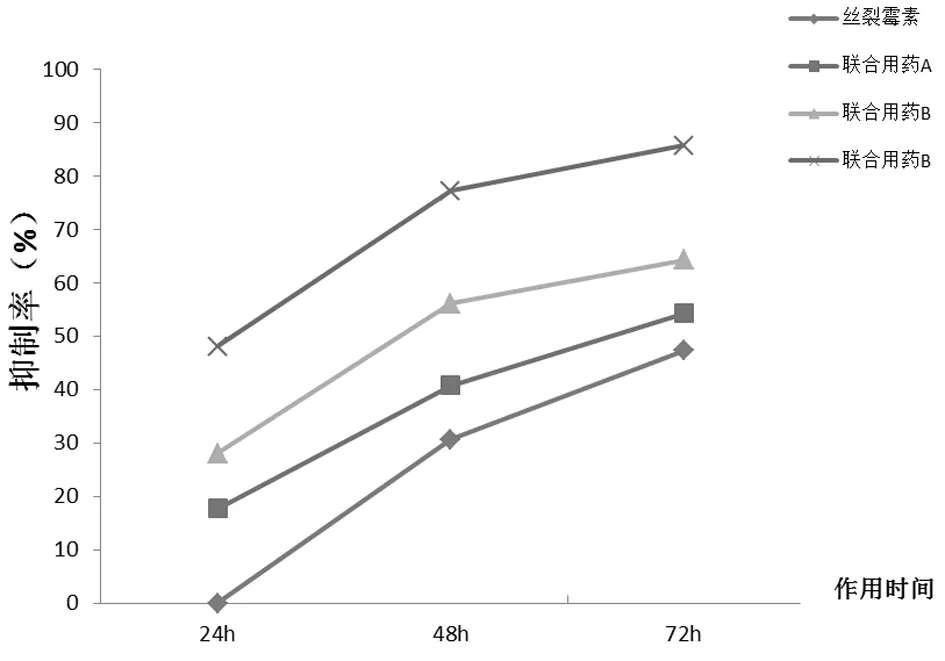
图1 4组药物抑瘤率随时间变化趋势
2.24组作用48 h后对细胞周期和凋亡率的影响消癌平(2 μl/ml)、丝裂霉素(2 μl/ml)与对照组相比,肺癌A549细胞G0/G1期细胞百分比均明显高于对照组(P<0.05)。联合用药显示肺癌A549细胞G0/G1期细胞百分比与消癌平、丝裂霉素相比明显增高(P<0.05)。消癌平、丝裂霉素凋亡率明显高于对照组(P<0.05)。联合用药时,肺癌A549细胞凋亡率由4.68%、提升9.56%(P<0.05)。见表1,图2、3。

表1 4组治疗48 h后对细胞周期及凋亡率的影响 ±s
注:与对照组比较,*P<0.05;与消癌平组比较,#P<0.05;与丝裂霉素组,△P<0.05
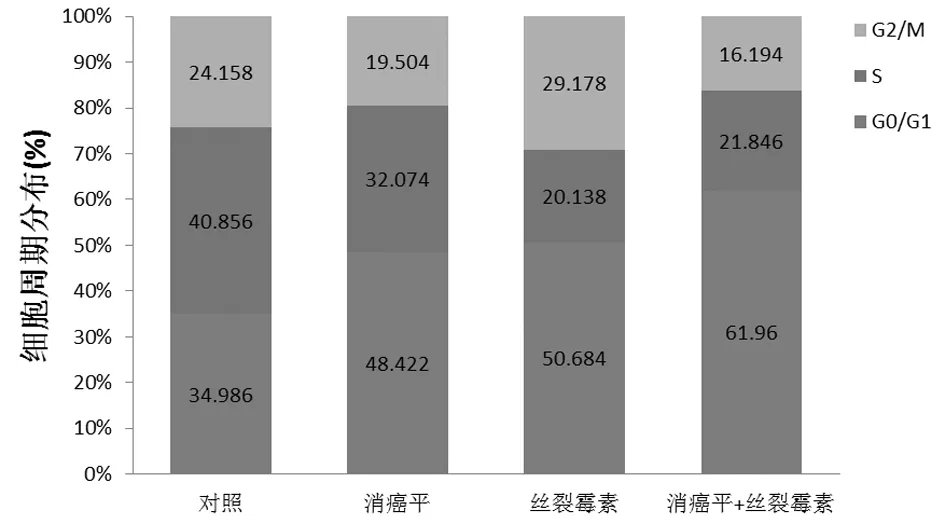
图2丝裂霉素联合消癌平注射液作用于肺癌A549肿瘤48 h后对细胞周期的影响

图3丝裂霉素联合消癌平注射液作用于肺癌A549肿瘤48 h后对细胞凋亡的影响
2.34组作用48 h后对p53、CyclinD1 mRNA表达的影响消癌平(2 μl/ml)、丝裂霉素(2 μl/ml)与对照组相比均能提高p53mRNA表达,相对表达量分别为、0.53、0.09,P<0.05。联合用药时对p53mRNA表达均高于消癌平、丝裂霉素0.80 VS 0.25、0.45,P<0.05。消癌平、丝裂霉素与对照组相比均能降低CyclinD1 mRNA的表达,其相对表达量分别是:0.51、0.46、0.88,与对照组相比,P<0.05。联合用药组与丝裂霉素单药比,可显著减低CyclinD1基因的表达,0.26 VS 0.46,P<0.05。见图4,表2。
3 讨论
细胞周期是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂结束所经历过程,即G1、S、G2和M期。癌基因与抑癌基因的突变致细胞周期失控、过度

图4丝裂霉素联合消癌平注射液作用于肺癌A549肿瘤48 h后对P53、CyclinD1 mRNA表达的影响
注:A:对照组,B:消癌平组,C:丝裂霉素组,D:消癌平组+丝裂霉素组
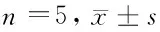

组别P53CyclinD1对照组0.09±0.020.88±0.09消癌平组0.25±0.03*0.51±0.08*丝裂霉素组0.53±0.05*0.46±0.05*消癌平+丝裂霉素组0.83±0.03*#△0.26±0.09*#△
注:与对照组比较,*P<0.05;与消癌平组比较,#P<0.05;与丝裂霉素组,△P<0.05
增殖,最终形成肿瘤,因此癌症是一种细胞周期疾病[5]。细胞周期的关卡即转换点,其中G0/S期和G2/M期最为关键。肿瘤细胞可以顺利通过这两个关卡,因此肿瘤细胞的特点是细胞周期运行失控[6]。本试验消癌平(作用于G0/G1期)与丝裂霉素(作用于G0/G1期)联合用药对肺癌A549生长抑制率及细胞周期阻滞于G0/G1期的细胞数目明显大于丝裂霉素及消癌平组。二者同作用于G0/G1期的不同化疗药物联合用药能够提高其肺癌细胞的G0/G1的阻滞效应。该结果与颉永乐等[7,8]研究结果一致。而赵可新等[9]研究表明作用于G0/G1期的吉西他滨和丝裂霉素联合用药,S期细胞比例升高到33.5%,与单药吉西他滨(S期占27.2%)和丝裂霉素(S期占17.5.2%)具有明显差异。表明共同作用于G0/G1期的不同化疗药物联合用药能够未必能够提高G0/G1期的阻滞效应。
无论特异性周期化疗药物联合用药对肿瘤细胞的阻滞于哪一期,最终均可以调控细胞周期机制来抑制增殖、促进凋亡。为此,本实验选取具有代表性的P53凋亡基因、细胞周期蛋白D1基因(作用G0/G1期)作为实验指标来进一步阐述上述作用机制。
细胞凋亡是通过基因编码调控的使细胞主动自杀的过程,又称程序性细胞死亡(programmedcell dath,PCD),既是其维持自身稳定、平衡的机制,亦是清除异常增殖细胞的有效途径[10]。p53是研究最多的肿瘤基因,野生型p53抑癌基因使细胞周期发阻滞、诱导凋亡和促进分化。通过对细胞G1期的调控,发挥检查点的职能,检测DNA是否损伤,从而控制细胞进入S期,诱导DNA修复,如果失败,则促使细胞凋亡,防止癌变。另一方面P53亦可通过激活TNF家族、Fas/Fasl、Bcl、bax等凋亡基因,促进癌变细胞凋亡,因此野生型P53具有“分子警察”之称[11]。p53基因是人类肿瘤中突变率最高的抑癌基因,特别是在非小细胞肺癌中的突变率超过50%[12,13]。
CyclinD1是细胞周期中的重要调控因子, CyclinD1是细胞周期G1/S期的调控蛋白,其基因和编码蛋白的异常,以及与多种肿瘤相关基因的协同作用可促使细胞恶性转化,CyclinD1 表达失控导致细胞增殖周期失调和肿瘤形成[14]。当CyclinD1扩增时,G1/S缩短,细胞持续增殖,致肿瘤的形成[15,16]。CyclinDl过度表达在很多肿瘤细胞中被发现,将其作为新的原癌基因[17]。本研究显示消癌平联合丝裂霉素不仅可以增强对肺癌A549细胞抑制率,亦可提高凋亡率及P53基因的表达量,表明消癌平协同丝裂霉素促进凋亡可能通过提高P53基因的表达实现的。该结论与张锐等[18]研究结果消癌平对肝癌细胞 Bel-7402的凋亡具有浓度依赖性,其P53蛋白的表达也随着药物浓度的增加而增加一致。但是消癌平除了诱导P53基因表达外,亦可影响凋亡相关蛋白的表达。如陈同生等[19]研究表明:消癌平作用于人肺腺癌(ASTC-a-1)可诱导了细胞内caspase-3的显著活化,诱导细胞凋亡。王思颖等[20]高剂量消癌平加奥曲肽抑制肿瘤生长可能与通过调控凋亡Bcl-2、Bax 的表达诱导肿瘤细胞凋亡。
为进一步明确其中相关机制,以CyclinD1(G0/G1期)的调控基因为指标,联合用药显著降低CyclinD1基因的表达水平,表明消癌平联合丝裂霉素提高对肺癌A549细胞周期G0/G1期阻滞效应,作用机制可能与下调CyclinD1 mRNA有关,提高P53基因的表达量,诱导细胞凋亡。
本研究为探索中西医结合治疗肺癌方案提供了实验依据,同时,研究细胞单一,检查的凋亡相关蛋白细胞周期相关蛋白较少,在以后的研究中值得深入探讨。
1Kawai H,Kiura K,Tabata M,et al.Characterization of non small cell lung cancer cell linesestablished before and after chemotherapy.Lung Cancer,2002,35:305-314.
2Triano LR ,Deshpande H,Gettinger SN. Management of patients with advanced non-small cell lung cancer: current and emerging options.Drugs,2010,70:167-179.
3Schwarzenbach H. Expression of MDR1/P-Glycoprotein,the Muti-drug Resistance Protein MRP,and the Lung-Resistance Protein LRP in Multiple Myeloma.Med Oncology,2006,19:87-104.
4习邢旺兴,程荣珍,林培英,等.中药通光藤中通光藤苷J的高效毛细管电泳分析.第二军医人学学报,2013,24:1338-1340.
5Hartwell LH,Kastan MB.Cell cycle and cancer.seience,1994,266:1821-1828.
6Ulurmen Be,Roberts JM.Cell cycler and cancer.National Cancer Institute,1995, 87:499.
7颉永乐,马力.丝裂霉素联合舒林酸对胃癌SGC7901细胞诱导凋亡的研究.世界华人消化杂志,2004,12:542-545.
8费洪新,张涛,孙丽慧,等.顺铂与丝裂霉素对体外人胃癌细胞的影响. 河北师范大学学报(自然科学版),2006,30:699-701.
9赵可新,李军霞,姜杉,等.吉西他滨和丝裂霉素联合应用对人肺癌细胞 A549 的作用. 河北医药,2011,33:1032-1033.
10Meier P,Finch A,Evan G,et al.Apoptosis in development.Nature,2000,407:796-801.
11Oda E,Ohki R,Murasawa H,et al.Noxa,a BH3-only member of the Bcl-2 family and candidate mediator of p53 induced apoptosis.Science, 2000,288:1053-1958.
12Migashita T,Krajewski S,Krajewska M,et al.Tumor suppressor P53 is a regulator of bcl-2 and bax gene expression in vitro and in vivo. Oncogene,1994,9:1799-1805.
13Dworakowska D,Jassem E,et al.Prognostic relevance of proliferating cell nuclear antigen and p53 expression in Non-small cell lung cancer,lung cancer,2002,35:35-41.
14Mitchel RA. Mechanisms and effectors of MIF-dependent promotion of tumourigenesis.Cell Signal,2004,16:13-9.
15Clurman BE,Robrets JM.Cell Cycle and cancer.J Natl Cancer Inst.1995, 87:1499-1506.
16Masciullo V,Scambia G,Marone M,et al.Altered expression of cyclinD 1 and CDK4 genes in ovarian carcinomas.Int J Cancer,1997,74:390-401.
17Lovec H,Sewing A,Lucibello F,et al.Oncogenic activity of cyclinD 1 revealed through cooperation with Ha-ras link between cell cycle control and malignant transformation.Oncogene,1994,9:323-326.
18张锐,刘静,刘阳晨,等.乌骨藤制剂诱导人肝癌细胞 Bel-7402 凋亡的实验研究. 现代肿瘤医学,2013,21:489-495.
19陈同生,王小平,王治平,等.消癌平诱导人肺腺癌(ASTC-a-1)细胞内caspase-3活化的荧光光谱分析.光谱学与光谱分析,2008,28:1327.
20王思颖,赵和平,王书敏.消癌平注射液联合奥曲肽对H22荷瘤小鼠细胞凋亡的影响. 中国药物与临床 2013,13:151-153.
Effects of Xiaoaiping injection combined with mitomycin on lung cancer cells in vitro
XIEZexin*,YANGYang*,WANGJinshuo.
*DepartmentofCardiothoracicSurgery,TheThirdHospitalofShijiazhuangCity,Shijiazhuang050011,China
ObjectiveTo observe the effects of Xiaoaiping injection combined with mitomycin on cell proliferation,cell cycle, cell apoptosis and expressions of related genes (CyclinD1,P53 mRNA) of lung cancer-A549 cells in vitro,and to explore potential action mechanism.MethodsThe inhibitory effects of Xiaoaiping injection (2,8,21μl/ml) combined with mitomycin (2μg/nl) were detected by MTT (combination treatment group A,B,C),moreover, control group, Xiaoaiping group and mitomycin group were established.The cell cycle and cell apoptosis of lung cancer-A549 cells in vitro were detected by cytometry,and the expression levels of CyclinD1 and P53 mRNA were measured by RT-PCR.ResultsThe results by MTT showed that the optical density value (OD) on 24h,48h,72h in combination treatment group A,B,C was significantly higher than that in mitomycin group (P<0.05).The results by cytometry showed that as compared with control group,the lung cancer cells were blocked at G0/G1 phase in Xiaoaiping group and mitomycin group (P<0.05). There were significant differences in the cell ratio at G0/G1 phase and cell apoptosis rate between combination treatment groups and mitomycin group (P<0.05). The expression levels of P53 mRNA in Xiaoaiping group and mitomycin group were significantly increased,as compared with those in control group (P<0.05). Moreover the expression levels of P53 mRNA in combination treatment groups were significantly higher than those in mitomycin group (P<0.05). The expression levels of Cyclin D1 in Xiaoaiping group and mitomycin group were significantly decreased,as compared with those in control group (P<0.05). Furthermore the expression levels of Cyclin D1 in combination treatment groups were significantly decreased,as compared with those in mitomycin group (P<0.05).ConclusionXiaoaiping injection combined with mitomycin can enhance the efficiency of chemotherapy on lung cancer-A549 cells in vitro,and the action mechanism may be correlated to up-regulating the expression levels of P53 mRNA,increasing cell apoptosis and down-regulating the expressions of CyclinD1 mRNA to block cancer cells at G0/G1 phase.
Xiaoaiping injection;mitomycin; cell cycle;apoptosis; CyclinD1; P5
10.3969/j.issn.1002-7386.2016.18.004
050011河北省石家庄市第三医院心胸外科(谢泽新、杨杨),肿瘤科(王金烁)
R 734.2
A
1002-7386(2016)18-2737-04
2016-01-11)

