高温诱导人ECV304的凋亡及其信号传导通路
朱晔晶,彭宁,凌杰,赵兵
高温诱导人ECV304的凋亡及其信号传导通路
朱晔晶,彭宁,凌杰,赵兵
目的 探讨不同温度对人ECV304凋亡的影响以及在凋亡过程中caspase家族所起的作用。方法 应用MTT法、Hochest33342/pI荧光双染、流式细胞术分析高温对人ECV304细胞诱导凋亡的影响;比色法测定高温诱导人ECV304凋亡过程中caspase-3、caspase-8、caspase-9活性变化。结果 39℃对细胞影响不明显,41℃、43℃处理后细胞凋亡明显增多,凋亡过程中,caspase-3活性与细胞凋亡率成正相关,caspase-8、caspase-9活性无明显变化。结论 高温对人ECV304有诱导凋亡作用,caspase-3在人ECV304凋亡过程中起重要作用。
细胞凋亡;热处理;caspase活性;人ECV304
高热环境对机体各个系统均有不同程度的损害,极端热环境可以导致某些蛋白结构和功能改变,导致体能减弱甚至死亡[1]。高热诱导机体细胞损伤程度与热的程度相关,极度高温(49~50℃以上)可导致细胞在5 min内以坏死方式死亡,而当环境温度在41.6~42℃时,细胞死亡方式以凋亡为主[2]。血管内皮细胞广泛分布于机体各个部位,研究发现,其是热打击时重要的反应细胞,也是最早发生损伤的细胞[3]。研究也证实,内皮细胞结构及功能损伤是引发多器官功能障碍综合征等严重并发症的重要因素[4]。本实验通过研究高热对内皮细胞凋亡的影响,为高温环境下作业人群健康体能的防护提供理论依据。报道如下。
1 资料与方法
1.1 主要仪器与细胞株 FormaSeriesⅡ隔水式CO2培养箱为美国Thermo公司;Nikon Eclipse TS100倒置显微镜来自日本Nikon公司;人脐静脉内皮细胞株(human ECV304)由温州医科大学惠赠。
1.2 主要试剂及耗材 RPMI1640培养基为美国Gibco公司产品;胎牛血清购自杭州四季青生物工程材料有限公司;细胞培养板和培养瓶购自Corning公司;Hoechst33342/PI细胞凋亡与坏死检测试剂盒、caspase全酶抑制剂(Z-VADFMK)及3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)细胞毒性与增殖检测试剂盒均购自碧云天生物技术研究所;Annexin V-488/PI凋亡检测试剂盒为美国 Invitrogen公司产品;caspase-3,caspase-8,caspase-9分光光度法检测试剂盒购自南京凯基生物技术有限公司。
1.3 方法
1.3.1 人ECV304细胞株培养及传代培养于含10%胎牛血清,100 g/ml链霉素,100U/ml青霉素的RPMI-1640培养液,置37℃,5%CO2饱和湿度的CO2培养箱中培养。当培养的细胞生长铺满瓶底时,用0.25%胰蛋白酶消化传代,2~3 d更换新鲜培养液。
1.3.2 MTT法测定细胞生长抑制率收集对数生长期的人ECV304细胞,接种于96孔板,4 h细胞完全贴壁后进行热处理,使其温度分别为39℃、41℃、43℃,设加培养液对照组37℃,2 h后取出,置37℃培养箱中培养24 h。按MTT检测试剂盒操作说明进行。用酶标仪570 nm处测定各组细胞(6个孔)的A值,以此表示细胞的相对活力。
1.3.3 Hoechst33342/PI荧光双染进行细胞凋亡形态学观察 人ECV304细胞按1×105/孔接种35 mm小培养皿,长满瓶底70%后改用无血清培养液孵育,并进行实验分组。作用2 h后,置37℃培养箱中培养24 h,按Hoechst33342/PI荧光染色试剂盒的操作说明进行活细胞染色,使用激光共聚焦显微镜观察细胞凋亡的形态。正常细胞核Hoechst33342染色为淡蓝色荧光,PI不染色;凋亡细胞核Hoechst33342染色为强亮蓝色荧光,PI不染色;死亡细胞核Hoechst33342染色为强亮蓝色荧光,PI染色呈红色荧光。
1.3.4 流式细胞术定量检测细胞凋亡人ECV304细胞按5×105/孔接种6孔板,长满瓶底 90%后改用无血清培养液孵育,并进行实组分组,按细胞凋亡形态学观察处理分组。作用2 h后,分别收集不同处理组细胞,按AnnexinV-488/PI凋亡检测试剂盒操作说明进行处理。1h内用流式细胞仪检测各组凋亡细胞率。
1.3.5 分光光度法检测caspase-3,caspase-8,caspase-9活性变化 收集 0、0.5、1、2、3、4 h对照组与43℃处理组细胞于50 l冷裂解缓冲液中,按照Caspase-3,caspase-8,caspase-9分光光度法检测试剂盒操作说明进行实验处理。各处理样品分别加样至96孔培养板,酶联免疫检测仪测A值,检测波长为405nm时caspase-3,caspase-8,caspase-9活性变化。
1.4 统计方法 采用SPSS13.0软件进行分析。计量资料以均数±标准差表示,多组比较采用单因素方差分析,两组间比较采用 检验。<0.05为差异有统计学意义。
2 结果
2.1 MTT结果 39℃热处理对细胞活力几乎无影响,其细胞存活率([4.16±0.36)%]与对照组([3.91±0.18)%]差异无统计学意义(i=1.77,>0.05),随着热处理温度的升高41℃、43℃组其细胞存活率([16.09± 0.40)%、(48.21±0.58)%]与对照组37℃差异均有统计学意义(i=86.46、226.90,均<0.05)。
2.2 细胞凋亡形态学观察 对照组细胞核均匀,Hoechst33342染色呈弥散均匀淡染荧光,PI不染色。39℃作用组经Hoechst33342染色后可见大部分为正常细胞核,仅少量细胞核出现核固缩,染色呈亮蓝色荧光增强等凋亡细胞核形态学改变,其中PI染色细胞数极少。43℃作用组凋亡细胞比例较39℃作用组明显增加,核为强蓝色荧光染色,核边缘呈明显波纹状或折缝状改变,可见到染色质聚集、边缘化等凋亡早期典型形态学改变,PI不染色。43℃+40MZ-VAD-FMK组凋亡细胞比例较43℃作用组有所下降,细胞凋亡影响与39℃作用组较接近。见封三彩图9。
2.3 流式细胞术检测凋亡 39℃作用组凋亡率高于对照组,但差异无统计学意义(i=1.11,>0.05);41℃、43℃作用后凋亡率均高于对照组,差异有统计学意义(i=25.31、74.95,均<0.05)。见表1。

表1 不同温度处理组对人ECV304细胞凋亡的影响( =3)
2.4 热处理诱导人ECV304凋亡过程中caspase-3,caspase-8,caspase-9活性变化caspase-3活性与对照组差异有统计学意义(t=32.63,<0.05);caspase-8,caspase-9活性变化不明显,与对照组差异无统计学意义(t=1.49、1.16,均>0.05)。见图1。
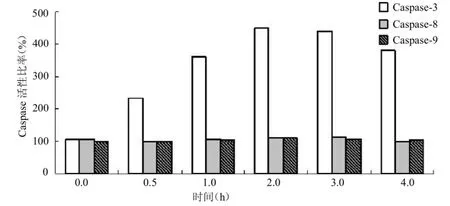
图1 不同温度对caspase-3、caspase-8、caspase-9活性的影响
3 讨论
细胞凋亡不同于细胞坏死,是细胞在生理或病理情况下发生有序的主动的非炎症死亡,又称程序性死亡,它不仅存在于生长发育的一般生命过程,还广泛参与了许多疾病的病理机制[5]。
血管内皮系统能维持血管内环境的稳定及各组织器官的功能,其内皮细胞出现凋亡或坏死改变能引起一系列继发机体生理生长功能改变,出现各种临床症状[6]。本实验验证高温对血管内皮细胞的伤害,从41℃开始,随着温度的增高,细胞凋亡的数量也逐渐增多,尤其在持续高温2~3 h时间段,凋亡率达到顶峰,显示出温度对其诱导作用具有依赖性;同时通过对人ECV304凋亡的检测,可以发现caspase全酶抑制剂对高温造成的细胞凋亡具有一定的抑制作用,可在一定程度降低高温对细胞凋亡的诱导率,推测caspase在细胞凋亡过程中发挥作用,本实验进一步观察发现在热处理人ECV304后,caspase-3随着时间的增加其活性变化与细胞凋亡趋势一致,说明caspase-3可能参与了高温诱导的人ECV304细胞凋亡;同时caspase-8和caspase-9活性变化不大,caspase-8和caspase-9在此次凋亡诱导实验中的具体作用仍有待进一步证实。由此证明血管内皮细胞凋亡是由caspase-3介导,caspase-8、caspase-9不参与或参与的较少。此次实验还显示出caspase全酶抑制剂并没有完全阻断高温诱导的人ECV304细胞的凋亡,提示高温诱导的细胞损伤还可能涉及其他信号传导通路,亦有研究显示不依赖caspase的凋亡模式存在[7],因此,其具体的细胞毒性机制仍有待进一步研究。
本实验证实caspase-3在血管内皮细胞损伤中的作用,为中暑的发病机制提供了实验依据,也为中暑与温度之间的关联提供了一些相关的实验与理论依据。
[1] Gasparrini A,Arostrong B.The impact of heat waves on mortality[J].Epidemiology, 2011,22(1):68-73.
[2] 张水文.热射病时中枢神经系统变化研究进展[J].解放军预防医学杂志,2000,18 (4):307-309.
[3]李丹丹,孟建中,吕苏一,等.野外演练致劳力性热射病的多器官功能损伤规律及高危因素[J].生物医学工程研究,2010,29 (4):287-292.
[4] Winn RK,Harlan JM.The role of endothelial cell apoptosis in inflammatory and immune diseases[J].Thromb Haemost, 2005,3(8):1815-1824.
[5] 邱志凌,张军平,郭晓辰.内质网应激与血管内皮细胞凋亡的研究进展[J].中国医学科学院学报,2014,36(1):102-107.
[6] 赵平,刘永海,王敦敬.血管内皮细胞功能检测方法的研究进展[J].国际免疫学杂志,2013,36(3):200-203.
[7] 石红,冯江敏.马兜铃酸通过ERKl/2信号传导途径诱导人脐静脉血管内皮细胞凋亡[J].基础医学与临床,2013,33(6):744-748.
10.3969/j.issn.1671-0800.2016.01.013
R594.1
A
1671-0800(2016)01-0025-03
2014-10-12(本文编辑:孙海儿)
318020浙江省台州,台州市第一人民医院
朱晔晶,Email:hyzyj001@163.com

