升温速率对高电压正极材料LiNi0.5Mn1.5O4晶粒形貌及电化学性能的影响
冯福山,方海升,杨 斌,马文会,戴永年
升温速率对高电压正极材料LiNi0.5Mn1.5O4晶粒形貌及电化学性能的影响
冯福山1, 2, 3,方海升1,2, 3,杨 斌1, 2, 3,马文会1, 2, 3,戴永年1, 2, 3
(1. 昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,昆明 650093;2. 昆明理工大学 冶金与能源工程学院,昆明650093;3. 昆明理工大学 真空冶金国家工程实验室,昆明 650093)
采用低温固相法合成LiNi0.5Mn1.5O4正极材料,考察升温速率对LiNi0.5Mn1.5O4正极材料结构、晶粒尺寸和形貌以及电化学性能的影响。结果表明:升温速率对LiNi0.5Mn1.5O4正极材料的晶粒形貌和电化学性能有重要的影响。当升温速率为10 ℃/min时,LiNi0.5Mn1.5O4的晶粒尺寸较小,形貌不规则,电化学性能不理想;当提高升温速率到20 ℃/min时,LiNi0.5Mn1.5O4的晶粒尺寸变大,同时大部分的晶粒形貌变成规则的八面体状,样品不仅容量高而且具有非常优异的倍率性能;当继续提高升温速率到30 ℃/min时,样品的晶粒尺寸基本不变,但表面出现破碎,破坏了晶粒八面体的完整性,样品的容量和倍率性能降低。因此,在低温固相合成时,升温速率控制是一种调控LiNi0.5Mn1.5O4正极材料晶粒形貌和电化学性能非常简单而有效的方法。
锂离子电池;正极材料;LiNi0.5Mn1.5O4;升温速率
近年来,一类具有高电压的尖晶石型正极材料LiMMn2−xO4(M=Cr、Co、Fe、Ni、Cu)引起了广泛的关注[1−7]。其中,LiNi0.5Mn1.5O4正极材料具有4.7 V的电压平台, 理论比容量147 (mA∙h)/g,能量密度达到650 (W·h)/kg,比传统LiCoO2的高20%,比LiFePO4的高30%,有望成为下一代高能锂离子电池正极材 料[8−9]。
根据Ni、Mn在晶格中的占位,LiNi0.5Mn1.5O4具有两种结构:有序的4332以及无序的[10]。 KIM等[10]通过熔融盐法制备出两种结构的LiNi0.5Mn1.5O4,认为结构的LiNi0.5Mn1.5O4具有更好的结构可逆性和电化学性能。MA等[11]采用简单固相法合成的4332结构LiNi0.5Mn1.5O4,同样表现出很高的倍率性能。XIAO等[5, 12]通过改变合成工艺参数,研究了Mn3+在LiNi0.5Mn1.5O4中的作用,认为该材料中存在一定量的Mn3+,有利于提高材料的电化学性能。CABANA等[13]研究了LiNi0.5Mn1.5O4材料结构−成分−性能间的关系,发现他们合成的材料是一个有序与无序的共存体。颗粒尺寸、形貌、晶体表面的变化都会影响LiNi0.5Mn1.5O4材料的电化学性能[14−25],显然这些因素都与制备方法和制备条件有关。
FANG等[26]报道了采用低温固相法合成LiNi0.5Mn1.5O4,所得材料具有很好的电化学性能。本文作者采用该低温固相法合成LiNi0.5Mn1.5O4正极材料,考察升温速率对LiNi0.5Mn1.5O4正极材料的结构、颗粒尺寸、形貌以及电化学性能的影响。
1 实验
1.1 材料制备
在不同升温速率条件下,采用低温固相法来制备LiNi0.5Mn1.5O4正极材料。以摩尔比1:0.5:1.5:3称取一定量的LiCl·H2O、NiCl2·6H2O、MnCl2·4H2O和草酸 (H2C2O4·2H2O) 进行球磨混合1 h,球磨过程中草酸会与3种盐发生室温固相反应生成草酸盐。然后,将球磨所得混合物放入真空干燥箱中于90℃烘干, 随后,继续将干燥物球磨30 min得到前驱体。在不同的升温速率(10、20、30 ℃/min)下,将前驱体置于马弗炉中500 ℃恒温烧结10 h,最后随炉自然冷却到室温得到样品。
1.2 材料表征
采用日本Rigaku型X射线粉末衍射仪对样品进行物相分析,并以Si(纯度为99.99%)内标对样品的衍射谱进行校正,计算样品的晶格参数。采用FEI公司生产的Quanta 200型扫描电子显微镜观察样品的形貌和颗粒尺寸。采用Netzsch thermoanalyzer STA449F3型仪器来分析前驱体的热分解过程。利用美国康塔仪器公司生产的NOVA2200e型仪器,采用BET方法测试样品的比表面积。通过inVia型激光拉曼光谱仪(雷尼绍公司生产),以Ar离子激光器的514.5 nm的激光束作为激发光源,在室温下对样品进行拉曼光谱测试。
1.3 电化学性能表征
将制备的样品super P和PVDF按质量比8:1:1配制,在添加NMP后搅拌均匀形成胶状物,之后将该胶状物涂覆在铝箔上,然后置于真空干燥箱中于80 ℃干燥12 h,再用打孔器将薄片裁切成直径13 mm的圆形电极极片。以该极片为正极,金属锂片为负极,Celgard 2400型聚丙烯微孔膜为隔膜,1 mol/L的LiPF6((EC):(DMC):(EMC)=1:1:1) 为电解液,在充满氩气的手套箱中组装成CR2025型扣式电池。采用武汉蓝电CT2001A型测试系统进行恒流充放电测试,测试温度为30 ℃。
2 结果与讨论
2.1 TG-DSC分析
图1所示为前驱体的TG-DSC曲线。从图1可以看出,当温度升高到500℃后,前驱体基本上已完全分解,之后样品基本上没有再出现质量损失;而当温度高于700 ℃时,样品出现连续的轻微质量损失,这与LiNi0.5Mn1.5O4材料高温失氧有关[27−29]。在本实验过程中,采用不同的升温速率升温到500 ℃对前驱体进行烧结。
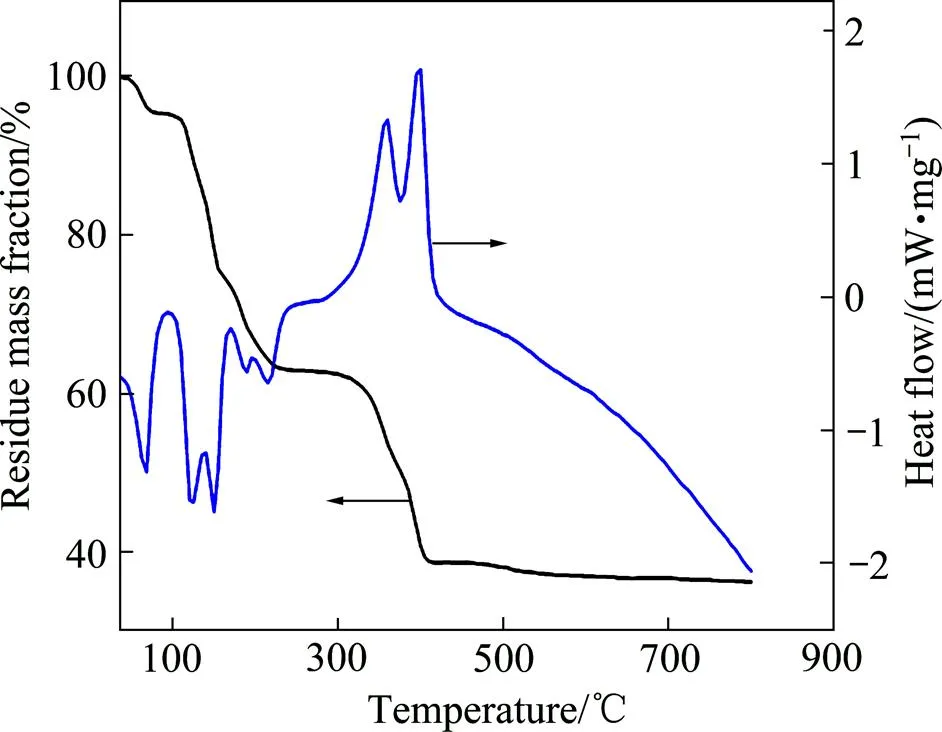
图1 前驱体的TG-DSC曲线
2.2 结构及形貌分析
图2所示为不同升温速率下所得样品的XRD谱。从图2可以看出, 所有样品都为结构的立方尖晶石相,没有生成杂相。表明在不同的升温速率下 500 ℃烧结时所得样品都是单一的LiNi0.5Mn1.5O4材料;同时各个样品的衍射峰尖锐,说明形成了结晶良好的尖晶石型LiNi0.5Mn1.5O4。对3个样品的晶格常数进行计算,结果表明,随着升温速率提高,样品的晶格参数略有增大,变化较小,特别是高升温速率下所得的两个样品。10、20和30 ℃/min样品的晶格参数分别为8.1624 Å、8.1695 Å和8.1704 Å。

图2 不同升温速率下LiNi0.5Mn1.5O4样品的XRD谱
图3所示为不同升温速率下样品的拉曼光谱。从图3可以看出,随着升温速率的增大,所有样品的拉曼光谱变化不大,595 cm−1处的峰没有明显分裂,以及221和241 cm−1处没有出现尖锐的峰,根据已有文献[18]可知,说明不同升温速率下所得LiNi0.5Mn1.5O4都为无序相的结构。

图3 不同升温速率下LiNi0.5Mn1.5O4样品的拉曼光谱
图4所示为不同升温速率下样品的SEM像。从图4可以看到,随着升温速率的增大,所有样品的晶粒尺寸和形貌都发生了明显的变化。通常,烧结温度对晶体生长会有重要的影响,依靠颗粒晶界变化获得不同形状的晶体颗粒。具有立方尖晶石结构的LiNi0.5Mn1.5O4材料,晶体的形状依靠晶面(111)/(100) 的相对生长率来获得。当(111)/(100)相对生长率值约为1.73时,将获得典型的(111)晶面的八面体晶粒,而在0.87~1.73时,将获得(111)晶面和(100)晶面混合的多面体晶粒[30]。

图4 不同升温速率下LiNi0.5Mn1.5O4样品的SEM像
在本实验中,10℃/min升温速率条件下获得的样品,晶粒尺寸在1 μm以下,分散性差,大部分晶粒形状不规则(见图4(a));当升温速率为20℃/min时,样品的晶粒尺寸增大,分散性变好,而且出现大量的八面体状的晶粒(见图4(b));当升温速率继续提高到30℃/min时,晶粒尺寸变化不明显,但大部分晶粒的棱角和表面明显出现了破碎(见图4(c)),破坏了八面体的完整性。因此,升温速率不仅会影响材料的晶粒尺寸,而且会影响晶粒的形貌,同时升温速率对晶粒尺寸和形貌的影响存在一个临界值,达到临界值后继续提高升温速率则基本不再产生影响,但会造成晶粒表面的破碎。样品的比表面积测试表明,10、20和30 ℃/min这3个样品的比表面积分别为6.49、0.92和1.73 m2/g。当升温速率从10 ℃/min提高到20 ℃/min时,比表面积明显减小,说明颗粒尺寸增大,这与电镜观察到的结果一致;而当升温继续提高到30 ℃/min时,样品的比表面积反而略有增大,可能与电镜观察到的晶粒表面破碎增大比表面积有关。
2.3 恒流充放电分析
图5所示为不同升温速率所得LiNi0.5Mn1.5O4样品的初始充放电曲线。测试以0.2倍率(1=147 mA/g)在电压3.5~5 V间进行恒流充放电。从图5可以看出,所有样品在4.7 V左右出现两个明显的电压平台,对应Ni2+/4+的氧化还原; 同时,在4.1 V左右出现一个微小的电压平台,对应Mn3+/Mn4+的氧化还原[8],而且随着升温速率的提高,该平台变得略微明显,表明所有的样品中存在少量的未被氧化的Mn3+,而且略有增加。根据文献[5, 12, 31−32]报道,Mn3+的存在促使LiNi0.5Mn1.5O4结构的变化,由有序的4332转向无序的,有利于材料电化学性能的提高。从充放电曲线可见,当升温速率为20℃/min时,样品的放电容量达到137 (mA∙h)/g,而在10℃/min和30℃/min时,材料的放电容量分别为110 (mA∙h)/g和120 (mA∙h)/g。
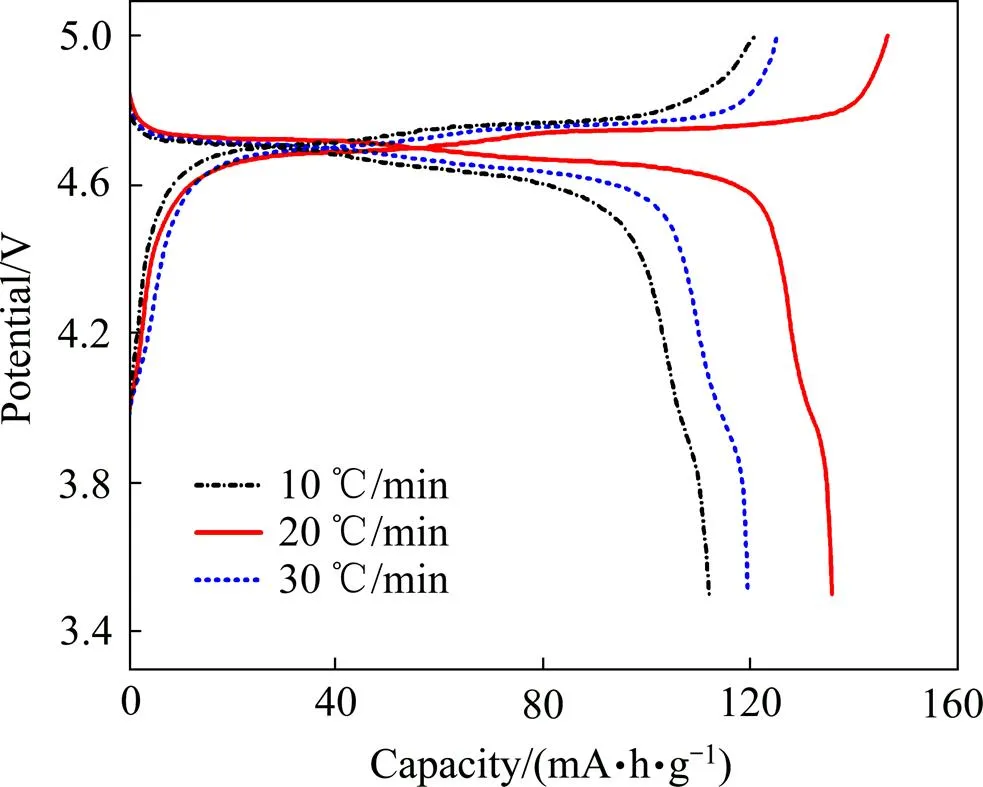
图5 不同升温速率下LiNi0.5Mn1.5O4样品的初始充放电曲线
图6所示为不同升温速率所得LiNi0.5Mn1.5O4样品的循环性能曲线。由图6可见,升温速率为20℃/min时所得样品不仅容量最高,而且循环稳定性也是最优,循环100次后放电容量由初始的137 (mA·h)/g衰减到125 (mA∙h)/g,容量保持率达到91%,而10℃/min和30℃/min升温速率条件下制备的样品容量保持率则为70%和85%。
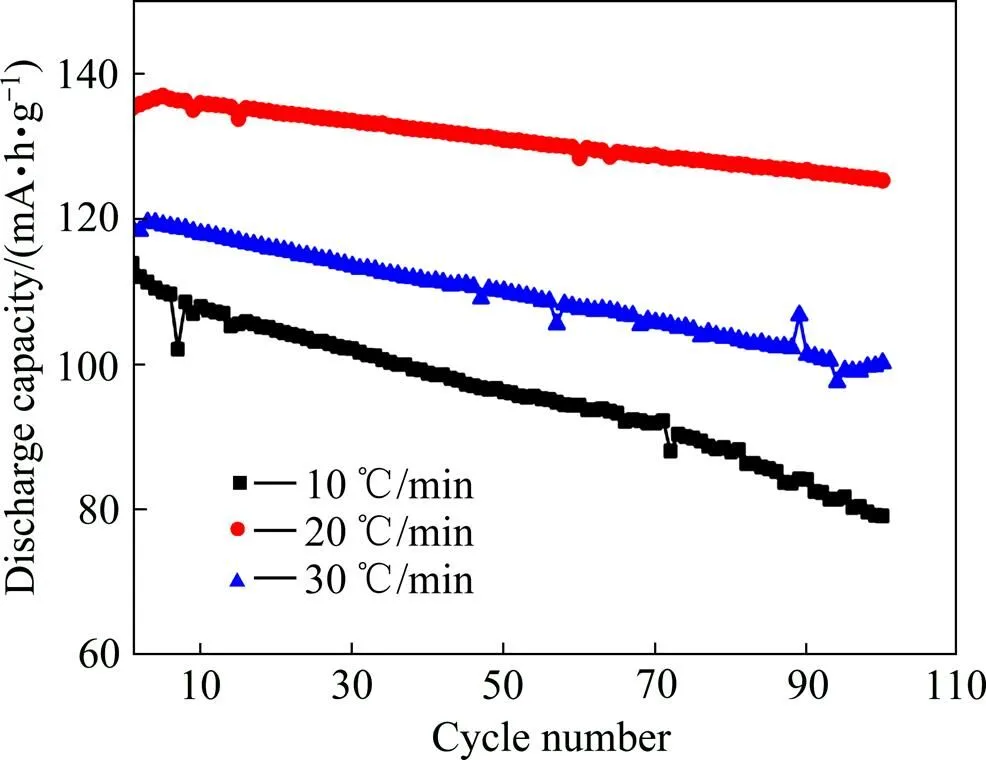
图6 不同升温速率下LiNi0.5Mn1.5O4样品的循环性能
图7所示为不同升温速率所得LiNi0.5Mn1.5O4样品的倍率性能。在电压3.0~5 V间时以0.2倍率进行恒流充电,然后不同的倍率(0.2、0.5、1、2、3、5、10)恒流放电并各循环5次。从图7可以看出,在升温速率为20℃/min时制备的样品不仅在各个放电倍率下容量都最高, 而且随着放电倍率的增大,放电容量下降很慢,具有很好的大倍率放电性能。当升温速率提高到30℃/min时,不仅放电容量降低,而且倍率性能下降,但仍优于升温速率为10℃/min时所得样品的容量和倍率性能。

图7 不同升温速率下所得LiNi0.5Mn1.5O4样品的倍率性能
综合上述测试结果,本文作者认为升温速率变化引起的晶粒形貌变化是所得LiNi0.5Mn1.5O4性能变化的主要原因。已有研究表明[18, 33],对于LiNi0.5Mn1.5O4材料,晶粒形貌比颗粒尺寸、晶体结构和Mn3+量对性能的影响更大,当所得的LiNi0.5Mn1.5O4晶粒为八面体状时,裸露的(111) 晶面非常利于锂离子的快速扩 散,即使所得样品为有序结构,Mn3+量较高,晶粒尺寸大于所得无规则形状的LiNi0.5Mn1.5O4晶粒尺寸,仍旧具有更好的电化学性能。在本工作中,当升温速率从10℃/min提高到20℃/min时,不仅晶粒尺寸长大,而且大部分晶粒从无规则状变成八面体状,继续提高升温速率到30℃/min时,则材料的晶粒尺寸基本没有变化,但晶粒表面出现破碎,破坏了晶粒八面体的完整性,因此,由于升温速率为20℃/min时所得LiNi0.5Mn1.5O4晶粒具有较好的八面体完整性,因此具有更好的电化学性能。另外,当升温速率从10℃/min提高到20℃/min以上时,所得样品的晶格常数略有增大,增大了锂离子的扩散通道,有利于锂离子的扩散,也是高升温速率的样品性能要优于低升温速率的样品性能的一个可能因素。本实验主要研究升温速率对LiNi0.5Mn1.5O4材料的晶粒形貌和电化学性能的影响,而关于升温速率对晶粒形貌的作用机理目前还不清楚,有待大家进一步的深入研究。
3 结论
采用低温固相法合成了立方尖晶石型LiNi0.5Mn1.5O4材料,升温速率对LiNi0.5Mn1.5O4材料的晶粒形貌和电化学性能有显著的影响,通过升温速率的控制可以实现晶粒形貌的调控。
REFERENCES
[1] SIGALA C, GUYOMARD D, VERBAERE A, PIFFARD Y, TOUMOUX M. Positive electrode materials with high operating voltage for lithium batteries: LiCrMn2−yO4(0≤≤1) [J]. Solid State Ionics, 1995, 81(3): 167−170.
[2] KAWAI H, NAGATA M, TUKAMOTO H, WESTA A R. A new lithium cathode LiCoMnO4: Toward practical 5V lithium batteries[J]. Electrochemical and Solid-State Letters, 1998, 1(5): 212−214.
[3] OHZUKU T, TAKEDA S, IWANAGA M. Solid-state redox potentials for Li[Me1/2Mn3/2]O4(Me: 3d-transition metal) having spinel-framework structures: a series of 5 volt materials for advanced lithium-ion batteries[J]. Journal of Power Sources, 1999, 81: 90−94.
[4] WU X, KIM S B. Improvement of electrochemical properties of LiNi0.5Mn1.5O4spinel[J]. Journal of Power Sources, 2002, 109(1): 53−57.
[5] XIAO Jie, CHEN Xi-lin, SUSHKO P V, SUSHKO M L, KOVARIK L, FENG Ji-jun, DENG Zhi-qun, ZHENG Jian-ming, GRAFF G L, NIE Zi-min, CHOI D W, LIU Jun, ZHANG Ji-guang, WHITTINGHAM M S. High-performance LiNi0.5Mn1.5O4spinel controlled by Mn3+concentration and site disorder[J]. Advanced Materials, 2012, 24(16): 2109−2116.
[6] 邓海福, 聂 平, 申来法, 罗海峰, 张校刚. 锂离子电池用高电位正极材料LiNi0.5Mn1.5O4[J]. 化学进展, 2014, 26(6): 939−949.
DENG Hai-fu, NIE Ping, SHEN Lai-fa, LUO Hai-feng, ZHANG Xiao-gang. High voltage spinel-structured LiNi0.5Mn1.5O4as cathode materials for Li-ion batteries[J]. Progress in Chemistry, 2014, 26( 6): 939−949.
[7] 伊廷锋, 胡信国, 霍慧彬, 高 昆. 5 V锂离子电池尖晶石正极材料LiNi0.5Mn1.5O4的研究评述[J]. 稀有金属材料与工程, 2006, 35(9): 1350−1353.
YI Ting-feng, HU Xin-guo, HUO Hui-bin, GAO Kun. Review of research on spinel cathode materials LiNi0.5Mn1.5O4for 5 V lithium ion battery[J]. Rare Metal Materials and Engineering, 2006, 35(9): 1350−1353.
[8] JULIEN C M, MAUGER A. Review of 5-V electrodes for Li-ion batteries: Status and trends[J]. Ionics, 2013, 19(7): 951−988.
[9] MANTHIRAM A, CHEMELEWSKI K, LEE E S. A perspective on the high-voltage LiNi0.5Mn1.5O4spinel cathode for lithium-ion batteries[J]. Energy & Environmental Science, 2014, 7(4): 1339−1350.
[10] KIM J H, MYUNG S T, YOON C S, KANG S G, SUN Y K. Comparative study of LiNi0.5Mn1.5O4−δand LiNi0.5Mn1.5O4cathodes having two crystallographic structures:and4332[J]. Chemistry of materials, 2004, 16(5): 906−914.
[11] MA X H, KANG B, CEDER G. High rate micron-sized ordered LiNi0.5Mn1.5O4[J]. Journal of the electrochemical Society, 2010, 157(8): A925−A931.
[12] ZHENG J, XIAO J, YU X, KOVARIK L, GU M, OMENYA F, CHEN X, YANG X Q, LIU J, GRAFF G L, WHITTINGHAM M S, ZHANG J G. Enhanced Li+ion transport in LiNi0.5Mn1.5O4through control of site disorder[J]. Physical Chemistry Chemical Physics, 2012, 14(39): 13515−13521.
[13] CABANA J, CASAS-CABANAS M, OMENYA F O, CHEMOVA N A, ZENG Dong-li, WHITTINGHAM M S, GREY C P. Composition-structure relationships in the Li-ion battery electrode material LiNi0.5Mn1.5O4[J]. Chemistry of Materials, 2012, 24(15): 2952−2964.
[14] MAO J, DAI K, ZHAI Y. Electrochemical studies of spinel LiNi0.5Mn1.5O4cathodes with different particle morphologies[J]. Electrochimica Acta, 2012, 63: 381−390.
[15] PARK S H, OH S W, KANG S H, BELHAROUAK I. Comparative study of different crystallographic structure of LiNi0.5Mn1.5O4−δcathodes with wide operation voltage (2.0−5.0 V)[J]. Electrochimica Acta, 2007, 52(25): 7226−7230.
[16] TALYOSEF Y, MARKOVSKY B, LAVI R, KOVACHEVA D, STOYANOVA R, SALITRA G, AURBACH D, KOVACHEVA D, GOROVA M, ZHECHEVA E, STOYANOVA R. Comparing the behavior of nano-and microsized particles of LiNi0.5Mn1.5O4spinel as cathode materials for Li-ion batteries[J]. Journal of the Electrochemical Society, 2007, 154(7): A682−A691.
[17] LEE H W, MURALIDHARAN P, MARI C M, RUFFO R, KIM D K. Facile synthesis and electrochemical performance of ordered LiNi0.5Mn1.5O4nanorods as a high power positive electrode for rechargeable Li-ion batteries[J]. Journal of Power Sources, 2011, 196(24): 10712−10716.
[18] HAI B, SHUKLA A K, DUNCAN H, CHEN G. The effect of particle surface facets on the kinetic properties of LiNi0.5Mn1.5O4cathode materials[J]. Journal of Materials Chemistry A, 2013, 1(3): 759−769.
[19] CHEN Z, ZHAO R, DU P, HU H, WANG T, ZHU L C, CHEN H. Polyhedral LiNi0.5Mn1.5O4with excellent electrochemical properties for lithium-ion batteries[J]. Journal of Materials Chemistry A, 2014, 2(32): 12835−12848.
[20] CHEMELEWSKI K R, SHIN D W, LI W, MANTHIRAM A. Octahedral and truncated high-voltage spinel cathodes: The role of morphology and surface planes in electrochemical properties[J]. Journal of Materials Chemistry A, 2013, 1(10): 3347−3354.
[21] LIN H B, ZHANG Y M, RONG H B, MAI S W, HU J N, LIAO Y H, XING L D, XU M Q, LI X P, LI W S. Crystallographic facet-and size-controllable synthesis of spinel LiNi0.5Mn1.5O4with excellent cyclic stability as cathode of high voltage lithium ion battery[J]. Journal of Materials Chemistry A, 2014, 2(30): 11987−11995.
[22] 朱 智, 其 鲁, 李 卫, 廖细英. 新型复合共沉淀法制备高能量/高功率型锂离子二次电池用5 V正极材料LiNi0.5Mn1.5O4及其电化学性能[J]. 物理化学学报, 2014, 30(4): 669−676.
ZHU Zhi, QI Lu, LI Wei, LIAO Xi-ying. Preparation and electrochemical performance of 5 V LiNi0.5Mn1.5O4cathode material by the composite co-precipitation method for high energy/high power lithium ion secondary batteries[J]. Acta Phys Chim Sin, 2014, 30(4): 669−676.
[23] 刘云建, 刘志远, 陈效华, 陈 龙. 正极材料 LiNi0.5Mn1.5O4的制备与性能[J]. 中南大学学报(自然科学版), 2012, 43(11): 4248−4252.
LIU Yun-jian, LIU Zhi-yuan, CHEN Xiao-hua, CHEN Long. Synthesis and performance of LiNi0.5Mn1.5O4cathodes[J]. Journal of Central South University (Science and Technology), 2012, 43(11): 4248−4252.
[24] 鞠博伟, 王先友, 魏启亮, 吴 春, 杨秀康, 舒洪波, 宋云峰, 温伟成. 球形高电压LiNi0.5Mn1.5O4的制备及其电化学性能[J]. 中国有色金属学报, 2013, 23(6): 1633−1639.
JU Bo-wei, WANG Xian-you, WEI Qi-liang, WU Chun, YANG Xiu-kang, SHU Hong-bo, SONG Yun-feng, WEN Wei-cheng. Synthesis and electrochemical performance of spherical highvoltage LiNi0.5Mn1.5O4[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(6): 1633−1639.
[25] CHEMELEWSKI K R, LEE E S, LI W, MANTHIRAM A. Factors influencing the electrochemical properties of high-voltage spinel cathodes: Relative impact of morphology and cation ordering[J]. Chemistry of Materials, 2013, 25(14): 2890−2897.
[26] FANG H S, LI L P, LI G S. A low-temperature reaction route to high rate and high capacity LiNi0.5Mn1.5O4[J]. Journal of Power Sources, 2007, 167(1): 223−227.
[27] SONG J, SHIN D W, LU Y H, AMOS C D, MANTHIRAM A, GOODENOUGH J B. Role of oxygen vacancies on the performance of Li[Ni0.5–xMn1.5+x]O4(=0, 0.05, and 0.08) spinel cathodes for lithium-ion batteries[J]. Chemistry of Materials, 2012, 24(15): 3101−3109.
[28] MAIYALAGAN T, CHEMELEWSKI K R, MANTHIRAM A. Role of the morphology and surface planes on the catalytic activity of spinel LiNi0.5Mn1.5O4for oxygen evolution reaction[J]. ACS Catalysis, 2014, 4(2): 421−425.
[29] KUNDURACI M, AMATUCCI G G. Effect of oxygen non- stoichiometry and temperature on cation ordering in LiMn2−NiO4(0.50>>0.36) spinels[J]. Journal of Power Sources, 2007, 165(1): 359−367.
[30] WANG Z L. Transmission electron microscopy of shape- controlled nanocrystals and their assemblies[J]. The Journal of Physical Chemistry B, 2000, 104(6): 1153−1175.
[31] DUNCAN H, HAI B, LESKES M, GREY C P, CHEN G. Relationships between Mn3+content, structural ordering, phase transformation, and kinetic properties in LiNiMn2–xO4cathode materials[J]. Chemistry of Materials, 2014, 26(18): 5374−5382.
[32] VITUCCI F M, PALUMBO O, PAOLONE A, CANTELLI R, BRUTTI S, PANERO S. Dynamics of Mn3+in off-stoichiometric LiNi0.5Mn1.5O4[J]. Journal of Alloys and Compounds, 2014, 604: 83−86
[33] ARIYOSHI K, MAEDA Y, KAWAI T, OHZUKU T. Effect of primary particle size upon polarization and cycling stability of 5 V lithium insertion material of Li[Ni1/2Mn3/2]O4[J]. Journal of the Electrochemical Society, 2010, 158(3): A281−A284.
(编辑 龙怀中)
Effect of heating rate on crystal morphology and electrochemical performance of high voltage cathode material LiNi0.5Mn1.5O4
FENG Fu-shan1, 2, 3, FANG Hai-sheng1, 2, 3, YANG Bin1, 2, 3, MA Wen-hui1, 2, 3, DAI Yong-nian1, 2, 3
(1. State Key Laboratory of Complex Nonferrous Metal Resources Clear Utilization, Kunming University of Science and Technology, Kunming 650093, China;2. Faculty of Metallurgy and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;3. National Engineering Laboratory for Vacuum Metallurgy, Kunming University of Science and Technology, Kunming 650093, China)
LiNi0.5Mn1.5O4cathode material was prepared by low temperature solid-state method, and the effects of heating rate on its structure, crystal size and morphology, and electrochemical performance were studied. The results show that the crystal morphology and electrochemical performance of the prepared LiNi0.5Mn1.5O4are highly influenced by the heating rate. The sample obtained at the heating rate of 10 ℃/min has smaller crystal size, irregular morphology and unsatisfactory electrochemical performance. When the heating rate increases to 20 ℃/min, the obtained sample shows bigger crystal size with octahedral shape and excellent electrochemical performance. Further increasing heating rate to 30 ℃/min leads to some surface cracking of crystal and obvious degradation of electrochemical performance. Therefore, when LiNi0.5Mn1.5O4is synthesized by low temperature solid-state method, heating rate control is a simple and effective way to tailor its crystal morphology and electrochemical performance.
lithium ion battery; cathode material; LiNi0.5Mn1.5O4; heating rate
Project(51304098) supported by the National Natural Science Foundation of China; Project (20125314120004) supported by the Specialized Research Fund for the Doctoral Program of Higher Education, China; Project(IRT1250) supported by the Program for Innovative Research Team in University of Ministry of Education of China; Project(2013HA011) supported by the Academician Exploration Program of Yunnan Province, China
2015-06-29; Accepted date: 2015-11-30
FANG Hai-sheng; Tel: +86-871-65107208; E-mail: hsfang1981@hotmail.com
1004-0609(2016)02-0347-07
TM912.9
A
国家自然科学基金资助项目(51304098);高等学校博士学科点专项基金资助项目(20125314120004);教育部创新团队资助项目(IRT1250);云南省院士探索项目(2013HA011)
2015-06-29;
2015-11-30
方海升,教授,博士;电话:0871-65107208;E-mail: hsfang1981@hotmail.com

