豆豉中生物胺含量的动态变化研究
韩忠安,罗信旭,杨春艳,吴拥军*
(贵州大学生命科学学院,贵州贵阳550025)
豆豉中生物胺含量的动态变化研究
韩忠安,罗信旭,杨春艳,吴拥军*
(贵州大学生命科学学院,贵州贵阳550025)
采用高效液相色谱法对豆豉中生物胺含量进行动态检测。结果表明,纯种强化发酵和自然发酵豆豉样品中均检测出色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺。纯种强化发酵条件下生物胺总含量在前、后发酵时期都呈先上升后下降的趋势,而自然发酵条件下均呈缓慢上升趋势,且前发酵总生物胺含量高于后发酵时期。两种发酵条件下,酪胺和亚精胺为主要生物胺,苯乙胺存在纯种发酵中。纯种强化发酵豆豉总生物胺含量高于自然发酵,酪胺和苯乙胺的含量分别高出2倍和4倍,与生产环境中粪肠球菌的污染关联性较大。豆豉发酵过程和成品中总生物胺含量均<250 mg/kg,短期内不存在食品安全问题。
高效液相色谱;生物胺;细菌型豆豉
生物胺(biogenic am ines,BAs)是一类具有生物活性含氮的低分子质量有机化合物的总称,是生物体(包括人体)内的正常活性成分,在生物活性细胞中促进生长和代谢、增强肠道系统免疫活性,并在神经系统中发挥活性,在生物体内发挥着重要作用[1]。但当人体摄入过量的生物胺(尤其是同时摄入多种生物胺)时,可能导致血压升高、脸色涨红、头痛,恶心、心悸、血压变化、呼吸紊乱,甚至出现皮疹等过敏反应,严重的还会危及生命[2-3]。
生物胺存在于多种食品中,尤其是发酵食品,食物中存在的生物胺主要有:组胺、酪胺、酪胺、腐胺、苯乙胺、尸胺、精胺、亚精胺等[4]。目前对食品中生物胺的研究主要集中在酒类、鱼类、肉类、酱油、发酵香肠、发酵蔬菜、豆腐乳等[5-11]。在腐乳研究中,王颖等[12]用雅致放射毛霉(Actinomucor elegans)发酵腐乳中主要以尸胺和酪胺为主,含量分别达到460.1 mg/kg、318.5 mg/kg,而少孢根霉(Rhizopusoligosporus)发酵腐乳中尸胺含量为668 mg/kg。胡鹏等[13]以高效液相色谱(high performance liquid chromatography,HPLC)法对中国传统发酵豆豉中生物胺的含量进行测定,结果表明,常见的8种生物胺总含量的范围为101.07~427.19 mg/kg;近年来,有报道称豆豉中生物胺含量已超标,检测到湖南曲霉型豆豉中苯乙胺含量为87.88 mg/kg,广东曲霉型豆豉中苯乙胺和组胺含量分别为83.44 mg/kg和64.45 mg/kg;在永川豆豉制曲第8天和第11天中苯乙胺含量分别为44.98 mg/kg和52.02 mg/kg;苏悟等[14]细菌型豆豉在自然发酵过程中48~120 h期间,酪胺含量范围在151~488mg/kg,苯乙胺含量从36.6mg/kg上升至190mg/kg。
鉴于细菌型豆豉中生物胺含量存在潜在危害,本研究拟对其细菌型豆豉生产过程中的生物胺种类和含量进行动态研究,从而对其食用安全性进行评价;同时针对生物胺高产阶段对其发酵工艺进行理论指导和改进,从而控制细菌型豆豉中生物胺含量,提高食品安全。对豆豉中生物胺含量进行检测不仅为发酵豆制品中生物胺安全评估具有借鉴和指导意义,同时对不同人群进行安全营养配餐提供实验数据。
1 材料与方法
1.1材料与试剂
豆豉样品:2015年11月17-27日采自贵阳市某风味食品厂,每次采集上、中、下层合计约100 g,送实验室-20℃保存,待全部样品采集完毕后批次进行检测。前发酵是自然发酵和接种枯草芽孢杆菌(Bacillus subtilis)BJ 3-2的纯种强化发酵豆豉样品分别每隔6 h采集一次,各采集12次;后发酵是加入调味料后装瓶控温(37℃)后发酵,每隔1 d采集一次,各7次。
枯草芽孢杆菌(B.subtilis)BJ3-2:本实验室保藏。
腐胺、尸胺、精胺、亚精胺、色胺、苯乙胺、组胺、酪胺、丹磺酰氯(纯度≥98%):美国Sigma公司;氢氧化钠、碳酸氢钠(分析纯):天津市永大化学试剂有限公司;高氯酸(分析纯):天津市东方化工厂;盐酸、丙酮(分析纯):重庆川东化工(集团)有限公司;氨水(分析纯)、乙腈(色谱纯):成都金山化学试剂有限公司;三蒸水:实验室自制。
1.2仪器和设备
Agilent 1260 infinit高效液相色谱仪(含紫外检测器):美国Agilent公司;2-16 k高速冷冻离心机、Research移液枪:德国Eppendorf公司;EL-2005电子分析天平:西特传感技术有限公司;0.22 μm针头微孔滤膜过滤器(一次性):天津市津腾实验设备有限公司。
1.3方法
1.3.1样品预处理
样品预处理按照胡鹏等[13]的方法略加修改而成。将不同发酵时期豆豉样品用研钵研磨均匀,称取5 g豆豉样品置于50 m L具塞离心管中,加入20 m L 0.4 mol/L高氯酸,混匀,振荡提取30 min,4℃、3 000 r/min离心10 min,取上清液备用。沉淀如上述方法再加入20 m L高氯酸提取一次,合并两次上清液,用0.4 mol/L高氯酸定容至50 m L。取0.5 m L上清液按照1.3.3方法进行衍生。
1.3.2生物胺标准溶液的制备
标准溶液的制备参照国标GB/T 5009.208—2008《食品中生物胺含量的测定》[15]。
1.3.3样品衍生
参考王颖等[12,16]的方法并有所进行改进。取0.5 m L标准生物胺溶液于5m L离心管中,依次加入100μL 2m ol/L氢氧化钠溶液,150 μL饱和碳酸氢钠溶液缓冲,振荡数秒,再加入1 m L丹磺酰氯衍生剂(5mg/m L,溶剂为丙酮),振荡混匀,在60℃黑暗条件下保温30 min,隔15 min振荡一次;加入50 μL 25%氨水终止反应,静置30 min,加入700 μL乙腈溶液,振荡混匀,用0.22 μm有机滤头过滤,于4℃避光保存,用于HPLC测定。样品稀释溶液的衍生与标准工作液衍生条件及方法相同。
1.3.4高效液相色谱色谱条件
参考王颖等[12]的方法并有所进行改进。色谱柱为Agilent XDB-C18(150 mm×4.6 mm,5 μm),紫外检测波长为254 nm,进样量20 μL,柱温30℃,流动相A为乙腈,流动相B为水,流速为0.8 m L/min。洗脱梯度程序见表1。
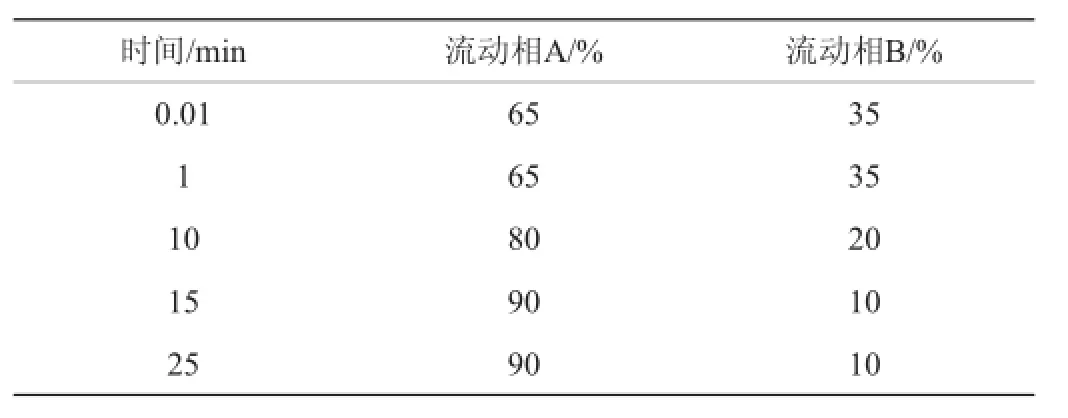
表1 梯度洗脱程序Table 1 Gradient e lution program
2 结果与分析
2.1生物胺混合标准品HPLC色谱分析
采用梯度洗脱程序,首先分别对每种生物胺进行定性检测,确定每种生物胺的出峰时间,再对8种生物胺混合标准品进行测定,结果见图1。由图1可知,各种生物胺在20 min内能够全部出峰,其出峰顺序分别为色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺。8种生物胺之间的分离度分别为2.47、7.19、3.44、1.88、2.71、9.00、6.28、6.01,且分离度都>1,由此可见各种生物胺标准品能够有效分离。
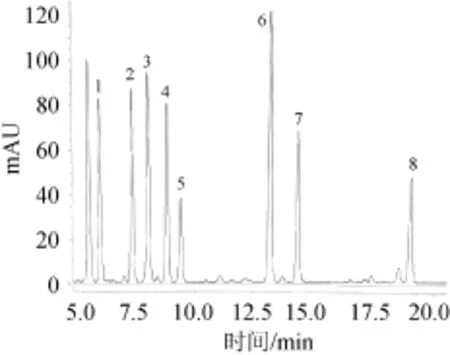
图1 生物胺混合标准品HPLC色谱图Fig.1 HPLC chromatogram of m ix standard o f biogenic amines
2.2标准曲线的回归方程和精密度试验
配制标准工作液进行线性试验,在1.25~80 mg/L范围得到每种生物胺的线性回归方程及其线性相关系数,结果见表2。
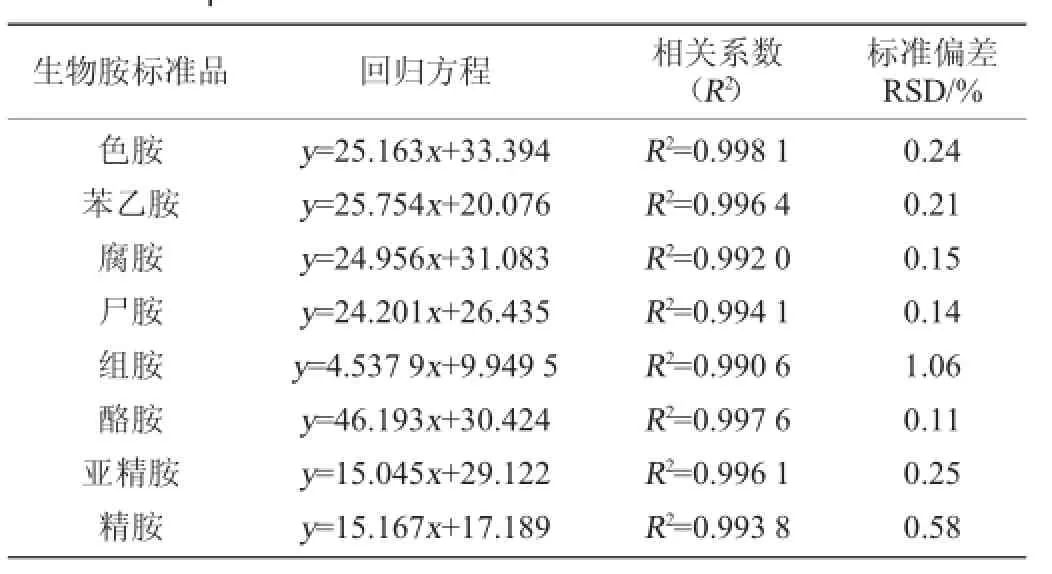
表2 标准曲线的回归方程及其精密度实验结果Tab le 2 Regression equations of standa rd curves and precision experiments results
由表2可见,8种生物胺的回归方程相关系数R2均>0.990 0,说明标准曲线呈良好的线性关系,满足检测要求。对质量浓度为80 m g/L衍生完成的生物胺混合标准工作液,连续进样7次,得到8种生物胺的标准偏差(relative standard deviation,RSD)范围在0.11%~1.06%,均<2%,说明该仪器具有较好的精密度,符合检测要求。
2.3不同发酵条件下豆豉样中总生物胺含量的变化
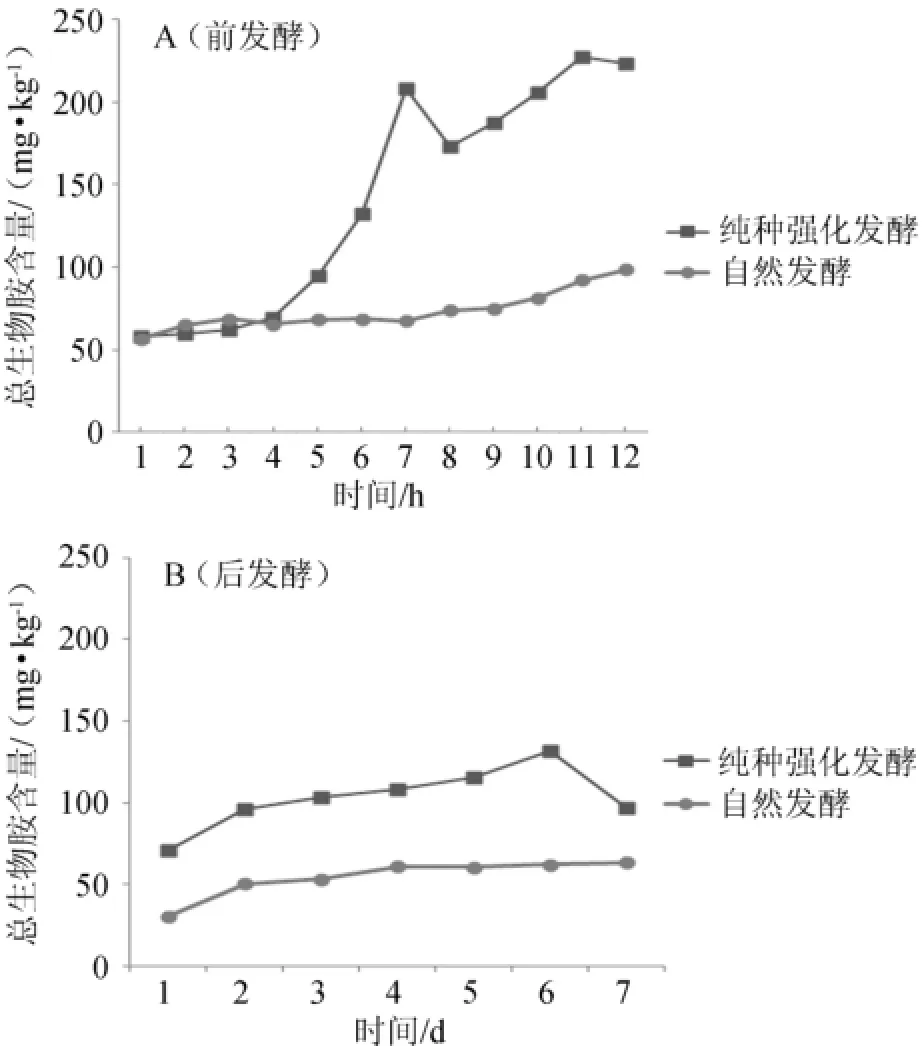
图2 不同发酵条件下总生物胺含量变化曲线Fig.2 Changing curves of biogenic am ines content in different fermentation conditions
在整个发酵过程中,纯种强化发酵条件下总生物胺含量远大于自然发酵条件下的(见图2),纯种强化发酵条件下,前发酵过程中总生物胺含量随发酵时间的推移而呈上升趋势,在36 h后呈略下降,而后又呈上升趋势;在后发酵中,总生物胺含量在1~6 d呈上升趋势,在第7天下降。自然发酵条件下,总生物胺含量在两个发酵时期都是呈平缓上升趋势。SANTOS M H S[3]认为摄入总生物胺含量超过1 000 mg/kg会严重危害人体健康,而由图2看出,两种发酵条件下各阶段总生物胺含量都<250 mg/kg。
2.4不同发酵条件豆豉样品中8种生物胺含量的变化
选取不同发酵时间梯度对豆豉中生物胺含量进行测定,结果见图3~图4。
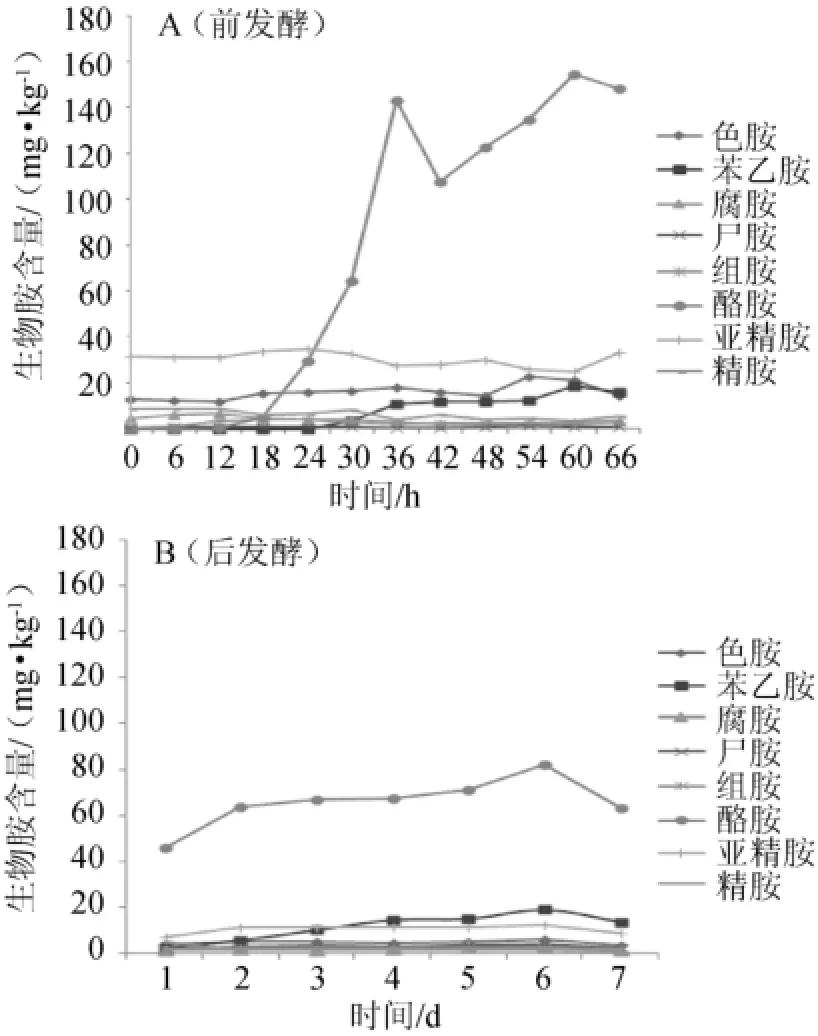
图3 纯种强化发酵条件下8种生物胺含量变化曲线Fig.3 Changing curves of eight biogenic am ines contents in pure-culture fermentation

图4 自然发酵条件下8种生物胺含量变化曲线Fig.4 Changing curves of eight biogenic am ines content in natural fermen tation
在2种豆豉发酵条件下都能够检测出8种生物胺,分别是色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺。不同发酵时期生物胺的含量和种类有差异,这可能与豆豉豆豉中微生物菌群变化有关。
由图3可知,在纯种强化发酵条件下,酪胺含量在豆豉发酵整个过程中远远高于别的生物胺含量,前发酵时期含量高于后发酵时期的。在前发酵过程中酪胺含量先大幅度上升,在36 h后略下降,再度缓慢上升,到60 h时含量最高,后发酵时期酪胺含量低于前发酵时期。在整个纯种发酵过程中,苯乙胺在后发酵先呈缓慢上升后下降的趋势,其他的生物胺含量较低,且变化不大。
由图4可知,自然发酵条件下,亚精胺含量在整个发酵过程中变化不大,并且在前发酵时期比别的生物胺中含量都高,而在后发酵时期其含量低于酪胺含量。酪胺在前发酵48 h后呈上升趋势,在后发酵时期从第2天起呈缓慢上升趋势,且含量是最高。
2.5豆豉成品中生物胺含量的测定
不同发酵条件下豆豉成品中各类生物胺含量见表3。
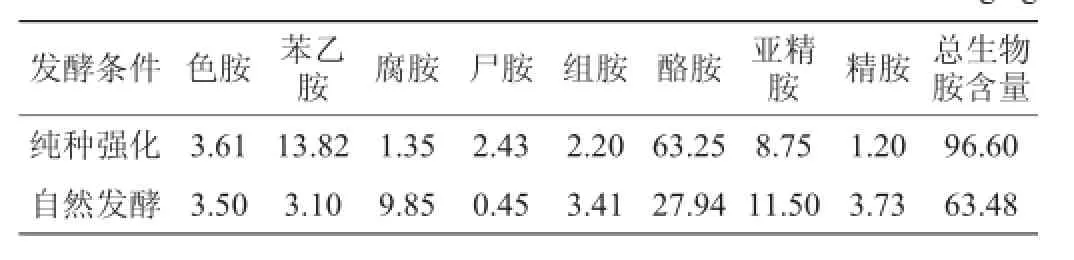
表3 纯种强化和自然发酵下豆豉成品的生物胺的含量Table 3 Biogenic am ines con tent of Douchi produc ts w ith pure-culture fermentation and natural fermentation mg/kg
由表3可知,纯种强化发酵条件下,主要的生物胺有酪胺、苯乙胺和亚精胺,它们的含量分别为63.25 mg/kg、13.82 mg/kg、8.75 mg/kg,占生物胺总含量的88%以上;自然发酵条件下,主要的生物胺是酪胺和亚精胺,它们占生物胺总含量的62%以上。两种发酵条件下相比,纯种发酵条件下苯乙胺和酪胺的含量比自然发酵条件分别高出4倍多和2倍多,腐胺含量则相反;而其他生物胺含量相近。
在两种发酵条件下,精胺和亚精胺的含量在自然发酵条件下略高于纯种强化发酵条件,且精胺和亚精胺含量在两个条件下相差不大,说明精胺和亚精胺在豆豉中一直存在,枯草芽孢杆菌BJ 3-2对其影响不大。生物胺含量相差最大的是酪胺,其次是苯乙胺和腐胺。在纯种强化发酵和自然发酵条件下,酪胺和苯乙胺的含量差别较大,有可能是由于工厂发酵室受到污染的原因。本实验室采用聚合酶链式反应-变性梯度凝胶电脉(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)法在豆豉的发酵过程中检测到粪肠球菌(Enterococcus faecalis)和粘质沙雷氏菌(Serratia marcescens)的存在,而接种的枯草芽孢杆菌与粪肠球菌有相互促进生长作用[17],导致粪肠球菌的快速繁殖。舒蕊华等[18]报道粪肠球菌和屎肠球菌(Enterococcus faecium)产有较强的产酪胺和苯乙胺的微生物;在李志军[19]的研究中发现粪肠球菌和屎肠球菌也能够产生大量的酪胺。因此,使纯种发酵条件下酪胺含量高于自然发酵条件。李蕊婷等[20]从新疆熏马肠中分离出具产腐胺的能力较强的粘质沙雷氏菌。在纯种强化发酵条件下枯草芽孢杆菌BJ 3-2是优势菌群,抑制了粘质沙雷氏菌的生长,自然发酵条件下粘质沙雷氏菌不受限制。所以自然发酵条件下腐胺含量比纯种强化发酵条件下腐胺的含量要高。
亚精胺和精胺的含量很低,并且这两种生物胺对人体没有直接的毒性。对人体有直接伤害的生物胺有苯乙胺、组胺和酪胺等3种。有文献称[21]组胺的毒性极限在8~40 mg是属于轻微中毒,40~100mg为中度中毒,超过100mg就会严重中毒;人体摄入酪胺含量超过100 mg/kg会引起偏头痛;苯乙胺含量在30 mg/kg以上[22]危害人体健康。根据文献报道[23],美国食品药品监督局(food and drug administration,FDA)规定水产品中组胺含量低于50 mg/kg,食品中组胺含量应低于500 m g/kg,酪胺含量低于100 mg/kg;欧盟规定鲭科鱼中组胺含量应低于100 mg/kg,其他食品中组胺含量不得超过100 mg/kg,酪胺不得超过100 mg/kg,就可对人体构成潜在的危险。按照对25%的日本人每天食用的豆制品在100~200 g的调查[24],以豆豉样品中的酪胺最高含量来进行估算,每天摄入的酪胺含量为30 mg以下,对人体健康不具伤害作用。由表3可以看出,细菌型豆豉在发酵过程中苯乙胺、组胺、酪胺等生物胺的含量低于危害对人体健康的范围。
在整个发酵过程中,纯种强化发酵条件下总生物胺含量远大于自然发酵条件下的,这是因为酪胺含量和苯乙胺含量在纯种发酵条件下远高于自然发酵条件的含量;在后发酵过程中,总生物胺含量远低于前发酵条件生物胺总量,最主要的原因是由于加入调料(食盐、老姜、花椒)和水稀释了生物胺含量。但随着发酵时间的推移,豆豉中pH逐渐上升,使生物胺氨基酸脱羧酶阳性细菌快速生长,导致生物胺的积累。对于非杀菌的水豆豉,随着保质期的延长,生物胺含量可能会持续增加,其安全性问题还需进一步研究。
3 结论
豆豉发酵各阶段中酪胺和组胺的含量没有超过FDA和欧盟规定的范围,苯乙胺含量也没有超过伤害人体健康的范围,其总生物胺含量均<250 mg/kg,理论上不存在食用安全问题。但细菌性豆豉在自然条件的后发酵过程中一直是呈缓慢上升趋势,细菌型豆豉在自然发酵过程中要控制发酵时间和发酵温度,且在集装运输过程中温度不宜超过37℃,否则可能会由于在高温条件下酪胺含量的升高而带来安全隐患。此外,细菌型豆豉在发酵过程中受到环境污染,从而增强了酪胺的含量。因此对发酵厂房进行彻底杀菌来控制粪肠球菌,防止污染,否则可能导致酪胺苯乙胺含量成倍增加,导致生物胺超标。因此豆豉生产企业应严格控制前发酵过程中的卫生环境条件才能控制生物胺的含量。本研究对于豆豉企业对细菌型豆豉中生物胺含量控制具有指导意义。
[1]CINQUINA A L,CAL A,LONGO F,et al.Determ ination of biogenic amines in fish tissues by ion-exchange chromatography w ith conductivity detection[J].J Chromatogr A,2004,1032(1-2):73-77.
[2]曲映红.发酵食品中生物胺的研究进展[J].食品工业,2012(3):115-119.
[3]SANTOS M H S.Biogenic amines:their importance in foods[J].Int J Food M icrobiol,1996,29(2-3):213-31.
[4]LU Y,LU X,CHEN X,et al.A survey of biogenic amines in Chinese rice w ines[J].Food Chem,2007,100(4):1424-1428.
[5]RUIZ-CAPILLAS C,MORAL A.Effect of controlled atmospheres enriched w ith O2in formation of biogenic amines in chilled hake(Merluccius merluccius L.)[J].Eur Food Res Technol,2001,212(5):546-550.
[6]VINCI G,ANTONELLI M L.Biogenic amines:quality index of freshness in red and white meat[J].Food Control,2002,13(8):519-524.
[7]邹阳,赵谋明,赵海锋.高效液相色谱法同时测定酱油中的8种生物胺[J].现代食品科技,2012,28(5):570-573.
[8]LU S L,XU X L,ZHOU G H,et al.Effect of starter cultures on microbial ecosystem and biogenic am ines in fermented sausage[J].Food Con trol,2010,21(4):444-449.
[9]BENEDUCE L,ROMANO A,CAPOZZI V,et al.Biogenic am ine in w ines[J].Ann M icrobiol,2010,60(60):573-578.
[10]TAM IM N M,BENNETT L W,SHELLEM A,et al.High performance liquid chromatographic determination of biogenicamines in poultry carcasses[J].J Agr Food Chem,2002,50:5012-5015.
[11]邢茜,陈浩,曲桂芹,等.高效液相法测定市售腌制蔬菜商品中8种生物胺的含量[J].食品与发酵工业,2013,39(5):161-165.
[12]王颖,邱璠,邢茜,等.腐乳前酵过程中生物胺含量变化[J].食品与发酵工业,2011,37(12):16-20.
[13]胡鹏,索化夷,阚建全,等.中国传统发酵豆豉中生物胺含量[J].食品科学,2013,34(20):108-112.
[14]苏悟,郑小芬,徐睿烜,等.1种细菌型豆豉自然发酵过程中生物胺的变化[J].食品与发酵工业,2014,40(7):40-45.
[15]中华人民共和国卫生部.GB/T 5009.208—2008食品中生物胺含量的测定[S].北京:中国标准出版社,2008.
[16]王长远,王云光,于长青,等.产生物胺乳酸菌的检测及产生物胺量的测定[J].农产品加工·学刊,2010(1):22-25.
[17]吴家泉,邓桂芳,刘爱君.饲用粪肠球菌与枯草芽孢杆菌共同培养实验[J].中国饲料添加剂,2013(10):18-20.
[18]舒蕊华,卢士玲,徐幸莲.粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium)产生物胺交互作用研究[J].食品与发酵工业,2011,37(6):16-20.
[19]李志军.食品中生物胺及其产生菌株检测方法研究[D].青岛:中国海洋大学博士论文,2007.
[20]李蕊婷,卢士玲,李开雄,等.新疆熏马肠中产氨基酸脱羧酶优势细菌的分离及鉴定[J].现代食品科技,2014,30(9):85-91.
[21]ANLI R E,VURAL N,YILMAZA S,et al.The determination of biogenic amines in Turkish red w ines[J].J Food Com pos Anal,2004,17(1):53-62.
[22]NOUT M J R,RUIKES M M W,BOUWMEESTER H M.Effect of processing conditions on the formation of biogenic am ines and ethyl carbamate in soybean tempe[J].J Food Safety,1993,13(4):293-303.
[23]王颖,邱璠,韩北忠,等.食品中的生物胺及其检测方法[J].中国酿造,2011,30(10):1-5.
[24]张建华,沈翔,于湘莉.纳豆发酵过程中的生物胺[J].上海交通大学学报:农业科学版,2007,25(1):1-5.
Dynamic changes of biogenic am ines content in Douchi
HAN Zhongan,LUO Xinxu,YANG Chunyan,WU Yongjun*
(College of Life Science,Guizhou University,Guiyang 550025,China)
The content of biogenic am ine in Douchi was detected dynamically by HPLC.The results showed that tryptam ine,phenylethylam ine,putrescine,cadaverine,histamine,tyram ine,sperm idine and sperm ine were found in pure-culture fermentation and natural bacteria-fermented Douchi samples.In pure-culture pre-fermentation and post-fermentation,the variation trend of the total biogenic amines content first increased,then decreased.While the biogenic amines content increased slow ly in natural fermentation.The total biogenic amines content in pre-fermentation was higher than that in post-fermentation.Under two fermentation conditions,the primary biogenic amines were tyram ine and sperm idine,phenylethylam ine mainly existed in pure-culture fermentation.The total biogenic am ines content in pure-culture fermentation was higher than that in natural fermentation.The tyramine content of bacteria-fermented Douchi was two times higher and phenylethylam ine content was four times higher than that in natural bacteria-fermented Douchi products,which might be related to the pollution of Enterococcus faecalis in the environment.The total biogenic amines content was less than 250 mg/kg in the fermentation process and in the product,which indicated no food safety problem in a short time.
HPLC;biogenic amine;bacteria-fermented Douchi
TS214.2
0254-5071(2016)05-0060-05
10.11882/j.issn.0254-5071.2016.05.013
2016-03-17
国家自然科学基金项目(31260394/C200207)
韩忠安(1990-),男,硕士研究生,研究方向为应用微生物学。
吴拥军(1971-),男,教授,博士,研究方向为食品生物技术。

